입체도
Stereoselectivity화학에서 입체성은[1] 새로운 스테레오 입자의 비스테레오 입자의 비스테레오 입자의 비스테레오 입자의 비스테레오 입자 동안에 단일 반응체가 스테레오 입자의 불평등한 혼합을 형성하는 화학 반응의 성질이다.[2] 선택성은 다른 생산물로 이어지는 기계론적 경로의 장점과 전자적 효과의 차이에서 발생한다. 입체도 정도는 다를 수 있지만 두 경로 사이의 활성화 에너지 차이가 한정적이기 때문에 절대 총량이 될 수 없다. 두 제품 모두 최소한 가능하고 단지 양만 다를 뿐이다. 단, 유리한 경우에는 사용된 분석 방법에 의해 마이너 스테레오소머를 검출할 수 없을 수 있다.
항억제반응은 한 엔노머가 다른 에노소머에 비해 다른 에노소머에 우선하여 형성되는 반응으로, 치랄 촉매, 효소 또는 치랄 시약을 사용하여 아치랄 시작 물질로부터 광학적으로 활성 제품을 만드는 반응이다. 선택성의 정도는 항산화제 과잉으로 측정된다. 중요한 변종은 운동 분해능이다. 운동성 분해능은 기존의 치랄 중심부가 치랄 촉매, 효소 또는 치랄 시약과 반응하여 한 엔안티머가 다른 엔안티머보다 빠르게 반응하고 덜 반응하는 엔안티머를 남기거나, 미리 존재하는 치랄 중심부가 다른 반응 중심부의 반응성에 영향을 미치는 것이다.같은 분자 안에.
이질회수반응은 한 이질회수체가 다른 이질회수체(또는 가능한 모든 이질회수체의 부분집합체가 제품 혼합물을 지배하는 것)에 우선하여 형성되어 선호되는 상대적 입체화학성을 확립하는 반응이다. 이 경우 한 개의 상대적 입체화학이 선호될 정도로 한 번에 두 개 이상의 치랄 중심이 형성되거나,[3] 또 다른 치랄 중심(광학적으로 순수할 필요는 없음)이 생성되는 동안 기존의 치랄 중심(chiral center)이 입체화학적인 결과를 편향시킨다. 상대적 선택성의 정도는 이뇨제 과다로 측정된다.
스테레오 컨버전스는 두 개의 서로 다른 스테레오 섬머의 반응이 단일 제품 스테레오 섬머를 산출할 때 스테레오 구체성과 반대되는 것으로 간주할 수 있다.
입체감의 품질은 오로지 제품과 그 입체화학에 관한 것이다. 가능한 여러 가지 입체 제품 중에서, 반응은 형성될 하나 또는 두 개를 선택한다.
예
보통 수준의 입체감을 보여주는 예로는 trans-2-butene 60%, cis-2-butene 20%를 산출하는 2-iodo-butane의 탈수소화가 있다.[4] 알켄 기하학적 이소머는 또한 디쓰레기레오머로 분류되기 때문에, 이 반응은 디쓰레기레오셀렉티브라고도 불릴 것이다.
노르보르네에 포름산을 첨가한 것도 엑소 이소머가 엔도 이소머 없이 독점적으로 형성되기 때문에 입체적이다.[5]
크램의 법칙은 치랄 중심 옆에 있는 카보닐 그룹에 이질제거 핵소독성분이 첨가되어 발생하는 주요 이질소체를 예측한다. 치랄 중심은 광학적으로 순수할 필요는 없다. 상대적 입체화학은 두 엔노머에 대해 동일할 것이기 때문이다. 아래의 예에서 (S)-알데히드는 티아졸과 반응하여 (S,S) 이염화합물을 형성하지만 (S,R) 이염화합물은 소량만 형성한다.[6]
샤플리스 에폭시디화는 아치랄 동맹인 알코올 기질이 광학적으로 활성인 에폭시알코올로 변형되는 항억제적 과정의 한 예다. 키랄 동맹 알코올의 경우 운동 분해능이 나타난다. 또 다른 예는 샤플리스 비대칭 다이히드록실화다. 아래의 예에서 아치랄 알켄은 가능한 4개의 스테레오 중 하나만 산출한다.[7]
탄수화물 옆에 있는 입체적인 중심에서 대체는 분자간 및 분자내 반응에서 입체적으로 이루어질 수 있다. 핵분열체(후란) 아래에 나타낸 반응에서, 부피가 큰 t-부틸 그룹에서 떨어진 가장 차폐가 적은 쪽에서 형성된 탄수화물에 접근하여 높은 안면 이질제거율을 유발할 수 있다.
입체적 생합성
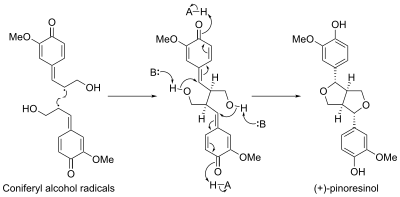
피노레시놀 생합성에는 디리겐트 단백질이라는 단백질이 포함되어 있었다. 최초의 단백질이 개나리 인터미디어에서 발견되었다. 이 단백질은 (+-pinoresinol)의 입체적 생합성을 코니페릴 알코올 모노머로부터 유도하는 것으로 밝혀졌다.[11] 최근 아라비도피스 탈리아나에서 두 번째 항항체성 단백질(---pinoresinol)의 항항체성 합성을 지시하는 단백질이 확인되었다.[12]
참고 항목
참고 및 참조
- ^ (a)"카바니오노이드 반응의 오버랩 제어. I. 알칼리성 에폭시드에서의 입체감," 짐머만, H. E.; 싱어, L.; Tyagarajan, B. S. J. Am. Chem. Soc. 1959, 81, 108-116. (b)Eilliel, E, "탄소 화합물의 화학" McGraw-Hill, 1962 pp 434-436.
- ^ 예를 들어, S1N 반응은 기존의 스테레오 입점을 파괴한 후 새로운 것을 만든다.
- ^ 또는 가능한 모든 상대적 입체화학물질보다 적게 얻는다.
- ^ 베이스 추진 제거 반응에서 베이스 강도와 크기가 미치는 영향. 리처드 A. 바트슈, 제럴드 M. 프루스, 브루스 A. 부쇼, 칼 E. Wiegers J. Am. Chem. Soc.; 1973; 95(10); 3405-3407. doi:10.1021/ja00791a067
- ^ 유기 합성 콜. 제 5, p.852 (1973); 제 42, 페이지 79 (1962). 링크
- ^ 유기합성체, 콜. 제10권, 제140권(2004); 제77권, 제78권(2000). 링크
- ^ 유기합성체, 콜. 10권, p.603 (2004); 79권, p.93 (2002)링크
- ^ 2-대체 1-페닐-1,2,3,4-테트라하이드로나프탈렌스 프리드리히 뮐타우, 토르스텐 바흐 합성 2005: 3428-3436 doi:10.1055/s-2005-918482
- ^ 치랄 벤질릭 뮐타우, 올리버 슈스터, 토르스텐 바흐 J. Am의 분자내 및 분자간 반응에서 높은 안면 역류율. Chem. Soc, 2005, 127 (26), 페이지 9348–9349 doi:10.1021/ja050626v
- ^ 안정화된 탄화수소 교각 조르지오 코치와 피데스 벤파티 안젤로의 입체적 반응 화학. 인트. 2009년 Ed. doi:10.1002/anie.200905235
- ^ Davin LB, Wang HB, Crowell AL, et al. (1997). "Stereoselective bimolecular phenoxy radical coupling by an auxiliary (dirigent) protein without an active center". Science. 275 (5298): 362–6. doi:10.1126/science.275.5298.362. PMID 8994027.
- ^ Pickel B, Constantin M-A, Pfannsteil J, Conrad J, Beifuss U, Schaffer A (March 2007). "An Enantiocomplementary Dirigent Protein for the Enantioselective Laccase-Catalyzed Oxidative Coupling of Phenols". Angewandte Chemie. 53 (4): 273–284. doi:10.1007/s10086-007-0892-x.