한츠슈 피리딘 합성
Hantzsch pyridine synthesis
| 한츠슈 피리딘 합성 | |
|---|---|
| 이름을 따서 명명됨 | 아서 루돌프 한츠슈 |
| 반응형 | 링 형성 반응 |
| 식별자 | |
| 유기화학포털 | 한츠슈-디히드롭디리딘-스페인 |
| RSC 온톨로지 ID | RXNO:0000268 |
한츠슈 피리딘 합성 또는 한츠슈 디히드롭디리딘 합성은 포름알데히드 등 알데히드, 에틸 아세토아세테이트 등 β-케토 에스테르 등 2개 성분과 아세트산 암모늄이나 암모니아 등 질소 기증자 사이의 다성 유기 반응이다.[1][2]초기 반응 제품은 디히드롭피리딘으로, 피리딘에 대한 후속 단계에서 산화될 수 있다.[3]이 두 번째 반응 단계의 원동력은 방향화다.이러한 반응은 1881년 아서 루돌프 한츠슈에 의해 보고되었다.
1,4-디히드롭디리딘 디카복시산(dicarboxylate)은 1,4-DHP 화합물 또는 한츠슈 에스테르라고도 불린다.이러한 화합물은 칼슘 채널 차단기의[2] 중요한 등급이며, 예를 들어 니페디핀, 앰로디핀 또는 니모디핀에서 상용화된다.
이 반응은 물에서 반응 용매로서 그리고 1-팟 합성에 있어서 염화 철, 이산화망간 또는 과망간산칼륨에 의한 직접적인 방향화 작용으로 진행되는 것으로 증명되었다.[4]
한츠슈 디히드롭디리딘 합성은 마이크로파 화학에 의해 영향을 받았다.[5]
메커니즘
1,4-디드롭디리딘의 한츠치 반응 합성에 대해 최소 5개의 유의한 경로가 제안되었다.낮은 수율과 예상치 못한 제품은 다양한 반응제 및 반응 조건에서 발생할 수 있다.이전의 연구들은 가장 가능성이 높은 메커니즘을 결정하고 성공적인 합성을 설계하기 위해 미리 형성된 중간체의 반응을 시험했다.[6]C와 NMR을 사용한 메커니즘에 대한 초기 연구는 찰콘 6과 에나민 3의 중간성을 나타냈다.이 데이터는 반응에 대한 다음과 같은 경로를 제시하였다.[7]
나중에 연구charge-tagged reactants과 질량 분석기 감시를 사용할 것 같은 경로로, 증거가 반응이 7precursor에 모인 추가적인 두 중간 경로 따라 보여 주었다. 중간 경로 A지원되는[6]Reagents 가능성이 영향력은 노선을 취한 때부터 메틸 그룹의 1교체에 의한 electron-wi.나사니.래윙 그룹은 대신 디케톤 중간 조직을 통해 반응이 진행된다.[8]
반응 조건의 최적화
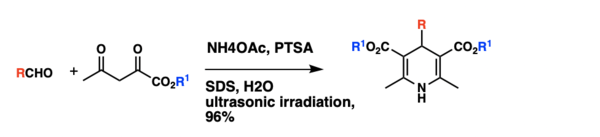
한츠슈 1,4-디드롭디드리딘 합성을 위한 고전적인 방법은 에틸 아세토세테이트와 암모니아를 가진 알데하이드의 1회 응축과 관련된 것으로 거친 반응 조건, 긴 반응 시간, 일반적으로 낮은 생산량 등 몇 가지 단점이 있다.초음파 조사 하에서 PTSA에 의해 촉매된 수용성 마이크로셀에 있는 1,4-디드롭디리딘의 합성.실험 결과, 모델로서 벤즈알데히드, 에틸 아세토아세테이트, 아세테이트 암모늄의 응축을 사용하여 초음파 조사 하에서 p-톨루엔설폰산(PTSA)에 의해 촉매화되었을 때, 반응은 수성(SDS, 0.1M)에서 96%의 제품 수율을 가질 수 있다는 것이 입증되었다.이 반응은 다양한 용매 시스템에서도 진행되었으며, 수용성 마이크로셀의 초음파 조사 결과 메탄올, 에탄올, THF와 같은 용매보다 수율이 더 높은 것으로 밝혀졌다.최적화된 반응 조건을 이용하여 1,4-디히드롭디리딘을 합성하였으며, 모두 90% 이상의 반응수율을 가진다.[9]
아로마화
1,4-DHP의 산화는 피리딘 유도체에 접근하는 가장 쉬운 방법 중 하나를 차지한다.1,4-DHP의 방향화를 촉진하는 데 [10]사용되는 일반적인 산화제는 CrO3, KMnO4, HNO이다3.[11]그러나 아로마화에는 종종 낮은 화학적 수율, 강한 산화 조건, 부담스러운 작업, 사이드 제품의 형성 또는 과도한 산화제의 필요성 등이 동반된다.[11][12]이와 같이, 보다 온화하고 효율적인 조건에서 피리딘 유도체를 산출하는 방향화 방법을 개발하는 데 특히 주의를 기울였다.이러한 조건에는 메탄올 역류 요오드,[11] 이산화크롬(CrO2), 염소산나트륨,[13] 그리고 UV광과 가시광선을 모두 사용하는 무금속 광화학 조건이 포함되지만 이에 국한되지는 않는다.[14]신진대사 시, 1,4-DHP 기반 고혈압 치료제는 간에서 시토크롬 P-450을 통해 산화를 거쳐 피리딘 유도체로 전환된다.[11]그 결과, 생물학적 시스템을 이해하고 피리딘에 접근하는 새로운 방법을 개발하기 위한 수단으로서 1,4-DHP의 방향화에 특히 주의를 기울였다.[13]
그린 케미스트리
다성분 반응으로서 한츠치 피리딘 합성은 선형 전략 합성에 비해 반응 단계 수가 더 단순해 원자 효율이 훨씬 높다.최근 몇 년 동안, 연구는 "친환경" 용제와 반응 조건을 조사함으로써 이것을 훨씬 더 환경 친화적인 반응으로 만들려고 했다.[15]한 연구 라인은 상온 반응을 위한 촉매로 이온 액체를 사용하는 실험을 했다.이온성 액체는 취급하기 쉽고 기존의 촉매를 대체하기 위한 무독성 옵션이다.또한, 이 촉매는 상온에서 높은 수율을 유도하여 장시간 동안 반응을 가열하는 영향을 감소시킨다.두 번째 연구는 질산암모늄(CAN)을 대체 촉매로 사용했고 용제 없는 실내 온도 반응을 얻었다.[16]
KnoEvenagel-Fries 수정
Knoevenagel-Fries 수정은 비대칭 피리딘 화합물의 합성을 허용한다.[17]
참고 항목
참조
- ^ Hantzsch, A. (1881). "Condensationprodukte aus Aldehydammoniak und Ketonartigen Verbindungen". Chemische Berichte. 14 (2): 1637–8. doi:10.1002/cber.18810140214.
- ^ a b Li, Jie Jack (19 July 2006). Name Reactions (3rd ed.). ISBN 3-540-30030-9.
- ^ Li, Jie Jack (11 October 2004). Name reactions in heterocyclic chemistry. p. 304. ISBN 0-471-30215-5.
- ^ Xia, J. J.; Wang, G. W. (2005). "One-Pot Synthesis and Aromatization of 1,4-Dihydropyridines in Refluxing Water". Synthesis. 2005 (14): 2379–83. doi:10.1055/s-2005-870022.
- ^ van den Eynde, J. J.; Mayence, A. (2003). "Synthesis and Aromatization of Hantzsch 1,4-Dihydropyridines under Microwave Irradiation. An Overview" (PDF). Molecules. 8 (4): 381–91. doi:10.3390/80400381. S2CID 98443099.
- ^ a b Santos, Vanessa G. (2014). "The Multicomponent Hantzsch Reaction: Comprehensive Mass Spectrometry Monitoring Using Charge-Tagged Reagants". Chemistry - A European Journal. 20 (40): 12808–12816. doi:10.1002/chem.201303065. PMID 25179028.
- ^ Katrinsky, Alan R.; Ostercamp, Daryl L.; Yousaf, Taher I. (1986). "The mechanism of the hantzsch pyridine synthesis: A study by 15N and 13C NMR spectroscopy". Tetrahedron. 42 (20): 5729–5738. doi:10.1016/S0040-4020(01)88178-3.
- ^ Saini, Anil (February 2008). "Hantzsch reaction: Recent advances in Hantzsch 1,4-dihydropyridines" (PDF). Journal of Scientific and Industrial Research. 67: 95-111.
- ^ Kumar, Atul (5 August 2008). "ChemInform Abstract: Efficient Synthesis of Hantzsch Esters and Polyhydroquinoline Derivatives in Aqueous Micelles". ChemInform. 39 (32). doi:10.1002/chin.200832145.
- ^ Mashraqui, Sabir H. (1998). "Bismuth Nitrate Pentahydrate: A Convenient Reagent for the Oxidation of Hantzsch 1,4-Dihydropyridines". Synthesis. 1998 (5): 713–714. doi:10.1055/s-1998-4516.
- ^ a b c d Yadav, Jhillu S. (2000). "Aromatization of Hantzsch 1,4-Dihydropyridines with I2-MeOH". Synthesis. 2000 (11): 1532–1534. doi:10.1055/s-2000-7613.
- ^ a b Ko, Kwang-Youn (1999). "Aromatization of Hantzsch 1,4-Dihydropyridines with Magtrieve". Tetrahedron Letters. 40: 3207–3208. doi:10.1016/S0040-4039(99)00467-0.
- ^ a b Liao, Xiali (2010). "Oxidative aromatization of Hantzsch 1,4-dihydropyridines by sodium chlorite". Tetrahedron Letters. 51 (29): 3859–3861. doi:10.1016/j.tetlet.2010.05.091.
- ^ Wei, Xiaojing (2014). "Metal-Free-Mediated Oxidation Aromatization of 1,4-Dihydropyridines to Pyridines Using Visible Light and Air". Chinese Journal of Chemistry. 32 (12): 1245–1250. doi:10.1002/cjoc.201400521.
- ^ Jassem, Ahmed Majeed; Almashal, Faeza Abdul Kareem; Mohammed, Mohammed Qasim; Jabir, Hadi Abdal Samad (7 February 2020). "A catalytic and green method for one-pot synthesis of new Hantzsch 1,4-dihydropyridines". SN Applied Sciences. 2 (3). doi:10.1007/s42452-020-2165-x.
- ^ Sharma, M.G; Rajani, D.P.; Patel, H.M. (14 June 2017). "Green approach for synthesis of bioactive Hantzsch 1,4-dihydropyridine derivatives based on thiophene moiety via multicomponent reaction". Royal Society Open Science. 4 (6): 170006. Bibcode:2017RSOS....470006S. doi:10.1098/rsos.170006. PMC 5493906. PMID 28680664.
- ^ Knoevenagel, E.; Fries, A. (1898). "Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese". Berichte der Deutschen Chemischen Gesellschaft. 31 (1): 761–7. doi:10.1002/cber.189803101157.