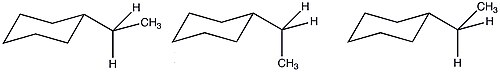
A 값
A valueA-값은 분자 내 원자의 가장 안정된 방향(적합성 분석)을 결정하는 데 사용되는 숫자 값이며, 스테릭 벌크의 일반적인 표현이다.A-값은 단분화 사이클로헥산 화학물질의 서로 다른 사이클로헥산 적합성의 에너지 측정에서 도출된다.[1]사이클로헥산 링의 대체물은 축방향의 적도 위치에 있는 것을 선호한다.높은 에너지 순응(축 대체)과 낮은 에너지 순응(동등 대체) 사이의 Gibbs 자유 에너지(ΔG)의 차이는 해당 대체물에 대한 A 값이다.
효용
A-값은 사이클로헥산 링의 순응을 예측하는 데 도움이 된다.가장 안정적인 순응은 적도를 대체하거나 대체하는 것이 될 것이다.여러 대체물을 고려할 때, 가장 큰 A-값을 가진 대체물이 적도인 순응을 선호한다.
A-값의 효용은 사이클로헥산 적합성 이외의 용도로 일반화할 수 있다.값은 대체물의 견고한 효과를 예측하는 데 도움이 될 수 있다.일반적으로 대체물의 A-값이 클수록 대체물의 견고한 효과가 커진다.메틸 그룹은 A-값이 1.74이고 테르트-부틸 그룹은 A-값이 ~5이다.테르트부틸의 A-값이 더 높기 때문에 테르트부틸은 메틸보다 더 큰 스테리크 효과를 갖는다.이러한 강직 효과의 차이는 화학 반응의 반응성을 예측하는 데 사용될 수 있다.
자유 에너지 고려사항
스테릭 효과는 사이클로헥사인의 구성 할당에 중요한 역할을 한다.축 또는 적도 평면에 거주하는 대체물의 성향을 결정하기 위해 강직 장애물을 사용할 수 있다.해당 적도결합보다 축방향결합이 더 방해를 받는 것으로 알려져 있다.축 위치에 있는 대체물이 다른 축 대체물 2개에 상대적으로 가깝기 때문이다.이것은 부피가 큰 대체재가 축방향으로 배치되었을 때 매우 붐빈다.이러한 유형의 강직 교호작용은 일반적으로 1,3 diaxial 교호작용이라고 알려져 있다.[2]이러한 유형의 상호작용은 적도 위치에서 대체물질과 함께 존재하지 않는다.
일반적으로 순응적 자유 에너지에 대한 세 가지 원칙적 기여가 있다고 간주된다.[3]
- 배이어 변형률, 결합 각도의 변형에서 발생하는 변형률로 정의된다.
- 피처 변형률(Pitzer strain)은 인접한 탄소에 부착된 그룹 간의 1.2 상호작용에서 발생하는 비틀림 변형률로 정의된다.
- 반 데르 발스 교호작용(Diaxial 교호작용)은 1,3 diaxial 교호작용과 유사하다.
엔탈피성분
상대적 안정성을 비교할 때 6-원자와 7-원자 상호작용은 순응 사이의 엔탈피의 차이를 대략적으로 추정하는 데 사용될 수 있다.각 6-원자 상호작용은 0.9 kcal/mol(3.8 kJ/mol)의 값이며, 각 7-원자 상호작용은 4 kcal/mol(17 kJ/mol)의 값이다.[4]
등방성분
엔트로피는 대체물이 적도 위치를 선호하는 역할도 한다.내향성 성분은 다음 공식에 의해 결정된다.
여기서 σ은 각 순응에 사용할 수 있는 마이크로스테이트의 수와 동일하다.
에틸 사이클로헥산(ethyl cyclohexane)의 가능한 순응 횟수가 더 많기 때문에 A 값은 순수하게 엔탈피크 조건에 기초하여 예측될 수 있는 값보다 감소한다.이러한 호의적인 내향성 조건 때문에 에틸 그룹의 견고한 관련성은 메틸 대체제의 관련성과 유사하다.
A-값 표
| 대체품 | A-값 | 대체품 | A-값 | 대체품 | A-값 | ||
|---|---|---|---|---|---|---|---|
| D | 0.006 | CH2Br | 1.79 | OSi(CH3)3 | 0.74 | ||
| F | 0.15 | CH(CH3)2 | 2.15 | 오호 | 0.87 | ||
| CL | 0.43 | c-C6H11 | 2.15 | OCH3 | 0.6 | ||
| BR | 0.38 | C(CH3)3 | >4 | 강박증3 | 0.56 | ||
| I | 0.43 | PH | 3 | OCH2CH3 | 0.9 | ||
| 씨엔 | 0.17 | CO2H | 1.35 | O-Ac | 0.6 | ||
| NC | 0.21 | CO2− | 1.92 | O-TFA | 0.68 | ||
| 엔코 | 0.51 | 코치23 | 1.27 | OCHO | 0.27 | ||
| NCS | 0.28 | COET2 | 1.2 | O-Ts | 0.5 | ||
| N=C=NR | 1 | CO2iPr | 0.96 | 오노2 | 0.59 | ||
| CH3 | 1.7 | COCl | 1.25 | NH2 | 1.6 | ||
| CF3 | 2.1 | 코치3 | 1.17 | NHCH3 | 1 | ||
| CHC23 | 1.75 | SH | 0.9 | N(CH3)2 | 2.1[10] | ||
| CH=CH2 | 1.35 | SMe | 0.7 | NH3+ | 1.9 | ||
| CCH | 0.41 | SPH | 0.8 | NO2 | 1.1 | ||
| CHBU2t | 2 | S− | 1.3 | HgBr | ~0 | ||
| 쵸츠2 | 1.75 | SOPh | 1.9 | HgCl | 0.3 | ||
| SO2Ph | 2.5 | SI(CH3)3 | 2.5 |
적용들
반응도 예측
윈스턴과 홀니스에 의해 수행된 원래 실험 중 하나는 크롬 촉매를 사용하여 트랜스 및 시스 대체 링의 산화율을 측정하는 것이었다.사용된 큰 테르트 부틸 그룹은 각 분자의 순응을 고정시켜 적도를 배치한다(표시된 cis 화합물).
시스 화합물은 트랜스 화합물보다 훨씬 빠른 속도로 산화 과정을 거쳤다는 것이 관찰되었다.그 명제는 축방향 위치에 있는 큰 히드록실 집단을 탐탁치 않게 여기고 이러한 긴장을 완화시키기 위해 더욱 쉽게 카보닐을 형성한다는 것이었다.트랜스 화합물은 단분해 사이클로헥산올에서 발견된 것과 동일한 비율을 가지고 있었다.
A-값을 이용한 근거리 근거리 근력강도
히드록실 및 이소프로필 서브유닛의 A-Value를 이용하여 유리한 분자내 수소 결합의 에너지 값을 계산할 수 있다.[11]
제한 사항
A-값은 단일 대체 사이클로헥산 링을 사용하여 측정되며, 특정 대체물이 분자에 전달되는 스테틱만을 나타낸다.이는 다른 시스템에서 전자적 요인을 안정화할 수 있을 때 문제로 이어진다.아래에 표시된 카복실산 대체제는 A-값이 양수임에도 불구하고 지면 상태에서 축방향이다.이 관찰을 통해 축방향 순응을 안정화하는 다른 가능한 전자적 교호작용이 있음을 알 수 있다.
기타 고려사항
A-값은 분자의 물리적 크기를 예측하는 것이 아니라, 단지 강직 효과만을 예측한다는 점에 유의해야 한다.예를 들어, 테르트-부틸 그룹(A-값=4.9)은 트리메틸릴 그룹(A-값=2.5)보다 A-값이 크지만, 실제로 테르트-부틸 그룹은 더 적은 공간을 차지한다.이러한 차이는 테르트 부틸 그룹의 탄소-탄소 결합에 비해 탄소-실리콘 결합의 길이가 길기 때문이라고 볼 수 있다.접착 시간이 길수록 인접 대체물과의 교호작용이 줄어들어 트리메틸실릴 그룹이 강직하게 방해받지 않게 되므로 A-값이 낮아진다.[2]이것은 할로겐을 비교할 때도 볼 수 있다.브로민, 요오드, 염소는 원자 방사선이 다르지만 모두 A-값이 유사하다.[4]그런 다음, A-값은 대체물의 겉보기 크기를 예측하고, 상대적 겉보기 크기는 화합물 간 강직 효과의 차이를 결정한다.따라서 A-값은 화학 반응의 복합 반응도를 결정하는 데 유용한 도구다.
참조
- ^ Muller, P (1994). "Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)". Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077.
- ^ a b Hoffman, Robert V. (2004). Organic Chemistry [An Intermediate Text] (second ed.). New Jersey: John Wiley and Sons, Inc. p. 167. ISBN 978-0-471-45024-5.
- ^ Anderson, J. Edgar (1974). Dynamic Chemistry [Topics in Current Chemistry]. Topics in Current Chemistry Fortschritte der Chemischen Forschung. Vol. 45. Springer-Verlag. p. 139. doi:10.1007/3-540-06471-0. ISBN 978-3-540-06471-8.
- ^ a b Anslyn, Eric V.; Dougherty, Dennis A. (2006). Modern Physical Organic Chemistry. Sausalito, CA: University Science Books. pp. 104–105. ISBN 978-1-891389-31-3.
- ^ 참고: 다양한 조건에서 측정
- ^ Eliel, E.L.; Wilen, S.H.; Mander, L.N. (1994). Stereochemistry of Organic Compounds. New York: Wiley. ISBN 81-224-0570-3.
- ^ Eliel, E.L.; Allinger, N.L.; Angyal, S.J.; G.A., Morrison (1965). Conformational Analysis. New York: Interscience Publishers.
- ^ Hirsch, J.A. (1967). Topics in Stereochemistry (first ed.). New York: John Wiley & Sons,Inc. p. 199.
- ^ Romers, C.; Altona, C.; Buys, H.R.; Havinga, E. (1969). Topics in Stereochemistry (fourth ed.). New York: John Wiley & Sons,Inc. p. 40.
- ^ https://groups.chem.ubc.ca/chem330/A-values.pdf
- ^ Huang, C.-Y.; Cabell, L.A.; Anslyn, E.V. (1994). "Molecular Recognition of Cyclitols by Neutral Polyaza-Hydrogen-Bonding Receptors: The Strength and Influence of Intramolecular Hydrogen Bonds between Vicinal Alcohols". Journal of the American Chemical Society. 116 (7): 2778–2792. doi:10.1021/ja00086a011.