니트로 화합물의 감소
Reduction of nitro compounds니트로 화합물의 감소는 유기화학에 대한 폭넓은 관심의 화학반응이다. 변환은 많은 시약에 의해 영향을 받을 수 있다. 니트로 그룹은 축소된 최초의 기능 그룹 중 하나였다. 알킬과 아릴 니트로 화합물은 다르게 작용한다. 가장 유용한 것은 아릴 니트로 화합물의 감소다.
방향성 니트로 화합물
아닐린으로 환원
질산염의 감소는 산업적 규모로 이루어진다.[1] 다음과 같은 많은 방법이 존재한다.
- 다음을 사용한 촉매 수소화: 래니 니켈[2] 또는 팔라듐-온-탄소,[3][4][5] 백금()IV) 산화물 또는 우루시바라 니켈.[6]
- 산성 용기에 철분을 넣는다.[7][8][9]
- 수황산나트륨[10]
- 황화 나트륨(또는 황화수소 및 염기). 디니트로페놀을 니트로아미노페놀로 선택적으로 감소시킴으로써 설명된다.[11]
- 염화 주석(II)[12]
- 염화 티타늄(III)
- 사마륨[13]
- 하이드로다이오드산[14]
금속 하이드라이드는 아조 화합물을 생산하는 경향이 있기 때문에 아릴 니트로 화합물을 아일린으로 줄이는 데 일반적으로 사용되지 않는다. (아래 참조)
히드록시아민에 대한 감소
아릴 니트로 화합물로부터 아릴 히드록시아민(aryl hydroxylamin)을 생산하기 위한 몇 가지 방법이 설명되었다.
히드라지노 화합물로의 감소
아연 금속이 과다한 니트로아렌을 처리하면 N,N'diarylhydrazine이 형성된다.[19]
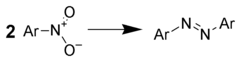
아조 화합물 감소
금속 하이드라이드를 사용한 방향족 니트로 화합물을 처리하면 아조 화합물의 수율이 좋다. 예를 들어 다음을 사용할 수 있다.
알리파아틱 니트로 화합물
탄화수소에 대한 감소
가수분해(니트로 집단을 수소로 대체)는 달성하기 어렵지만 고온에서 실리카겔에 백금 이상의 촉매수소로 효과를 볼 수 있다.[21] 이러한 반응은 하이드라이드인 트리뷰티린과 급진적인 이니시에이터인 AIBN을 예로 들면서 급진적인 반응을 통해서도 나타날 수 있다.[22]
아민으로 환원
몇 가지 시약에 의해 아미노산 화합물을 아미노산염으로 줄일 수 있다.
- 백금을 사용한 촉매 수소화().IV) 산화물(PTO2)[23] 또는 래니 니켈[24]
- 환류 아세트산[25] 철금속
- 사마륨다이오다이오드[26]
- 래니 니켈, 탄소 백금, 아연 분진 및 폼산 또는 암모늄 포메이트[6]
α,β-불포화 니트로 화합물은 다음을 통해 포화 아민으로 감소할 수 있다.
- 팔라듐-온-탄소에서의 촉매 수소화
- 철금속
- 리튬 알루미늄 하이드라이드[27](참고: 히드록시아민과 소시지는 대표적인 불순물이다.)
- 리튬보루무화수소 또는 보루무화 나트륨 및 트리메틸실릴 염화물[28]
- 레드알[29]
히드록시아민에 대한 감소
알리프하틱 니트로 화합물은 디보레인(diborane)[30]을 사용하여 알리프하틱 히드록시아민으로 감소시킬 수 있다.
또한 아연 분진과 염화암모늄을 사용하여 다음과 같은 반응을 수행할 수 있다.[31][32][33]
- R-NO2 + 4 NH4Cl + 2 Zn → R-NH-OH + 2 ZnCl2 + 4 NH3 + H2O
소변량 감소
니트로 화합물은 일반적으로[34] 금속 염분을 사용하여 산화물로 환원된다.II) 염화물.[35] 또한, 조절된 양의 수소를 이용한 촉매 수소는 소변을 발생시킬 수 있다.[36]
참조
- ^ Gerald Booth (2007). "Nitro Compounds, Aromatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_411.
- ^ Allen, C. F. H.; VanAllan, J. (1955). "2-Amino-p-cymene". Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Bavin, P. M. G. (1973). "2-Aminofluorene". Organic Syntheses.; Collective Volume, vol. 5, p. 30
- ^ Smith, Michael B.; March, Jerry (2007). March's Advanced Organic Chemistry (6th ed.). John Wiley & Sons. p. 1816. ISBN 978-0-471-72091-1.
- ^ Ram, Siya; Ehrenkaufer, Richard E. (1984). "A general procedure for mild and rapid reduction of aliphatic and aromatic nitro compounds using ammonium formate as a catalytic hydrogen transfer agent". Tetrahedron Lett. 25 (32): 3415–3418. doi:10.1016/S0040-4039(01)91034-2. hdl:2027.42/25034.
- ^ a b Adams, J. P. (2002). "Nitro and related groups". Journal of the Chemical Society, Perkin Transactions 1 (23): 2586–2597. doi:10.1039/b009711j.
- ^ Fox, B. A.; Threlfall, T. L. (1964). "2,3-Diaminopyridine". Organic Syntheses. 44: 34. doi:10.15227/orgsyn.044.0034.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Mahood, S. A.; Schaffner\doi=10.15227/orgsyn.011.0032, P. V. L. (1931). "2,4-Diaminotoluene". Organic Syntheses. 11: 32. doi:10.15227/orgsyn.011.0032.
- ^ "O-Aminobenzaldehyde, Redox-Neutral Aminal Formation and Synthesis of Deoxyvasicinone". Organic Syntheses. 89: 274. 2012. doi:10.15227/orgsyn.089.0274.
- ^ Redemann, C. T.; Redemann, C. E. (1955). "5-Amino-2,3-dihydro-1,4-phthalazinedione". Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Hartman, W. W.; Silloway, H. L. (1945). "2-Amino-4-nitrophenol". Organic Syntheses. 25: 5. doi:10.15227/orgsyn.025.0005.
- ^ Faul, Margaret M.; Thiel, Oliver R. (2005). "Tin(II) Chloride". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rt112.pub2. ISBN 9780470842898.
- ^ Basu, M. K. (2000). "Ultrasound-promoted highly efficient reduction of aromatic nitro compounds to the aromatic amines by samarium/ammonium chloride". Tetrahedron Lett. 41 (30): 5603–5606. doi:10.1016/S0040-4039(00)00917-5.
- ^ Kumar, J. S. Dileep; Ho, ManKit M.; Toyokuni, Tatsushi (2001). "Simple and chemoselective reduction of aromatic nitro compounds to aromatic amines: reduction with hydriodic acid revisited". Tetrahedron Letters. 42 (33): 5601–5603. doi:10.1016/s0040-4039(01)01083-8.
- ^ Ayyangar, N. R.; Brahme, K. C.; Kalkote, U. R.; Srinivasan, K. V. (1984). "Facile Transfer-Reduction of Nitroarenes to N Arylhydroxylamines with Hydrazine in the Presence of Raney Nickel". Synthesis. 1984 (11): 938. doi:10.1055/s-1984-31027.
- ^ Harman, R. E. (1963). "Chloro-p-benzoquinone". Organic Syntheses.; Collective Volume, vol. 4, p. 148
- ^ Kamm, O. (1941). "β-Phenylhydroxylamine". Organic Syntheses.; Collective Volume, vol. 1, p. 445
- ^ Ichikawa, S.; Zhu, S.; Buchwald, S. (2018). "A Modified System for the Synthesis of Enantioenriched N-Arylamines through Copper-Catalyzed Hydroamination". Angewandte Chemie International Edition. 57 (28): 8714–8718. doi:10.1002/anie.201803026. hdl:1721.1/125726. PMC 6033674. PMID 29847002.
- ^ a b Bigelow, H. E.; Robinson, D. B. (1955). "Azobenzene". Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ R. F. Nystrom & W. G. Brown (1948). "Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds". J. Am. Chem. Soc. 70 (11): 3738–3740. doi:10.1021/ja01191a057. PMID 18102934.
- ^ M. J. Guttieri & W. F. Maier (1984). "Selective cleavage of carbon-nitrogen bonds with platinum". J. Org. Chem. 49 (16): 2875–2880. doi:10.1021/jo00190a006.
- ^ T. V. (바부) 라잔바부, 필립 C. Bulman Page, Benjamin R. Buckley, "Tri-n-butylstanane" 유기합성을 위한 시약 백과사전, John Wiley & Sons. doi:10.1002/047084289X.rt181.pub2
- ^ A. T. Nielsen (1962). "The Isomeric Dinitrocyclohexanes. II. Stereochemistry". J. Org. Chem. 27 (6): 1998–2001. doi:10.1021/jo01053a019.
- ^ Dauben, Jr., H. J.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, Jr., A. G. (1963). "Cycloheptanone". Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Senkus, M. (1948). "Ind. Eng. Chem". 40: 506.
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ A. S. Kende & J. S. Mendoza (1991). "Controlled reduction of nitroalkanes to alkyl hydroxylamines or amines by samarium diiodide". Tetrahedron Letters. 32 (14): 1699–1702. doi:10.1016/S0040-4039(00)74307-3.
- ^ A. Burger, M. L. Stein and J. B. Clements (1957). "Some Pyridylnitroalkenes, Nitroalkanols, and Alkylamines". J. Org. Chem. 22 (2): 143–144. doi:10.1021/jo01353a010.
- ^ Giannis, A.; Sandhoff, K. (1989). "LiBH4(NaBH4)/Me3SiCl, an Unusually Strong and Versatile Reducing Agent". Angewandte Chemie International Edition in English. 28 (2): 218–220. doi:10.1002/anie.198902181.
- ^ Butterick, John R.; Unrau, A. M. (1974). "Reduction of β-nitrostyrene with sodium bis-(2-methoxyethoxy)-aluminium dihydride. A convenient route to substituted phenylisopropylamines". J. Chem. Soc., Chem. Commun. (8): 307–308. doi:10.1039/c39740000307.
- ^ H. Feuer, R. S. Bartlett, B. F. Vincent and R. S. Anderson (1965). "Diborane Reduction of Nitro Salts. A New Synthesis of N-Monosubstituted Hydroxylamines". J. Org. Chem. 30 (9): 2880–2882. doi:10.1021/jo01020a002.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Smith, P.W.G.; Tatchell, A.R. (1965), "Aliphatic Nitro Compounds and Amines", Fundamental Aliphatic Chemistry, Elsevier, pp. 245–266, doi:10.1016/b978-0-08-010746-2.50016-8, ISBN 978-0-08-010746-2, retrieved 2021-01-27
- ^ Kelly, Sean M.; Lipshutz, Bruce H. (2014-01-03). "Chemoselective Reductions of Nitroaromatics in Water at Room Temperature". Organic Letters. 16 (1): 98–101. doi:10.1021/ol403079x. ISSN 1523-7060. PMC 4013784. PMID 24341483.
- ^ Ung, Stéphane; Falguières, Annie; Guy, Alain; Ferroud, Clotilde (August 2005). "Ultrasonically activated reduction of substituted nitrobenzenes to corresponding N-arylhydroxylamines". Tetrahedron Letters. 46 (35): 5913–5917. doi:10.1016/j.tetlet.2005.06.126.
- ^ Braun, V. J.; Sobecki, W. (1911). "Über primäre Dinitro-, Nitronitrit- und Dialdoxim-Verbindungen der Fettreihe". Ber. 44 (3): 2526–2534. doi:10.1002/cber.19110440377.
- ^ J. R. Hanson & E. Premuzic (1967). "Applications of chromous chloride--II : The reduction of some steroidal nitro-compounds". Tetrahedron. 23 (10): 4105–4110. doi:10.1016/S0040-4020(01)97921-9.
- ^ C. Grundmann (1950). "Über die partielle Reduktion von Nitro-cyclohexan". Angewandte Chemie. 62 (23–24): 558–560. doi:10.1002/ange.19500622304.