유기 촉매 분석
Organocatalysis유기화학에서 유기촉매는 유기촉매에 의해 화학반응 속도가 증가하는 촉매작용의 한 형태이다.이 "유기 촉매"는 탄소,[3][4][5][6][7][8] 수소, 황 그리고 유기 화합물에서 발견되는 다른 비금속 원소들로 구성됩니다.구성 및 설명의 유사성 때문에 반응 속도와 관련된 촉매 작용의 형태에 대한 유사한 효과로 인해 효소의 잘못된 명칭으로 오인되는 경우가 많다.
2차 아민기능을 나타내는 유기촉매는 에나민 촉매(활성 에나민 친핵체의 촉매량 형성) 또는 이미늄 촉매(활성화된 이미늄 일렉트로파일의 촉매량 형성) 중 하나를 수행하는 것으로 기술할 수 있다.이 메커니즘은 공유성 유기 조직 투석을 위한 전형적인 메커니즘입니다.기질의 공유 결합은 일반적으로 높은 촉매 부하를 필요로 한다(프롤린 촉매의 경우 일반적으로 20~30 mol%).수소 결합과 같은 비공유 상호작용은 낮은 촉매 부하(0.001 mol%까지 감소)를 촉진합니다.
유기 촉매 작용은 몇 가지 이점을 제공합니다.금속 기반 촉매 작용이 필요하지 않으므로 녹색 화학에 기여합니다.이러한 맥락에서 단순 유기산은 물 속의 셀룰로오스 변형을 위한 촉매로 사용되어 왔다.[9]유기 촉매가 키랄일 때 비대칭 촉매작용을 할 수 있는 길이 열립니다. 예를 들어, 알돌 반응에 프롤린을 사용하는 것은 키랄성과 녹색 화학의 [10]한 예입니다.유기 화학자인 데이비드 맥밀런과 벤자민 리스트는 비대칭 유기 [11]촉매에 대한 연구로 2021년 노벨 화학상을 받았다.
서론
일반적인 아키랄 유기 촉매는 크노에베나겔 [12]축합에 사용되는 피페리딘과 같은 질소를 기반으로 합니다.에스테르페이션에[13] 사용되는 DMAP 및 Baylis-Hillman [14]반응에 사용되는 DABCO.스테터 반응에는 티아졸륨염이 사용된다.이러한 촉매와 반응은 오랜 역사를 가지고 있지만, 현재 유기 촉매에 대한 관심은 비대칭 유기 촉매 또는 에난티오 선택적 유기 촉매라고 불리는 키랄 촉매와의 비대칭 촉매에 집중되어 있습니다.1970년대에 개발된 선구적 반응을 하조스-파리쉬-에더-사우르-비체르트 반응이라고 한다.1968년과 1997년 사이에 작은 유기 분자를 비대칭 반응에 촉매로 사용하는 것에 대한 보고는 거의 없었지만(하호스-파리 반응은 아마도 가장 유명할 것이다), 이러한 화학 연구는 더 크고 상호 연결된 [15]분야의 필수적인 부분이라기보다는 독특한 화학 반응으로 간주되었다.
이 반응에서 자연발생하는 키랄프롤린은 알돌 반응에서 키랄촉매이다.원료는 아키랄 트리케톤이며, 93%의 항산화질 과잉 케톨인 반응 생성물을 얻기 위해서는 3%의 프롤린만 있으면 된다.이것은 아미노산 촉매 비대칭 알돌 [16][17]반응의 첫 번째 예이다.
Wieland-Miescher 케톤의 비대칭 합성(1985)도 프롤린에 기초하고 있으며, 또 다른 초기 적용은 로버트 B에 의한 에리트로마이신 전체 합성에서의 변형 중 하나였다. 우드워드(1981년).[18]미니 리뷰 다이제스트 기사는 유기 촉매 [19]반응을 이용한 천연 및 의약품의 종합 합성 예에 초점을 맞추고 있다.
많은 키랄 유기 촉매는 키랄 리간드의 적응이며(금속 중심과 함께 비대칭 반응을 촉매하기도 함) 두 개념 모두 어느 정도 겹친다.
1997년 Yian Shi가 트랜스 및 트리치환 [20]올레핀과 키랄 다이옥시란의 촉매적 비대칭 에폭시화를 통한 최초의 일반적이고 고도로 항선택적인 유기 촉매 반응을 보고하면서 유기 촉매 분야의 돌파구가 마련되었다.그 이후로, 몇 가지 다른 유형의 반응이 개발되었습니다.
유기 촉매 클래스
비대칭 합성을 위한 유기 촉매는 여러 등급으로 분류할 수 있다.
- 생체분자: 프롤린, 페닐알라닌.일반적으로 [21]2차 아민입니다.신초나 알칼로이드, 특정 올리고펩타이드.
- 생체 분자에서 파생된 합성 촉매.
- TADDOLs를 포함한 수소결합촉매, NOBIN 등의 BINOL 유도체 및 티오레아에 기초한 유기촉매
- 차세대 스테터 반응 촉매로서의 트리아졸륨염
유기 촉매와 관련된 비대칭 반응의 예는 다음과 같다.
프롤린
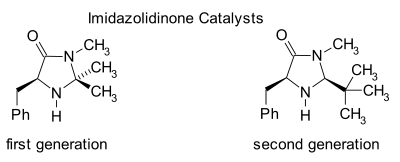
이미다졸리디논유기촉매
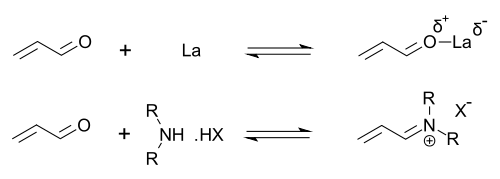
이미다졸리디논은 비대칭 디엘-알더 반응과 마이클 첨가물과 같은 많은 변환의 촉매이다.키랄 촉매는 종종 높은 에난티오선택성을 가진 비대칭 반응을 유도한다.이 촉매는 α,β-불포화 알데히드(에날) 및 에논의 카르보닐기와 함께 빠른 화학적 평형 상태에서 이미늄 이온을 형성함으로써 작동합니다.이 이미늄 활성화는 루이스산에 의한 카르보닐기 활성화와 유사하며 두 촉매 모두 기질의 LUMO를 [24][25]낮춥니다.
과도성 이미늄 중간체는 키랄 유도를 통해 반응 생성물로 전달되는 키랄이다.촉매는 Diels-Alder 반응, Michael 첨가물, Friedel-Crafts 알킬레이션, 전달 수소화 및 에폭시화에 사용되었습니다.
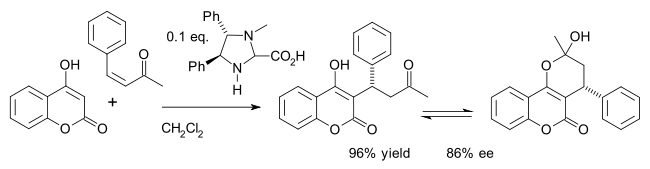
한 가지 예는 4-히드록시쿠마린과 벤질리데아세톤의 [26]Michael 첨가물에서 약물 와파린의 비대칭 합성이다.
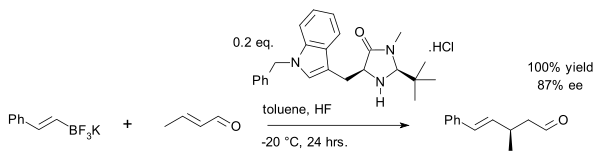
최근의 개발은 유기 [27]불소산염에 의한 크로톤알데히드의 비닐 알킬화이다.
그 밖의 사용 예로는 유기 촉매 전달 수소화 및 비대칭 디엘-알더 반응을 참조한다.
티오요소 유기 촉매 작용
유기촉매의 큰 그룹은 요소 또는 티오요소 부분을 포함한다.(티오) 요소 유기 촉매라고 불리는 이러한 촉매 효과적 요소 유도체는 H 결합 수용 기질을 조정하고 활성화하기 위해 [28]명시적인 이중 수소 결합 상호작용을 제공합니다.
레퍼런스
- ^ Justus von Liebig, Justus (1860). "Ueber die Bildung des Oxamids aus Cyan". Annalen der Chemie und Pharmacie. 113 (2): 246–247. doi:10.1002/jlac.18601130213.
- ^ W. Langenbeck (1929). "Über organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden". Liebigs Ann. 469: 16–25. doi:10.1002/jlac.19294690103.
- ^ Berkessel, A.; Groeger, H. (2005). Asymmetric Organocatalysis. Weinheim: Wiley-VCH. ISBN 978-3-527-30517-9.
- ^ 특별호:
- ^ Peter I. Dalko; Lionel Moisan (2004). "In the Golden Age of Organocatalysis". Angew. Chem. Int. Ed. 43 (39): 5138–5175. doi:10.1002/anie.200400650. PMID 15455437.
- ^ Matthew J. Gaunt; Carin C.C. Johansson; Andy McNally; Ngoc T. Vo (2007). "Enantioselective organocatalysis". Drug Discovery Today. 12 (1/2): 8–27. doi:10.1016/j.drudis.2006.11.004. PMID 17198969.
- ^ Dieter Enders; Christoph Grondal; Matthias R. M. Hüttl (2007). "Asymmetric Organocatalytic Domino Reactions". Angew. Chem. Int. Ed. 46 (10): 1570–1581. doi:10.1002/anie.200603129. PMID 17225236.
- ^ Peter I. Dalko; Lionel Moisan (2001). "Enantioselective Organocatalysis". Angew. Chem. Int. Ed. 40 (20): 3726–3748. doi:10.1002/1521-3773(20011015)40:20<3726::AID-ANIE3726>3.0.CO;2-D.
- ^ 국제특허 WO 2006068611 A1 20060629 "아민 및 알코올의 직접 균질 및 이종 유기산 및 아미노산 촉매 수정" 발명가: Armando Cördova, 스웨덴, 스톡홀름, 요나스 하프렌.
- ^ 미국 특허 3,975,440의 예4 1976년 8월 17일, 1970년 12월 9일 출원된 Zoltan G.하조스와 데이비드 R. 패리쉬.
- ^ "2021 Nobel Prize in chemistry". Nobel Prize. Nobel Prize. Retrieved 6 October 2021.
- ^ List, B. (2010). "Emil Knoevenagel and the Roots of Aminocatalysis". Angewandte Chemie International Edition in English. 49 (10): 1730–1734. doi:10.1002/anie.200906900. PMID 20175175.
- ^ Neises, Bernhard; Steglich, Wolfgang (July 1978). "Simple Method for the Esterification of Carboxylic Acids". Angewandte Chemie International Edition in English. 17 (7): 522–524. doi:10.1002/anie.197805221.
- ^ Basavaiah, Deevi; Rao, Anumolu Jaganmohan; Satyanarayana, Tummanapalli (March 2003). "Recent Advances in the Baylis−Hillman Reaction and Applications". Chemical Reviews. 103 (3): 811–892. doi:10.1021/cr010043d. PMID 12630854.
- ^ MacMillan, David W. C. (2008). "The advent and development of organocatalysis". Nature. Springer Science and Business Media LLC. 455 (7211): 304–308. doi:10.1038/nature07367. ISSN 0028-0836. PMID 18800128. S2CID 205215034.
- ^ Z. G. Hajos, D. R. Parrish, 독일 특허 DE 2102623 1971
- ^ Zoltan G. Hajos; David R. Parrish (1974). "Asymmetric synthesis of bicyclic intermediates of natural product chemistry". J. Org. Chem. 39 (12): 1615–1621. doi:10.1021/jo00925a003.
- ^ R. B. Woodward; E. Logusch; K. P. Nambiar; K. Sakan; D. E. Ward; B. W. Au-Yeung; P. Balaram; L. J. Browne; et al. (1981). "Asymmetric total synthesis of erythromcin. 1. Synthesis of an erythronolide A secoacid derivative via asymmetric induction". J. Am. Chem. Soc. 103 (11): 3210–3213. doi:10.1021/ja00401a049.
- ^ B. -F. Sun (2015). "Total synthesis of natural and pharmaceutical products powered by organocatalytic reactions". Tetrahedron Lett. 56 (17): 2133–2140. doi:10.1016/j.tetlet.2015.03.046.
- ^ Wang, Zhi-Xian; Tu, Yong; Frohn, Michael; Zhang, Jian-Rong; Shi, Yian (1997-11-01). "An Efficient Catalytic Asymmetric Epoxidation Method". Journal of the American Chemical Society. 119 (46): 11224–11235. doi:10.1021/ja972272g. ISSN 0002-7863.
- ^ Bertelsen, Søren (2009). "Organocatalysis—after the gold rush". Chemical Society Reviews. 38 (8): 2178–89. doi:10.1039/b903816g. PMID 19623342.
- ^ Gaunt, M. J.; Johansson, C. C. C.; McNally, A.; Vo, N. T. (2007). "Enantioselective organocatalysis". Drug Discovery Today. 12 (1–2): 8–27. doi:10.1016/j.drudis.2006.11.004. PMID 17198969.
- ^ Kucherenko, A. S.; Siyutkin, D. E.; Maltsev, O. V.; Kochetkov, S. V.; Zlotin, S. G. (2013). "Asymmetric organocatalysis: From proline to highly efficient immobilized organocatalysts". Russian Chemical Bulletin. 61 (7): 1313. doi:10.1007/s11172-012-0177-4. S2CID 93168492.
- ^ Gérald Lelais; David W. C. MacMillan (2006). "Modern Strategies in Organic Catalysis: The Advent and Development of Iminium Activation" (PDF). Aldrichimica Acta. 39 (3): 79.
- ^ Erkkilä, Anniinä; Majander, Inkeri; Pihko, Petri M. (2007). "Iminium Catalysis". Chem. Rev. 107 (12): 5416–5470. doi:10.1021/cr068388p. PMID 18072802.
- ^ Nis Halland; Tore Hansen; Karl Anker Jørgensen (2003). "Organocatalytic Asymmetric Michael Reaction of Cyclic 1,3-Dicarbonyl Compounds and α,β-Unsaturated Ketones – A Highly Atom-Economic Catalytic One-Step Formation of Optically Active Warfarin Anticoagulant". Angew. Chem. Int. Ed. 42 (40): 4955–4957. doi:10.1002/anie.200352136. PMID 14579449.
- ^ Sandra Lee; David W. C. MacMillan (2007). "Organocatalytic Vinyl and Friedel-Crafts Alkylations with Trifluoroborate Salts" (PDF). J. Am. Chem. Soc. 129 (50): 15438–15439. doi:10.1021/ja0767480. PMID 18031044.
- ^ Madarász, Ádám; Dósa, Zsolt; Varga, Szilárd; Soós, Tibor; Csámpai, Antal; Pápai, Imre (July 2016). "Thiourea Derivatives as Brønsted Acid Organocatalysts" (PDF). ACS Catalysis. 6 (7): 4379–4387. doi:10.1021/acscatal.6b00618.