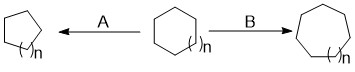
링의 신축
Ring expansion and contraction유기합성 과정에서 발생하는 링 팽창 및 링 수축 반응은 기존 링의 팽창 또는 수축으로 이어질 수 있는 일련의 반응을 말한다.이것은 종종 단일 순환 반응으로 합성하는 것이 불가능하지는 않더라도 어려운 구조에 접근하는 것을 가능하게 한다.링 확장은 형성 속도가 느리기 때문에 단일 사이클라이제이션으로 합성하기 어려운 대형 시스템에 접근할 수 있기 때문에 중요합니다.링 수축은 큰 링에서 작고 변형된 링을 만드는 데 유용합니다.팽창은 팽창 메커니즘과 추가된 원자에 의해 분류된다. 수축은 단순히 수축하는 반응성 중간체로 특징지어진다.
묘사
유기 합성 과정에서 화학자는 종종 새로운 고리를 형성하거나 기존 고리를 변경해야 한다.링 확장 및 링 수축 반응은 기존 링을 확장 또는 수축하기 위해 사용되며, 단일 사이클화 반응으로는 합성하기 어렵지만 종종 어려운 구조에 접근할 수 있습니다.
링 팽창 반응
링 확장은 형성 속도가 느리기 때문에 단일 사이클라이제이션으로 합성하기 어려운 대형 시스템에 접근할 수 있기 때문에 가치가 있습니다(7개 이상의 멤버 [1]링).팽창 메커니즘과 첨가된 원자(들)에 의해 링 팽창을 분류함으로써 다른 팽창 방법과 다른 통합된 원자 사이의 유사성을 볼 수 있다.가장 광범위한 분류는 확장 메커니즘에 의해 이루어집니다.링은 링에 이미 부가된 외부 그룹에 대한 공격(이동/삽입), 자전거가 하나의 큰 링에 개방되거나 링 폐쇄와 확장을 [2]결합함으로써 확장할 수 있습니다.이러한 팽창은 팽창 링에 어떤 유형의 원자(탄소 또는 헤테로 원자)를 포함시키느냐에 따라 더욱 세분화될 수 있습니다.
탄소 삽입 반응
탄소 삽입은 고리 안에 추가적인 탄소 원자를 도입하는 매우 유용한 반응입니다.이러한 반응은 많은 약물과 천연물의 [2]합성에 사용된다.이것들은, 다음의 몇개의 메카니즘에 의해서 진행됩니다.
순환 외 집단으로의 이동을 통한 탄소 삽입
이러한 반응은 고리 근처의 탄소 위에 외환상 이탈기를 가지며, 고리 위에 내환상 결합의 이동을 개시할 수 있는 전자공여기를 갖는 일반적인 특징을 가진다.
탄소의 일반적인 이동 도입은 피나콜 [2]재배열이다.이 반응은 특히 바이시날 디히드록시드 재배열을 참조하지만 티페노프-뎀야노프 재배열과 같은 일반적인 메커니즘을 통해 진행되는 다른 피나콜 유형 재배열도 있습니다.이러한 "세미피나콜 재배치"는 보다 가벼운 조건에서 발생하므로 복잡한 [3]합성에서 선호된다.이러한 반응은 단순히 고리를 확장하는 것 이상으로 유용합니다. 왜냐하면 공격받은 외순환 그룹은 이탈 그룹 외에 다른 기능이 추가될 수 있기 때문입니다.또한 이미 존재하는 기능성(예를 들어 고리형 케톤에 대한 1.2 첨가)에 기초하여 내환 결합이 이동하는 그룹을 선택적으로 고리에 추가할 수 있다.
자전거 개통을 통한 탄소 삽입
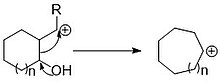
이륜계의 개구부를 통한 탄소 도입은 단일 탄소 또는 한 번에 여러 개의 탄소를 링에 도입하는 또 다른 방법이다.단일 탄소 도입은 종종 사이클로프로판을 통해 이루어지며, 사이클로프로판은 이후에 개방되어 확장된 고리를 형성합니다.팽창은 전기 실린더 링의 개구부를 통해 또는 공유 결합의 유도된 균열로 인해 발생할 수 있습니다.
이러한 반응은 탄소가 사이클로프로판 고리를 형성하기 위해 어떻게 첨가되는지에 따라 구별됩니다.알켄 함유 고리와의 시몬스-스미스 반응을 이용하여 단일 탄소를 도입할 수 있다.다른 기능을 사이클로프로판트화하는 방법으로는 부흐네르 고리 포뉴클레오필릭 공격(A) 및 인접 그룹 기증(B)이 있다.단일 탄소 팽창 시 사이클로프로판 링을 형성하면 삽입되는 카본에 추가 기능이 추가될 경우 링 팽창과 함께 추가 기능을 도입할 수 있습니다.사이클로프로판화의 표적은 또한 사용된 조건에 따라 달라집니다.Simmons-Smith 반응은 알켄을 증가시키고 Buchner 고리의 팽창은 전형적으로 반응하지 않는 아렌을 증가시킨다.부흐네르 고리 팽창은 아줄렌과 같은 일부 천연물의 핵심에서 발견되는 고리 개방 생성물로 시클로헵타트리엔을 제공하기 때문에 유용합니다.이러한 고리의 팽창에 있어서 중요한 고려사항은 원래 고리의 외환기 또는 열 수 없는 제품이 아닌 확장된 고리에 대한 고리 개방이다.부흐네르 고리의 팽창은 첨가된 탄소에 전자 인출기를 배치함으로써 원하는 제품에 개방되도록 장려된다.포화 이환 분자에 대해 링 개방을 실시하기 위해서는 인접한 그룹이 팽창을 촉진하거나 팽창을[4] 공격하여 링을 개방하거나 외부 [5]그룹의 공격에 의해 링을 개방하도록 사이클로프로판을 도입해야 한다.
링 확장 수단으로서의 링 개방은 더 큰 링 시스템 사이클라이제이션에 접근할 수 있도록 더 큰 시스템에 적용할 수도 있습니다.Grob 플래그멘테이션은 이러한 확장의 예로서 적용할 수 있습니다.피나콜형 이동과 마찬가지로 그로브 조각화는 결합 이동을 촉진하고 이탈 그룹을 추방하기 위해 전자 기증 그룹에 의존합니다.이 때 전자공여기는 전자쌍을 제거하여 파괴결합을 가진 탄소에 기부할 수 있는 의사전자공여기일 수 있다.두 개의 작은 고리로 작업하면 확장된 고리로 작업하기 전에 분자의 두 부분을 개별적으로 정교하게 만들 수 있습니다.Dowd-Beck with ring expansion은 한 번에 여러 개의 탄소를 링에 추가할 수 있으며, 한 번에 여러 개의 탄소를 링에 추가할 수 있어 큰 [6]링을 만드는 데 유용한 도구입니다.중간 자전거를 통해 진행되는 동안 최종 사이클라이제이션과 링 개방은 동일한 래디컬 [7]반응 내에서 이루어집니다.이 팽창은 베타 케토에스테르를 큰 고리형 케톤으로 확장할 수 있게 해주기 때문에 유용하며, 고리형 케톤 또는 고리형 에스테르 중 하나를 사용하여 쉽게 정교해질 수 있다.
헤테로 원자 삽입 반응
링에 대한 헤테로 원자 추가는 링 확장을 통해 발생할 수 있습니다.이러한 추가는 탈노보 링 [8]합성을 통해 이루어지지 않을 경우 발생합니다.이러한 도입은 탄소에 대해 위에서 언급한 것과 유사한 이동/삽입 경로를 통해 발생하기 때문에 주로 고리 팽창이다.예를 들어, 합성 시 베크만 재배열([9]코데인에 질소를 도입하기 위한)과 바이어-빌리거 산화(케이지-애너레이션 [10]에테르에 산소 도입)의 높은 충격 적용을 포함한다.둘 다 알킬기가 피나콜형 재배열과 현저하게 유사한 외환 헤테로 원자 위로 이동하면서 이탈기가 배출되면서 발생한다.
링 수축 반응
링 수축은 큰 링에서 작고 변형된 링을 만드는 데 유용합니다.이러한 링을 만드는 원동력은 그러한 링이 원자를 절단할 수 있는 정교한 큰 링에서 더 쉽게 만들어질 수 있거나 원래의 큰 골격에 [11]더 쉽게 접근할 수 있을 때 완전히 정교한 작은 링을 만드는 것과 관련된 어려움에서 비롯됩니다.
링 수축은 단순히 수축하는 반응성 중간체에 의해 쉽게 특징지어진다.표준 중간체는 음이온성, 양이온성 및 카르베노이드입니다.[12]
음이온 수축
Favoreskii 편곡은 음이온 [13]고리 수축의 포스터 차일드입니다.그것은 내환 탄소를 공격하고 원래의 것보다 작은 고리를 가진 이환 분자를 형성하는 이탈 그룹(할로겐화물)을 배출하는 카르보니온을 통해 진행됩니다.그런 다음 자전거를 케톤에 대한 친핵성 공격에 의해 개방하여 수축된 제품을 제공합니다.
표준적인 Friveskii 전위 대신에 음이온기가 이탈기와 정렬된 결합을 촉진하여 이탈기를 이동 및 배출하는 음의 피나콜 전위라고 생각되는 것을 실행하는 것이다.이 결합은 여러 [12]합성에서 사용되어 왔다.또한 소위 "준-파보르스키 재배열"은 추가 친핵성 없이 진행되어 최종 계약 생성물을 형성한다는 점에 유의해야 한다.
양이온 수축
양이온성 재배열 수축은 이탈 그룹의 손실과 탄소위치로의 내순환 결합 이동을 통해 진행됩니다.피나콜 타입의 재배열은 이러한 종류의 [14]수축에 자주 사용됩니다.팽창 반응처럼 이것은 전자 기증 그룹이 이동을 돕는 것과 함께 진행됩니다.
한쪽 링의 수축반응을 다른 한쪽 링의 팽창과 결합하여 균일한 크기의 융착링과 불균등한 자전거로 할 수 있다.이러한 양이온성 재배열은 복잡한 [15]분자의 핵심을 합성하는 데 사용되었습니다.
카르베노이드 수축
Wolff 재배열을 사용하여 링 축소를 실행할 수 있습니다.그것은 디아조케톤의 분해에서 생성된 카르베노이드를 통해 진행되며, 이는 케톤의 [16]반대편에 있는 탄소-탄소 결합에 삽입된다.
레퍼런스
- ^ Casadei, M.A.; Calli, C.; Mandolini, L. (February 1, 1984). "Ring-closure reactions. 22. Kinetics of cyclization of diethyl (.omega.-bromoalkyl)malonates in the range of 4- to 21-membered rings. Role of ring strain". Journal of the American Chemical Society. 106 (4): 1051–1056. doi:10.1021/ja00316a039.
- ^ a b c Kantorowski, E.J.; Kurth, M.J. (2000). "Expansion to seven-membered rings" (PDF). Tetrahedron. 56 (26): 4317–4353. doi:10.1016/S0040-4020(00)00218-0. S2CID 34628258. Archived from the original (PDF) on August 18, 2019.
- ^ Kurti, L.; Czako, B. (2005). Strategic Applications of Named Reactions. Elsevier. p. 350. ISBN 978-0-12-429785-2. OCLC 1107566236.
- ^ Bieräugel, H.; Akkerman, J. M.; Armande, J. C. L.; Pandit, U. K. (1974). "A specific insertion of carbenes into carbon-carbon bonds". Tetrahedron Letters. 15 (33): 2817–2820. doi:10.1016/S0040-4039(01)91751-4.
- ^ Hoberg, J.O.; Bozell, J.J. (September 1995). "Cyclopropanation and ring-expansion of unsaturated sugars". Tetrahedron Letters. 36 (38): 6831–6834. doi:10.1016/0040-4039(95)01387-W.
- ^ Hierold, J.; Lupton, D.W. (July 2012). "Synthesis of Spirocyclic γ-Lactones by Cascade Beckwith–Dowd Ring Expansion/Cyclization". Organic Letters. 14 (13): 3412–3415. doi:10.1021/ol301387t. PMID 22691029.
- ^ 다우드, P; 최; S. C. J. Am.화학, Soc. 1987, 3493–3494
- ^ McMurry, John (2008). Organic Chemistry 7th Ed. pp. 945–946. ISBN 978-0-495-11258-7.
- ^ White, J. D.; Hrnciar, P.; Stappenbeck, F. (1999). "Asymmetric Total Synthesis of (+)-Codeine via Intramolecular Carbenoid Insertion". Journal of Organic Chemistry. 63 (21): 7871–7884. doi:10.1021/jo990905z.
- ^ Marchand, A. P.; Kumar, V. S.; Hariprakasha, H. K. (2001). "Synthesis of Novel Cage Oxaheterocycles". Journal of Organic Chemistry. 66 (6): 2072–2077. doi:10.1021/jo001611c. PMID 11300903.
- ^ 실바, L.F.4면체 2002, 9137-9161[full citation needed]
- ^ a b Myers, Andrew. "Methods for Ring Contraction" (PDF). Retrieved November 30, 2014 – via Harvard University Department of Chemistry and Chemical Biology.
- ^ Chenier, Philip J. (1978). "The Favorskii Rearrangement in Bridged Polycyclic Compounds". Journal of Chemical Education. 55 (5): 286–291. Bibcode:1978JChEd..55..286C. doi:10.1021/ed055p286.
- ^ Song, Zhen-Lei; Fan, Chun-An; Tu, Yong-Qiang (2011). "Semipinacol Rearrangement in Natural Product Synthesis". Chemical Reviews. 111 (11): 7523–7556. doi:10.1021/cr200055g. PMID 21851053.
- ^ Büchi, G.; Hofheinz, W.; Paukstelis, J. V. (November 1969). "Synthesis of (-)-aromadendrene and related sesquiterpenes". Journal of the American Chemical Society. 91 (23): 6473–6478. doi:10.1021/ja01051a051.
- ^ Kirmse, W. (July 2002). "100 Years of the Wolff Rearrangement". European Journal of Organic Chemistry. 2002 (14): 2193. doi:10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D.