현미경 검사
Microscopy

현미경은 현미경을 사용하여 육안으로 볼 수 없는 물체(일반적인 눈의 해상도 범위 내에 있지 않은 물체)[1]와 물체의 영역을 보는 기술 분야입니다.최근 부상하고 있는 X선 현미경 [citation needed]분야와 함께 광학, 전자, 주사 프로브 현미경의 세 가지 잘 알려진 현미경 분야가 있습니다.
광학 현미경 및 전자 현미경은 표본과 상호 작용하는 전자기 방사선/전자 빔의 회절, 반사 또는 굴절, 그리고 이미지를 만들기 위해 산란 방사선 또는 다른 신호의 수집을 포함합니다.이 프로세스는 샘플의 광역 조사(예: 표준 광 현미경 및 투과 전자 현미경) 또는 샘플 위의 미세 빔(예: 공초점 레이저 스캔 현미경 및 스캔 전자 현미경)에 의해 수행될 수 있습니다.스캔 프로브 현미경 검사는 스캔 프로브와 관심 대상의 표면의 상호 작용을 포함합니다.현미경의 개발은 생물학에 혁명을 일으켰고, 조직학의 분야를 일으켰고, 따라서 생명과 물리학에서 필수적인 기술로 남아있습니다.X선 현미경 검사는 3차원적이고 비파괴적이며, 현장 또는 4D 스터디에 대해 동일한 샘플을 반복적으로 이미징할 수 있으며, 고해상도 기술에 희생되기 전에 연구 중인 샘플을 "내부를" 볼 수 있는 기능을 제공합니다.3D X선 현미경은 컴퓨터 단층 촬영(microCT) 기술을 사용하여 샘플을 360도 회전시키고 영상을 재구성합니다.CT는 일반적으로 평면 패널 디스플레이로 수행됩니다.3D X선 현미경은 4X에서 40X와 같은 다양한 목표를 사용하며 평면 패널도 포함할 수 있습니다.
역사

현미경 (광학 현미경) 분야는 적어도 17세기로 거슬러 올라갑니다.초기 현미경, 제한된 배율의 단일 렌즈 확대경은 적어도 13세기에 안경에 렌즈가 널리 사용된 것으로 거슬러 올라간다[2]. 그러나 더 발전된 복합 현미경은 1620년경 유럽에서 처음 등장했다[3][4] 현미경의 초기 실천자는 갈릴레오 갈릴레이를 포함한다,그는 1610년에 그가 c를 할 수 있다는 것을 발견했다망원경의 초점을 잃어 작은 물체들을[5][6] 가까이서 보기 위해 그리고 1620년경[7][8] Antonie van Leuwenhook에 복합 현미경을 발명했을 지도 모르는 Cornelis Drebel은 1670년대에 매우 높은 배율의 간단한 현미경을 개발했고 종종 최초로 인정된 현미경과 [9][10]미생물학자로 여겨집니다.
광학현미경

광학 또는 광현미경법은 [11]샘플을 확대하여 볼 수 있도록 샘플에서 투과되거나 반사된 가시광선을 단일 렌즈 또는 여러 렌즈를 통해 통과시키는 것을 포함합니다.결과 이미지는 눈으로 직접 감지하거나 사진판에 이미지를 찍거나 디지털로 캡처할 수 있습니다.기본 광현미경은 부착된 단일 렌즈 또는 렌즈 및 영상 장비의 시스템과 적절한 조명 장비, 샘플 스테이지 및 지지대가 구성됩니다.가장 최근의 개발은 관심 전시에 초점을 맞추기 위해 CCD 카메라를 사용하는 디지털 현미경입니다.이미지는 컴퓨터 화면에 표시되므로 아이피스가 [12]필요하지 않습니다.
한계
표준 광학 현미경(밝은 필드 현미경)의 한계는 세 가지 영역에 있습니다.
- 이 기술은 어둡거나 강하게 굴절되는 물체만 효과적으로 이미지화할 수 있습니다.
- 입사 파장에 따라 회절 제한 분해능이 있습니다. 가시 범위에서 광학 현미경의 분해능은 약 0.2 마이크로미터(현미경 참조)로 제한되고 실제 배율은 ~1500x로 [13]제한됩니다.
- 초점 평면 외부의 점에서 초점이 맞지 않는 빛은 이미지 [14]선명도를 감소시킵니다.
특히 살아있는 세포는 일반적으로 세포의 내부 구조가 무색하고 투명하기 때문에 성공적으로 연구되기에 충분한 대비가 부족합니다.콘트라스트를 증가시키는 가장 일반적인 방법은 선택적인 염료로 구조를 염색하는 것이지만, 이것은 종종 [15]샘플을 죽이고 고정하는 것을 포함합니다.또한 염색은 검체의 처리로 인해 발생하는 명백한 구조적 세부 사항인 아티팩트를 도입할 수 있으므로 검체의 특징이 아닙니다.일반적으로, 이러한 기술은 세포 구조의 굴절률의 차이를 이용합니다.밝은 장 현미경은 유리 창문을 통해 보는 것과 비슷합니다. 유리가 아니라 단지 유리 위의 먼지를 볼 수 있습니다.유리는 밀도가 높은 물질이기 때문에 빛이 통과하는 위상에 차이가 있습니다.인간의 눈은 이 위상의 차이에 민감하지 않지만, 이 위상의 차이를 진폭의 차이(빛의 [citation needed]세기)로 바꾸기 위해 교묘한 광학 솔루션이 고안되었습니다.
기술
검체 대비를 개선하거나 검체의 구조를 강조 표시하려면 특수 기술을 사용해야 합니다.조영제를 증가시키거나 검체에 레이블을 지정하기 위해 광범위한 현미경 검사 기술을 사용할 수 있습니다.
브라이트필드
밝은 자기장 현미경은 모든 빛 현미경 기술 중에서 가장 단순합니다.샘플 조명은 투과된 백색광을 통해 이루어집니다. 즉, 아래에서 조명되고 위에서 관찰됩니다.대부분의 생물학적 샘플의 낮은 대비와 초점이 맞지 않는 물질의 흐림으로 인한 낮은 겉보기 해상도가 제한됩니다.기술의 단순성과 필요한 최소한의 샘플 준비는 중요한 [citation needed]이점입니다.
비스듬한 조명
측면에서 비스듬한 조명을 사용하면 이미지가 3차원적으로 보이고 그렇지 않으면 보이지 않는 특징이 강조 표시될 수 있습니다.이 방법에 기초한 더 최근의 기술은 세포 배양에 사용하기 위해 반전 현미경에서 발견된 시스템인 호프만의 변조 대조입니다.비스듬한 조명은 선명한 표본에서도 대비를 향상시키지만, 빛이 축을 벗어나므로 초점이 변경되면 물체의 위치가 이동하는 것처럼 보입니다.이러한 제한으로 인해 z축에서 광학적 분할 또는 정확한 측정과 같은 기술이 불가능합니다.
다크필드
다크 필드 현미경은 얼룩이 없고 투명한 [16]표본의 대비를 개선하기 위한 기술입니다.다크 필드 조명은 신중하게 정렬된 광원을 사용하여 영상 평면으로 들어오는 직접 전송(산란되지 않은) 빛의 양을 최소화하고 샘플에 의해 산란된 빛만 수집합니다.다크 필드는 장비 설정이나 샘플 준비를 거의 필요로 하지 않으면서 특히 투명한 물체의 이미지 대비를 크게 향상시킬 수 있습니다.그러나 이 기술은 많은 생물학적 샘플의 최종 이미지에서 낮은 빛의 강도로 인해 어려움을 겪고 있으며 계속해서 낮은 겉보기 해상도의 영향을 받습니다.

라인버그 조명은 투명한 색상의 필터가 콘덴서 바로 앞에 삽입되어 높은 조리개에서의 광선과 낮은 조리개에서의 광선의 색이 다르게 나타납니다(즉, 물체가 자체적으로 밝은 빨간색으로 보이는 동안 표본의 배경은 파란색일 수 있습니다).다른 색상 조합도 가능하지만 효과는 매우 [17]다양합니다.
분산염색
분산 염색은 무색 물체의 컬러 이미지를 생성하는 광학 기술입니다.이것은 광학적 염색 기술이며 색 효과를 내기 위해 얼룩이나 염료가 필요하지 않습니다.분산 염색의 광범위한 기술에 사용되는 다섯 가지 다른 현미경 구성이 있습니다.여기에는 밝은 필드 베케 선, 사선, 어두운 필드, 위상 대비 및 목표 중지 분산 염색이 포함됩니다.
위상 대비

더 정교한 기술은 광학 밀도의 비례적 차이를 보여줄 것입니다.위상 대비는 굴절률의 차이를 대비의 차이로 보여주는 널리 사용되는 기술입니다.그것은 1930년대에 네덜란드 물리학자 프리츠 체르니케에 의해 개발되었습니다 (그는 1953년에 노벨상을 수상했습니다).예를 들어, 세포의 핵은 주변 세포질에 대해 어둡게 나타날 것입니다.대비는 우수하지만 두꺼운 물체에는 사용할 수 없습니다.종종 작은 물체 주변에도 후광이 형성되어 세부 사항을 흐리게 합니다.이 시스템은 콘덴서의 원형 고리로 구성되어 있으며, 이 고리는 빛의 원뿔을 생성합니다.이 원뿔은 위상 목표 내에서 유사한 크기의 링에 중첩됩니다.각 목표에는 크기가 다르므로 각 목표에 대해 다른 콘덴서 설정을 선택해야 합니다.그 물체의 고리는 특별한 광학적 특성을 가지고 있습니다: 첫째로, 그것은 직접적인 빛의 세기를 감소시키지만, 더 중요한 것은, 그것이 약 4분의 1 파장의 인공적인 위상 차이를 만든다는 것입니다.이 직사광선의 물리적 특성이 변경되면 회절광에 대한 간섭이 발생하여 위상 대비 영상이 생성됩니다.위상 대비 현미경의 한 가지 단점은 헤일로 형성(헤일로-라이트 링)입니다.
차동 간섭 대비
더 우수하고 훨씬 더 비싼 것은 간섭 대비를 사용하는 것입니다.광학 밀도의 차이는 릴리프의 차이로 나타날 것입니다.Georges Nomarski에 따르면 세포 내의 핵은 실제로 가장 자주 사용되는 미분 간섭 대비 시스템에서 구상체로 나타날 것입니다.그러나 이것은 광학적 효과이며, 부조가 반드시 실제 모양을 닮지는 않는다는 것을 명심해야 합니다.콘덴서 조리개는 콘덴서 대비가 매우 우수하며 완전히 개방된 상태에서 사용할 수 있으므로 필드 깊이를 줄이고 분해능을 극대화할 수 있습니다.
이 시스템은 일반 빔과 비범한 빔으로 빛을 분할하는 콘덴서의 특수 프리즘(노마르스키 프리즘, 울라스톤 프리즘)으로 구성되어 있습니다.두 빔 사이의 공간 차이는 최소입니다(목표의 최대 분해능보다 낮음).표본을 통과한 후 빔은 대상에서 유사한 프리즘에 의해 재결합됩니다.
균질 표본에서는 두 빔 사이에 차이가 없으며 대비가 생성되지 않습니다.하지만, 굴절 경계 근처(세포질 내의 핵과 같은)에서, 보통 빔과 특별 빔 사이의 차이는 이미지에 완화를 생성할 것입니다.차동 간섭 대비가 작동하려면 편광 광원이 필요합니다. 두 개의 편광 필터가 광 경로에 하나는 콘덴서(편광기) 아래에, 다른 하나는 목표(분석기) 위에 장착되어야 합니다.
참고: 현미경의 광학 설계로 두 빔의 측면 분리가 눈에 띄게 발생하는 경우, 우리는 완화 이미지가 발생하지 않는 고전적인 간섭 현미경의 경우가 있지만 그럼에도 불구하고 현미경 물체의 질량 두께를 정량적으로 결정하는 데 사용할 수 있습니다.
간섭 반사
간섭을 사용하는 추가 기술은 간섭 반사 현미경(반사 간섭 대비 또는 RIC라고도 함)입니다.간섭 신호를 생성하기 위해 슬라이드에 대한 셀 접착에 의존합니다.유리에 셀이 부착되어 있지 않으면 간섭이 발생하지 않습니다.
간섭 반사 현미경은 프리즘 없이 DIC에서 사용하는 것과 동일한 요소를 사용하여 얻을 수 있습니다.또한 DIC를 사용할 때는 검출되는 빛이 반사되어 그대로 전달되지 않습니다.
형광

특정 화합물이 높은 에너지 빛으로 조명될 때, 그들은 낮은 주파수의 빛을 방출합니다.이 효과는 형광이라고 알려져 있습니다.종종 표본은 화학적 구성에 따라 특징적인 자동 형광 이미지를 보여줍니다.
이 방법은 매우 민감하여 단일 분자를 탐지할 수 있기 때문에 현대 생명 과학에서 매우 중요합니다.많은 형광 염료는 구조물이나 화학 화합물을 염색하는 데 사용될 수 있습니다.한 가지 강력한 방법은 면역 염색에서와 같이 형광 포어에 결합된 항체의 조합입니다.일반적으로 사용되는 형광체의 예로는 플루오레세인 또는 로다민이 있습니다.
항체는 화학 화합물에 맞게 제작될 수 있습니다.예를 들어, 종종 사용되는 한 가지 전략은 유전 코드(DNA)에 기반한 단백질의 인공적인 생산입니다.이 단백질들은 토끼를 면역시키는데 사용될 수 있고, 단백질에 결합하는 항체를 형성합니다.그 항체들은 그 다음 형광 포어에 화학적으로 결합되고 연구 중인 세포의 단백질을 추적하는 데 사용됩니다.
녹색 형광 단백질(GFP)과 같은 고효율 형광 단백질은 형광 화합물의 발현을 표적 단백질의 발현과 연결하는 과정인 유전자 융합의 분자 생물학 기술을 사용하여 개발되었습니다.이 결합된 형광 단백질은 일반적으로 유기체에 독성이 없으며 연구 중인 단백질의 기능을 거의 방해하지 않습니다.유전자 변형 세포나 유기체는 형광 태그가 달린 단백질을 직접적으로 발현시켜 생체 내에서 원래 단백질의 기능을 연구할 수 있게 합니다.
단백질 결정의 성장은 단백질과 소금 결정을 모두 초래합니다.둘 다 무색이고 미세합니다.단백질 결정의 복구는 단백질의 고유 형광 또는 투과 현미경을 사용하여 수행할 수 있는 이미징을 필요로 합니다.두 방법 모두 단백질이 280nm에서 빛을 흡수하기 때문에 자외선 현미경이 필요합니다.단백질은 또한 280 nm [18]빛으로 들뜨면 약 353 nm에서 형광을 띠게 됩니다.
형광 방출은 여기광과 파장(색상)이 다르기 때문에 이상적인 형광 이미지는 형광 염료로 레이블이 지정된 관심 구조만 보여줍니다.이러한 높은 특이성은 생물 의학 연구에서 형광 빛 현미경의 광범위한 사용으로 이어졌습니다.다른 형광 염료는 다른 생물학적 구조를 염색하는 데 사용될 수 있으며, 염료의 개별 색상으로 인해 여전히 특정한 상태에서 동시에 검출될 수 있습니다.
여기광이 관찰자 또는 검출기에 도달하는 것을 차단하려면 고품질의 필터 세트가 필요합니다.여기에는 일반적으로 여기 파장 범위를 선택하는 여기 필터, 다이크로익 미러 및 여기 빛을 차단하는 방출 필터가 포함됩니다.대부분의 형광 현미경은 검출기로 들어오는 여기광의 양을 더욱 줄이기 위해 에피 조명 모드(샘플의 한쪽에서 조명 및 검출)에서 작동합니다.
공초점
공초점 레이저 스캐닝 현미경은 형광을 포인트 바이 포인트 방식으로 들뜨게 하기 위해 샘플을 가로질러 스캔되는 초점 레이저 빔(예: 488 nm)을 사용합니다.방출된 빛은 핀홀을 통해 전달되어 초점이 맞지 않는 빛이 검출기(일반적으로 광전자 증배관)에 도달하는 것을 방지합니다.이미지는 컴퓨터에서 생성되어 여기 레이저의 위치에 따라 측정된 형광 강도를 표시합니다.전체 샘플 조명에 비해 공초점 현미경은 약간 높은 측면 분해능을 제공하고 광학적 분할(축 분해능)을 크게 향상시킵니다.따라서 공초점 현미경은 3D 구조가 중요한 경우에 일반적으로 사용됩니다.
공초점 현미경의 하위 클래스는 샘플 전체에 걸쳐 여러 점을 동시에 스캔할 수 있는 회전 디스크 현미경입니다.핀홀이 있는 해당 디스크는 초점이 맞지 않는 빛을 거부합니다.회전하는 디스크 현미경의 광 검출기는 디지털 카메라로, 일반적으로 EM-CCD 또는 sCMOS입니다.
2광자 현미경법
2광자 현미경 또한 레이저 스캔 현미경이지만, UV, 파란색 또는 녹색 레이저 빛 대신 펄스 적외선 레이저가 여기에 사용됩니다.레이저의 작은 초점에서만 2광자 여기에 의해 형광을 생성할 수 있을 정도의 강도가 있습니다. 즉, 초점을 벗어난 형광이 생성되지 않으며 이미지를 [19]정리하는 데 핀홀이 필요하지 않습니다.이를 통해 공초점 현미경이 광자를 [20]효율적으로 수집할 수 없는 산란 조직 깊숙이 이미징할 수 있습니다.광시야 검출이 가능한 2광자 현미경은 뇌 [21]조직에서 칼슘 이미징과 같은 기능적 이미징에 자주 사용됩니다.비록 2광자 여기 대신 3광자를 사용하는 것의 이득이 미미하지만, 그것들은 여러 회사에 의해 멀티광자 현미경으로 마케팅됩니다.
단일 평면 조명 현미경 및 광시트 형광 현미경
좁은 각도에서 원통형 렌즈를 통해 빛을 초점으로 맞추거나 물체의 축에 수직인 평면에서 빛의 선을 스캔하여 형성된 빛의 평면을 사용하여 고해상도 광학 단면을 [22][23][24]촬영할 수 있습니다.단일 평면 조명 또는 라이트 시트 조명은 다중 프리즘 빔 [25][26]익스팬더를 포함하는 빔 쉐이핑 기술을 사용하여 수행됩니다.이미지는 CCD에 의해 캡처됩니다.이러한 변형을 통해 매우 빠르고 높은 신호 대 잡음비 이미지 캡처가 가능합니다.
광시야 다광자 현미경
광시야 다광자[27][28][29][30] 현미경은 물체의 넓은 영역을 스캔할 필요 없이 조명하고 이미징하는 광학 비선형 이미징 기술을 말합니다.2광자 형광 또는 2차 고조파 생성과 같은 비선형 광학 프로세스를 유도하려면 높은 강도가 필요합니다.스캔 다중 광자 현미경에서 높은 강도는 빛을 촘촘하게 초점을 맞추면 달성되고 이미지는 빔 스캔을 통해 획득됩니다.광시야 다중 광자 현미경에서 높은 강도는 광학적으로 증폭된 펄스 레이저 소스를 사용하여 큰 시야(~100µm)[27][28][29]를 달성하는 것이 가장 좋습니다.이 경우 이미지는 스캔할 필요 없이 CCD 카메라가 있는 단일 프레임으로 획득되므로 관심 대상에 걸쳐 동적 프로세스를 동시에 시각화하는 데 특히 유용합니다.광시야 다중 광자 현미경을 사용하면 프레임 속도가 다중 광자 스캔 [28]현미경에 비해 최대 1000배까지 증가할 수 있습니다.그러나 산란 조직에서는 깊이가 증가함에 따라 이미지 품질이 급격히 저하됩니다.
디콘볼루션
형광 현미경은 복잡한 환경 내에서 특별히 레이블이 지정된 구조를 보여주고 생물학적 구조의 3차원 정보를 제공하는 강력한 기술입니다.그러나 조명 시 초점 여부와 관계없이 모든 형광 레이블이 부착된 구조물이 빛을 방출한다는 사실로 인해 이 정보가 흐려집니다.그래서 특정 구조의 이미지는 초점이 맞지 않는 구조의 빛의 기여로 인해 항상 흐릿해집니다.이 현상은 특히 높은 분해능을 가진 목표, 일반적으로 높은 수치 조리개를 가진 오일 침지 목표를 사용할 때 대비가 손실됩니다.
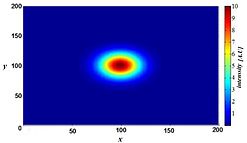
그러나 흐림은 빛 산란과 같은 임의의 과정에 의해 발생하는 것이 아니라 현미경 영상 시스템에서 이미지 형성의 광학적 특성에 의해 잘 정의될 수 있습니다.작은 형광 광원(본질적으로 밝은 점)을 고려하면, 이 점에서 오는 빛은 점이 초점에서 더 멀어질수록 우리의 관점에서 더 멀리 퍼집니다.이상적인 조건에서는 세 번째(축) 차원에서 이 점 소스의 "모래시계" 모양이 생성됩니다.이 모양을 현미경 영상 시스템의 PSF(Point Spread Function)라고 합니다.모든 형광 이미지는 이러한 작은 형광 광원의 많은 수로 구성되므로 이미지는 "점 확산 함수에 의해 컨볼루션"된다고 합니다.테라헤르츠 레이저 펄스 영상 시스템의 수학적으로 모델링된 PSF는 오른쪽에 나와 있습니다.
영상 시스템의 출력은 다음 방정식을 사용하여 설명할 수 있습니다.
는 가법 [32]노이즈입니다.이 점 확산[33] 함수를 아는 것은 디콘볼루션 현미경법으로 [34]알려진 컴퓨터 기반 방법으로 이 과정을 어느 정도 역전시킬 수 있다는 것을 의미합니다.2D 또는 3D 디콘볼루션에 사용할 수 있는 다양한 알고리즘이 있습니다.이들은 대략 비복원 및 복원 방법으로 분류될 수 있습니다.비복원 방법은 초점면에서 초점이 맞지 않는 빛을 제거하여 대비를 개선할 수 있지만, 복원 방법만이 실제로 빛을 적절한 원점으로 재할당할 수 있습니다.이러한 방식으로 형광 이미지를 처리하는 것은 공초점 현미경의 이미지와 같이 초점이 맞지 않는 빛 없이 직접 이미지를 획득하는 것보다 장점이 될 수 있습니다. 그렇지 않으면 제거된 빛 신호는 유용한 정보가 되기 때문입니다.3D 디콘볼루션의 경우 일반적으로 서로 다른 초점면(Z-stack이라고 함)에서 가져온 일련의 이미지와 실험적 또는 이론적으로 현미경의 모든 매개 변수를 아는 것에서 도출할 수 있는 PSF에 대한 지식을 제공합니다.
서브 회절 기법

회절 한계를 우회하는 많은 초해상도 현미경 기술이 최근에 개발되었습니다.
이는 대부분 충분히 정적인 샘플을 여러 번 이미징하고 여기광을 수정하거나 이미지의 확률적 변화를 관찰하여 달성됩니다.이전 섹션에서 설명한 디콘볼루션 방법은 PSF 유도 블러를 제거하고 수학적으로 '정확한' 빛의 원점을 할당하는 방법이지만 픽셀의 값이 의미하는 것에 대한 이해는 약간 다릅니다.대부분의 경우 단일 형광 포어가 하나의 단일 촬영 이미지에 하나의 단일 블롭에 기여한다고 가정하면, 이미지의 블롭을 계산된 위치로 대체하여 회절 한계보다 훨씬 낮은 해상도를 크게 향상시킬 수 있습니다.
이러한 가정을 실현하기 위해 형광체 광물리학에 대한 지식과 화학적 제어가 ~20나노미터의 해상도를 얻는 [35][36]기술의 핵심입니다.
직렬 시간 인코딩 증폭 현미경
직렬 시간 인코딩 증폭 현미경(STEAM)은 감도와 속도 사이의 근본적인 균형을 피하기 위해 광학 이미지 증폭을 사용하여 초고속 셔터 속도와 프레임 속도를 제공하는 이미징 방법입니다.그리고 검출기 배열 및 판독 시간 제한의[37] 필요성을 제거하는 단일 픽셀 광 검출기 이 방법은 최첨단 CCD 및 CMOS 카메라보다 최소 1000배 더 빠릅니다.따라서 충격파의 실시간 진단 및 평가, 미세유체학, MEMS 및 레이저 [38]수술을 포함하여 높은 영상 획득률을 필요로 하는 과학, 산업 및 생물의학 애플리케이션에 잠재적으로 유용합니다.
확장 기능
대부분의 최신 기기는 마이크로 사진 및 이미지 기록을 위한 간단한 솔루션을 제공합니다.그러나 이러한 기능이 항상 있는 것은 아니며 경험이 많은 현미경 사용자는 사진보다 손으로 그린 이미지를 선호할 수 있습니다.주제에 대한 지식이 있는 현미경 사용자가 3차원 이미지를 정확한 2차원 도면으로 변환할 수 있기 때문입니다.그러나 사진이나 다른 이미지 캡처 시스템에서는 하나의 얇은 평면만이 좋은 [citation needed]초점을 맞춥니다.
정확한 현미경 사진을 만들기 위해서는 단안 접안 렌즈를 사용한 현미경 기술이 필요합니다.양쪽 눈을 모두 뜨고 현미경 아래를 관찰하지 않는 눈이 대신 현미경 옆 벤치의 종이에 집중되는 것이 필수적입니다.연습을 통해 머리나 눈을 움직이지 않고 현미경 [citation needed]이미지에서 연필 점을 동시에 "보는" 것으로 관찰된 모양을 정확하게 추적할 수 있습니다.
영상을 [citation needed]무한대로 볼 수 있도록 초점을 맞춘 현미경으로 관찰하는 것은 항상 덜 피곤합니다.
기타 향상된 기능
엑스레이
해상도는 빛의 파장에 따라 달라집니다.1930년대부터 빛 대신 전자빔을 사용하는 전자현미경법이 개발되었습니다.전자빔의 파장이 훨씬 작기 때문에 해상도가 훨씬 높습니다.
덜 흔하지만, 엑스레이 현미경 또한 1940년대 후반부터 개발되었습니다.X선 현미경의 해상도는 빛 현미경과 전자 현미경 사이에 있습니다.
전자현미경
서브 회절 현미경이 발명되기 전까지, 빛의 파장은 전통적인 현미경의 해상도를 약 0.2 마이크로미터로 제한했습니다.더 높은 해상도를 얻기 위해, 훨씬 더 작은 파장의 전자 빔을 전자 현미경에 사용합니다.
- 투과전자현미경(TEM)은 시료의 매우 얇은 조각을 통해 전자빔을 보내 복합광현미경과 매우 유사합니다.2005년의 분해능 한계는 약 0.05[dubious ] 나노미터였으며 그 이후로 눈에 띄게 증가하지 않았습니다.
- 주사 전자 현미경(SEM)은 표본 표면의 세부 사항을 시각화하고 매우 멋진 3D 보기를 제공합니다.그것은 스테레오 빛 현미경의 결과와 매우 유사한 결과를 제공합니다.2011년 SEM의 최고 해상도는 0.4 나노미터였습니다.
X선 분광학에 장비된 전자 현미경은 정성적이고 정량적인 원소 분석을 제공할 수 있습니다.분석 전자 현미경이라고도 알려진 이 유형의 전자 현미경은 나노 [39]물질을 조사하는 데 매우 강력한 도구가 될 수 있습니다.
탐침 현미경 검사
이것은 하위 회절 기법입니다.주사 프로브 현미경의 예로는 원자력 현미경(AFM), 주사 터널링 현미경, 광자력 현미경 및 재발 추적 현미경이 있습니다.이러한 모든 방법은 고체 프로브 팁의 물리적 접촉을 사용하여 물체의 표면을 스캔하는데, 물체는 거의 평평합니다.
초음파력
초음파 힘 현미경법(UFM)은 AFM 영상이 대조적으로 제한되는 "평평한" 관심 영역에서 세부 정보와 영상 대비를 개선하기 위해 개발되었습니다.AFM-UFM의 조합을 통해 근거리 음향 현미경 이미지를 생성할 수 있습니다.AFM 팁은 초음파를 감지하는 데 사용되며 음향 현미경에서 발생하는 파장의 한계를 극복합니다.AFM 팁 아래의 탄력적인 변경을 사용하면 AFM 지형보다 훨씬 상세한 이미지를 생성할 수 있습니다.
초음파 힘 현미경법은 캔틸레버 또는 샘플에 초음파 진동을 적용하여 원자력 현미경법에서 탄성을 국소적으로 매핑할 수 있습니다.초음파 힘현미경법의 결과를 정량적으로 분석하기 위해 캔틸레버 베이스에 초음파 진동을 가하여 힘-거리 곡선 측정을 수행하고 그 결과를 유한차분 기법에 기초한 캔틸레버 역학 및 팁-샘플 상호작용 모델과 비교합니다.
자외선 현미경법
자외선 현미경은 두 가지 주요 목적을 가지고 있습니다.첫 번째는 자외선 전자기 에너지의 짧은 파장을 사용하여 표준 광학 현미경의 회절 한계 이상의 이미지 해상도를 향상시키는 것입니다.이 기술은 현대 반도체에서 발견되는 것과 같은 매우 작은 특징을 가진 장치의 비파괴 검사에 사용됩니다.UV 현미경에 대한 두 번째 적용은 샘플 자체 내의 분자와 빛의 상호 작용으로 인해 개별 샘플의 반응이 주변에 비해 향상되는 대비 향상입니다.한 가지 예는 단백질 결정의 성장입니다.단백질 결정은 소금 용액에서 형성됩니다.소금과 단백질 결정은 모두 성장 과정에서 형성되며, 일반적으로 둘 다 사람의 눈에 투명하기 때문에 표준 광학 현미경으로 구별할 수 없습니다.단백질의 트립토판이 280nm에서 빛을 흡수하기 때문에 280nm 대역통과 필터가 달린 UV 현미경으로 촬영하면 두 종류의 결정체를 쉽게 구별할 수 있습니다.단백질 결정은 어두운 반면 소금 결정은 투명합니다.
적외선 현미경법
적외선 현미경 검사라는 용어는 적외선 파장에서 수행되는 현미경 검사를 말합니다.일반적인 기기 구성에서 FTIR(푸리에 변환 적외선 분광계)은 광학 현미경 및 적외선 검출기와 결합됩니다.적외선 검출기는 단일 점 검출기, 선형 배열 또는 2D 초점 평면 배열일 수 있습니다.FTIR은 적외선 분광법을 통해 화학 분석을 수행할 수 있는 기능을 제공하며 현미경 및 점 또는 배열 검출기를 통해 이 화학 분석을 공간적으로 해결할 수 있습니다. 즉, 샘플의 다른 영역에서 수행할 수 있습니다.이 기술은 적외선 현미경이라고도[40][41] 불립니다. 레이저 직접 적외선(LDIR) 이미징이라고 불리는 대안적인 아키텍처는 조정 가능한 적외선 광원과 비행 물체에 대한 단일 점 검출기의 조합을 포함합니다.이 기술은 적외선 화학 이미징에 자주 사용되며, 여기서 이미지 대비는 사용자가 선택한 특정 IR 파장, 일반적으로 특정 IR 흡수 대역 및 관련 분자 공명에 대한 개별 샘플 영역의 반응에 의해 결정됩니다.기존 적외선 현미경의 주요 한계는 공간 해상도가 회절 제한적이라는 것입니다.구체적으로 공간 해상도는 빛의 파장과 관련된 수치로 제한됩니다.실용적인 IR 현미경의 경우, 공간 해상도는 사용되는 특정 기술과 기구에 따라 파장의 1-3배로 제한됩니다.중간 IR 파장의 경우, 이것은 ~3-30 μm의 실용적인 공간 해상도 한계를 설정합니다.
서브 회절 현미경의 IR 버전도 [40][41]존재합니다.여기에는 IR 근거리 스캔 광학 현미경(NSOM),[42] 광열 현미경 및 원자력 현미경 기반 적외선 분광법(AFM-IR)뿐만 아니라 IR 파장에서 나노 크기의 공간 해상도를 제공하는 산란형 스캔 근거리 광학 현미경(s-SNOM)[43] 및 나노 FTIR이 포함됩니다.
디지털 홀로그래피 현미경법

디지털 홀로그래픽 현미경(DHM)에서는 일관된 (단색) 광원으로부터의 간섭파 전선이 센서에 기록됩니다.영상은 기록된 홀로그램으로부터 컴퓨터에 의해 디지털로 재구성됩니다.일반적인 밝은 필드 영상 외에도 위상 편이 영상이 생성됩니다.
DHM은 반사 모드와 변속기 모드 모두에서 작동할 수 있습니다.반사 모드에서 위상 편이 영상은 상대 거리 측정을 제공하므로 반사 표면의 지형도를 나타냅니다.전송 모드에서 위상 편이 영상은 검체의 광학 두께에 대한 레이블 없는 정량적 측정을 제공합니다.생물학적 세포의 위상 이동 이미지는 염색된 세포의 이미지와 매우 유사하며 고함량 분석 소프트웨어에 의해 성공적으로 분석되었습니다.
DHM의 독특한 특징은 모든 초점 평면이 홀로그램에 의해 동시에 기록되기 때문에 영상이 기록된 후 초점을 조정할 수 있다는 것입니다.이 기능을 사용하면 볼륨에서 움직이는 입자를 이미지화하거나 표면을 빠르게 스캔할 수 있습니다.또 다른 매력적인 기능은 DHM이 소프트웨어에 의한 광학 수차를 보정하여 저렴한 광학을 사용할 수 있다는 것입니다.
디지털 병리학(가상 현미경)
디지털 병리학은 디지털 슬라이드에서 생성된 정보를 관리할 수 있는 컴퓨터 기술로 가능한 이미지 기반 정보 환경입니다.디지털 병리학은 부분적으로 유리 슬라이드를 보고 관리하고 분석할 수 있는 디지털 슬라이드로 변환하는 가상 현미경 검사에 의해 가능합니다.
레이저 현미경
레이저 현미경은 다양한 형태의 [44]현미경에서 레이저 광원을 사용하는 빠르게 성장하는 분야입니다.예를 들어, 생물학적 응용에 초점을 맞춘 레이저 현미경은 비선형 현미경, 포화 현미경 및 2광자 [45]여기 현미경으로 분류된 많은 기술에서 초단 펄스 레이저를 사용합니다.
고강도의 단펄스 실험실 X선 레이저는 몇 년 동안 개발되어 왔습니다.이 기술이 실현되면 정확하게 정의된 순간에 살아있는 상태의 기본 생물학적 구조의 확대된 3차원 이미지를 얻을 수 있을 것입니다.물과 단백질 사이의 최적의 대비와 최고의 감도와 분해능을 위해 레이저는 약 0.3 나노미터의 질소 라인 근처에서 조정되어야 합니다.분해능은 주로 필요한 수의 [46]광자가 등록되는 동안 발생하는 유체역학적 팽창에 의해 제한됩니다.따라서, 노출에 의해 표본이 파괴되는 동안,[47][48][49][50][51][52][excessive citations] 폭발하기 전에 표본의 구성을 캡처할 수 있습니다.
과학자들은 적절한 [53][54][55][56][57][58][59][60][excessive citations]레이저의 오랜 개발에도 불구하고 X선 홀로그래피 현미경을 위한 실용적인 디자인과 프로토타입을 연구해 왔습니다.
광음향현미경

광음향 효과,[61] 즉 빛 흡수에 의한 (초)음 발생에 의존하는 현미경 기술.초점 및 강도 변조된 레이저 빔은 샘플 위에서 래스터 스캔됩니다.생성된 (울트라) 소리는 초음파 변환기를 통해 감지됩니다.일반적으로 압전 초음파 변환기가 [62]사용됩니다.
영상 대비는 샘플의 흡수 α{\와 관련이 있습니다. 이는 투과율 또는 산란으로 인해 영상 대비가 발생하는 밝고 어두운 필드 현미경과 대조됩니다.원칙적으로 형광 현미경의 대비는 샘플의 흡수에 비례합니다.그러나 형광 현미경 검사에서 형광 양자 δ \}}은 신호를 감지하기 위해 0으로 동일하지 않아야 합니다.그러나 광음향 현미경에서 모든 흡수 물질은 다음과 같은 비율의 광음향 를 제공합니다
여기서 는 Grüneisen 이고, 는 레이저의 광자 이며, 는 샘플의 밴드 갭 에너지입니다.따라서, 높은 형광 양자 수율은 높은 형광 신호로 이어지고, 낮은 형광 양자 수율은 높은 광음향 신호로 이어지기 때문에 광음향 현미경법은 형광 현미경법의 보완 기술로 매우 적합한 것으로 보입니다.
비선형 효과를 무시하면 측면 분해능은 Abbe 회절 한계에 의해 제한됩니다.
여기서{{displaystyle \lambda는 여기 레이저의 파장이며, 대물 렌즈의 수치 조리개입니다.들어오는 파형 전면이 평행할 경우 Abbe 회절 한계가 유지됩니다.그러나 실제로 레이저 빔 프로파일은 가우스입니다.따라서 달성 가능한 분해능을 계산하려면 잘린 가우스 빔에 대한 공식을 [63]사용해야 합니다.
아마추어 현미경법
아마추어 현미경은 레크리에이션 목적으로 생물학적 및 비생물학적 표본을 조사하고 관찰하는 것입니다.광물, 곤충, 조개껍질, 그리고 식물의 수집가들은 현미경을 도구로 사용하여 수집된 물품을 분류하는 데 도움이 되는 특징을 발견할 수 있습니다.다른 아마추어들은 연못의 물과 다른 샘플에서 발견된 생명체를 관찰하는 것에 관심이 있을지도 모릅니다.현미경은 또한 가정용 수족관을 키우는 사람들의 수질 평가에 유용할 수도 있습니다.사진 문서화 및 현미경 이미지 그리기는 추가적인 즐거움입니다.현미경 사진 예술 대회가 있습니다.이 취미의 참가자들은 상업적으로 준비된 현미경 슬라이드를 사용하거나 자신만의 슬라이드를 준비할 수 있습니다.
현미경은 생물학적 표본을 문서화하는 데 있어 중심적인 도구이지만, 현미경 조사만으로 새로운 종에 대한 설명을 정당화하는 것은 종종 불충분합니다.종종 새로운 종의 발견을 확인하기 위해 유전자 검사와 생화학 검사가 필요합니다.실험실과 학술 문헌에 대한 접근은 필수입니다.하지만, 아마추어들이 전문가들보다 더 나은 한 가지 이점이 있습니다: 그들의 주변 환경을 탐험할 시간입니다.종종, 고급 아마추어들은 그들의 발견을 검증하고 새로운 종을 기술하기 위해 전문가들과 팀을 이룹니다.
1800년대 후반에, 아마추어 현미경법은 미국과 유럽에서 인기 있는 취미가 되었습니다.몇몇 '프로 아마추어'들은 일요일 오후에 그들을 즐겁게 해주기 위해 자선가들에 의해 샘플링 여행과 현미경 탐험에 대한 대가를 받고 있었습니다(예: 규조류 전문가 A).그루노우, (다른 것들 중에서) 벨기에 기업가로부터 보수를 받고 있습니다.존 핀 교수는 "현미경의 선택과 사용에 관한 실용적 힌트"(1878년 제2판)를 출판했고 "미국 현미경학 저널"의 편집자이기도 했습니다.
아마추어 현미경 이미지의 예:
-
"집벌" 입 100X
-
라이스 스템스 400X
-
토끼 테스트는 100X입니다.
-
펀 프로탈륨 400X
법의학에서의 응용
현미경은 [64]법의학에 적용됩니다.현미경은 종종 어떠한 변경이나 파괴 없이 가장 작은 증거 항목을 감지, 해결 및 이미지화할 수 있습니다.현미경은 섬유, 머리카락, 흙, 먼지 등을 식별하고 비교하는 데 사용됩니다.
잉크 자국, 혈흔 또는 탄환의 경우 검체 처리가 필요하지 않으며 현미경 검사를 통해 직접 증거를 확인할 수 있습니다.특정 물질의 흔적의 경우 현미경 검사를 [clarification needed]수행하기 전에 검체 준비를 수행해야 합니다.
빛 현미경은 광자를 사용하여 이미지를 형성하는 법의학에서 가장 많이 사용되며, 법의학 표본을 검사하는 데 가장 적합한 현미경은 [65]다음과 같습니다.
복합현미경
비교 현미경
입체 현미경
편광현미경
마이크로 분광 광도계
법의학 응용 분야의 현미경 유형의 이러한 다양성은 주로 광학 현미경, SEM 및 TEM에 [65]대한 (1-1200X), (50-30,000X) 및 (500-250,000X)의 확대 범위에서 비롯됩니다.
참고 항목
레퍼런스
- ^ The University of Edinburgh (March 6, 2018). "What is Microscopy?". The University of Edinburgh. Archived from the original on April 10, 2018. Retrieved April 9, 2018.
- ^ 아티 델라 폰다지오네 조르지오 론치 E 코포뉴티 델'Istituto Nazionale Di Ottica, 제30권, La Fondazione-1975, 554페이지
- ^ Albert Van Helden; Sven Dupré; Rob van Gent (2010). The Origins of the Telescope. Amsterdam University Press. p. 24. ISBN 978-90-6984-615-6. Archived from the original on 15 February 2017.
- ^ 윌리엄 로젠탈, 안경과 다른 시력 보조 기구: 수집의 역사와 가이드, 노먼 출판, 1996, 391 - 392페이지
- ^ 로버트 D.Huerta, Giants of Delft: Johannes Vermeer and the Natural Philosphers: 발견의 시대 동안의 지식의 병렬 탐색, Bucknell University Press - 2003, 126페이지
- ^ A. 마크 스미스, 시각에서 빛으로:고대에서 현대 광학으로 가는 길, 시카고 대학 출판부 - 2014, 387페이지
- ^ 레이먼드 J. 시거, 물리학자: 갈릴레오 갈릴레이, 그의 생애와 작품, 엘스비어 - 2016, 24페이지
- ^ J. 윌리엄 로젠탈, 안경과 다른 시력 보조 기구: 수집의 역사와 가이드, Norman Publishing, 1996, 391페이지
- ^ Ford, Brian J. (1992). "From Dilettante to Diligent Experimenter: a Reappraisal of Leeuwenhoek as microscopist and investigator". Biology History. 5 (3). Archived from the original on 2021-04-19. Retrieved 2021-04-16.
- ^ 레인, 닉 (2015년 3월 6일)"보이지 않는 세상: 레우웬후크에 대한 성찰 (1677) '작은 동물에 대하여'Philoso R Soc Lond B B Biol Sci. 2015년 4월 370(1666): 20140344.[doi:10.1098/rstb.2014.0344]
- ^ Abramowitz M, Davidson MW (2007). "Introduction to Microscopy". Molecular Expressions. Archived from the original on 2021-04-27. Retrieved 2007-08-22.
- ^ "Microscope - Compound, Numerical Aperture, and Immersion Microscopy Britannica". www.britannica.com. Archived from the original on 2023-06-22. Retrieved 2023-06-22.
- ^ Abbe, E. (1874) 현미경 이론과 현미경 시력의 본질에 대한 공헌.브리스톨 낫 박사님1,200-261쪽.
- ^ Paulley JB (편집자) (2006).생물학적 공초점 현미경 핸드북(3판).베를린: 스프링거.ISBN 0-387-25921-X.
- ^ Lakowicz, Joseph R. (1999) 형광 분광학의 원리.뉴욕: Kluwer Academic/Plenum.
- ^ Abramowitz M, Davidson MW (2003-08-01). "Darkfield Illumination". Archived from the original on 2015-11-23. Retrieved 2008-10-21.
- ^ Abramowitz M, Davidson MW (2003-08-01). "Rheinberg Illumination". Archived from the original on 2008-09-29. Retrieved 2008-10-21.
- ^ Gill, Harindarpal (January 2010). "Evaluating the efficacy of tryptophan fluorescence and absorbance as a selection tool for identifying protein crystals". Acta Crystallographica. F66 (Pt 3): 364–372. doi:10.1107/S1744309110002022. PMC 2833058. PMID 20208182.
- ^ Denk, Winfried; Svoboda, Karel (March 1997). "Photon Upmanship: Why Multiphoton Imaging Is More than a Gimmick". Neuron. 18 (3): 351–357. doi:10.1016/S0896-6273(00)81237-4. PMID 9115730. S2CID 2414593.
- ^ Denk, W.; Delaney, K.R.; Gelperin, A.; Kleinfeld, D.; Strowbridge, B.W.; Tank, D.W.; Yuste, R. (1994). "Anatomical and functional imaging of neurons using 2-photon laser scanning microscopy". Journal of Neuroscience Methods. 54 (2): 151–162. doi:10.1016/0165-0270(94)90189-9. PMID 7869748. S2CID 3772937.
- ^ Svoboda, Karel; Denk, Winfried; Kleinfeld, David; Tank, David W. (1997). "In vivo dendritic calcium dynamics in neocortical pyramidal neurons". Nature. 385 (6612): 161–165. Bibcode:1997Natur.385..161S. doi:10.1038/385161a0. ISSN 0028-0836. PMID 8990119. S2CID 4251386. Archived from the original on 2021-05-25. Retrieved 2020-05-20.
- ^ Voie, A.H. (1993). "Imaging the intact guinea pig tympanic bulla by orthogonal-plane fluorescence optical sectioning microscopy". Hearing Research. 71 (1–2): 119–128. doi:10.1016/S0378-5955(02)00493-8. ISSN 0378-5955. PMID 12204356. S2CID 12775304.
- ^ Greger, K.; J. Swoger; E. H. K. Stelzer (2007). "Basic building units and properties of a fluorescence single plane illumination microscope". Review of Scientific Instruments. 78 (2): 023705–023705–7. Bibcode:2007RScI...78b3705G. doi:10.1063/1.2428277. ISSN 0034-6748. PMID 17578115.
- ^ Buytaert, J.A.N.; E. Descamps; D. Adriaens; J.J.J. Dirckx (2012). "The OPFOS Microscopy Family: High-Resolution Optical Sectioning of Biomedical Specimens". Anatomy Research International. 2012: 206238. arXiv:1106.3162. doi:10.1155/2012/206238. ISSN 2090-2743. PMC 3335623. PMID 22567307.
- ^ F. J. Duarte, 고출력 염료 레이저(Springer-Verlag, Berlin, 1991) 2장
- ^ Duarte FJ(1993), 전기 광학 간섭계 마이크로 밀도계 시스템, 미국 특허 5255069 웨이백 머신에서 2017-10-13 보관.
- ^ a b Peterson, Mark D.; Hayes, Patrick L.; Martinez, Imee Su; Cass, Laura C.; Achtyl, Jennifer L.; Weiss, Emily A.; Geiger, Franz M. (2011-05-01). "Second harmonic generation imaging with a kHz amplifier [Invited]". Optical Materials Express. 1 (1): 57. Bibcode:2011OMExp...1...57P. doi:10.1364/ome.1.000057.
- ^ a b c Macias-Romero, Carlos; Didier, Marie E. P.; Jourdain, Pascal; Marquet, Pierre; Magistretti, Pierre; Tarun, Orly B.; Zubkovs, Vitalijs; Radenovic, Aleksandra; Roke, Sylvie (2014-12-15). "High throughput second harmonic imaging for label-free biological applications". Optics Express. 22 (25): 31102–12. Bibcode:2014OExpr..2231102M. doi:10.1364/oe.22.031102. PMID 25607059. Archived from the original on 2020-06-20. Retrieved 2019-12-11.
- ^ a b Cheng, Li-Chung; Chang, Chia-Yuan; Lin, Chun-Yu; Cho, Keng-Chi; Yen, Wei-Chung; Chang, Nan-Shan; Xu, Chris; Dong, Chen Yuan; Chen, Shean-Jen (2012-04-09). "Spatiotemporal focusing-based widefield multiphoton microscopy for fast optical sectioning". Optics Express. 20 (8): 8939–48. Bibcode:2012OExpr..20.8939C. doi:10.1364/oe.20.008939. PMID 22513605.
- ^ Oron, Dan; Tal, Eran; Silberberg, Yaron (2005-03-07). "Scanningless depth-resolved microscopy". Optics Express. 13 (5): 1468–76. Bibcode:2005OExpr..13.1468O. doi:10.1364/opex.13.001468. PMID 19495022.
- ^ Ahi, Kiarash; Anwar, Mehdi (2016-05-26). Anwar, Mehdi F; Crowe, Thomas W; Manzur, Tariq (eds.). "Modeling of terahertz images based on x-ray images: a novel approach for verification of terahertz images and identification of objects with fine details beyond terahertz resolution". Terahertz Physics, Devices, and Systems X: Advanced Applications in Industry. Terahertz Physics, Devices, and Systems X: Advanced Applications in Industry and Defense. 9856: 985610. Bibcode:2016SPIE.9856E..10A. doi:10.1117/12.2228685. S2CID 124315172.
- ^ Solomon, Chris (2010). Fundamentals of Digital Image Processing. John Wiley & Sons, Ltd. ISBN 978-0-470-84473-1.
- ^ Nasse M. J.; Woehl J. C. (2010). "Realistic modeling of the illumination point spread function in confocal scanning optical microscopy". J. Opt. Soc. Am. A. 27 (2): 295–302. Bibcode:2010JOSAA..27..295N. doi:10.1364/JOSAA.27.000295. PMID 20126241.
- ^ Wallace W, Schaefer LH, Swedlow JR (2001). "A workingperson's guide to deconvolution in light microscopy". BioTechniques. 31 (5): 1076–8, 1080, 1082 passim. doi:10.2144/01315bi01. PMID 11730015.
- ^ Kaufmann Rainer; Müller Patrick; Hildenbrand Georg; Hausmann Michael; Cremer Christoph (2010). "Analysis of Her2/neu membrane protein clusters in different types of breast cancer cells using localization microscopy". Journal of Microscopy. 242 (1): 46–54. CiteSeerX 10.1.1.665.3604. doi:10.1111/j.1365-2818.2010.03436.x. PMID 21118230. S2CID 2119158.
- ^ van de Linde S.; Wolter S.; Sauer S. (2011). "Single-molecule Photoswitching and Localization". Aust. J. Chem. 64 (5): 503–511. doi:10.1071/CH10284.
- ^ K. Goda; K. K. Tsia; B. Jalali (2009). "Serial time-encoded amplified imaging for real-time observation of fast dynamic phenomena". Nature. 458 (7242): 1145–9. Bibcode:2009Natur.458.1145G. doi:10.1038/nature07980. PMID 19407796. S2CID 4415762.
- ^ Jalali, Bahram; Capewell, Dale; Goda, Keisuke; Tsia, Kevin K. (2010-05-10). "Performance of serial time-encoded amplified microscope". Optics Express. 18 (10): 10016–10028. Bibcode:2010OExpr..1810016T. doi:10.1364/OE.18.010016. hdl:10722/91333. ISSN 1094-4087. PMID 20588855. S2CID 8077381.
- ^ Kosasih, Felix Utama; Ducati, Caterina (May 2018). "Characterising degradation of perovskite solar cells through in-situ and operando electron microscopy". Nano Energy. 47: 243–256. doi:10.1016/j.nanoen.2018.02.055. Archived from the original on 2021-01-26. Retrieved 2019-06-28.
- ^ a b 분석화학 백과사전(Robert A)에서 중적외선의 현미경 관찰, HM Pollock과 SG Kazarian.마이어스, 에드, 1-26(2014), 존 와일리 & 선즈 유한회사,
- ^ a b Pollock Hubert M (2014). "Microspectroscopy in the Mid-Infrared". Encyclopedia of Analytical Chemistry. pp. 1–26. doi:10.1002/9780470027318.a5609.pub2. ISBN 9780470027318.
- ^ HM Pollock과 DA Smith, 진동 분광학 및 광열 이미징을 위한 근거리 프로브의 사용, 진동 분광학 핸드북, J.M. Chalmers and P.R. Griffiths (eds), John Wiley & Sons Ltd, Vol. 2, 1472 - 1492 (2002) 페이지.
- ^ Keilmann, Fritz; Hillenbrand, Rainer (2004-04-15). Richards, David; Zayats, Anatoly (eds.). "Near-field microscopy by elastic light scattering from a tip". Philosophical Transactions of the Royal Society of London. Series A: Mathematical, Physical and Engineering Sciences. 362 (1817): 787–805. doi:10.1098/rsta.2003.1347. ISSN 1364-503X. PMID 15306494. S2CID 20211405. Archived from the original on 2020-11-09. Retrieved 2020-11-02.
- ^ Duarte FJ (2016). "Tunable laser microscopy". In Duarte FJ (ed.). Tunable Laser Applications (3rd ed.). Boca Raton: CRC Press. pp. 315–328. ISBN 9781482261066.
- ^ Thomas JL, Rudolph W (2008). "Biological Microscopy with Ultrashort Laser Pulses". In Duarte FJ (ed.). Tunable Laser Applications (2nd ed.). Boca Raton: CRC Press. pp. 245–80. ISBN 978-1-4200-6009-6.
- ^ Solem, J. C. (1983). "X-ray imaging on biological specimens". Proceedings of International Conference on Lasers '83: 635–640. OSTI 5998195.
- ^ Solem, J. C. (1982). "High-intensity x-ray holography: An approach to high-resolution snapshot imaging of biological specimens". Los Alamos National Laboratory Technical Report LA-9508-MS. 83: 23581. Bibcode:1982STIN...8323581S. doi:10.2172/7056325. OSTI 7056325. Archived from the original on 2020-08-04. Retrieved 2019-06-28.
- ^ Solem, J. C.; Baldwin, G. C. (1982). "Microholography of living organisms". Science. 218 (4569): 229–235. Bibcode:1982Sci...218..229S. doi:10.1126/science.218.4569.229. PMID 17838608. S2CID 32381820.
- ^ Solem, J. C.; Chapline, G. F. (1984). "X-ray biomicroholography". Optical Engineering. 23 (2): 193. Bibcode:1984OptEn..23..193S. doi:10.1117/12.7973410.
- ^ Solem, J. C. (1985). "Microholography". McGraw-Hill Encyclopedia of Science and Technology.
- ^ Solem, J. C. (1984). "X-ray holography of biological specimens". Proceedings of Ninth International Congress on Photobiology, Philadelphia, PA, USA, 3 July 1984 (LA-UR-84-3340, CONF-840783-3): 19. OSTI 6314558.
- ^ Solem, J. C. (1986). "Imaging biological specimens with high-intensity soft X-rays". Journal of the Optical Society of America B. 3 (11): 1551–1565. Bibcode:1986JOSAB...3.1551S. doi:10.1364/josab.3.001551.
- ^ W. S., J. C., Cullen, D., Boyer, K., Rodes, C. K. (1987)"푸리에 변환 홀로그램의 디지털 재구성을 위한 이론과 장치에 대한 설명", 전자 이미징 '87, 11월 2-5일, 보스턴; 전자 이미징 저널, (Institute for Graphic Communication, Inc., Boston), 페이지 693.
- ^ Haddad, W. S.; Cullen, D.; Boyer, K.; Rhodes, C. K.; Solem, J. C.; Weinstein, R. S. (1988). "Design for a Fourier-Transform Holographic Microscope". X-Ray Microscopy II. Springer Series in Optical Sciences. Vol. 56. pp. 284–287. doi:10.1007/978-3-540-39246-0_49. ISBN 978-3-662-14490-9.
- ^ Haddad, W. S.; Solem, J. C.; Cullen, D.; Boyer, K.; Rhodes, C. K. (1988). "Design for a Fourier-transform holographic microscope incorporating digital image reconstruction". Proceedings of CLEO '88 Conference on Lasers and Electro-Optics, Anaheim, CA, April, 1988; Optical Society of America, OSA Technical Digest. 7: WS4. Archived from the original on 2016-02-02. Retrieved 2016-01-13.
- ^ Haddad, W. S.; Cullen, D.; Solem, J. C.; Boyer, K.; Rhodes, C. K. (1988). "X-ray Fourier-transform holographic microscope". Proceedings of the OSA Topical Meeting on Short Wavelength Coherent Radiation: Generation and Applications, September 26–29, 1988, Cape Cod, MA., Falcone, R.; Kirz, J.; Eds. (Optical Society of America, Washington, DC): 284–289. Archived from the original on 2016-01-27. Retrieved 2016-01-13.
- ^ Solem, J. C.; Boyer, K.; Haddad, W. S.; Rhodes, C. K. (1990). Prosnitz, Donald (ed.). Prosnitz, D.; ed. SPIE. "Prospects for X-ray holography with free-electron lasers". Free Electron Lasers and Applications. Free-Electron Lasers and Applications. 1227: 105–116. Bibcode:1990SPIE.1227..105S. doi:10.1117/12.18609. S2CID 121807907.
- ^ Haddad, W. S.; Cullen, D.; Solem, J. C.; Longworth, J. W.; McPherson, L. A.; Boyer, K.; Rhodes, C. K. (1991). "Fourier-transform holographic microscope". Proceedings of SPIE Electronic Imaging '91, San Jose, CA; International Society for Optics and Photonics. Camera and Input Scanner Systems. 1448 (24): 81–88. Bibcode:1991SPIE.1448...81H. doi:10.1117/12.45347. PMID 20733659. S2CID 120679508.
- ^ Haddad, W. S.; Cullen, D.; Solem, J. C.; Longworth, J.; McPherson, A.; Boyer, K.; Rhodes, C. K. (1992). "Fourier-transform holographic microscope". Applied Optics. 31 (24): 4973–4978. Bibcode:1992ApOpt..31.4973H. doi:10.1364/ao.31.004973. PMID 20733659.
- ^ Boyer, K.; Solem, J. C.; Longworth, J.; Borisov, A.; Rhodes, C. K. (1996). "Biomedical three-dimensional holographic microimaging at visible, ultraviolet and X-ray wavelengths". Nature Medicine. 2 (8): 939–941. doi:10.1038/nm0896-939. PMID 8705867. S2CID 25231033.
- ^ Bell, A. G. (1880). "On the production and reproduction of sound by light". American Journal of Science. s3-20 (118): 305–324. Bibcode:1880AmJS...20..305B. doi:10.2475/ajs.s3-20.118.305. S2CID 130048089. Archived from the original on 2022-11-27. Retrieved 2019-06-28.
- ^ Yao, J.; Wang, L. V. (2013). "Photoacoustic Microscopy". Laser Photonics Rev. 7 (5): 1–36. Bibcode:2013LPRv....7..758Y. doi:10.1002/lpor.201200060. PMC 3887369. PMID 24416085.
- ^ Langer, G.; Buchegger, B.; Jacak, J.; Klar, T. A.; Berer, T. (2016). "Frequency domain photoacoustic and fluorescence microscopy". Biomedical Optics Express. 7 (7): 2692–702. doi:10.1364/BOE.7.002692. PMC 4948622. PMID 27446698.
- ^ Kotrly M (August 2015). "New Possibilities of Using Micrscopic Techniques in Forensic Field". Proceedings of Microscopy & Microanallysis. 21 (S3): 1365–1366. Bibcode:2015MiMic..21S1365K. doi:10.1017/S1431927615007618.
- ^ a b Basu S, Millette JR (1986). Electron Microscopy in Forensic Occupational and Environmental Health Sciences. New York: Plenum Press.
진일보한 내용
- Pluta, Maksymilian (1988). Advanced Light Microscopy vol. 1 Principles and Basic Properties. Elsevier. ISBN 978-0-444-98939-0.
- Pluta, Maksymilian (1989). Advanced Light Microscopy vol. 2 Specialised Methods. Elsevier. ISBN 978-0-444-98918-5.
- Bradbury, S.; Bracegirdle, B. (1998). Introduction to Light Microscopy. BIOS Scientific Publishers. ISBN 978-0-387-91515-9.
- Inoue, Shinya (1986). Video Microscopy. Plenum Press. ISBN 978-0-306-42120-4.
- Cremer, C.; Cremer, T. (1978)."고해상도 및 심도 있는 레이저 스캐닝 현미경에 대한 고려"(PDF).현미경법. 81 (1): 31–44.PMID 713859.2016-03-04 원본(PDF)에서 보관.2009-12-22를 검색했습니다.초고해상도 4Pi 현미경의 이론적 기초 및 공초점 레이저 주사 형광 현미경의 설계
- Willis, Randall C. (2007). "Portraits of life, one molecule at a time". Analytical Chemistry. 79 (5): 1785–8. doi:10.1021/ac0718795. PMID 17375393.분석 화학 2007년 3월 1일자 부회절 현미경에 관한 특집 기사
외부 링크
일반
- 현미경 용어집, 아마추어 빛 현미경에서 일반적으로 사용되는 용어.
- 니콘 현미경U 광현미경에 대한 광범위한 정보
- 올림푸스 현미경 현미경 자료 센터
- 칼 자이스 "처음부터 현미경", 현미경의 기초에 대한 단계별 튜토리얼.
- 상세 현미경 - 가장 일반적인 현미경 기술을 자세히 설명하는 많은 그림이 있는 리소스
- 마나와투 현미경 - 현미경 및 이미지 분석을 위한 최초의 공동 작업 환경으로 알려져 있습니다.
- 오디오 현미경 용어집







 제공합니다
제공합니다
 Grüneisen
Grüneisen  레이저의 광자
레이저의 광자  샘플의 밴드 갭 에너지입니다.따라서, 높은 형광 양자 수율은 높은 형광 신호로 이어지고, 낮은 형광 양자 수율은 높은 광음향 신호로 이어지기 때문에 광음향 현미경법은 형광 현미경법의 보완 기술로 매우 적합한 것으로 보입니다.
샘플의 밴드 갭 에너지입니다.따라서, 높은 형광 양자 수율은 높은 형광 신호로 이어지고, 낮은 형광 양자 수율은 높은 광음향 신호로 이어지기 때문에 광음향 현미경법은 형광 현미경법의 보완 기술로 매우 적합한 것으로 보입니다.
 여기 레이저의 파장이며, 대물 렌즈의 수치 조리개입니다.들어오는 파형 전면이 평행할 경우 Abbe 회절 한계가 유지됩니다.그러나 실제로 레이저 빔 프로파일은 가우스입니다.따라서 달성 가능한 분해능을 계산하려면 잘린 가우스 빔에 대한 공식을
여기 레이저의 파장이며, 대물 렌즈의 수치 조리개입니다.들어오는 파형 전면이 평행할 경우 Abbe 회절 한계가 유지됩니다.그러나 실제로 레이저 빔 프로파일은 가우스입니다.따라서 달성 가능한 분해능을 계산하려면 잘린 가우스 빔에 대한 공식을