헥소키나아제
Hexokinase| 헥소키나아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kluyveromyces 락티스로부터 [1]얻은 헥소키나아제 1의 결정 구조. | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.7.1.1 | ||||||||
| CAS 번호 | 9001-51-8 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| 헥소키나아제1 | |||||||
|---|---|---|---|---|---|---|---|
 헥소키나아제1, 호모디머, 인간 | |||||||
| 식별자 | |||||||
| 기호. | HK1 | ||||||
| NCBI유전자 | 3098 | ||||||
| HGNC | 4922 | ||||||
| 옴 | 142600 | ||||||
| 참조 | NM_000188 | ||||||
| 유니프로트 | P19367 | ||||||
| 기타 데이터 | |||||||
| 궤적 | 성서 10절 문제 22 | ||||||
| |||||||
| 헥소키나아제2 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호. | HK2 | ||||||
| NCBI유전자 | 3099 | ||||||
| HGNC | 4923 | ||||||
| 옴 | 601125 | ||||||
| 참조 | NM_000189 | ||||||
| 유니프로트 | P52789 | ||||||
| 기타 데이터 | |||||||
| 궤적 | 제2장 p13 | ||||||
| |||||||
| 헥소키나아제3(백색세포) | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호. | HK3 | ||||||
| NCBI유전자 | 3101 | ||||||
| HGNC | 4925 | ||||||
| 옴 | 142570 | ||||||
| 참조 | NM_002115 | ||||||
| 유니프로트 | P52790 | ||||||
| 기타 데이터 | |||||||
| 궤적 | 제5장 문제 35.2 | ||||||
| |||||||
| 헥소키나아제_1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 인간글루코키나아제결정구조 | |||||||||
| 식별자 | |||||||||
| 기호. | 헥소키나아제_1 | ||||||||
| 팜 | PF00349 | ||||||||
| 빠맘 클랜 | CL0108 | ||||||||
| 인터프로 | IPR022672 | ||||||||
| 프로 사이트 | PDOC00370 | ||||||||
| SCOP2 | 1cza/SCOPe/SUPFAM | ||||||||
| |||||||||
| 헥소키나아제_2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 랫드뇌헥소키나아제I형복합체포도당및억제제포도당6-인산 | |||||||||
| 식별자 | |||||||||
| 기호. | 헥소키나아제_2 | ||||||||
| 팜 | PF03727 | ||||||||
| 빠맘 클랜 | CL0108 | ||||||||
| 인터프로 | IPR022673 | ||||||||
| 프로 사이트 | PDOC00370 | ||||||||
| SCOP2 | 1cza/SCOPe/SUPFAM | ||||||||
| |||||||||
헥소키나아제는 헥소스를 인산염으로 인산화시키는 효소이다.대부분의 유기체에서 포도당은 헥소키나아제에게 가장 중요한 기질이고 포도당 6-인산은 가장 중요한 생성물이다.헥소키나아제는 무기인산기를 ATP에서 기질로 전달하는 능력을 가지고 있다.
헥소키나아제는 헥소키나제의 특이적 이소 형태인 글루코키나아제와 혼동해서는 안 된다.모든 헥소키나아제는 여러 헥소스를 인산화할 수 있지만 글루코키나아제는 50배 낮은 기질 친화력으로 작용하며 주요 헥소키나아제는 포도당이다.
변화
헥소키나제를 코드하는 유전자는 생명의 모든 영역에서 발견되었고 박테리아, 효모, 식물에서 인간과 다른 척추 동물에 이르기까지 다양한 종에 존재한다.그들은 액틴 폴드 단백질로 분류되며, 기질 친화성과 다른 특성을 결정하는 보다 가변적인 배열로 둘러싸인 공통의 ATP 결합 부위 코어를 공유한다.
서로 다른 기능을 제공하는 여러 헥소키나아제 이소형질 또는 이소자임은 단일 종에서 발생할 수 있다.
반응
헥소키나아제에 의해 매개되는 세포내 반응은 다음과 같이 표현될 수 있다.
- 헥소스-CHOH2 + MgATP → 헥소스-CHO-PO22−
3 + MgADP−
+ H+
여기서2 헥소스-CHOH는 접근성 -CHOH2 부분을 포함하는 여러 육탄당(포도당 등) 중 하나를 나타낸다.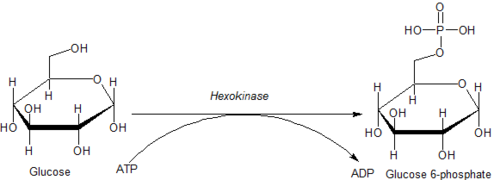
헥소스 인산화 결과
포도당과 같은 헥소스의 인산화 작용은 당분해 또는 글리코겐 합성과 같은 세포 내 대사 과정으로 종종 제한된다.이것은 인산화 헥소스가 충전되어 세포 밖으로 운반하는 것이 더 어렵기 때문이다.
필수 프룩토소뇨증 환자의 경우, 헥소키나아제에 의한 과당의 과당-6-인산으로의 대사가 식이 과당의 주요 대사 방법이며, 정상적인 개인에서는 이 경로가 유의하지 않다.
다양한 Isoform의 크기
대부분의 박테리아 헥소키나아제는 크기가 약 50 kD이다.식물과 동물을 포함한 다세포 유기체는 종종 하나 이상의 헥소키나아제 이소형을 가지고 있다.대부분은 크기가 약 100kD이고, 많은 시퀀스 호몰로지를 공유하는 두 개의 절반(N 및 C 단자)으로 구성됩니다.이는 박테리아와 유사한 50kD 조상 헥소키나아제의 복제와 융합에 의한 진화적 기원을 시사한다.
포유류 헥소키나아제 종류
상이한 기질 및 조건, 생리 기능과 관련하여 세포하 위치와 동역학에서 다른 네 가지 중요한 포유류의 헥소키나아제 이소효소(EC 2.7.1.1)가 있다.이들은 헥소키나아제 I, II, III 및 IV 또는 헥소키나아제 A, B, C 및 D로 지정된다.
헥소키나아제 I, II 및 III
헥소키나아제 I, II, III는 포도당에 대한 높은 친화력(1mM 이하) 때문에 "저Km" 동질효소로 언급된다.헥소키나아제 I 및 II는 [citation needed]기질의 생리적 농도에서 Michaelis-Menten 역학을 따른다.세 가지 모두 포도당 6-인산에 의해 강하게 억제된다.분자량은 약 100kD입니다.각각은 두 개의 유사한 50kD 반으로 구성되지만, 헥소키나아제 II에서만 두 반쪽 모두 기능 활성 부위가 있다.
- 헥소키나아제 I/A는 모든 포유류의 조직에서 발견되며, 대부분의 생리적, 호르몬, 대사적 변화에 영향을 받지 않는 "하우스키핑 효소"로 여겨진다.
- 헥소키나아제 II/B는 많은 세포 유형에서 주요 조절 아이소폼을 구성하며, 많은 암에서 증가한다.그것은 근육과 심장에서 발견되는 헥소키나아제이다.헥소키나아제 II는 또한 미토콘드리아 외막에 위치하여 [2]ATP에 직접 접근할 수 있다.헥소키나아제 II의 상대적 특이 활성은 pH에 따라 적어도 6.9~8.[3]5의 pH 범위에서 증가한다.
- 헥소키나아제III/C는 생리학적 농도로 포도당에 의해 기질 저해된다.이 Isoform의 규제 특성에 대해서는 거의 알려져 있지 않다.
헥소키나아제IV('글루코키나아제')
글루코키나아제라고도 불리는 포유류의 헥소키나아제 IV는 동역학 및 기능 면에서 다른 헥소키나아제와는 다르다.
아세포 수준에서 인산화 위치는 글루코키나제가 간세포의 세포질과 핵 사이를 이동할 때 발생한다.글루코키나아제는 이 기질의 농도가 충분히 높을 때만 포도당을 인산화시킬 수 있으며, 포도당에 대한 Km은 헥소키나아제 I, II, III의 Km보다 100배 높다.
헥소키나아제 IV는 약 50kD의 단량체이며, 포도당과 양의 협동성을 보이며, 그 생성물인 포도당 6-인산에 의해 알로스테릭하게 억제되지 않는다.
헥소키나아제 IV는 간, 췌장, 시상하부, 소장 및 아마도 다른 특정 신경내분비세포에 존재하며 탄수화물 대사에서 중요한 조절 역할을 한다.췌도 베타세포에서는 인슐린 방출을 제어하는 포도당 센서 역할을 하며 알파세포에서도 마찬가지로 글루카곤 방출을 제어한다.간세포에서 글루코키나아제는 글리코겐 합성을 증가 또는 감소시킴으로써 주위 포도당 수준의 변화에 반응한다.
해당과정에서
포도당은 분자 산소(O2)의 유무 모두에서 모든 세포에 의해 ATP를 생성하는데 사용될 수 있다는 점에서 독특하다.해당과정의 첫 단계는 헥소키나아제에 의한 포도당의 인산화이다.
| D-포도당 | 헥소키나아제 | α-D-글루코스-6-인산 | |
 |  | ||
| ATP | ADP | ||
 | |||
KEGG 경로 데이터베이스의 복합 C00031. KEGG 경로 데이터베이스의 효소 2.7.1.1. KEGG 경로 데이터베이스의 화합물 C00668. KEGG 경로 데이터베이스에서의 반응 R01786.
포도당의 인산화를 촉매하여 포도당 6-인산을 생성함으로써 헥소키나제는 세포로의 포도당의 원활한 운반을 선호하는 내리막 농도 구배를 유지한다.또한 이 반응은 당분해 및 펜토스 [4]인산 경로를 포함하여 생리적으로 관련된 포도당 이용 경로를 모두 개시한다.또한 하전된 인산기가 6위치에 추가되면 하전된 헥소스 인산기가 세포막을 쉽게 통과할 수 없기 때문에 세포 내에서 포도당과 2-디옥시헥소스 포도당 유사체(예: 2-디옥시글루코스 및 2-디옥시글루코스)의 '트랩'이 보장된다.
미토콘드리아와의 연관성
헥소키나아제 I 및 II는 포린 또는 전압의존성 음이온 채널에 대한 특정 결합을 통해 미토콘드리아 외막의 외표면에 물리적으로 결합할 수 있다.이 연관성은 헥소키나아제의 두 기질 중 하나인 미토콘드리아에 의해 생성된 ATP에 대한 헥소키나아제 직접 접근을 보장한다.미토콘드리아 헥소키나아제는 빠르게 성장하는 악성 종양 세포에서 정상 조직보다 최대 200배 높은 수준으로 높은 수치를 보인다.미토콘드리아 결합 헥소키나아제는 종양 세포에서 곡예적으로 일어나는 매우 높은 당화 속도를 이끄는[5] 원동력이라는 것이 입증되었다.
수경도
단백질의 잠재적 막 통과 부분은 수경 분석으로 검출될 수 있다.수경 분석에서는 폴리펩타이드 사슬을 따라 각 위치에서 소수성 특성을 정량화하는 알고리즘을 사용합니다.수용된 수경성 척도 중 하나는 수경성 플롯의 생성에 의존하는 Kyte와 Doolittle의 척도이다.이 그림에서 음수는 친수성 영역을 나타내고 양수는 Y축의 소수성 영역을 나타냅니다.잠재적 막 통과 도메인은 x축에서 약 20개의 아미노산 길이이다.
효모 내 헥소키나아제의 수경성 분석은 이러한 기준에 의해 생성되었다.헥소키나아제는 아미노산 400 주위에 위치한 단일 잠재적 막 통과 도메인을 가지는 것으로 보인다.따라서 [6]헥소키나아제는 효모에서 일체형 막단백질이 아닐 가능성이 높다.
부족.
헥소키나아제 결핍증은 만성 용혈성 빈혈의 원인이 되는 유전적 상염색체 열성 질환이다.만성 용혈성 빈혈은 HK 효소를 코드하는 HK 유전자의 돌연변이에 의해 발생한다.돌연변이는 헥소키나아제 [7]결핍을 일으키는 HK 활성의 감소를 일으킨다.
「 」를 참조해 주세요.
- 알로스테리
- 효소 촉매 작용
- 유연한 링커
- 형광 포도당 바이오센서
- 글루코키나아제
- 당분해
- 글리코겐
- 글루코오스6-인산가수분해효소
- 헥소스인산흡수
- 인슐린
- 단백질 도메인 다이내믹스
- 단백질 유연성
레퍼런스
- ^ PDB: 3O08; Kuettner EB, Kettner K, Keim A, Svergun DI, Volke D (2010). "Crystal structure of dimeric KlHxk1 in crystal form I". doi:10.2210/pdb3o08/pdb.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ "Hexokinase data on Uniprot". uniprot.org.
- ^ Šimčíková D, Heneberg P (August 2019). "Identification of alkaline pH optimum of human glucokinase because of ATP-mediated bias correction in outcomes of enzyme assays". Scientific Reports. 9 (1): 11422. Bibcode:2019NatSR...911422S. doi:10.1038/s41598-019-47883-1. PMC 6684659. PMID 31388064.
- ^ Robey, RB; Hay, N (2006). "Mitochondrial hexokinases, novel mediators of the antiapoptotic effects of growth factors and Akt". Oncogene. 25 (34): 4683–96. doi:10.1038/sj.onc.1209595. PMID 16892082.
- ^ Bustamante E, Pedersen P (1977). "High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase". Proc Natl Acad Sci USA. 74 (9): 3735–9. Bibcode:1977PNAS...74.3735B. doi:10.1073/pnas.74.9.3735. PMC 431708. PMID 198801.
- ^ Bowen, R. A. Molecular Toolkit: 단백질 소수성 플롯.콜로라도 주립 대학교, 1998년Web. 2010년 11월 15일<http://www.vivo.colostate.edu/molkit/index.html 2010년 6월 25일 Wayback Machine에서 아카이브 완료>
- ^ "Hexokinase deficiency". Enerca. Enerca. Archived from the original on 8 August 2020. Retrieved 6 April 2017.













