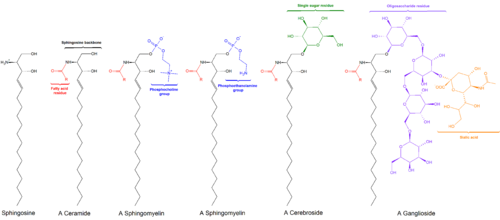
스핑골리피드
Sphingolipid스핑골리피드는 스핑고신을 포함한 일련의 아미노 알코올인 스핑고이드 베이스의 등뼈를 함유한 지질의 일종이다.그것들은 1870년대에 뇌 추출물에서 발견되었고 수수께끼 같은 성질 때문에 신화적인 스핑크스의 이름을 따서 명명되었다.[1]이러한 화합물은 신호 전달과 세포 인식에 중요한 역할을 한다.스핑골리피도스, 즉 스핑골리피도스 신진대사의 장애는 신경조직에 특별한 영향을 미친다.수소 원자로만 구성된 R그룹을 가진 스핑골리피드는 세라마이드다.다른 일반적인 R 그룹에는 각각 세레브로시드와 글로보사이드, 스핑고멜린을 분비하는 인포콜린과 다양한 설탕 모노머 또는 디머가 있다.세레브로시드와 글로보시드는 집합적으로 글리코스포싱올리피드로 알려져 있다.
구조
때때로 단순히 스핑고이드 베이스로 알려진 롱 체인 베이스는 효모와 포유류 모두에서 데 노보 스핑골리피드 합성의 첫 번째 비투명 제품이다.이러한 화합물들은 특히 피토스핀과 디히드로스핀으로 알려져 있으며(이 용어는 덜 흔하지만 스핑가닌으로도 알려져 있다)[2]은 주로18 C 화합물이며, C20 염기 수준이 다소 낮다.[3]세라마이드와 글리코스포신골리피드는 이들 화합물의 N-아킬 유도체다.[4]
스핑고신 백본은 에탄올아민, 세린 또는 콜린과 같은 (일반적으로) 충전된 헤드 그룹에 O-연결된다.[citation needed]
등뼈는 지방산과 같은 아틸 그룹과도 아미드 연계가 된다.[citation needed]
종류들
스핑고이드 베이스와 세라마이드 등이 포함된 단순 스핑고립드는 스핑고이드 합성경로의 초기 생산물을 구성한다.
- 스핑고이드 베이스는 모든 스핑고이드의 기본 구성 요소다.포유류의 주된 스핑고이드 베이스는 디하이드로스핀과 스핑고신이며, 디하이드로스핀과 피토스핀은 효모에 주요 스핑고이드 베이스다.[5][6]스핑고신, 디하이드로스핀, 피토스핑고신은 인산염일 수 있다.
- 세라마이드는 일반 클래스로서 추가적인 헤드 그룹이 없는 N-아큐레이트 스핑고이드 베이스다.
- 디하이드로세라미드는 디하이드로스핀의 N-아킬레이션에 의해 생성된다.디히드로세라마이드는 효모와 포유류 계통 모두에서 발견된다.
- 세라마이드는 디하이드로세라마이드 데스포라아제 1(DES1)에 의한 디하이드로세라미드(dihydroceramide)의 착색에 의해 포유류 시스템에서 생산된다.이 고활성 분자는 세라마이드-1-인산염을 형성하기 위해 인산염일 수도 있다.
- 피토세라마이드(Pytoceramide)는 C-4에서 디하이드로세라마이드의 히드록시화에 의해 효모에서 생산된다.
세라마이드 또는 피토세라마이드에 머리 그룹을 추가하여 복잡한 스피놀리피드를 형성할 수 있다.
- 스핑고멜린은 세라마이드의 1-히드록시 그룹과 에스테르 연계가 있는 인포콜린 또는 인포이에탄올아민 분자를 가지고 있다.
- 글리코스포싱올리피드는 하나 이상의 설탕 잔류물이 1-하이드록실 위치에서 β-글리코시디드 연결로 결합되는 세라마이드다(이미지 참조).
- 피토세라마이드에서 유래한 이노시톨 함유 세라마이드는 효모에서 생산된다.여기에는 이노시톨 인산화물, 만노오스 이노시톨 인산화물, 만노오스 디이노시톨 인산화라미드 등이 포함된다.
포유류 스핑골리피드 대사
De novo spingolipid 합성은 serine palmitoyl transferase에 의한 3-keto-dihydrospingosine의 형성으로 시작한다.[7]이 반응을 위해 선호하는 기판은 팜티토일-코아(Palmitoyl-CoA)와 세린이다.그러나 세린팔미토일전달효소가 다른 종류의 지방 아킬-CoA와[8] 대체 아미노산을 대상으로 어느 정도 활동을 하고 있다는 연구결과가 나와 최근 스핑고이드 베이스의 다양성이 검토되고 있다.[9][10]다음으로 3케토-디히드로스핀신을 줄여 디히드로스핀신을 만든다.디하이드로스핀은 원래 LASS라고 불리던 6개의 (다이하이드로)-세라마이드 신타아제 중 하나에 의해 아틸화 되어 디하이드로세라마이드(Dihydrospingosine)[11]를 형성한다.6개의 CerS 효소는 아틸-CoA 기질에 대해 서로 다른 특수성을 가지고 있어 체인 길이가 다른 디하이드로세라미드가 생성된다(C14-C26과 동일).그리고 나서 디히드로세라마이드는 세라마이드를 형성하기 위해 불포화된다.[12]
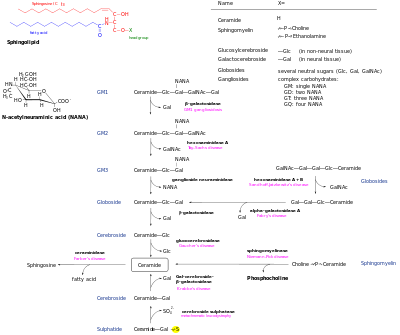
데 노보 생성 세라마이드(De novo generated shermide)는 스핑골리피드 네트워크의 중심 허브로, 그 후 여러 가지 운명도 있다.세라마이드-1-인산염을 형성하기 위해 세라마이드 키나아제에 의해 인산염될 수 있다.또는 글루코실세라마이드 신타아제 또는 갈락토실세라마이드 신타아제로 글리코실화 할 수 있다.또, 스핑고멜린 신타아제(spingomelin synthase)에 의해 인포릴콜린 헤드그룹을 첨가하여 스핑고멜린으로 변환할 수 있다.디아실글리세롤은 이 과정에 의해 생성된다.마지막으로 세라마이드는 세라마이드제에 의해 분해되어 스핑고신을 형성할 수 있다.스핑고신은 스핑고신-1-인산염을 형성하기 위해 인산염일 수 있다.이것은 스핑고신을 개혁하기 위해 탈인산화될 수 있다.[13]
파괴 경로를 통해 이들 대사물이 세라마이드로 역류할 수 있다.복합 글리코스포싱골리피드는 글루코실세라마이드와 갈락토실세라마이드로 가수분해된다.그리고 나서 이 지질들은 세라마이드 재생을 위해 베타글루코시다제와 베타갈락토시다제에 의해 가수분해된다.마찬가지로 스핑고멜린도 스핑고멜리나아제에 의해 분해되어 세라마이드를 형성할 수 있다.[citation needed]
스핑골리피드가 비스핑골리피드로 변환되는 유일한 경로는 스핑고신-1-인산염 리아제를 경유하는 것이다.이것은 에탄올아민 인산염과 헥사데칼을 형성한다.[14]
포유류 스핑골리피드의 기능
스핑골리피드는 일반적으로 플라즈마 막 지질 빌레이어의 기계적으로 안정적이고 화학적으로 저항적인 외부 전단을 형성하여 유해한 환경 요인으로부터 세포 표면을 보호하는 것으로 알려져 있다.특정 복합 글리코스포싱올리피드는 세포 인식과 신호와 같은 특정 기능에 관여하는 것으로 밝혀졌다.세포인식은 주로 스핑골리피드의 물리적 특성에 의존하는 반면, 신호는 인접한 세포나 단백질에 존재하는 유사한 지질을 가진 글리코스포싱골리피드의 글리칸 구조의 특정한 상호작용을 포함한다.[citation needed]
최근 세라마이드, 스핑고신-1-인산염과 같은 단순한 스핑골리피드 대사물이 사멸, 증식, 스트레스 반응, 괴사, 염증, 자가포화, 노화, 분화에 관여하는 신호 폭포에서 중요한 매개체가 되고 있는 것으로 나타났다.[15][16][17][18][19][20]세라마이드 기반 지질들은 세포막에서 자가집합하여 벌크 인광질체보다 유체가 적은 별도의 단계를 형성한다.이러한 스핑골리피드에 기반을 둔 마이크로돔, 즉 "지질 뗏목"은 원래 막 운반의 세포 경로를 따라 막 단백질을 분류하기 위해 제안되었다.현재 대부분의 연구는 신호 전달 중 조직 기능에 초점을 맞추고 있다.[21]
스핑골리피드는 ER에서 시작하여 골기 기구에서 완성되는 경로에서 합성되지만, 이러한 지질들은 플라즈마 막과 엔도솜에서 농축되어 많은 기능을 수행한다.[22]수송은 시토솔에서 염소와 단층수송을 통해 일어난다.스피놀리피드는 미토콘드리아와 ER에는 사실상 없지만 플라즈마 막 지질의 20-35 몰 분율을 구성한다.[23]
실험동물에서 스피놀리피드를 먹이면 대장 발암을 억제하고 LDL 콜레스테롤을 감소시키며 HDL 콜레스테롤을 상승시킨다.[24]
다른 스핑골리피드
스핑골리피드는 진핵생물에서는 보편적이지만 박테리아와 고고학에서는 드물다.스핑고모나디아과, FCB 그룹(일부 멤버), 델타프로테오박테리아 일부에서 스피고모나디아과가 발견된다.[25]
이스트 스피놀리피스
포유류 시스템의 놀라운 복잡성 때문에, 효모는 종종 새로운 경로를 개척하는 모범적인 유기체로 사용된다.이러한 단세포 유기체는 포유류 세포보다 유전적으로 다루기 쉬운 경우가 많으며, 균주 도서관은 거의 모든 비살상적인 개방형 독서 프레임 단일 삭제를 포함하는 균주를 공급할 수 있다.병원성 효모 칸디다 알비칸에서도 연구가 진행되지만 가장 많이 사용되는 효모 두 가지는 사카로마이오스 세레비시아에와 정신분열증균 폼베이다.[citation needed]
복잡한 스핑골리피드(inositol phospholylceramide 및 그것의 mannosylated 파생상품)의 중요한 구조적 기능 외에도, 스핑고이드 베이스인 피토스핀과 디히드로스핀(spinagine)은 S. serebisiae에서 활력 신호 역할을 한다.이러한 영향에는 내포세포증 규제, 유비퀴틴 의존 단백질 분해(따라서 영양소 흡수 조절), 세포골격 역학, 세포 주기, 번역, 후전 단백질 수정, 열응력 반응이 포함된다.[27]또한, Slm1p와 Slm2p 및 캘시네우린을 통한 인산염(4,5)-비스포인산 신호에 의한 스핑골리피드 신진대사의 변조가 최근 설명되고 있다.[28]또한, 인산염리노시톨 키나제 Stt4p와 지질인산효소 Sac1p에 의한 인산염 4-인산염의 복잡한 스피놀리피드 합성과 순환 사이에 기질 수준의 상호작용이 나타났다.[29]
식물성스핀지류
고등식물은 동물이나 곰팡이보다 더 다양한 종류의 스피놀리피드를 함유하고 있다.[citation needed]
장애
스핑골리피도스라고 알려진 스핑골리피드 대사에는 여러 가지 장애가 있다.이 집단의 주요 구성원은 니만-픽병, 파브리병, 크라베병, 고셔병, 타이-삭스병, 메타크롬 백혈구증후군이다.그것들은 일반적으로 자가 열성적인 방식으로 유전되지만, 특히 파브리병은 X와 연관되어 있다.종합하면, 스피놀리피도스는 대략 1만분의 1의 발병률을 가지고 있지만, 아슈케나지 유태인과 같은 특정 인구에서 훨씬 더 많이 발병한다.효소대체요법은 주로 파브리병과 고셔병을 치료할 수 있으며, 이러한 유형의 스피골리피도스를 가진 사람들은 성인기까지는 잘 살 수 있을 것이다.다른 유형들은 일반적으로 유아기 형태에 대해 1세에서 5세까지 치명적이지만, 청소년 또는 성인기 형태에 대해서는 진행이 미미할 수 있다.[citation needed]
스핑골리피드는 프리드리히의 아탁시아(Fxn)와 관련이 있는 프락신 단백질과도 관련이 있다.마우스에서 신경계의 Fxn 상실은 또한 철/스핑골리피드/PDK1/Mef2 경로를 활성화하여 메커니즘이 진화적으로 보존되어 있음을 나타낸다.게다가, 스핑 고지질 수준과PDK1 활동 또한 FRDA 환자들의 마음 속 FRDA.[30]에 다른 연구들의 신경 체계에 철을 축적 sphingolipids고, 그것은 그 다음에 3-phosphoinositide 의존 단백질 친족을 활성화시키는 합성, 보다 보여 왔다 비슷한 경로 큰 영향을 받고 있는이 늘어나고 있다.ase-1 (Pdk1) 및 근세포증진제 인자-2 (Mef2)를 사용하여 성인용 광수용체의 신경분석을 유발한다.[31]
추가 이미지
참고 항목
참조
- ^ Chun J, Hartung HP (2010). "Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis". Clinical Neuropharmacology. 33 (2): 91–101. doi:10.1097/wnf.0b013e3181cbf825. PMC 2859693. PMID 20061941.
- ^ [http://www.sigmaaldrich.com/US/en/product/sigma/d3314 Sigma&N5=SEARK_CONCAT_PNO BRAND_KEY&F=SPEC 제품 페이지(Sigma Aldrich)]
- ^ Dickson RC (1998). "Sphingolipid functions in Saccharomyces cerevisiae: comparison to mammals". Annual Review of Biochemistry. 67: 27–48. doi:10.1146/annurev.biochem.67.1.27. PMID 9759481.
- ^ Gunstone, F. (1996) F.F. 지방산과 지질화학, 페이지 43-44에 간략하고 매우 이해할 수 있는 검토가 주어진다.블랙키 아카데미와 프로페셔널.ISBN 0-7514-0253-2
- ^ Dickson RC (May 2008). "Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast". Journal of Lipid Research. 49 (5): 909–21. doi:10.1194/jlr.R800003-JLR200. PMC 2311445. PMID 18296751.
- ^ Bartke N, Hannun YA (April 2009). "Bioactive sphingolipids: metabolism and function". Journal of Lipid Research. 50 Suppl: S91-6. doi:10.1194/jlr.R800080-JLR200. PMC 2674734. PMID 19017611.
- ^ Merrill AH (December 1983). "Characterization of serine palmitoyltransferase activity in Chinese hamster ovary cells". Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 754 (3): 284–91. doi:10.1016/0005-2760(83)90144-3. PMID 6652105.
- ^ Merrill AH, Williams RD (February 1984). "Utilization of different fatty acyl-CoA thioesters by serine palmitoyltransferase from rat brain". Journal of Lipid Research. 25 (2): 185–8. PMID 6707526.
- ^ Zitomer NC, Mitchell T, Voss KA, Bondy GS, Pruett ST, Garnier-Amblard EC, Liebeskind LS, Park H, Wang E, Sullards MC, Merrill AH, Riley RT (February 2009). "Ceramide synthase inhibition by fumonisin B1 causes accumulation of 1-deoxysphinganine: a novel category of bioactive 1-deoxysphingoid bases and 1-deoxydihydroceramides biosynthesized by mammalian cell lines and animals". The Journal of Biological Chemistry. 284 (8): 4786–95. doi:10.1074/jbc.M808798200. PMC 2643501. PMID 19095642.
- ^ Pruett ST, Bushnev A, Hagedorn K, Adiga M, Haynes CA, Sullards MC, Liotta DC, Merrill AH (August 2008). "Biodiversity of sphingoid bases ("sphingosines") and related amino alcohols". Journal of Lipid Research. 49 (8): 1621–39. doi:10.1194/jlr.R800012-JLR200. PMC 2444003. PMID 18499644.
- ^ Pewzner-Jung Y, Ben-Dor S, Futerman AH (September 2006). "When do Lasses (longevity assurance genes) become CerS (ceramide synthases)?: Insights into the regulation of ceramide synthesis". The Journal of Biological Chemistry. 281 (35): 25001–5. doi:10.1074/jbc.R600010200. PMID 16793762.
- ^ Causeret C, Geeraert L, Van der Hoeven G, Mannaerts GP, Van Veldhoven PP (October 2000). "Further characterization of rat dihydroceramide desaturase: tissue distribution, subcellular localization, and substrate specificity". Lipids. 35 (10): 1117–25. doi:10.1007/s11745-000-0627-6. PMID 11104018.
- ^ Hannun YA, Obeid LM (February 2008). "Principles of bioactive lipid signalling: lessons from sphingolipids". Nature Reviews Molecular Cell Biology. 9 (2): 139–50. doi:10.1038/nrm2329. PMID 18216770.
- ^ Bandhuvula P, Saba JD (May 2007). "Sphingosine-1-phosphate lyase in immunity and cancer: silencing the siren". Trends in Molecular Medicine. 13 (5): 210–7. doi:10.1016/j.molmed.2007.03.005. PMID 17416206.
- ^ Hannun YA, Obeid LM (July 2002). "The Ceramide-centric universe of lipid-mediated cell regulation: stress encounters of the lipid kind". The Journal of Biological Chemistry. 277 (29): 25847–50. doi:10.1074/jbc.R200008200. PMID 12011103.
- ^ Spiegel S, Milstien S (July 2002). "Sphingosine 1-phosphate, a key cell signaling molecule". The Journal of Biological Chemistry. 277 (29): 25851–4. doi:10.1074/jbc.R200007200. PMID 12011102.
- ^ Lavieu G, Scarlatti F, Sala G, Carpentier S, Levade T, Ghidoni R, Botti J, Codogno P (March 2006). "Regulation of autophagy by sphingosine kinase 1 and its role in cell survival during nutrient starvation". The Journal of Biological Chemistry. 281 (13): 8518–27. doi:10.1074/jbc.M506182200. PMID 16415355.
- ^ Venable ME, Lee JY, Smyth MJ, Bielawska A, Obeid LM (December 1995). "Role of ceramide in cellular senescence". The Journal of Biological Chemistry. 270 (51): 30701–8. doi:10.1074/jbc.270.51.30701. PMID 8530509.
- ^ Hetz CA, Hunn M, Rojas P, Torres V, Leyton L, Quest AF (December 2002). "Caspase-dependent initiation of apoptosis and necrosis by the Fas receptor in lymphoid cells: onset of necrosis is associated with delayed ceramide increase". Journal of Cell Science. 115 (Pt 23): 4671–83. doi:10.1242/jcs.00153. PMID 12415011.
- ^ Snider AJ, Orr Gandy KA, Obeid LM (June 2010). "Sphingosine kinase: Role in regulation of bioactive sphingolipid mediators in inflammation". Biochimie. 92 (6): 707–15. doi:10.1016/j.biochi.2010.02.008. PMC 2878898. PMID 20156522.
- ^ Brown DA, London E (June 2000). "Structure and function of sphingolipid- and cholesterol-rich membrane rafts". The Journal of Biological Chemistry. 275 (23): 17221–4. doi:10.1074/jbc.R000005200. PMID 10770957.
- ^ Futerman AH (December 2006). "Intracellular trafficking of sphingolipids: relationship to biosynthesis". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12): 1885–92. doi:10.1016/j.bbamem.2006.08.004. PMID 16996025.
- ^ van Meer G, Lisman Q (July 2002). "Sphingolipid transport: rafts and translocators". The Journal of Biological Chemistry. 277 (29): 25855–8. doi:10.1074/jbc.R200010200. PMID 12011105.
- ^ Vesper H, Schmelz EM, Nikolova-Karakashian MN, Dillehay DL, Lynch DV, Merrill AH (July 1999). "Sphingolipids in food and the emerging importance of sphingolipids to nutrition". The Journal of Nutrition. 129 (7): 1239–50. doi:10.1093/jn/129.7.1239. PMID 10395583.
- ^ Heaver, SL; Johnson, EL; Ley, RE (June 2018). "Sphingolipids in host-microbial interactions" (PDF). Current Opinion in Microbiology. 43: 92–99. doi:10.1016/j.mib.2017.12.011. PMID 29328957.
- ^ Chung N, Mao C, Heitman J, Hannun YA, Obeid LM (September 2001). "Phytosphingosine as a specific inhibitor of growth and nutrient import in Saccharomyces cerevisiae". The Journal of Biological Chemistry. 276 (38): 35614–21. doi:10.1074/jbc.m105653200. PMID 11468289.
- ^ Cowart LA, Obeid LM (March 2007). "Yeast sphingolipids: recent developments in understanding biosynthesis, regulation, and function". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1771 (3): 421–31. doi:10.1016/j.bbalip.2006.08.005. PMC 1868558. PMID 16997623.
- ^ Dickson RC (May 2008). "Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast". Journal of Lipid Research. 49 (5): 909–21. doi:10.1194/jlr.R800003-JLR200. PMC 2311445. PMID 18296751.
- ^ Brice SE, Alford CW, Cowart LA (March 2009). "Modulation of sphingolipid metabolism by the phosphatidylinositol-4-phosphate phosphatase Sac1p through regulation of phosphatidylinositol in Saccharomyces cerevisiae". The Journal of Biological Chemistry. 284 (12): 7588–96. doi:10.1074/jbc.M808325200. PMC 2658053. PMID 19139096.
- ^ Chen K, Ho TS, Lin G, Tan KL, Rasband MN, Bellen HJ (November 2016). "Loss of Frataxin activates the iron/sphingolipid/PDK1/Mef2 pathway in mammals". eLife. 5. doi:10.7554/eLife.20732. PMC 5130293. PMID 27901468.
- ^ Chen K, Lin G, Haelterman NA, Ho TS, Li T, Li Z, Duraine L, Graham BH, Jaiswal M, Yamamoto S, Rasband MN, Bellen HJ (June 2016). "Loss of Frataxin induces iron toxicity, sphingolipid synthesis, and Pdk1/Mef2 activation, leading to neurodegeneration". eLife. 5. doi:10.7554/eLife.16043. PMC 4956409. PMID 27343351.
외부 링크
- 미국 국립 의학 도서관의 Spingolipids(MesH) 제목