ELISA
ELISA| ELISA | |
|---|---|
 TMB와 함께 개발 중인 ELISA | |
| 메쉬 | D004797 |
효소연계면역흡수분석(ELISA)(/ɪlaəz,/, /ːiɪlaəz)/)은 일반적으로 사용되는 분석 생화학분석으로 1971년 [1]에바 Engvall과 Peter Perlmann에 의해 처음 기술되었다.이 검사는 고체상 효소 면역측정법(EIA)을 사용하여 측정할 단백질에 대해 지시된 항체를 사용하여 액체 샘플에서 리간드(일반적으로 단백질)의 존재를 감지합니다.ELISA는 의학, 식물병리학, 생명공학 등의 진단도구로 활용되고 있으며, 다양한 산업의 품질관리 체크에도 활용되고 있습니다.
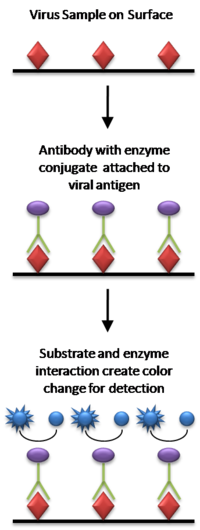
ELISA의 가장 간단한 형태에서는 피검체로부터의 항원을 표면에 부착한다.그런 다음, 항원을 결합할 수 있도록 일치하는 항체를 표면에 바른다.이 항체는 효소와 연결되고 결합되지 않은 항체는 제거된다.마지막 단계에서는 효소 기질을 포함한 물질을 첨가한다.결합이 있는 경우 후속 반응은 감지 가능한 신호, 즉 가장 일반적으로 색상 변화를 생성합니다.
ELISA를 실행하는 것은 특정 항원에 대해 특이성을 가진 적어도 1개의 항체를 포함한다.알 수 없는 양의 항원을 가진 샘플은 비특이적으로(표면 흡착을 통해) 또는 특이적으로("샌드위치" ELISA에서 동일한 항원에 고유한 다른 항체를 통해) 고체 지지체(일반적으로 폴리스티렌 마이크로티터 플레이트)에 고정된다.항원 고정화 후 검출항체를 첨가하여 항원과 착체를 형성한다.검출항체는 효소와 공유결합할 수도 있고 생체결합을 통해 효소와 결합하는 2차 항체에 의해 검출될 수도 있다.각 단계 사이에 플레이트는 일반적으로 순한 세제 용액으로 세척되어 비특이적으로 결합되어 있는 단백질이나 항체를 제거합니다.최종 세척공정 후 효소기질을 첨가하여 판을 현상하여 시료 중의 항원량을 나타내는 가시신호를 생성한다.
주목해야 할 점은 ELISA는 엄밀하게 "immuno" 측정 대신 다른 형태의 리간드 결합 측정을 수행할 수 있지만, 이 방법의 일반적인 사용 및 개발 역사 때문에 원래 "immuno"라는 이름이 붙었다는 것입니다.이 기술은 기본적으로 고체상에 고정될 수 있는 결합 시약과 특정 결합 시약을 필요로 하며 적절한 정량화가 가능한 신호를 생성하기 위해 효소를 사용합니다.세척 사이에 리간드와 그 특정 결합성분만이 고체에 대한 항원-항체 상호작용에 의해 특이적으로 결합되거나 "면역흡수"된 상태로 유지되며, 비특이적 또는 결합성분은 세척된다.세척 후 동일한 반응 우물(예: 큐벳)을 재사용할 수 있는 다른 분광 광도계 습식 실험실 분석 형식과 달리, ELISA 플레이트는 플레이트의 일부인 고체상에 반응 생성물을 면역 흡착하므로 쉽게 재사용할 수 없습니다.
원칙
분석 생화학 어세이 및 "습윤랩" 기술로서 ELISA는 분석 중에 액체 시약을 계속 사용하는 방법(즉, 생화학 반응의 제어된 시퀀스)에 의해 액체 샘플에서 분석 물질(즉, 정량적 또는 정성적으로 분석되는 특정 물질)의 검출을 포함한다.쉽게 정량화할 수 있고 시료 내 분석물질의 양을 측정하는 것으로 해석할 수 있는 신호를 생성한다.) 액체를 유지하고 반응실 내에 남아 있거나 반응물질을 함유하는 [2][3]데 필요한 우물.이는 마른 스트립을 사용하는 "드라이 랩" 기법과는 대조적입니다.시료가 액체(예: 측정된 작은 방울)인 경우에도 "건조" 분석의 최종 검출 단계는 반사계측 등의 방법으로 건조 스트립을 판독하는 것을 포함하며, [4]시료 간의 유출이나 혼합을 방지하기 위해 반응 격납실이 필요하지 않습니다.
ELISA는 이종분석으로서 특정 성분을 물리적으로 고정화된 고체상에 흡착함으로써 분석반응 혼합물의 일부 성분을 분리한다.ELISA에서 액체 샘플은 특별한 결합 특성을 가진 고정 고체상에 첨가되며, 이어서 여러 액체 시약이 순차적으로 첨가, 배양 및 세척되고, 그 후 유정의 최종 액체에서 약간의 광학적 변화(예를 들어 효소 반응의 산물에 의한 발색)가 일어난다.분석물이 측정됩니다.정량적 "판독치"는 보통 분광 광도법에 의한 투과광의 강도 검출에 기초한다. 분광 광도법은 액체를 통한 빛의 특정 파장의 투과량(다중 우물 플레이트 [2][3]형식의 우물 바닥도 포함한다)을 포함한다.검출 감도는 분석 반응 중 신호의 증폭에 따라 달라집니다.효소 반응은 매우 잘 알려진 증폭 과정이기 때문에 정확한 정량화를 위해 검출 시약과 일정한 비율로 연결된 효소에 의해 신호가 생성되며, 따라서 "효소 연결"[5]이라는 이름이 붙습니다.
분석 물질은 검출 시약에 특이적으로 결합하거나 결합하기 때문에 리간드라고도 불리며, 따라서 ELISA는 리간드 결합 [2]분석의 더 큰 범주에 속합니다.그ligand-specific 바인딩 시약이 있"고정화,"즉, 보통과 투명한 그 아래에 말린 피복이며 또한 때때로는 보통multiple-well 접시는 "효소 면역 측정법 복수로 왜곡된 well[6]( 떨어져 세탁할 수 있는 고정형"고체상""고체 기질"여기처럼 견고한 microparticle/beads에 반대하)의 벽 좌우로.에서e. 다른 형태의 면역측정법과 마찬가지로 항원-항체형 반응의 특이성은 항원에 대한 항체를 시약으로 대량으로 배양하기 쉽기 때문에 사용된다.또는 분석물 자체가 항체일 경우에는 그 표적항원을 결합시약으로 [7]사용할 수 있다.
역사
ELISA가 개발되기 전에 면역측정 실시의 유일한 선택지는 방사성 라벨이 부착된 항원 또는 항체를 사용하는 기술인 방사성 면역측정이었다.방사선면역측정에서는 방사성 물질이 시료에 특정 항원 또는 항체가 존재하는지 여부를 나타내는 신호를 제공한다.Radioimunoassay는 로잘린 수스만 얄로와 솔로몬 버슨이 1960년에 [8]발표한 과학 논문에서 처음 기술되었다.
방사능이 잠재적인 건강상의 위협이 되기 때문에, 보다 안전한 대안이 모색되었다.방사선 면역 측정의 적절한 대안은 방사선 신호 대신 비방사성 신호를 대체할 수 있다.효소(예: 고추냉이 과산화효소)가 적절한 기질(예: ABTS 또는 TMB)과 반응하면 색상의 변화가 일어나 신호로 사용됩니다.그러나, 신호는 항체 또는 항원의 존재와 관련되어야 하며, 이것이 효소가 적절한 항체와 연결되어야 하는 이유이다.이 링크 프로세스는 Stratis Avrameas와 G. B.[9] Pierce에 의해 독립적으로 개발되었습니다.세척을 통해 결합항체 또는 항원을 제거해야 하므로 항체 또는 항원은 용기 표면에 고정되어야 하며, 즉 면역흡수제를 조제해야 한다.이를 위한 기술은 1966년 [10]와이드와 저커 포라스에 의해 발표되었습니다.
1971년 스웨덴 스톡홀름 대학의 Peter Perlmann과 Eva Engvall, 네덜란드의 Anton Schuurs와 Bauke van Weemen은 이 지식을 EIA/[11][12]ELISA를 수행하는 방법에 통합한 논문을 독립적으로 발표했다.
전통적인 ELISA는 일반적으로 항원 또는 분석 물질의 존재를 나타내기 위해 관찰 가능한 색상 변화를 일으키는 색소 생성 리포터와 기질을 포함합니다.새로운 ELISA 유사 기술은 정량 가능한 신호를 생성하기 위해 불소 생성, 전기 화학 발광 및 정량 대립형 PCR 리포터를 사용합니다.이 새로운 리포터들은 더 높은 감성과 [13][14]멀티플렉싱을 포함한 다양한 장점을 가질 수 있다.기술적인 용어로 볼 때, 이러한 유형의 새로운 분석은 엄밀하게는 ELISA가 아니며, 이는 "효소 연결"이 아니라 일부 비효소 리포터와 연결되어 있기 때문이다.그러나, 이러한 평가의 일반 원칙은 대체로 유사하기 때문에, ELISA와 같은 카테고리로 분류되는 경우가 많다.
2012년에 나노 입자를 색소 리포터로 사용한 초감응성 효소 기반 ELISA 테스트는 분석 물질의 단순한 도표 검출에서 육안 색신호를 제공할 수 있었다.파란색은 긍정적인 결과를 나타내고 빨간색은 부정적인 결과를 나타냅니다.이 검출은 실제 [15]농도가 아닌 분석물질의 유무만을 확인할 수 있다는 점에 유의하십시오.
종류들
일치하는 항체를 사용하는 특정 분자에 대한 많은 ELISA 테스트가 있습니다.ELISA 테스트는 분석물질과 항체가 어떻게 결합되고 [16][17]사용되는지에 따라 몇 가지 유형의 테스트로 나뉩니다.여기에서는 [18]주요 유형에 대해 설명합니다.
다이렉트 ELISA
ELISA의 다이렉트[19] 순서는, 다음의 메카니즘에 따릅니다.
- 마이크로타이터 플레이트의 각 웰(통상 96웰 플레이트)에 시험대상 항원의 완충용액을 첨가하여 전하 상호작용을 통해 플라스틱에 부착할 시간을 부여한다.
- 항원에 의해 코팅되지 않은 우물 내 플라스틱 표면을 덮기 위해 각 웰에 소세럼 알부민이나 카제인 등의 비반응성 단백질 용액을 첨가한다.
- (결합) 효소가 부가된 1차 항체가 첨가되어 유정을 코팅하는 시험 항원과 특이적으로 결합한다.
- 이어서 이 효소의 기질을 첨가한다.종종 이 기질은 효소와 반응하면서 색이 변한다.
- 혈청 내 1차 항체의 농도가 높을수록 색상의 변화가 강해진다.종종 분광계가 색 강도의 정량적 값을 제공하기 위해 사용됩니다.
효소는 증폭기 역할을 한다; 비록 소수의 효소 연결 항체만 결합되어 있더라도, 효소 분자는 많은 신호 분자를 생산할 것이다.상식적인 한계 내에서 효소는 무한히 색을 낼 수 있지만, 항체가 많이 결합될수록 색이 더 빨리 발달할 것이다.직접 ELISA의 주요 단점은 항원 고정화 방법이 특이하지 않다는 것이다. 혈청을 테스트 항원의 소스로 사용할 경우 샘플 내의 모든 단백질이 마이크로미터 플레이트에 잘 부착될 수 있으므로 혈청 중 소량의 분석물질은 우물 표면에 결합할 때 다른 혈청 단백질과 경쟁해야 한다.샌드위치 또는 간접 ELISA는 혈청의 분자 [citation needed]혼합물에서 추출하기 위해 테스트 항원에 특정한 "포착" 항체를 사용함으로써 이 문제에 대한 해결책을 제공합니다.
ELISA는 질적 또는 정량적 형식으로 실행될 수 있습니다.정성적 결과는 표본에 대해 단순한 양수 또는 음수 결과(예 또는 아니오)를 제공합니다.양성과 음성의 컷오프는 분석가가 결정하며 통계적일 수 있다.표준 편차(검정에 내재된 오차)의 두 세 배는 양 표본과 음의 표본을 구별하는 데 종종 사용됩니다.정량 ELISA에서 시료의 광학밀도(OD)는 표준곡선과 비교되며, 표준곡선은 일반적으로 표적분자의 알려진 농도용액의 연속희석이다.예를 들어, 시험 표본이 1.0의 OD를 반환하는 경우, OD = 1.0인 표준 곡선의 점은 표본과 [citation needed]동일한 분석 물질 농도를 가져야 한다.
「간접 ELISA」와 「직접 ELISA」의 명칭의 사용법이나 의미는, 실험의 맥락에 따라서 문헌이나 Web 사이트에서 다르다.항원의 존재를 분석할 때, '직접 ELISA'란 라벨 부착 1차 항체만을 사용하는 ELISA를 의미하며, '간접 ELISA'란 라벨 부착 2차 항체에 의해 항원이 결합되어 검출되는 ELISA를 의미한다.후자의 경우 샌드위치 ELISA는 간접 ELISA와 명확하게 구별됩니다.예를 들어 면역분석의 경우 '1차' 항체가 관심 있는 경우, 이 항체는 2차 항체에 의해 직접 검출되며, 2개의 [citation needed]항체가 있는 환경에 '간접 ELISA'라는 용어가 적용된다.
샌드위치 ELISA
"샌드위치" ELISA는 샘플 [20]항원을 검출하기 위해 사용됩니다.순서는 다음과 같습니다.
- 표면은 알려진 양의 포획 항체로 제조된다.
- 표면의 비특이 결합 부위는 차단됩니다.
- 항원 함유 시료를 플레이트에 도포하여 항체로 포착한다.
- 결합되지 않은 항원을 제거하기 위해 플레이트를 세척합니다.
- 특정 항체가 첨가되어 항원과 결합한다(따라서 "샌드위치": 항원은 두 개의 항체 사이에 고착된다).이 1차 항체는 항원에 대한 반응성을 테스트하기 위해 기증자의 혈청에 있을 수 있다.
- 효소결합 2차항체는 특이적으로 항체의 Fc영역(비특이적)에 결합하는 검출항체로 적용된다.
- 플레이트를 세척하여 결합되지 않은 항체-효소 결합체를 제거합니다.
- 효소에 의해 색신호, 형광신호 또는 전기화학신호로 변환되는 화학물질을 첨가한다.
- 플레이트 웰의 흡광도, 형광 또는 전기화학 신호(예: 전류)를 측정하여 항원의 존재와 양을 결정합니다.
오른쪽 이미지는 효소에 결합된 2차 항체의 사용을 포함하지만, 기술적 의미에서는 1차 항체가 효소(직접 ELISA)에 결합되는 경우에는 필요하지 않습니다.그러나 2차 항체 결합체를 사용하면 검출하고 싶은 모든 항원에 대해 효소 결합 항체를 만드는 값비싼 과정을 피할 수 있다.다른 항체의 Fc영역을 결합하는 효소결합항체를 사용함으로써 동일한 효소결합항체를 다양한 상황에서 사용할 수 있다."포착" 항체의 첫 번째 층이 없다면, 샘플의 모든 단백질(혈청 단백질 포함)은 플레이트 표면에 경쟁적으로 흡착되어 고정화된 항원의 양을 낮출 수 있습니다.정제된 특정 항체를 사용하여 항원을 플라스틱에 부착함으로써 측정 전에 복잡한 혼합물로부터 항원을 정제할 필요가 없어지고, 검사가 간소화되며, 검사의 특이성과 감도를 높일 수 있다.따라서 연구에 사용되는 샌드위치 ELISA는 종종 잘못된 양성 [21]결과의 위험을 줄이기 위해 검증이 필요하다.
경쟁사의 ELISA
ELISA의 세 번째 용도는 경쟁적인 바인딩을 통해서입니다.이 ELISA의 순서는 앞의 두 가지 예시와 다소 다릅니다.
라벨이 없는 항체는 항원(샘플)의 존재 하에 배양된다.
- 이러한 결합 항체/항원 복합체는 항원 코팅 웰에 첨가된다.
- 접시가 세척되어 결합 항체가 제거됩니다.(시료 내 항원이 많을수록 Ag-Ab 복합체가 더 많이 형성되므로 우물 내 항원과 결합할 수 있는 결합 항체가 적기 때문에 "경쟁")
- 1차 항체에 특이적인 2차 항체가 첨가된다.이 두 번째 항체는 효소와 결합된다.
- 기판을 첨가하고 나머지 효소가 발색신호 또는 형광신호를 도출한다.
- 신호의 궁극적인 포화를 방지하기 위해 반응이 중지됩니다.
일부 경쟁력 있는 ELISA 키트에는 효소 연결 항체가 아닌 효소 연결 항원이 포함되어 있습니다.라벨링된 항원은 샘플 항원(라벨링되지 않음)과 1차 항체 결합 부위에서 경쟁합니다.검체의 항원이 적을수록 라벨이 부착된 항원이 웰에 더 많이 유지되고 신호가 더 강합니다.
일반적으로 항원은 우물 안에 처음 배치되지 않는다.
HIV 항체를 검출하기 위해 마이크로미터 플레이트의 웰에 HIV 항원을 코팅합니다.두 개의 특정 항체가 사용됩니다. 하나는 효소와 결합되고 다른 하나는 혈청에 존재합니다(혈청이 항체에 양성인 경우).동일한 항원에 대해 두 항체 간에 누적경쟁이 일어나 더 강한 신호가 나타난다.테스트할 혈청을 이러한 웰에 첨가하고 37°C에서 배양한 후 세척합니다.항체가 존재하면 항원-항체 반응이 일어난다.효소표지 특정 HIV 항체에 대한 항원은 남아 있지 않다.이러한 항체는 첨가 시 자유 상태를 유지하며 세척 중에 씻겨 내려갑니다.기질을 첨가하지만 이에 작용하는 효소가 없기 때문에 양성반응은 변색되지 않는다.
리버스 ELISA
네 번째 ELISA 테스트에서는 기존의 유정을 사용하지 않습니다.이 테스트에서는 항원이 [22][23]테스트액에 현탁되어 있습니다.
- 라벨이 부착되지 않은 항체는 항원(샘플)의 존재 하에 배양된다.
- 항체가 항원에 결합할 수 있도록 충분한 잠복기를 제공한다.
- 그런 다음 샘플은 Scavenger 컨테이너를 통과합니다.테스트 튜브 또는 특별히 설계된 채널 흐름일 수 있습니다.Scavenger 컨테이너 또는 채널의 표면에는 "Scavenger Antigens"가 결합되어 있습니다.이것들은 유리 항체가 결합할 1차 항원과 동일하거나 충분히 유사할 수 있다.
- Scavenger 용기는 Scavenger Antigens가 샘플에 도입된 모든 과잉 항체에 결합할 수 있는 충분한 표면적과 충분한 시간을 가져야 합니다.
- 이제 태그 부착 및 결합 항체가 포함된 샘플이 검출기를 통과합니다.이 장치는 태그를 비추고 [24]응답을 기록하는 유량 세포계 또는 기타 장치일 수 있습니다.
이 테스트를 통해 여러 항원을 태그 붙이고 동시에 셀 수 있습니다.이를 통해 특정 균주를 두 개 이상의 다른 색상 태그로 식별할 수 있습니다.양쪽 태그가 셀에 존재할 경우 셀은 특정 변종입니다.1개만 존재하면 존재하지 않습니다.
이 테스트는 일반적으로 한 번에 한 가지 테스트를 수행하며 마이크로미터 플레이트에서는 수행할 수 없습니다.일반적으로 필요한 장비는 덜 복잡하며 현장에서 사용할 수 있습니다.
일반적으로 사용되는 효소 마커
다음 표에는 ELISA 검사에 일반적으로 사용되는 효소 마커가 나열되어 있습니다. ELISA 검사를 완료하면 검사 결과를 측정할 수 있습니다.
- OPD(o-페닐렌디아민디염산염)는 공역 단백질로 [25]자주 사용되는 HRP(Horseradish Peroxidase)를 검출하기 위해 호박색으로 변한다.
- TMB(3,3',5,5'-테트라메틸벤지딘)는 HRP 검출 시 파란색으로 변하고 황산 [25]또는 인산 첨가 후 노란색으로 변한다.
- ABTS(2,2'-아지노비스[3-에틸벤조티아졸린-6-술폰산]-디아모늄염]는 HRP [25]검출 시 녹색으로 변한다.
- PNPP(p-Nitrophenyl Phosphate, 이나트륨 Salt)는 알칼리성 인산가수분해효소 [25]검출 시 노란색으로 변한다.
적용들
ELISA는 시료 내 항원의 존재 또는 항체의 존재를 평가하기 위해 수행될 수 있기 때문에 혈청 항체 농도(HIV[26] 테스트 또는 웨스트 나일 바이러스 등)를 결정하는 데 유용한 도구입니다.또한 식품업계에서 우유, 땅콩, 호두, 아몬드[27], 계란과 같은 잠재적 식품 알레르겐을 검출하고, 강장성 [28][29]질환에 대한 혈청학적 혈액 검사로 응용되는 것을 발견했다.ELISA는 또한 특정 종류의 약물에 대한 신속한 추정 스크린으로 독성학에서 사용될 수 있다.
ELISA는 높은 민감도 때문에 HIV에 널리 사용되는 첫 번째 선별 검사였다.ELISA는 사람의 혈청을 400회 희석하여 HIV 항원이 부착된 접시에 도포한다.HIV에 대한 항체가 혈청에 존재한다면, 그것들은 이 HIV 항원들과 결합할 수 있다.그런 다음 플레이트를 세척하여 혈청의 다른 모든 성분을 제거합니다.특수하게 준비된 "2차 항체" 즉, 다른 항체에 결합하는 항체가 플레이트에 도포된 후 다시 세척됩니다.이 2차 항체는 화학적으로 효소와 미리 연결되어 있다.
따라서 플레이트는 플레이트에 결합된 2차 항체의 양에 비례하여 효소를 포함할 것이다.효소용 기질을 도포하고, 해당 효소에 의한 촉매작용에 의해 색변화 또는 형광변화를 가져온다.ELISA 결과는 수치로 보고된다. 이 테스트의 가장 논란이 되는 측면은 양성 결과와 음성 결과 사이의 "차단" 지점을 결정하는 것이다.
컷오프점은 기존의 표준과 비교하여 결정할 수 있다.직장에서의 약물 스크리닝에 ELISA 시험을 사용하는 경우, 예를 들어 50 ng/ml의 컷오프 농도를 설정하고, 분석물의 표준 농도를 포함한 시료를 조제한다.알려진 표본보다 더 강한 신호를 생성하는 미지의 것은 "양성"입니다.약한 신호를 생성하는 것은 "음성"입니다.
뎅기열, 말라리아, 샤가스병,[30] 조네병 [31]등 다양한 질병을 발견하기 위한 ELISA 검사가 있습니다.ELISA 테스트는 또한 의료 실험실의 체외 진단에 광범위하게 사용된다.ELISA의 다른 용도는 다음과 같습니다.
- 혈액[32] 샘플 중 SARS-CoV-2 항체 검출
「 」를 참조해 주세요.
주 및 참고 자료
- ^ Engvall, E (1972-11-22). "Enzyme-linked immunosorbent assay, Elisa". The Journal of Immunology. 109 (1): 129–135. ISSN 0022-1767. PMID 4113792.
- ^ a b c Msagati, T.A. (2017). Food Forensics and Toxicology. John Wiley & Sons. p. PT229. ISBN 9781119101383.
- ^ a b Crowther, J.R. (1995). "Chapter 2: Basic Principles of ELISA". ELISA: Theory and Practice. Methods in Molecular Biology. Vol. 42. Humana Press. pp. 35–62. doi:10.1385/0-89603-279-5:1. ISBN 0896032795. PMID 7655571.
- ^ Sonntag, O. (1993). "Chapter 1: Introduction to dry chemistry". In van der Vliet, P.C. (ed.). Dry Chemistry: Analysis with carrier-bound reagents. Laboratory Techniques in Biochemistry and Molecular Biology. Vol. 25. pp. 1–6. ISBN 9780080887364.
- ^ Hsieh, Y.-H.P.; Rao, Q. (2017). Nielsen, S.S. (ed.). Food Analysis. Springer. pp. 491–98. ISBN 9783319457765.
- ^ Schasfoort, R.B.M. (2017). Handbook of Surface Plasmon Resonance (2nd ed.). Royal Society of Chemistry. p. 296. ISBN 9781782627302.
- ^ Elgert, K.D. (2009). Immunology: Understanding the Immune System. John Wiley & Sons. pp. 149–50. ISBN 9780470081570.
- ^ Yalow, Rosalyn S.; Berson, Solomon A. (1960). "Immunoassay of endogenous plasma insulin in man". The Journal of Clinical Investigation. 39 (7): 1157–75. doi:10.1172/JCI104130. PMC 441860. PMID 13846364.
- ^ Lequin, R. M. (2005). "Enzyme Immunoassay (EIA)/Enzyme-Linked Immunosorbent Assay (ELISA)". Clinical Chemistry. 51 (12): 2415–8. doi:10.1373/clinchem.2005.051532. PMID 16179424.
- ^ Wide, Leif; Porath, Jerker (1966). "Radioimmunoassay of proteins with the use of Sephadex-coupled antibodies". Biochimica et Biophysica Acta (BBA) - General Subjects. 130 (1): 257–60. doi:10.1016/0304-4165(66)90032-8.
- ^ Engvall, Eva; Perlmann, Peter (1971). "Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G". Immunochemistry. 8 (9): 871–4. doi:10.1016/0019-2791(71)90454-X. PMID 5135623.
- ^ Van Weemen, B.K.; Schuurs, A.H.W.M. (1971). "Immunoassay using antigen—enzyme conjugates". FEBS Letters. 15 (3): 232–236. doi:10.1016/0014-5793(71)80319-8. PMID 11945853. S2CID 37147723.
- ^ Leng, S. X.; McElhaney, J. E.; Walston, J. D.; Xie, D.; Fedarko, N. S.; Kuchel, G. A. (2008). "ELISA and Multiplex Technologies for Cytokine Measurement in Inflammation and Aging Research". The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 63 (8): 879–84. doi:10.1093/gerona/63.8.879. PMC 2562869. PMID 18772478.
- ^ Adler, Michael; Schulz, Sven; Spengler, Mark (2009). "Cytokine Quantification in Drug Development: A comparison of sensitive immunoassay platforms". Chimera Biotech.
- ^ de la Rica, Roberto; Stevens, Molly M. (2012). "Plasmonic ELISA for the ultrasensitive detection of disease biomarkers with the naked eye". Nature Nanotechnology. 7 (12): 821–4. Bibcode:2012NatNa...7..821D. doi:10.1038/nnano.2012.186. hdl:10044/1/21938. PMID 23103935.
- ^ R., Crowther, J. (1995). ELISA : theory and practice. Methods in Molecular Biology. Vol. 42. Totowa, N.J.: Humana Press. pp. 1–218. doi:10.1385/0-89603-279-5:1. ISBN 978-0896032798. OCLC 32130600. PMID 7655571.
- ^ ROBERT., HNASKO (2016). ELISA (SOFTCOVER reprint OF ed.). [Place of publication not identified]: HUMANA. ISBN 978-1493953851. OCLC 960834982.
- ^ "What is an ELISA?". R&D Systems. Retrieved 31 January 2020.
- ^ Spence, Zachary (2018-10-18). "Biochemistry 8th ed - Jeremy M. Berg": 83.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Schmidt, SD; Mazzella, MJ; Nixon, RA; Mathews, PM (2012). Aβ measurement by enzyme-linked immunosorbent assay. Methods in Molecular Biology. Vol. 849. pp. 507–27. doi:10.1007/978-1-61779-551-0_34. ISBN 978-1-61779-550-3. PMID 22528112.
- ^ Kragstrup, Tue W; Vorup-Jensen, Thomas; Deleuran, Bent; Hvid, Malene (2013). "A simple set of validation steps identifies and removes false results in a sandwich enzyme-linked immunosorbent assay caused by anti-animal IgG antibodies in plasma from arthritis patients". SpringerPlus. 2 (1): 263. doi:10.1186/2193-1801-2-263. PMC 3695686. PMID 23875127.
- ^ US 7767404, Charbonnet, Derrick, "단일 및 다중 분석물질에 대한 단일 단계 면역흡수제 분석용 부속품 및 방법" 2010년 8월 3일 발행
- ^ US 8735142, Charbonnet, Derrick & Evans, Norman Scott, "단일 및 다중 분석물질에 대한 면역흡수제 측정 시스템 및 방법" 2014년 5월 27일 발행
- ^ Mahmoudi Gomari, Mohammad; Saraygord-Afshari, Neda; Farsimadan, Marziye; Rostami, Neda; Aghamiri, Shahin; Farajollahi, Mohammad M. (December 2020). "Opportunities and challenges of the tag-assisted protein purification techniques: Applications in the pharmaceutical industry". Biotechnology Advances. 45: 107653. doi:10.1016/j.biotechadv.2020.107653. ISSN 0734-9750. PMID 33157154. S2CID 226276355.
- ^ a b c d "Enzyme Substrates for ELISA". Thermo Fisher Scientific - US. Retrieved 2018-06-06.
- ^ Medline Plus Encyclopedia: ELISA/Western Blot HIV 테스트
- ^ "Food Allergen Partnership" (Press release). FDA. January 2001. Retrieved August 20, 2015.
- ^ Sblattero, D.; Berti, I.; Trevisiol, C.; Marzari, R.; Tommasini, A.; Bradbury, A.; Fasano, A.; Ventura, A.; Not, T. (2000). "Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease". The American Journal of Gastroenterology. 95 (5): 1253–7. doi:10.1111/j.1572-0241.2000.02018.x. PMID 10811336. S2CID 11018740.
- ^ Porcelli, Brunetta; Ferretti, Fabio; Vindigni, Carla; Terzuoli, Lucia (2014). "Assessment of a Test for the Screening and Diagnosis of Celiac Disease". Journal of Clinical Laboratory Analysis. 30 (1): 65–70. doi:10.1002/jcla.21816. PMC 6807240. PMID 25385391.
- ^ Del-Rei, Rodrigo Pimenta; Leony, Leonardo Maia; Celedon, Paola Alejandra Fiorani; Zanchin, Nilson Ivo Tonin; Reis, Mitermayer Galvão dos; Gomes, Yara de Miranda; Schijman, Alejandro Gabriel; Longhi, Silvia Andrea; Santos, Fred Luciano Neves (2019-04-18). "Detection of anti-Trypanosoma cruzi antibodies by chimeric antigens in chronic Chagas disease-individuals from endemic South American countries". PLOS ONE. 14 (4): e0215623. Bibcode:2019PLoSO..1415623D. doi:10.1371/journal.pone.0215623. ISSN 1932-6203. PMC 6472793. PMID 30998741.
- ^ Griffin, J. F. T.; Spittle, E.; Rodgers, C. R.; Liggett, S.; Cooper, M.; Bakker, D.; Bannantine, J. P. (2005). "Immunoglobulin G1 Enzyme-Linked Immunosorbent Assay for Diagnosis of Johne's Disease in Red Deer (Cervus elaphus)". Clinical and Vaccine Immunology. 12 (12): 1401–9. doi:10.1128/CDLI.12.12.1401-1409.2005. PMC 1317074. PMID 16339063.
- ^ Dhamad, AE; Abdal Rhida, MA (2020). "COVID-19: molecular and serological detection methods". PeerJ. 8: e10180. doi:10.7717/peerj.10180. PMC 7547594. PMID 33083156.
외부 링크
- 미국 국립 의학 도서관 의학 과목 표제(MeSH)의 ELISA
- "ELISA 활동 소개"—애리조나 대학의 애니메이션을 포함한 HIV 검출에 사용되는 ELISA의 시작 단계