화학 용어집
Glossary of chemistry terms| 다음에 대한 시리즈 일부 |
| 화학 |
|---|
 |
이 화학 용어의 용어집은 화학 법칙, 도표 및 공식, 실험실 도구, 유리 제품 및 장비를 포함하여 화학에 관련된 용어와 정의의 목록이다. 화학은 물질의 구성, 구조, 성질, 그리고 화학 반응 동안 일어나는 변화들과 관련된 물리 과학이다. 화학은 광범위한 어휘와 상당한 양의 전문용어를 특징으로 한다.
참고: 모든 주기율표 참조는 주기율표의 IUPAC 스타일을 참조한다.
A
- absolute zero
- 열역학 온도 눈금의 최저 한계인 시스템 또는 시스템이 에너지를 방출하거나 흡수하지 않는 0 켈빈에 관련된 이론적 조건(즉, 모든 원자가 정지 상태임) 이상적인 가스 법칙을 추론함으로써 절대 영도에 대한 국제적으로 합의된 값을 -273.15°C(-459.67°F; 0.00K)로 결정했다.
- absorbance
- absorption
- 1. 한 상태의 물질이 다른 상태의 다른 물질에 통합되어 유지되는 물리적 또는 화학적 과정 흡수는 첫 번째 물질이 표면에만 달라붙는 것이 아니라 두 번째 물질의 대량 전체에 침투한다는 점에서 흡착과 다르다.
- 2. 물질(일반적으로 원자로 묶인 전자)이 전자기 방사선의 에너지를 흡수하여 열 에너지와 같은 다양한 형태의 내부 에너지로 변환하는 과정 이 흡수 유형은 분광측정법의 기초가 되는 원리다.
- abundance
- accuracy
- 측정값이 실제 값 또는 참 값에 얼마나 가까운지. 정밀도를 비교하라.
- acid
- 물에 용해되었을 때 pH가 7.0 미만이거나 수소 이온을 공급하는 화합물.
- acid anhydride
- 산에서 물 분자를 제거하여 얻은 모든 화학 화합물. 무수화물 대비 기반.
- acid dissociation constant (Ka)
- 산-기저 반응의 맥락에서 화학적 분해 반응에 대한 평형 상수로 표현되는 용액 내 산의 강도에 대한 정량적 측정. 그것은 종종 그것의 베이스-10 cologarithm, pK로a 주어진다.
- acid–base extraction
- 물에 용해되었을 때 pH가 7.0 미만이거나 수소 이온을 공급하는 화합물.
- actinides
- 액티늄에서 로렌슘까지 원자 번호 89부터 103까지의 금속 원소의 주기적인 계열이다.
- activated complex
- 새로운 결합이 형성되는 동안 분자 간의 충돌로 인해 형성되는 구조.
- activation energy
- 화학 반응을 일으키기 위해 잠재적 반응 물질이 있는 화학 시스템에서 사용할 수 있어야 하는 최소 에너지.
- activity series
- 반응도 시리즈를 참조하십시오.
- actual yield
- acyclic
- 원자의 선형 구조만 포함(특히 탄화수소의 경우).
- addition reaction
- 유기화학에서는 둘 이상의 분자가 결합하여 더 큰 분자를 만들 때
- adhesion
- 분자간 힘의 결과로 서로 다른 입자나 표면이 서로 달라붙는 경향. 대비 응집력.
- adsorption
- 원자, 이온 또는 한 물질(기체, 액체 또는 용해된 고체)의 분자가 다른 물질의 표면에 화학적 접착을 하여 첫 번째 물질의 필름이 두 물질 사이의 인터페이스에 약하게 결합되는 결과를 초래한다. 흡착은 독점적으로 표면 현상이라는 점에서 흡착과는 다른 반면 흡착은 전체 부피의 물질을 포함한다.
- aeration
- 액체나 고체로 공기의 혼합.
- alcohol
- 포화 탄소 원자에 부착된 히드록실 기능 그룹으로 구성된 모든 유기 화합물.
- aldehyde
- 수소 원자 및 기타 R 그룹에 부착된 카보닐 그룹으로 구성된 모든 유기 화합물.
- alkali metal
- 주기율표의 그룹 1에 속하는 금속 원소로는 리튬(Li), 나트륨(Na), 칼륨(K), 루비듐(Rb), 세슘(Cs), 프랑슘(Fr)이 있다.
- alkaline earth metal
- 주기율표 2그룹에 속하는 금속성 원소로는 베릴륨(Be), 마그네슘(Mg), 칼슘(Ca), 스트론튬(Sr), 바륨(Ba), 라듐(Ra)이 있다.
- alkane
- 모든 포화 아사이클릭 탄화수소.
- alkene
- 최소 한 쌍의 이중 결합 탄소를 포함하는 불포화 탄화수소.
- alkyl group
- 수소 원자가 빠진 알카인으로 구성된 기능 그룹.
- alkyne
- 적어도 한 쌍의 삼중 결합 탄소를 포함하는 불포화 탄화수소.
- allomer
- 화학 성분은 다르지만 다른 물질과 같은 결정 구조를 가진 물질.
- allotrope
- 탄소(다이아몬드, 흑연, 풀레렌)와 같이 서로 다른 구조(따라서 다른 형태)를 가질 수 있는 원소.
- alloy
- 금속 또는 금속과 다른 원소의 혼합물로서 조합하여 금속 접합 특성을 나타낸다. 일반적인 예로는 청동, 놋쇠, 송곳니가 있다.
- amalgam
- 다른 금속과 수은 합금.
- ammoniacal
- 용제가 수용성 암모니아인 용액을 설명함.[1]
- amount of substance
- 주어진 물질의 샘플에서 아보가드로 상수로 나눈 이산형 입자(분자, 원자, 이온, 전자 또는 기타 원자 규모의 실체)의 수입니다. 물질의 양에 대한 SI 기준 단위는 몰(몰)이다.
- amphoteric
- (화학 종의) 종들이 위치한 매질에 따라 산과 염기 둘 다 행동하도록 하는 것; 예를 들어 황산은24 물에 강한 산이지만 초산종의 염기처럼 행동한다.
- amphipathic
- (분자) 소수성 그룹과 소수성 그룹으로 구성된다. 예: 습식제 및 멤브레인 지질.[2]
- amyl
- pentyl 그룹의 일반적인 비체계적 이름.
- analyte
- 화학적 분석에 관심이 있는 특정 물질 또는 화학 성분.
- analytical chemistry
- 화학 물질을 분리, 정량화 및 식별하기 위한 기기와 방법을 연구하고 사용하는 화학의 분과는 강수, 추출, 증류, 관측 분석과 같은 고전적인 습식 화학 기법과 크로마토그래피, 분광학, 전기 화학자와 같은 현대 기법에 의해 이루어진다.ry.
- anhydrous
- 물 분자를 가지거나 포함하지 않으며, 특히 수화 물을 가리킨다.[2] 화학의 많은 과정들이 물이 있는 곳에서 방해되기 때문에, 무수 시약과 기술을 사용하는 것이 종종 매우 중요하다. 무수 화합물은 대기 중의 물을 점진적으로 흡수하는 경향이 있다. 대조 수성.
- anion
- 음전하 이온, 즉 양자에 비해 전자의 과잉으로 인한 순 음전하를 가진 원자나 분자.
- anode
- 1. 기존의 전류(양전하의 흐름)가 극성 전기 회로에 들어가는 전극.
- 2. 양전하가 과다한 전기화학세포의 전선이나 판. 음전하 음이온은 항상 양극을 향해 움직인다. 콘트라스트 음극.
- aqua regia
- 질산(HNO3)과 염산(HCl)의 액체 혼합물로서, 어금니 비율이 1:3으로 최적으로, 고귀한 금속을 금과 백금을 용해할 수 있기 때문에 역사적 연금술사들에 의해 그렇게 명명되었다.
- aquation
- 물 분자가 이온과 함께 용해되거나 조정 콤플렉스를 형성하는 과정.[1]
- aqueous solution
- 용제가 물인 용액. 화학 공식에 (aq)를 첨가하여 화학 공식으로 나타낸다.
- aromaticity
- 벤젠과 같은 원자의 결합 고리의 화학적 특성으로서, 비정상적으로 높은 안정성을 초래한다. 그런 고리는 향기롭다고 한다.
- arrow pushing
- aryl
- 페닐 또는 나프틸과 같은 방향족 링에서 파생된 모든 기능 그룹 또는 대체물. 기호 AR은 구조 다이어그램에서 일반 아릴 그룹의 자리 표시자로 자주 사용된다.
- atmolysis
- 다른 확산 속도를 이용하여 기체의 혼합물을 분리하는 것으로, 보통 기체가 다공성 칸막이나 막의 벽을 통해 확산되도록 허용한다.[1]
- atom
- 가장 작은 형태의 화학 원소로, 핵 내에서 양성자와 중성자로 구성되고 핵 주위를 도는 전자로 구성된다.
- atomic mass
- 일반적으로 통일된 원자 질량 단위로 표현되며 질량 수와 거의 동등한 원자 질량.
- atomic mass unit
- 통일 원자 질량 단위를 참조하십시오.
- atomic number (Z)
- 주어진 화학 원소의 원자핵에서 발견된 양자의 수. 핵의 전하 번호와 동일하며 주기율표에 각 화학 원소를 고유하게 식별하기 위해 사용된다.
- atomic orbital
- (분자 내에서의 전자와는 대조적으로) 하나 이상의 전자가 개별 원자에서 발견될 수 있는 모든 영역.
- atomic radius
- atomic weight
- 상대 원자 질량을 참조하십시오.
- atomicity
- 주어진 물질의 단일 분자에 존재하는 원자의 총 수. 예를 들어 오존(O3)은 원자성이 3인 반면 벤젠(CH66)은 원자성이 12인 것이다.[1]
- autoignition temperature
- Avogadro's law
- Avogadro's number
- 물질의 한 몰에서 분자, 원자23 또는 이온과 같은 이산 구성 입자의 수, 정확히 6.02214076×10으로 정의된다.
- azeotrope
- 증류에 의해 화학 성분이 변하지 않는 액체 혼합물.
B
- barometer
- 대기압 측정에 사용되는 장치.
- base
- 양성자를 수용하고 pH가 7.0 이상인 물질. 일반적인 예로는 수산화나트륨(NaOH)이 있다.
- base anhydride
- 그룹 I 및 II 금속 원소의 산화물.
- beaker
- 바닥이 평평한 원통형 용기 또는 용기, 가장 일반적으로 유리 용기의 한 종류로서 화학 물질, 샘플 또는 용액을 준비, 보유, 함유, 수집 또는 체적 측정과 같은 다양한 목적으로 실험실에서 널리 사용되거나 화학 반응이 발생하는 챔버로 사용된다. 비커는 경사면이 아닌 곧은 면을 가짐으로써 플라스크와 구별된다; 대부분의 비커들은 또한 붓기를 돕기 위해 테두리에 작은 주둥이를 가지고 있다.
- Beer–Lambert law
- biochemistry
- 생물학적 시스템과 유기체의 화학에 대한 연구.
- Bohr model
- boiling
- 기화를 보라.
- boiling point
- 물질이 액체에서 기체(또는 증기)로 변하는 온도. 압력에 따라 다르며 일반적으로 표준 조건에서 주어진 물질에 대해 지정된다.
- boiling-point elevation
- 물질의 비등점이 다른 물질을 첨가하여 상승하는 과정.
- bond
- 화학 화합물의 형성을 가능하게 하는 원자, 이온 또는 분자 사이의 지속적인 끌어당김. 결합은 다양한 전기 화학적 힘의 결과로 만들어지는데, 그 강점은 상당히 다를 수 있다; 그것들은 다른 힘에 의해 극복될 때 깨진다. 화학 물질을 결합하는 결합의 종류, 강도, 수량은 물질의 구조와 부피 성질을 좌우한다.
- Boyle's law
- 일정한 온도에서 주어진 가스 질량의 경우 부피는 압력에 반비례하여 변한다.
- Bragg's law
- Brønsted–Lowry acid
- 양성자를 쉽게 기증하는 모든 화학종.
- Brønsted–Lowry acid–base reaction
- Brønsted–Lowry base
- 양성자를 쉽게 받아들이는 모든 화학종.
- Brownian motion
- Büchner flask
- buffered solution
- 약한 산과 그 결합 베이스 또는 약한 베이스로 구성된 수용액과 강한 산이나 베이스가 추가될 때 pH에서 변화를 억제하는 결합산으로 구성된다.
- bumping
- 끓는점까지 상승된 균일한 액체가 과열되어 핵에 의해 기체 국면으로 빠르게 끓어 용기에서 액체가 격렬하게 배출되는 현상. 극단적인 경우 용기 자체가 산산조각 날 수 있다. 잦은 젓기, 적절한 용기 사용, 끓는 칩을 사용하면 부딪히는 것을 예방할 수 있다.
- bung
- burette
- 정밀도가 필요할 때 특정 양의 액체를 분사하는 데 사용되는 유리 제품(예: 적정량 및 자원 의존 반응).
C
- calorific value
- 주어진 물질의 완전 연소에 의해 생성되는 단위 질량 당 열의 측정값으로, 일반적으로 킬로그램 당 메가줄(MJ/kg) 또는 그램 당 킬로줄(kJ/g) 단위로 표현된다.[1]
- calorimeter
- 열 특성(즉, 열)을 측정하는 데 사용되는 다양한 장치 중 하나로서 열량 값이나 화학 반응의 가열 등이 있다.[1]
- calx
- 광석을 공기에 가열하여 형성된 금속 산화물.[1]
- carbanion
- carbocation
- carbonyl
- carboxylic acid
- catalyst
- 화학 반응 속도의 증가를 촉진하지만 반응 중에 소비되거나 파괴되지 않는 모든 원소 또는 화합물. 그것은 반응물질과 반응의 산물로 간주된다.
- cathode
- 기존의 전류(양전하의 흐름)가 극성 전기회로를 빠져나가는 전극. 음극의 극성은 전기 장치의 종류와 작동 방식에 따라 양 또는 음이 될 수 있지만 양극으로 충전된 양이온은 항상 음극 쪽으로 이동한다. 대비 양극.
- cation
- 양전하 이온.
- cell potential
- 환원제를 통해 전자를 산화제로 끌어당기는 갈바닉 셀의 힘.
- centrifugation
- 입자의 크기, 형태 및 밀도에 따라 용액에서 입자를 분리하기 위해 원심력을 가하는 실험실 기법. 더 크고/또는 더 밀도가 높은 물질은 원심분리기의 축에서 멀리 이동하는 반면, 더 작고/또는 더 조밀한 물질은 축을 향해 이동한다.
- centrifuge
- 원심분리 또는 극히 높은 속도에서 중심축을 중심으로 물질을 포함하는 용기의 회전으로 크기, 형태, 밀도에 따라 물질을 분리하는 데 사용되는 장치.
- chain reaction
- charge number
- 쿨롬의 전하를 초 충전 상수, 또는 z = q/e로 나눈 정량화된 전하의 값. 이온의 충전 번호는 위첨자로 표시된다(예: Na는+ 충전 번호가 양수인 나트륨 이온을 나타낸다). 원자 번호는 원자핵의 전하수다.
- Charles's law
- 건조한 기체의 표본에 대한 압력이 일정하게 유지되면 켈빈 온도는 그 부피에 정비례한다.
- chelating agent
- chelation
- 폴리덴산 리간드와 단일 중앙 금속 이온 사이에 두 개의 개별 좌표 공밸런트 결합을 형성하는 것과 관련된 결합의 일종이다. 리간드는 보통 킬런트 또는 킬레이트 화합물이라고 불리는 유기 화합물이다.
- chemical composition
- 화학적 화합물을 구성하는 원소의 정체성과 상대적인 수로서, 종종 화학적 공식으로 표현할 수 있다.
- chemical decomposition
- 단일 입자 또는 실체(분자 또는 반응성 중간체 등)를 둘 이상의 조각으로 분해하거나, 둘 이상의 제품이 단일 반응제로부터 형성되는 화학 반응. 대조 화학 합성.
- chemical formula
- 문자, 숫자 및/또는 인쇄 기호를 사용하여 화합물 또는 분자의 화학적 구성에 대한 정보를 간결하게 표시하는 다양한 수단. 경험적 공식과 분자 공식과 같은 화학 공식은 단지 화합물 내 원자의 정체성과 수치적 비율만을 나타낼 수 있으며 따라서 화학적 이름이나 구조 공식보다 기술력에 더 제한적이다.
- chemical law
- 질량 보존의 법칙과 같이 화학에 관련된 자연의 법칙.
- chemical nomenclature
- chemical process
- 1. 자연적 또는 인위적으로 또는 자연적으로 또는 외부 힘의 작용에 의해 하나 이상의 화학 물질 또는 화학 화합물을 어떤 방식으로든 변화시키는 방법 또는 수단.
- 2. 화학공학에서는 하나 이상의 화학 물질이나 재료의 구성을 바꾸기 위해 산업적 규모(특히 제조업에서)에 사용되는 모든 방법을 사용한다.
- chemical reaction
- 하나 이상의 물질을 하나 이상의 다른 물질로 바꾸는 것.
- chemical species
- 화학 물질 또는 화학적으로 동일한 분자 실체로 구성된 물질의 앙상블이며, 특성 또는 묘사된 시간 척도로 동일한 분자 에너지 수준을 탐구할 수 있다.
- chemical substance
- 화학적 구성과 특성이 일정하고 순수하게 물리적 방법에 의해(즉, 화학적 결합을 깨뜨리지 않고) 단순한 성분으로 분리될 수 없는 물질의 형태. 이것을 혼합물과 구별하기 위해 종종 순수한 물질이라고 불린다.
- chemical synthesis
- 하나 이상의 제품을 얻기 위한 하나 이상의 화학 반응의 인위적인 실행. 현대 실험실 맥락에서 특정 화학 합성은 신뢰할 수 있고 재현할 수 있다.
- chemistry
- 다양한 화학 원소의 원자로 구성된 화학 물질, 화합물, 분자를 비롯해 그 구성, 구조, 성질, 행동, 그리고 그들이 다른 물질과 반응하는 동안 겪는 변화 등을 연구하는 과학적인 학문이다.
- chirality
- 분자나 이온이 거울 이미지와 구별되어 기하학적 회전, 번역 또는 일부 순응적 변화의 조합에 의해 겹쳐질 수 없는 비대칭성의 속성.[3][4] 그러한 분자나 이온은 치랄이라고 하며, 서로 스테레오아오머라고 알려진 두 가지 형태로 존재한다. 이러한 형태는 종종 그들의 절대적 구성이나 다른 기준에 의해 "오른손" 또는 "왼손"으로 구별된다. 몇 가지 다른 유형의 비대칭은 치열을 발생시킬 수 있는데, 가장 일반적으로 분자가 하나 이상의 스테레오센서(중앙 치성), 입체 축(축 치성), 입체 평면(평형 치성)과 같은 입체적인 요소를 가지고 있을 때, 분자의 고유 곡률로 인해 치랄이 내재할 수 있다.이티
- chromatography
- cis–trans isomerism
- closed system
- cluster
- cohesion
- 분자간 힘의 결과로 유사한 입자나 표면이 서로 달라붙는 경향. 대비 접착.
- colligative property
- 용액의 용매 입자 수에 대한 용매 입자 수에 대한 비율에 따라 달라지는 용액의 모든 특성이며, 존재하는 화학 종의 특성에 따라 달라지지 않는다. 삼투압, 동결점 우울증, 비등점 상승 등이 대표적이다.
- colloid
- 많은 밀크와 같이 고르게 분산된 물질의 혼합물.
- combustion
- 산화제와 많은 양의 열을 발생시키고 종종 빛을 내는 연료 사이의 발열 반응.
- Commission on Isotopic Abundances and Atomic Weights (CIAAW)
- compound
- 두 개 이상의 화학적으로 결합된 원소로 구성된 물질.
- compression
- 종파에서 입자가 더 가깝고 밀리는 영역이다.
- concentration
- 혼합물의 단위 수량당 혼합물 구성 요소의 수량 또는 풍부함. 예를 들어 용액의 단위 부피당 용해 용해 용해 용액의 양, 어금성이라고 알려진 척도. 화학에는 질량농도, 부피농도, 어금니농도 등 몇 가지 다른 농도의 정의가 널리 사용되고 있다.
- condensation
- 기체에서 액체로 물질의 위상 전환.
- condosity
- 시험 대상 용액과 동일한 특정 전기 전도성을 갖는 염화나트륨(NaCl) 용액의 어금농도로 정의되는 용액의 전기전도도를 비교 측정한다. 일반적으로 리터당(또는 다른 부피 단위당) 몰 단위로 표현된다.
- conductor
- 하나 이상의 방향으로 전류를 흐르게 하는 물체 또는 물질. 대비 절연체.
- conformation
- 형식적으로 단일 결합에 대한 회전으로 상호 변환될 수 있는 스테레오이오머 사이의 구별을 제공하는 원자의 공간적 배열.
- conjugate acid
- conjugate base
- conjugated system
- 단일 결합으로 분리된 이중 또는 삼중 결합을 포함하는 분자(예: 화학적 구조 HC2=CH-CH=CH2=CH)와 함께 화합물 부타-1,3-다이엔이 이중 결합을 결합하였다. 그러한 분자에서, 단일 결합에 의해 연결된 탄소 원자 사이의 파이 궤도에는 전자의 약간의 소산성이 있다.[1]
- constitutional isomer
- 구조적 이성질체를 참조하십시오.
- cooling curve
- coordinate chemistry
- coordinate covalent bond
- coordination complex
- corrosion
- 물질, 특히 금속과 그 환경의 불가역적인 계면 화학 반응으로 인해 물질이 소비되거나 환경의 외부 구성 요소 물질로 분해된다.
- coulomb
- 전하의 SI 단위(심볼:C)는 1초 안에 1암페어의 정전류에 의해 운반되는 전하로 정의된다.
- covalent bond
- 원자 사이의 전자쌍의 공유를 수반하는 결합. 원자가 전자를 공유할 때 원자 사이에 발생하는 매력적이고 반발적인 힘의 안정적인 균형을 공밸런스 결합이라고 한다.
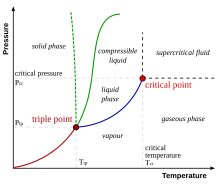
- critical point
- 위상 평형 곡선 또는 압력 온도 곡선의 끝점이며, 위상 경계는 사라지고 액체와 증기 등 물질의 상이 서로 다른 조건이 공존할 수 있다. 임계점은 임계 온도 T와c 임계 압력 p의c 교차점에 의해 정의된다. 이 온도 및 압력 이상에서는 위상 간의 모든 구분이 사라지고 물질이 초임계 액체가 된다.
- crucible
- 세라믹, 금속 접시 또는 다른 용기로, 물질을 녹이거나 매우 높은 온도에 노출될 수 있다.[1]
- crystal
- 구성 입자(원자, 이온 또는 분자 등)가 질서정연한 주기적인 현미경 구조로 배열되어 모든 방향으로 확장되는 격자를 형성하는 고체. 그러한 물질들은 종종 결정체라고 묘사된다.
- crystallization point
- 동결점을 보라.
- crystallography
- 화학의 분과는 결정체 고형분 내 원자의 배열을 결정하는 것과 관련이 있다.
- cuvette
- 분광 실험에 사용되는 유리 그릇의 일종. 그것은 보통 플라스틱, 유리 또는 석영으로 만들어지며 가능한 깨끗하고 맑아야 한다.

연소 예

이원자 수소 분자인 H2(오른쪽)는 두 개의 단일 수소 원자가 두 개의 전자를 공유할 때 공밸런스 결합에 의해 형성된다.
D
- d-block
- Dalton's law of partial pressures
- deionization
- 이온 제거, 물의 경우 나트륨, 철분, 칼슘 등의 미네랄 이온.
- deliquescence
- 물질은 물에 대한 친화력으로, 종종 대기 중의 수분을 흡수하여 수용액을 형성하는 경향이 있다. 가장 강력한 델리케이트 물질은 염화칼슘과 탄산칼륨과 같은 소금이다.
- delocalized electron
- 분자, 이온 또는 고형 금속 중 개별 원자 또는 공밸런트 결합과 관련이 없는 모든 전자. 이 용어는 결합 시스템이나 방향성 화합물에서 공명에 관련된 전자, 전기 전도성을 촉진하는 자유 전자, 또는 인접한 여러 원자를 포괄하는 분산된 분자 궤도 내의 전자를 가리킬 수 있다.
- density
- 단위 부피 당 질량으로 정의되고 d = m/V 등식으로 표현되는 물질의 집약적 특성.
- denticity
- 단일 리간드에서 조정 복합체에서 중심 원자에 바인딩되는 기증자 그룹의 수입니다.
- dependent variable
- deposition
- 용액 또는 혼합물 내의 입자 침전.
- Dewar flask
- 진공 플라스크를 참조하십시오.
- diatomic
- 원자가 같거나 다른 두 개의 원자로 구성되어 있다. 단원자 및 다원자 대조.
- diatomic molecule
- 동일한 원소 또는 다른 원소의 두 개의 원자만으로 구성된 모든 분자.
- diffusion
- 고농도의 영역에서 저농도의 영역으로 원자나 분자의 순이동. 확산은 확산종의 화학적 전위의 경사로에 의해 추진되며 입자의 무작위 보행에 의존한다. 따라서 필요한 유도 벌크 운동 없이 혼합 또는 대량 수송이 이루어진다.
- dilatant
- 모양이 바뀌면 부피가 늘어나는 기능을 가진 물질.[2]
- dilution
- dimer
- 화학적 결합으로 결합된 두 개의 단일체로 구성된 과점체로서, 변동성이 강하거나 약할 수 있으며, 공밸런스 또는 분자간 결합이 될 수 있다. 호모디머는 두 개의 동일한 분자로 구성된다; 이단체는 두 개의 다른 분자로 구성된다.
- dipolar bond
- dipole
- 전하의 전기적 또는 자기적 분리.
- dipole moment
- 극성 공밸런트 결합의 극성.
- diastereomer
- dispersion
- 한 물질의 입자가 다른 물질의 연속적인 위상 내에 분포하는 시스템; 두 단계는 물질의 동일하거나 다른 상태에 있을 수 있다. 침전될 수 있을 만큼 큰 입자의 분산은 현수라고 불리는 반면, 작은 입자의 분산은 콜로이드 또는 용액이라고 불린다.
- dissociation
- dissolution
- 용매의 분자나 이온과의 상호작용, 결합 형성, 수소 결합 및 반 데르 발스 힘을 포함한다.
- distillation
- 선택적 비등과 후속 응축을 통해 혼합물 성분의 상대적 변동성의 차이를 이용하여 액체 혼합물의 성분 물질을 분리하는 과정. 물질을 증류할 때 사용하는 기구를 정이라고 하며, 그 과정에서 산출되는 재응축 물질을 증류라고 한다.
- double bond
- 두 쌍의 전자의 공동 공유와 관련된 결합.
- double-replacement reaction
- ductility
- 일반적으로 인장 시험에서 연신율 또는 면적 감소율(%)으로 표현되며 재료가 와이어로 확장되는 것이 특징인 파열 전 소재의 상당한 플라스틱 변형을 경험할 수 있는 능력 측정.

나트륨 이온(Na+)은 수용액에 용해되었을 때 물 분자와 함께 용해 복합체를 형성한다.
E
- earth metal
- 알칼리성 접지 금속을 참조하십시오.
- electric charge
- 전자기 상호작용을 결정하는 측정된 특성(쿨롬)
- electrolyte
- 일정량의 전류를 전도하고, 약하고 강한 전해질로 분류하여 나눌 수 있는 용액.
- electrochemical cell
- 화학반응의 전류를 이용하여 기전력이 만들어진다.
- electromagnetic radiation
- 물질뿐만 아니라 진공도 통과할 수 있는 파형의 일종으로 자가제안 파동으로 분류된다.
- electromagnetic spectrum
- electromagnetism
- 전하를 가진 필드 및 입자가 움직이고 상호작용하는 방식을 변화시키는 전기적 특성.
- electromotive force (emf)
- electron
- 음의 순전하를 갖는 아원자 입자의 일종.
- electron configuration
- 원자 또는 분자 궤도 내에서 원자 또는 분자의 전자의 분포. 광범위한 표기법은 각 원자 종의 전자 구성에 관한 정보를 간결하고 독특하게 표시하기 위해 사용된다. 서로 다른 원자에 있는 전자의 특정 배열에 대한 지식은 화학적 결합과 원소의 주기율표 구성을 이해하는 데 유용하다.
- electron deficiency
- electron pair
- 같은 분자 궤도를 차지하지만 반대 방향으로 회전하는 두 개의 전자. 전자쌍은 화학적 결합을 형성하거나 발란스 전자의 한 쌍으로 발생하며, 전자가 미숙련 전자로서 개별적으로 발생하는 것도 가능하다.
- electron shell
- 일정한 수의 전자를 포함하는 원자의 핵 주위의 궤도(보통 두 개 또는 여덟 개)
- electronegativity (χ)
- 한 쌍의 전자(또는 전자 밀도)를 자기 쪽으로 끌어당기는 원자의 경향을 설명하는 화학적 특성. 원자의 전기성은 핵에 있는 양성자의 수에 비례하는 핵 전하와 원자 껍질에 존재하는 전자의 수와 위치(발란스 전자로부터 핵의 거리에 영향을 미친다)에 의해 모두 영향을 받는다. 원자나 대체자의 전기성이 높을수록 자기 자신을 향해 전자를 더 많이 끌어당긴다. 일반적으로 계산되듯이, 전기성은 원자 자체의 특성이 아니라 분자 내의 원자이기 때문에 일반적으로 전달 가능한 특성으로 간주되지만 원소의 화학적 환경에 따라 변화한다.
- electrophile
- 전자쌍을 받아들일 수 있는 모든 원자 또는 분자. 대부분의 전자는 순 양전하를 띠거나, 부분적 양의 전하를 띠는 원자를 포함하거나, 전자의 완전한 옥텟을 가지지 않는 중성 원자를 포함하며, 따라서 다른 종의 전자가 풍부한 영역을 끌어들인다; 공궤도를 가진 전자는 핵성분자가 기증한 전자쌍을 받아 화학물질을 만들 수 있다.그 두 종 사이의 결속력 그들은 전자를 받아들이기 때문에, 전자는 루이스 산이다.
- electrosynthesis
- element
- 원자핵에 동일한 수의 양성자가 있고 따라서 동일한 원자 번호를 갖는 원자의 한 종. 화학 원소는 우주의 모든 통상적인 물질을 구성한다; 118개의 원소가 확인되었고 원소의 주기율표에서 그들의 다양한 화학적 성질에 의해 구성된다.
- elementary reaction
- 하나 이상의 화학 종이 단일 반응 단계에서 하나의 전환 상태(즉, 매개체가 없는 경우)로 제품을 형성하기 위해 직접 반응하는 모든 화학 반응. 단계적 반응을 대조한다.
- elution
- 용매로 세척하여 한 물질을 다른 물질에서 추출하는 과정. 용출은 분석 물질 분자를 선택적으로 결합하도록 설계된 흡착물 매트릭스를 지나 분석 물질을 함유한 용액을 작동시킨 후 용해제라고 알려진 용제로 흡착제/분석제 콤플렉스를 세척하는 방식으로 작용한다. 용제 분자는 제자리에 있는 흡착제에 결합하여 분석물질을 대체하여 현재 용출물의 일부인 분석물질을 복합체에서 추출하여 분석할 수 있도록 한다.
- empirical formula
- 화학 화합물에 존재하는 각 원소의 원자에 대한 가장 단순한 정수 비율.
- emulsion
- 한 액체의 작은 입자가 다른 액체로 분산되는 콜로이드의 일종. 예를 들어 기름에 물이 분산되거나 물에 기름이 분산되는 것이다. 유화는 종종 분자 안에 극소성 부분과 극소성 부분을 모두 가지고 있는 유화제라고 알려진 물질을 첨가함으로써 안정된다.[1]
- enantiomer
- enantiomorph
- endothermic process
- energy
- 시스템의 작업 능력.
- enplethy
- 물질의 양을 보아라.
- enthalpy
- 열역학 시스템의 총 내부 에너지에 대한 측정값으로, 일반적으로 H로 상징된다.
- enthalpy of fusion
- entropy
- 닫힌 열역학 시스템에서 작업에 사용할 수 없는 에너지의 양으로, 일반적으로 S로 상징된다.
- environmental chemistry
- enzyme
- 화학 반응을 촉진하는 생물학적 단백질 촉매.
- epimer
- Eppendorf tube
- 마이크로 센트리퓨지 튜브를 가리키는 데 사용되는 일반화되고 상표 있는 이름.
- equilibrium
- 보편적으로, 그것은 모든 경쟁적인 영향들이 균형을 이루는 시스템의 조건이다. 화학적 평형상태는 반응물질과 제품의 농도가 시간에 따라 변동을 멈춘 상태를 말한다.
- Erlenmeyer flask
- ester
- ether
- 두 개의 알킬 또는 아릴 그룹에 연결된 산소 원자를 포함하는 유기 화합물의 종류 및 기능 그룹이며, 동일하거나 다를 수 있다. 에테르에는 일반적인 공식 R-O-R'이 있는데, 여기서 R과 R'은 알킬 또는 아릴 그룹을 나타낸다.
- eutectic mixture
- 이러한 성분의 가능한 혼합물 중에서 용해점이 가장 낮은 두 개 이상의 물질로 구성된 고체 용액.[1]
- exothermic process
- extensive property
- 값이 설명하는 시스템의 크기 또는 시스템의 물질의 양에 비례하는 물리적 수량. 예를 들면 질량, 부피, 엔탈피, 엔트로피 등이 있다. 대비 집약적 특성.
- extraction
- 1. 선택적 [1]용해도에 의해 성분이 혼합물로부터 분리되는 분리 과정 파티션을 참조하십시오.
- 2. 성분 분석물질과 행렬의 분리
- extrinsic property

500밀리미터 엘렌마이어 플라스크
F
- f-block
- Faraday constant
- 전자의 1 몰을 나타내는 전기화학에 널리 사용되는 전하의 단위: 6.022 × 1023 전자. 약 96,500쿨롬(F = 96 485.339 9(24) C/mol)과 같다.
- Faraday's laws of electrolysis
- a) 전기 분해 중 전극에서 변경된 물질의 질량은 그 전극에서 전달되는 전기의 양과 정비례하며, b) 전극에서 변경된 원소 물질의 질량은 원소의 등가 중량에 정비례한다.
- Fick's laws of diffusion
- filtration
- 필터라 불리는 충분히 작은 크기의 입자만이 통과할 수 있는 복잡한 격자 구조를 통해 혼합물을 통과시켜 큰 입자(고형물질)와 작은 입자(종종 유체)를 분리하는 모든 물리적, 생물학적 또는 화학적 작동. 필터를 성공적으로 통과한 유체와 작은 입자를 여과물이라고 한다.
- fire point
- 휘발성 물질 위의 증기가 표준 치수의 개방 불꽃에 의해 점화된 후 최소 5초 동안 계속 연소되는 최저 온도.[5] 화재 지점은 물질이 잠시 점화되지만 지속적인 연소에 충분한 속도로 증기가 생성되지 않는 점멸 지점과 혼동해서는 안 된다.
- first-order reaction
- flash point
- 점화원이 주어진 경우 휘발성 물질 위의 증기가 점화되는 최저 온도. 플래시 포인트에서 불꽃을 개방하면 주변 온도가 여전히 너무 낮은 지속 연소보다는 순간적인 "플래시"만 발생한다. 섬광 지점은 조금 높은 온도에서 발생하는 화재 지점과 혼동해서는 안 되며, 고요함보다 높은 발화 지점과 혼동해서는 안 된다.
- flask
- 용기 또는 용기는, 가장 일반적으로 유리 용기의 한 종류로서, 화학 물질, 샘플 또는 용액의 준비, 보유, 함유, 수집 또는 부피 측정과 같은 다양한 목적을 위해 실험실에서 널리 사용되거나 화학 반응이 발생하는 챔버로서 사용된다. 플라스크는 다양한 모양과 크기로 제공되지만 일반적으로 혈관 "몸통"이 넓어지고 관형 부분이 하나 이상 좁아지는 것이 특징이며, 상단에는 개구부가 있다.
- flocculation
- 콜로이드의 분산된 입자들이 자발적으로 또는 명확화 물질의 첨가로 인해 floc 또는 flake라고 알려진 더 큰 덩어리로 집합하기 위해 정지 상태에서 나오는 과정. 이 용어는 입자를 붙들고 있는 힘이 약하고 콜로이드가 동요에 의해 다시 분해될 수 있는 가역적 집계를 가리키는 말로 자주 쓰인다.[1]
- formal charge (FC)
- 모든 결합의 모든 전자가 각 원자의 상대적 전기성에 관계없이 원자 사이에 균등하게 공유된다고 가정하여 분자 내의 원자에게 할당되는 전하를 말한다. The formal charge of any atom that is part of a molecule can be calculated by the equation , where is the number of valence electrons of the neutral atom in its ground state; is the number of valence electrons of the atom 분자 내 결합에 참여하지 않고 은(는) 분자 내 다른 원자와의 결합에서 공유되는 전자 수입니다.
- formula weight (FW)
- 어금니 질량과 분자 중량의 동의어로, 이온염과 같은 비분자 화합물에 자주 사용된다.
- fraction
- fractional distillation
- 일반적으로 증류 용기에 부착되고 유리 구슬로 채워진 긴 수직 기둥을 사용하여 증류 과정에 의해 구성 요소 부분 또는 분수에 액체가 혼합된 분율. 혼합물은 하나 이상의 성분 화합물이 기화되는 온도로 가열된다. 수증기는 응축될 때까지 기둥 위로 올라가 용기로 다시 흘러 들어가 온도 및 변동성 구배를 생성하며 기둥 길이를 따라 다른 지점에서 다양한 분수를 추출할 수 있다.[1] 산업 화학에서 흔히 볼 수 있는 이 기술은 표준 압력에서 서로 25°C(45°F) 미만의 비등점을 갖는 화합물을 분리할 수 있을 정도로 민감하다.
- fractionation
- 위상 전환 중에 특정 양의 혼합물이 다수의 소량으로 분할되는 분리 과정(분수라고 함)으로, 화학적 성분은 경사에 따라 달라진다. 분율은 혼합물의 성분 화합물들 사이의 일부 특정 특성(예: 질량, 비등점, 용해성 등)의 미묘한 차이를 이용하여 혼합물의 세 가지 이상의 성분을 동시에 분리할 수 있다. 과학기술의 많은 분야에서 사용되는 분류에는 많은 종류가 있다.
- free radical
- 급진적인 것을 보아라.
- freezing
- 액체에서 고체로 물질의 위상 전환.
- freezing point
- 물질이 액체에서 고체로 변하는 온도. 동결은 용융의 역행이기 때문에 물질의 동결점은 용융점과 동일하지만 관례상 용융점만을 물질의 특성이라고 한다.
- freezing-point depression
- frequency
- 특정 공정의 시간 단위당 주기 수 측정. 주파수 측정을 위한 SI 단위는 헤르츠(Hz)이며, 1Hz = 초당 1 사이클이다.
- functional group

분수 증류를 위해 설계된 실험실 기구의 도표
G
- galvanic cell
- 염교로 연결된 두 개의 서로 다른 금속을 가진 전기 화학 물질로 구성된 배터리의 일종.
- gas
- 물질의 4가지 기본 상태 중 하나로, 용기는 채워지지만 확실한 형태나 부피가 없는 고에너지 입자가 특징이다.
- gas chromatography
- 분해 없이 기화될 수 있는 화학성분들을 분리하고 분석하기 위해 분석 화학에서 일반적으로 사용되는 크로마토그래피의 일종이다. 가스 크로마토그래피는 종종 물질의 순도를 테스트하고, 알려지지 않은 물질을 식별하며, 혼합물의 다른 성분의 상대적인 양을 측정하는 데 사용된다.
- Gay-Lussac's law
- 프랑스 화학자 조셉 루이스 게이-루삭이 도출한 두 관계 각각에 사용하는 화학 법칙으로, 비록 그 이름이 부피를 결합하는 그의 법칙에 더 많이 적용되기는 하지만 가스의 성질에 관련된 것이다.
- geochemistry
- 지구의 화학적 구성과 지질학적 과정에 대한 연구.
- Gibbs energy
- 반응의 자발성을 나타내는 값. 보통 G로 상징된다.
- glass
- gram-atom
- 원소의 1그램 원자는 6.023X10^23 원자의 집합으로 정의된다.
- Grignard reaction
- ground glass joint
- 누출 방지 유리 제품 두 개를 빠르고 쉽게 함께 장착할 수 있도록 설계된 장치로서, 접지 유리 표면과 일반적으로 맞춤 제작된 원뿔형 테이퍼가 특징이다.
- group
- 원소와 이를 공유하는 원소의 주기적 표의 수직 열. 대비 기간.
H
- hadron
- 강한 상호작용에 참여할 수 있는 바이런과 중간자를 포함하는 유형의 아원자 입자.
- halogen
- 주기율표 17조의 5개 비금속 원소 중 불소(F), 염소(Cl), 브롬(Br), 요오드(I), 아스타틴(At) 중 하나.
- heat
- 열 상호작용에 의해 한 시스템에서 다른 시스템으로 전달되는 에너지.
- heat of fusion
- 핵융합 엔탈피를 참조하십시오.
- Henry's law
- Hess' law of constant heat summation
- 화학반응이 진행되는 동안 총 엔탈피 변화가 한 단계로 완료되는지 여러 단계로 완료되는지 여부는 동일하다고 기술한 물리화학 법칙.
- Hund's rules
- hydrate
- 물이나 그 구성 요소 또는 다른 분자에 물 또는 그 원소를 첨가하여 형성된 화합물을 포함하는 모든 물질.
- hydration reaction
- hydrogen
- hydrogen bond
- 전기 원자와 두 번째 전기 원자에 묶인 수소 원자의 정전기 상호작용의 한 형태. 수소 결합은 수소 원자의 작은 크기가 상호작용하는 전하의 근접성을 허용하고, 분자간 또는 분자간 힘으로 발생할 수 있기 때문에 독특하다.
- hydrogenation
- hydrolysis
- 물의 첨가에 의한 화학적 결합의 갈라짐.
- hydrous
- 물 분자를 가지거나 포함하며, 특히 수화 물을 가리킨다. 무수 대비를 하다.
- hygroscopy
I
- ideal gas
- ideal gas constant
- 이상 가스법에서 0.08206 L·atm/(K·mol)로 정의되는 비례 상수.
- ideal gas law
- 기체의 부피는 기체의 양과 켈빈 온도에 비례하고 압력에 반비례한다는 화학 법칙.
- ideal solution
- 기체 위상이 이상적인 기체의 혼합물과 유사한 열역학적 특성을 나타내는 용액.
- independent variable
- indicator
- 용액의 산도에 따라 색이 변하는 용액에 첨가된 특수 화합물. 지표마다 색상이 다르고 pH 범위 내에서 효과가 있다.
- induced radioactivity
- 안정적 동위원소에 원소 입자를 투하하여 방사성 동위원소를 형성함으로써 발생하는 방사능
- inert
- inorganic compound
- 예외는 있지만 탄소를 포함하지 않는 모든 화학 화합물. 대조 유기 화합물.
- inorganic chemistry
- 무기 화합물의 화학적 특성과 반응에 관한 화학적 분야. 유기화학을 대조하다.
- insulator
- 전류의 흐름에 저항하는 모든 물질. 콘트라스트 컨덕터.
- intensive property
- 시스템의 크기 또는 측정되는 물질의 양에 따라 값이 달라지지 않는 물리적 수량. 예를 들면 밀도, 온도, 압력 등이 있다. 광범위한 속성을 대조하십시오.
- intermolecular force
- International System of Units (SI)
- International Union of Pure and Applied Chemistry (IUPAC)
- 화학 명명법 및 기타 화학 방법론 표준 개발에서 세계 권위자로 인정받는 국제 화학자 연맹.
- intramolecular force
- intrinsic property
- ion
- 중성 상태에서 하나 이상의 전자를 얻거나 잃어서 음전하 또는 양의 전하를 가진 분자.
- ionic bond
- 반대방향으로 충전된 이온 사이의 정전기 흡인력.
- ionic strength
- 용액 내 이온 농도의 측정값으로, 일반적으로 어금니(mol/L 용액) 또는 어금니(mol/kg 용액) 단위로 표현된다.[6]
- ionization
- 화학 화합물이 분리된 이온으로 분해되는 것.
- isoelectronicity
- 둘 이상의 화학종(atoms, 분자, 이온 등)이 서로 다른 원소로 구성되지만 동일한 수의 발란스 전자와 동일한 구조 배열(즉, 동일한 연결성을 가진 원자의 수)을 갖는 현상이다. 이소전자 종은 일반적으로 화학적 성질에 있어 유용한 일관성과 예측 가능성을 보여준다.
- isomerization
- isomers
- 화학 공식은 동일하지만 뚜렷한 구조나 공간 배치를 가진 이온이나 분자. Isomer는 반드시 유사한 속성을 공유하지는 않는다. 이소머의 두 가지 주요 유형은 구조 이소머와 입체이다.
- isotope
- 핵에 존재하는 중성자의 수가 다른 특정 화학 원소의 변형이다. 주어진 원소의 모든 동위원소는 각 원자에 동일한 수의 양성자를 가지고 있다.
J
K
- kelvin (K)
- SI 기본 온도 단위(기호: K). 켈빈 눈금은 절대 0을 null 점으로 사용하는 절대 열역학 온도 눈금이다.
- ketone
- 유기 화합물의 종류와 두 탄소 원자 사이의 카보닐 그룹으로 구성된 기능 그룹. 케톤은 일반적인 공식 RC2=O를 가지고 있는데, 여기서 R은 탄소를 함유하는 대체물이 될 수 있다.
- kindling point
- 자동 점화 온도를 참조하십시오.
- kinetics
- 반응률을 전문으로 하는 화학의 하위 분야.
- kinetic energy
- 움직임으로 인한 물체의 에너지.
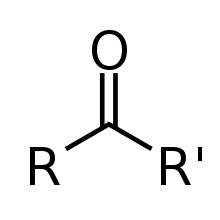
일반 케톤에 대한 골격식으로서, 가변 탄소 함유 대체물군을 나타낸다.
L
- lability
- lanthanides
- 란타넘에서 루테튬까지 원자 번호 57부터 71까지의 금속 원소의 주기적인 연속이다.
- lattice
- 결정체 액체나 고체에 있는 원자나 분자의 독특한 배열.
- lattice energy
- law of conservation of energy
- law of conservation of mass
- law of multiple proportions
- laws of thermodynamics
- leveling effect
- 용매에 용해된 산이나 염기의 화학적 특성에 대한 용매의 영향. 강산의 강도는 용매의 기본성에 의해 제한되거나 "준위"되며, 마찬가지로 강기반의 강도는 용매의 산성도에 의해 제한되어 용액의 유효 pH가 산이나 염기의 분해 상수에서 제안할 수 있는 것보다 높거나 낮다.
- Lewis acid
- Lewis base
- Lewis structure
- ligand
- 중앙 금속 원자에 결합하여 조정 콤플렉스를 형성하는 이온, 기능 그룹 또는 기타 분자. 이러한 결합은 공밸런트에서 이온에 이르기까지 다양하지만 일반적으로 하나 이상의 리간드의 전자쌍을 금속으로 공식적으로 기증하는 것을 포함한다.
- light
- 보조되지 않은 사람의 눈에 보이는 전자파 스펙트럼의 부분.
- liquefaction
- liquefaction point
- 용해점을 참조하십시오.
- liquid
- 물질의 4가지 기본 상태 중 하나로, 일정한 체적은 유지하지만 일정한 형태는 유지하지 않는 거의 비압축성 유체 입자로 특징지어진다.
- liquid–liquid extraction (LLE)
- locant
- London dispersion forces
- 약한 분자간 힘의 일종이다.
M
- magnetic quantum number
- malleability
- 연성을 참조하십시오.
- manometer
- 에반젤리스타 토리첼리가 1643년에 발명한 압력을 측정하는 데 사용되는 기구다.
- mass
- 순력이 가해질 때 가속도에 대한 저항의 척도인 물리적 물질의 속성. 질량의 SI 기준 단위는 kg(kg)이다.
- mass concentration
- mass fraction
- mass number (A)
- 원자의 핵 내에 있는 양성자와 중성자의 총 수입니다. 그것은 원자의 원자 질량을 결정한다. 질량 번호는 동일한 화학 원소의 서로 다른 동위원소 간에 다르며, 특정 동위원소를 식별하기 위해 원소 이름(탄소-12 참조) 뒤에 또는 원소 기호(C) 왼쪽에 위첨자로 포함되는 경우가 많다.
- mass spectrometry (MS)
- 일반적으로 알려지지 않은 물질의 원소 또는 동위원소 시그니처를 결정하기 위해 샘플을 이온화 지점까지 전자와 충돌시킨 다음 충전된 파편을 전기장 또는 자기장에 피폭하여 분리함으로써 화학 샘플에서 이온의 질량 대 충전 비율을 측정하는 분석 기법.구성 입자의 질량 및/또는 그 안에 있는 분자의 정체성 또는 구조물의 질량. 결과는 질량 스펙트럼으로 제시되며, 질량 대 충전 비율의 함수로 이온 신호의 강도에 대한 그래프로 제시된다.
- matter
- 질량이 있고 부피가 있어 공간을 차지하는 모든 물질.
- metal
- 전기와 열을 모두 잘 전도하고 비금속과 쉽게 양이온 및 이온 결합을 형성하는 모든 화학 원소.
- melting
- 고체에서 액체로 물질의 위상 전환.
- melting point
- 물질이 고체에서 액체로 변하는 온도. 압력에 따라 다르며 일반적으로 표준 조건에서 주어진 물질에 대해 지정된다. 물질의 녹는점은 그 동결점과 동일하다.
- metalloid
- 금속과 비금속 모두의 특성을 가진 화학 원소 또는 물질.
- methylene blue
- 분자 공식 CHNSCl이16183 있는 이질 순환 방향족 화합물.
- microcentrifuge tube
- 소량의 액체를 저장하는 데 사용되는 작은 플라스틱, 밀봉 가능한 용기, 일반적으로 2밀리리터 미만.
- mineral
- 상당히 잘 정의된 구성과 순수한 형태로 자연적으로 발생하는 특정 결정 구조를 가진 고체 화학 화합물.[7]
- miscibility
- mixture
- 물리적으로 혼합되지만 화학적으로 결합되지 않는 둘 이상의 다른 물질로 구성된 물질(즉, 물질의 분자를 새로운 물질로 변화시킨 화학 반응이 일어나지 않았다)
- moiety
- 다른 종류의 분자에서도 식별할 수 있는 큰 분자의 명명된 특성 그룹, 분기 또는 기타 부분. 기능 그룹은 일반적으로 모이에티보다 작고 일반적이지만, 대체품이나 사이드 체인은 모이에티로 분류되는 경우가 많고 그 반대의 경우도 있다.
- molality
- 용제의 단위 질량 당 용액의 양 측면에서 용액 내 용액의 농도를 측정한다. 어금니는 일반적으로 킬로그램 당 점(몰/kg) 단위로 표현된다. 정확히 1 mol/kg의 농도를 가진 용액은 때때로 1 mol이라고 한다. 대조 어금니.
- molar attenuation coefficient
- molar concentration
- 용액의 단위 부피당 종양의 양 측면에서 화학종, 특히 용액의 용해종 농도의 측정값. 몰밀도는 일반적으로 리터당 몰(mol/L) 단위로 표시되며, 정확히 1 mol/L 농도의 용액은 일반적으로 1 mol(mol/L)이며, 1 m contrast(대조도)로 상징된다.
- molar fraction
- molar mass
- mole (mol)
- 물질을 구성하는 입자 또는 실체의 절대 개수를 기준으로 물질의 양을 측정하는 단위(기호: mol) 단일 몰에는 약 6.022×1023 입자 또는 실체가 포함되어 있다.
- molecular formula
- molecular orbital (MO)
- (개별 원자 내에서와 반대로) 분자에서 하나 이상의 전자가 발견될 수 있는 모든 영역.
- molecular orbital diagram
- molecular weight
- molecule
- 화학적으로 서로 결합되어 집합적으로 전기적으로 중립적인 다수의 원자.
- monatomic
- 둘 이상의 분자와는 대조적으로, 하나의 원자만 가지고 있다. 사실상 모든 원소는 충분히 높은 온도에서 가스 단계에서 단원자적이다. 이원자 및 다원자 대조군.
N
- natural abundance
- neat
- 액체 시약 또는 가스가 첨가되지 않은 용매 또는 코솔벤트 없이 수행된 조건.
- neutron
- 전기적으로 중립적이며 순전하가 없는 아원자 입자의 한 유형.
- nitrogen
- noble gas
- 주기율표 18조의 비금속 원소 6개 중 하나: 헬륨(He), 네온(Ne), 아르곤(Arg), 크립톤(Kr), 제논(Xe), 라돈(Rn)이다. 모든 고귀한 가스는 외부 전자 껍데기를 가지고 있는데, 이 껍데기는 자연적으로 발생하는 상태로 완전히 채워져 있어 화학 반응성이 매우 낮다.
- non-metal
- 금속이 아닌 모든 화학 원소.
- normality
- nuclear
- 원자핵에 관련된 것.
- nuclear chemistry
- 방사능을 포함한 원자핵과 관련된 다양한 과정과 성질을 연구하는 화학의 분야.
- nuclear magnetic resonance spectroscopy
- 특정 원자핵의 자기성을 이용하는 기법으로, 미지의 화합물을 식별하는 데 유용하다. 핵자기공명은 흔히 NMR이라고 약칭한다.
- nuclear transmutation
- nucleon
- 원자핵의 구성 요소로서 그것의 역할에서 고려되는 양성자나 중성자 둘 중 하나이다.
- nucleophile
- 전자쌍을 다른 원자나 분자에 기부할 수 있는 모든 원자나 분자. 자유 쌍의 전자 또는 적어도 하나의 파이 결합을 가진 모든 분자나 이온은 다른 종의 전자 결핍 지역에 끌리는 핵물질 역할을 할 수 있다; 전자 쌍을 전기영양체에 기증하는 핵성분과 관련된 화학 반응을 핵성 공격이라고 할 수 있다. 그들이 전자를 기증하기 때문에 핵소체는 정의상 루이스의 기초가 된다.
- nucleus
- 중성자와 양성자로 구성되고 순 양전하를 갖는 원자의 중심.
- nuclide
- 질량 수, 원자 수, 핵 에너지 상태에 의해 특징지어지는 원자의 한 종류로서, 그 상태의 평균 수명이 관측할 수 있을 만큼 길다는 것을 전제로 한다.
- number density
- 단위 부피당 숫자로 표현되는 공간 내 계수 가능한 물체(atoms, 분자 등)의 농도에 대한 측정값.
O
- octet rule
- 특정 분자 내 원자의 전자 구성을 설명하는 고전적인 규칙: 주기율표의 첫 번째 행에 있는 원소의 발란스 쉘에 수용될 수 있는 전자 쌍의 최대 수는 4개(또는 총 8개의 전자)이다. 두 번째 행과 후속 행의 요소의 경우 이 규칙에는 많은 예외가 있다.
- olefin
- 알켄에 대한 사소한(비 IUPAC) 이름.
- optical activity
- orbital
- 하나 이상의 전자를 찾을 수 있는 원자 또는 분자의 모든 영역. 이 용어는 원자 궤도 또는 분자 궤도 중 하나를 가리킬 수 있다.
- orbital hybridisation
- order of reaction
- organic acid
- 산성 성질을 가진 모든 유기 화합물. 대비 유기농 베이스.
- organic base
- 기본 특성이 있는 모든 유기 화합물. 유기산을 대조하다.
- organic chemistry
- 화학의 분과는 유기화합물의 화학적 특성 및 반응과 관련이 있다. 무기화학을 대조하다.
- organic compound
- 하나 이상의 탄소 원자를 포함하는 모든 화학 화합물. 무기 화합물을 대조하다.
- organic redox reaction
- osmotic pressure
- other metal
- p-블록의 금속 요소 중 하나로서, 비교적 낮은 용해 지점(950 K 미만 모두)과 비교적 높은 전기율 값(1.6 이상, 수정된 Pauling)의 조합을 갖는 것이 특징이다.
- oxidation
- 일반적으로 전자를 잃음으로써, 리독스 반응에서 화학 종의 산화 상태의 증가. 대비 감소.
- oxidation state
- 1. 화학적 화합물에서 개별 원자의 산화 정도, 원자의 자연 발생 원소 상태에 상대적인 전자 수의 감소로 측정한다.
- 2. 서로 다른 원소의 원자에 모든 결합이 공밸런스 성분이 없는 100% 이온성이면 원자가 가질 가상의 전하(양, 음 또는 0)가 된다.
- oxidizing agent
- 1. 환원제라 불리는 다른 종으로부터 하나 이상의 전자를 얻거나 받아들이는 화학종으로서, 리독스 반응으로 다른 종들의 산화를 유발하고, 결국 그 자체가 감소되는 것이다. 산화제의 산화 상태는 감소하는 반면 환원제의 산화 상태는 증가한다.[1]
- 2. 강한 전기 원자, 보통 산소를 기질로 옮기는 화학종.
- oxoacid
- 1. 산성군에 산소가 있는 모든 산.
- 2. 산소, 적어도 다른 원소, 그리고 산소와 결합한 수소 원자 하나 이상을 함유하고 있으며, 양의 수소 이온의 상실에 의해 결합 기반을 생성하는 화합물.
- oxygen
P
- p-block
- paraffin
- 1. 알칸에 대한 사소한 (비 IUPAC) 이름.
- 2. 등유의 다른 이름.
- partial pressure
- pascal (Pa)
- passivation
- period
- 원소와 이를 공유하는 원소의 주기적 표의 수평 행. 대조군.
- periodic table of the elements
- 원자 번호, 전자 구성 및 기타 화학적 특성에 의해 구성된 화학 원소의 표 배열로, 채택된 구조는 주기적인 경향을 보이며 화학자들에 의해 다양한 원소 사이의 관계를 도출하는 데 사용되며, 발견되지 않았거나 새로 합성된 원소의 특성과 행동을 예측하는 데 사용된다. 원소들의 첫 번째 주기율표는 1869년 러시아의 화학자 드미트리 멘델레예프에 의해 출판되었다.
- pH
- 수용액의 산도 또는 기초도를 지정하는 데 사용되는 로그 척도. pH 척도는 용액 내 수소 이온의 어금니 농도의 base-10 로그의 음수에 가깝다. 상온에서 순수수는 중성(pH = 7)이며, pH가 7 미만인 용액은 산성, pH가 7 이상인 용액은 기본이다.
- phase
- 물질의 모든 물리적 특성이 본질적으로 균일한 공간 영역 또는 화학적으로 균일하고, 물리적으로 구별되며, 종종 기계적으로 분리할 수 있는 물질의 영역. 용어는 화학적 맥락에서 몇 가지 다른 용도를 가질 수 있다; 구어체적으로, 그것은 종종 물질의 상태와 교환할 수 있게 사용되지만, 많은 뚜렷한 단계들이 물질의 단일 상태 내에 존재할 수 있다.
- phase transition
- 1. 물질의 고체, 액체, 기체 상태의 화학 물질과 드물게 플라즈마 사이의 변화.
- 2. 그러한 변형이 발생하는 외부 조건의 측정 가능한 값.
- phi bond
- photon
- 모든 파장의 전자파 방사 캐리어(감마선, 전파 등)
- physical chemistry
- 그 중에서도 운동, 에너지, 힘, 시간, 열역학, 화학 평형, 통계 역학 등 물리학의 원리, 실천, 개념에 따라 화학 체계를 연구하는 화학의 분야. 화학물리학과는 대조적으로 물리화학은 물질 대량량의 물리적 화학적 상호작용을 연구하는 거시과학(전부는 아니지만)이 우세하다.
- pi bond
- pipette
- 정밀하게 측정된 양의 액체를 전달하고 분사하기 위해 화학, 생물학 및 의학에서 일반적으로 사용되는 실험실 도구.
- plasma
- 물질의 4가지 기본 상태 중 하나로, 매우 높은 에너지 입자가 다른 3개의 상태와 달리 독특한 특성과 행동을 보일 정도로 부분적으로 또는 완전히 이온화된다. 플라즈마는 자연 상태에서는 지구 표면에 자유롭게 존재하지 않는다.
- polarity
- polyatomic
- 둘 이상의 원자로 구성되며, 동일하거나 다른 원소로 구성된다. 단원자 및 이원자 대조군.
- polyatomic ion
- 둘 이상의 공동 결합 원자로 구성된 분자로, 집합적으로 순전하를 띠며, 따라서 이온 역할을 한다.
- potential energy
- 힘 영역에서의 위치 또는 구성으로 인해 신체 또는 시스템에 저장된 에너지.
- precipitate
- 화학 반응 중 또는 고체의 확산에 의해 용액 또는 다른 고체의 내부에서 고체의 형성.
- precision
- 여러 실험 실험 또는 관측 결과가 서로 얼마나 가까운지. 정확성을 비교하다.
- pressure
- 단위 면적당 물체의 표면에 수직으로 가해지는 힘. 압력을 위한 SI 단위는 파스칼(Pa)이지만, 다른 많은 압력 단위는 화학에서도 흔히 사용된다.
- protective group
- proton
- 원자핵에서 발견되는 양의 전하를 가진 아원자 입자. 종종 기호 H로+ 표시된다.
- protonation
- 원자, 분자 또는 이온에 양성자(H+)의 추가.
- pure substance
- 화학 물질을 보라.
- pyrolysis
- 진공 가스 같은 불활성 대기에서 상승된 온도에서 물질의 열 분해.
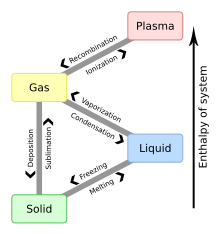
이 다이어그램은 각 상 전환에 일반적으로 사용되는 명명법을 보여준다.
Q
- quantum
- quantum mechanics
- 원자, 분자, 아원자 입자 등이 어떻게 행동하고 구조화되는지에 대한 연구.
- quark
- 기초 입자와 물질의 기본 구성 요소.
R
- racemate
- 광학 활동을 나타내지 않는 한 쌍의 항산화제의 등극 혼합물. 레이스메이트의 화학적 이름 또는 공식은 접두사(±-) 또는 RS 및 SR 기호로 에반토머와 구별된다.
- radiation
- 고에너지 상태에서 저에너지 상태로의 변화가 있을 때 파동이나 아원자 입자의 형태로 방출되는 에너지.
- radical
- 적어도 한 개의 손상된 발란스 전자가 있는 원자, 분자 또는 이온. 거의 예외 없이, 그러한 손상되지 않은 전자는 활성산소를 화학적으로 매우 반응하게 만들고, 따라서 유기산소는 보통 수명이 짧다.
- radioactive decay
- 불안정한 원자핵이 방사선을 방출하여 에너지를 잃는 과정.
- Raoult's law
- 이상적인 액체 혼합물의 각 기체 성분의 부분 압력은 순수한 성분의 증기 압력에 혼합물의 어금니 분율을 곱한 것과 같다고 말하는 열역학 법칙.
- rare-earth element
- 란타니드 시리즈(원자 번호 57부터 71)와 스칸듐, 이트리움을 포함한 세트에 속하는 거의 구별할 수 없는, 은백색, 부드럽고 무거운 금속 원소 17개 중 하나.
- rate equation
- rate-determining step
- 화학 반응에서 가장 느린 단계는 한 단계 이상이다. 이 단계의 비율이 전체 반응 속도를 결정한다.[1]
- reactant
- 화학 반응 과정에서 소비되는 모든 물질.
- reaction mechanism
- 더 큰 화학 반응 또는 전체적인 변화가 발생하는 기초 반응의 단계별 시퀀스. 완전한 메커니즘은 어떤 결합이 깨지고 어떤 결합이 형성되고 어떤 순서로 형성되는지(그리고 어떤 순서로 포함되는지), 그리고 모든 반응제, 제품 및 촉매의 양, 모든 매개체, 활성 복합체 및 전환 상태, 그리고 각 화학종의 입체화학성을 기술하고 설명해야 한다. 복잡한 반응의 상세한 과정은 대부분의 경우 관찰할 수 없기 때문에, 반응 메커니즘은 열역학적 타당성에 근거한 이론적 추측이며 실험에서 얻을 수 있는 거의 없는 것이다.
- reaction rate
- 화학 반응에서 반응 물질이 제품으로 변환되는 속도.
- reaction rate constant
- reactive intermediate
- reactivity
- 특정 화학 물질이 화학적 반응을 일으키려는 경향은 일반적으로 물질이 특정 상황에서 반응하는지 여부와 반응 속도(즉, 반응 속도)라는 두 가지 뚜렷한 관측치 중 하나 또는 둘 다를 가리킨다. 열역학적으로 화학반응은 반응물질보다 낮은 자유에너지에 제품(그룹으로 인식)이 존재하기 때문에 생기며, 따라서 에너지적으로 "안정적"이지만 반응성의 개념은 용도에 따라 운동적 요인을 구현하기도 한다. 화학적 안정성과 화학적 호환성은 관련이 있지만 뚜렷한 개념이다.
- reactivity series
- 일련의 금속의 경험적, 계산적, 구조적으로 분석적 진행으로, 금속의 일반 반응도에 의해 최고에서 최저로 배열되며, 산과 물에 대한 반응과 광석에서 금속을 추출하는 데 사용되는 방법에 대한 정보를 요약하는 데 사용된다.
- reagent
- 화학 반응을 일으키거나 반응이 발생하는지 여부를 확인하기 위해 시스템에 첨가되는 시험 물질.
- redox
- reducing agent
- 산화제라 불리는 하나 이상의 전자를 다른 종에 잃거나 기증하는 화학종, 즉 산화작용에 의해 다른 종의 감소를 초래하고 결국 그 자체가 산화되는 것이다. 환원제의 산화 상태는 증가하는 반면 산화제의 산화 상태는 감소한다.[1]
- reduction
- 일반적으로 전자를 얻음으로써 리독스 반응에서 화학 종의 산화 상태가 감소함. 대비 산화.
- reduction potential
- refractory
- 1. 용해점이 높다.[1]
- 2. 열, 압력, 화학적 공격에 의한 분해에 내성이 있고 고온에서 강도와 형태를 유지하여 그러한 조건에 노출된 환경의 적용에 적합하게 되는 물질. 굴절은 보통 다결정질, 다상, 무기질, 비금속, 다공성, 이질적인 화합물이다.
- resonance
- retort
- 화학 물질의 증류 또는 건조 증류에 사용되는 실험실 기구로서, 전통적으로 증류에 의해 생성된 응축된 증기를 별도의 수거 용기로 전도하는 길고 아래를 가리키는 목을 가진 구형 용기로 구성된다.
- rotamer
- round-bottom flask
- rust
S
- s-block
- 주기율표(알칼리 금속 및 알칼리 금속)의 그룹 1과 2에 있는 원소와 수소와 헬륨의 집합 이름.
- saline solution
- 물(HO2)에 용해된 염화나트륨 용액(NaCl)의 일반적인 용어.
- salt
- 하나 이상의 음이온과 하나 이상의 양이온으로 구성된 이온 화합물.
- salt bridge
- 감소를 전기화학세포의 산화반세포와 연결하는데 사용되는 장치.
- Schrödinger equation
- 원자 주위의 전자의 행동을 나타내는 양자 상태 방정식.
- second-order reaction
- semiconductor
- 전도성의 정도가 도체와 절연체 사이에 있는 전기 전도성 고체.
- serial dilution
- side chain
- 더 큰 분자의 핵심 부분 또는 "백본"에 부착된 화학 대체물 그룹, 특히 생화학 및 유기화학에 사용되는 더 긴 매크로몰리큘의 1차 사슬에서 분기되는 과두 또는 고분자 탄화수소 체인.
- single bond
- 한 쌍의 전자를 공유하는 결합.
- skeletal formula
- sol
- 액체 속의 고체 입자의 서스펜션. 인공적인 예로는 솔젤이 있다.
- solid
- 물질의 4가지 기본 상태 중 하나로, 비교적 낮은 에너지 입자가 확실한 형태와 부피를 가진 단단한 구조물에 빽빽하게 채워져 있는 것이 특징이다. 영의 계수를 보라.
- solid-phase extraction (SPE)
- solubility
- 고체, 액체 또는 기체 용매에서 용해되는 고체, 액체 또는 기체 용매의 특성. 일반적으로 포화 용액의 용매에 용해된 용액의 비율로 표현된다.
- solute
- 용매에 용해되는 용액의 부분. 예를 들어 염화나트륨(NaCl)은 식염수 용액의 용액이다.
- solution
- 일반적으로 용액과 용매라고 불리는 여러 물질로 이루어진 균일한 혼합물.
- solvated electron
- solvation
- 해산을 보라.
- solvation shell
- solvent
- 용액을 분해하는 용액의 부분. 예를 들어, 물(HO2)은 식염수 용액의 용매다.
- spatial isomer
- 입체파를 참조하십시오.
- specific heat capacity (cp)
- 물질의 샘플 열 용량을 샘플의 질량으로 나눈 값. 비공식적으로, 그것은 한 단위의 온도를 증가시키기 위해 물질의 한 단위 질량에 추가되어야 하는 열의 양이다. 특정 열 용량의 SI 단위는 kg당 kelvin 당 joule이다(J/K/kg). 특정 열 용량은 종종 온도 및 물질 상태에 따라 달라진다.
- spectrochemistry
- spectrometry
- 질량 분광법을 참조하십시오.
- spectroscopy
- X선 흡수 및 방출 분광법과 같은 방사선 및 물질에 대한 연구.
- standard solution
- standard conditions of temperature and pressure (STP)
- 실험 결과를 쉽게 비교하기 위해 사용되는 주변 온도와 압력의 표준화. 표준 온도는 섭씨 25도(°C), 표준 압력은 100.000킬로파스칼(kPa)이다. 표준 조건은 흔히 STP 또는 SATP라는 약어로 표시된다.
- state of matter
- 구별되고 동질적이며 거시적인 형태로 존재하는 물질의 상태. 고체, 액체, 가스, 플라즈마는 물질의 전통적인 4가지 상태로서 가장 잘 알려져 있다. 위상을 참조하십시오.
- stepwise reaction
- stereochemistry
- stereogenic center
- stereoisomer
- 동일한 화학적 구성을 가지지만 원자의 공간 배열이 다른 이성질체.
- stoichiometry
- 화학 반응에서 반응제 및 제품의 수량 계산. 스토이치측정법은 질량보전 법칙과 반응물질과 제품의 양이 일반적으로 양의 정수 비율로 존재한다는 관측에 근거한 것으로, 개별 반응물질의 양을 알면 제품의 양을 계산할 수 있고, 그 반대의 경우도 마찬가지임을 시사한다.
- strong acid
- strong base
- structural formula
- 특정 화학 화합물의 분자 구조와 기하학을 그래픽으로 표현하여 원자가 실제 3차원 공간에 어떻게 배열되어 있는지를 보여준다. 분자 내의 화학적 결합도 암묵적으로 또는 명시적으로 나타난다. 확실히 알려졌을 때, 구조 공식은 화학자들이 화학 반응 동안 분자와 그 안에서 일어나는 구조 변화를 시각화할 수 있게 해주기 때문에 매우 유용하다.
- structural isomer
- subatomic particle
- 원자보다 작은 모든 입자. 그 예로는 양성자, 중성자, 전자가 있다.
- sublimation
- 고체에서 석회수 연료 또는 기체로 물질의 단계적 전환 과정 중 액체로의 명백한 전환 없이.
- substance
- 화학 물질을 보라.
- substituent
- surface science
- suspension
- 침전물이 발생하기에 충분히 큰 고체 입자를 포함하는 이질적인 혼합물로서, 이러한 입자들은 방해받지 않고 내버려 두면 시간이 지남에 따라 액체로부터 분리되어 정착된다. 서스펜션에서 용액은 용해되지 않고 일시적으로만 기계적 동요와 함께 유체 용제 전체에 흩어지거나 매달려 있다. 콜로이드와 용액을 대조한다.
T
- tarnish
- temperature
- 시스템 구성 미세 입자의 무작위 운동 평균 운동 에너지에 대한 비례 측정값. 온도의 SI 기준 단위는 켈빈이다.
- theoretical yield
- 수율을 참조하라.
- thermal conductivity
- 열 에너지 또는 열을 전도할 수 있는 물질의 속성( 로 표시되는 수량).
- thermochemistry
- 화학반응 중 열의 흡수 또는 방출에 관한 연구
- thermodynamic stability
- 시스템이 환경과 함께 가장 낮은 에너지 상태에 있는 상태(균형화).
- thermodynamics
- 온도, 부피 또는 압력(또는 작업, 열 및 에너지)의 변화가 거시적 척도에 미치는 영향에 대한 연구
- thermometer
- 온도를 측정하는 데 사용되는 기기.
- titration
- 확인된 분석 물질의 농도를 결정하는 데 사용되는 정량적 화학 분석의 실험실 방법. 이 절차에는 특정 시약을 알려진 농도와 부피의 표준 용액(타이트런트 또는 타이트레이터라고 함)으로 준비하고 분석 물질(타이트랜드라고 함)의 용액과 반응하여 후자의 농도를 결정하는 과정이 포함된다.
- torr
- 압력 측정 단위, 133.322 Pa 또는 1.3158×10−3 atm에 해당한다.
- transition metal
- 원자가 불완전하게 채워진 "d" 하위 쉘과 함께 자연적으로 발생하는 원소. 이 원소들은 주기율표에서 소위 d-블록 원소로 분류된다.
- transuranic element
- 원자 번호가 92보다 큰 원소(즉, 주기율표의 우라늄 이후에 발생) 자연 조건에서는 어떤 초우라늄 원소도 안정적이지 않다.
- triple bond
- 세 쌍의 전자(예를 들어, 이원자 질소 분자 N은2 삼중 결합에 의해 연결된 두 개의 질소 원자로 구성되어 있다)의 공밸런트 공유를 수반하는 결합.
- triple point
- 3상 온도와 압력이 같은 곳. 물은 특별한 위상도를 가지고 있다.
- Tyndall effect
- 콜로이드 또는 부유 입자에 의한 빛의 산란 효과.
U
- UN number
- 위험 물질과 인화성 물질을 기록하는 데 사용되는 네 자리 코드.
- uncertainty
- 어떤 양의 추정을 수반하는 측정은 정확히 재현될 수 없다는 개념이다.
- uncertainty principle
- 입자의 위치를 알면 모멘텀이 불확실해지는 반면, 입자의 모멘텀을 알면 위치가 불확실해진다.
- unified atomic mass unit (u)
- 한 양성자 또는 중성자의 질량과 거의 동일한 질량의 단위. 때로는 기술적으로 구별되고 구식 원자 질량 단위와 동일시되며, 약칭은 amu이다.
- unit cell
- 결정 격자의 최소 반복 단위.
- unit factor
- 단위 간 변환에 사용되는 문장.
- unpaired electron
V
- vacuum flask
- 두 개의 플라스크나 다른 용기로 구성된 저장 용기는 다른 용기에 한 용기는 다른 용기에 넣고 목과 연결되며, 그 사이의 공간은 부분적으로 공기가 빠져나가 선박 내부와 주변 환경 사이의 열 전달을 현저히 감소시키는 진공에 가까운 상태를 만든다. 진공 플라스크는 내용물이 주변 환경보다 따뜻하거나 시원하게 유지되는 시간을 크게 늘릴 수 있다.
- valence electron
- 전자 껍질에 위치한 원자의 가장 바깥쪽 전자들 중 하나.
- valence bond theory
- 분자 내의 화학적 결합, 즉 원자에 의해 형성된 화학적 결합의 수를 논의함으로써 분자 내부의 화학적 결합을 설명하는 이론.
- valency
- 요소의 결합 용량.
- van der Waals force
- 분자 사이의 힘(매력/억제력) 중 하나.
- van 't Hoff factor
- 용액 내 입자 몰과 용해된 솔루트 몰의 비율.
- vapor
- 가스 단계에서 물질이 임계 온도 이하일 때.
- vapor pressure
- 폐쇄 시스템에서 주어진 온도에서 응축된 위상(고체 또는 액체)과 열역학적 평형 상태에 있는 증기에 의해 가해지는 압력. 일반적으로 입자가 액체나 고체상태에서 자발적으로 기체상태로 빠져나가는 경향으로 설명되며 액체의 증발률을 나타내는 지표로 사용된다.
- vaporization
- 액체에서 기체로 물질의 단계적 전환.
- vaporization point
- 끓는점을 보라.
- viscosity
- 액체가 흐를 때의 저항력 측정.
- volatility
- 물질이 얼마나 쉽게 증발하는지를 설명하는 물질적 품질. 주어진 온도와 압력에서 변동성이 높은 물질은 기체로 존재할 가능성이 높은 반면, 변동성이 낮은 물질은 액체나 고체로 존재할 가능성이 높은 반면, 균등하게 휘발성이 낮은 물질은 휘발성이 강한 물질보다 기체 상태에서 더 쉽게 응축될 것이다.
- volt (V)
- 전위, 전위차, 기전력의 파생 단위로서 쿨롱당 1줄로 정의된다.
- voltmeter
- 전기 셀 전위를 측정하는 기구.
- volume
- 닫힌 표면으로 둘러싸인 3차원 공간의 양 또는 물질(고체, 액체, 가스 또는 플라즈마)이 차지하거나 포함되는 공간. 부피의 SI 단위는 입방 미터(m3)이다.
- volumetric analysis
- 적정을 보라.
- volumetric flask
W
- watch glass
- 화학 실험실에서 일반적으로 사용되는 원형 오목한 유리 조각으로 액체를 증발시키거나, 무게를 재는 동안 고체를 보유하거나, 소량의 물질을 가열하거나, 비커를 덮는 등 다양한 목적을 위한 작업 표면으로 사용된다.
- water
- 지구 표면의 고체와 기체로도 자연적으로 발생하지만, 표준 온도와 압력에서 맛없고, 무취하며, 일반적으로 무색의 액체인 화학식 HO를2 가진 극성 무기 화합물이다. 그것은 지구상에서 가장 풍부한 물질이고 따라서 사실상 모든 화학적, 생물학적 시스템의 필수적인 구성요소다. 물은 많은 물질을 녹이는 고유의 능력에 대해 종종 "범용 용매"로 묘사된다.
- water of crystallization
- 수정 안에 존재하는 물 분자. 물이나 수용액으로부터의 결정화 시, 많은 화합물들은 결정체 틀에 물을 포함시킨다; 물 분자는 일반적으로 계량비로 존재하며 결정 원자와 다양한 정도로 상호작용할 수 있다.
- wave function
- 3차원 공간에서 전자의 위치를 설명하는 수학적 함수.
- weak acid
- weak base
- wet chemistry
- 화학 물질과 화학 반응을 연구하기 위해 간단한 관찰과 기본적인 화학 시험과 같은 고전적인 실험실 방법을 사용하는 분석 화학의 한 형태, 즉 정교한 기구를 사용하거나 자동화된 또는 전산화된 분석을 사용하지 않는다. 학교에서 학생들에게 화학 원리를 가르치기 위해 자주 사용된다.
- wetting agent
- work
- work-up
- 원하는 화학 반응의 제품 또는 제품을 분리하고 정화하기 위해 필요한 일련의 조작.
X
- X-ray
- 전자파 스펙트럼에서 감마선과 자외선 사이의 전자파 방사, 이온화의 한 형태.
- X-ray diffraction
- 단파장 X선을 이용하여 결정 고형물의 구조를 설정하고 회절 패턴을 보는 방법
- X-ray photoelectron spectroscopy
- 물질의 화학적 구성을 측정하는 데 사용되는 분광기법.
Y
Z
- zone melting
- 원소를 녹여 불순물을 제거하고 잉곳(캐스트)을 천천히 내려오는 방법.
- zinc
- 원자 번호 30과 기호 Zn을 가진 금속 화학 원소.
참고 항목
참조
- ^ a b c d e f g h i j k l m n o p q r Daintith, John, ed. (2004). A Dictionary of Chemistry (5th ed.). Oxford: Oxford University Press. ISBN 0-19-860918-3.
- ^ a b c Dictionary of Chemistry (2nd ed.). New York: McGraw-Hill. 2003. ISBN 0-07-141046-5.
- ^ 유기 화학 (제3판) 메리 앤 폭스, 제임스 K. 화이트셀 존스 & 바틀렛 출판사(2004) ISBN 0763721972
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "치레리티". doi:10.1351/골드북.C01058
- ^ Steven A., Treese; Peter R., Pujado; David S. J., Jones (2015). Handbook of Petroleum Processing (2 ed.). Springer. p. 1736. ISBN 978-3-319-14528-0.
- ^ Solomon, Theodros (2001). "The definition and unit of ionic strength". Journal of Chemical Education. 78 (12): 1691. Bibcode:2001JChEd..78.1691S. doi:10.1021/ed078p1691.
- ^ 존 P. 래퍼티, 에드(2011): 광물; 페이지 1. 지질학 시리즈에서: 지형, 광물, 암석. 로젠 출판 그룹. ISBN 978-1615304899
외부 링크
| Wikibooks에는 다음과 같은 주제의 책이 있다. 화학 |
| Wikiquote는 다음과 관련된 인용구를 가지고 있다: English_chemistry_mnemonics |





 (는) 분자 내 다른 원자와의 결합에서 공유되는 전자 수입니다.
(는) 분자 내 다른 원자와의 결합에서 공유되는 전자 수입니다.