교아세포종
Glioblastoma| 교아세포종 | |
|---|---|
| 기타 이름 | 교아세포종 다형성 4급 성상세포종 |
 | |
| 15세 남성의 교아세포종 대비 관상 MRI 15세 | |
| 전문 | 신경학, 신경외과 |
| 증상 | 초기에는 비특이성, 두통, 성격 변화, 메스꺼움, 뇌졸중과[1] 유사한 증상 |
| 통상적인 개시 | 64세까지[2][3] |
| 원인들 | 보통[2] 불명확함 |
| 위험요소 | 유전 질환(신경섬유종증, Li-Fraumeni 증후군), 이전 방사선[2][3] 치료 |
| 진단 방법 | CT스캔, MRI스캔, 조직생검[1] |
| 예방 | 불명[3] |
| 치료 | 수술, 화학요법, 방사선[3] 치료 |
| 약 | 테모졸로미드, 스테로이드[1][4] |
| 예후 | 평균수명~치료시 12개월(5년 생존<10%)[2][5] |
| 빈도수. | 연간[3] 100,000명당 3명 |
교모세포종은 이전에 교모세포종 멀티폼으로 알려진 암으로 [6][better source needed]뇌에서 시작되는 가장 공격적인 암은 뇌에서 시작된다.처음에는 교모세포종의 징후와 증상이 [1]특이적이지 않다.그것들은 두통, 성격 변화, 메스꺼움, [1]뇌졸중과 유사한 증상을 포함할 수 있다.증상은 종종 빠르게 악화되고 [2]무의식으로 진행될 수 있다.
대부분의 교모세포종의 원인은 알려져 [2]있지 않다.일반적이지 않은 위험인자에는 신경섬유종증 및 Li-Fraumeni 증후군과 같은 유전적 장애와 이전의 방사선 [2][3]치료가 포함된다.교아세포종은 모든 [1]뇌종양의 15%를 차지한다.그들은 정상적인 뇌세포에서 시작하거나 기존의 낮은 등급의 [7]성상세포종에서 발달할 수 있다.진단은 일반적으로 CT 스캔, MRI 스캔 및 조직 [1]생검을 조합하여 이루어집니다.
암을 [3]예방할 수 있는 알려진 방법은 없다.치료는 보통 수술을 수반하며, 그 후에 화학요법과 방사선 치료를 사용한다.[3]약물 테모졸로미드는 화학요법의 [3][4][8]일부로 자주 사용된다.다량의 스테로이드제가 붓기를 줄이고 [1]증상을 줄이는데 사용될 수 있다.종양의 외과적 제거(감압)는 생존율 증가와 관련이 있지만, 몇 [9]달 정도만 관련이 있다.
최대한의 치료에도 불구하고 암은 거의 항상 [3]재발한다.진단 후 생존 기간은 10-13개월이며, 5년 [10][11][5]이상 생존하는 사람은 5~10% 미만이다.치료를 받지 않으면 생존 기간은 보통 3개월이다.[12]그것은 뇌에서 시작되는 가장 흔한 암이고 뇌수막종 [6][13]다음으로 두 번째로 흔한 뇌종양이다.매년 [3]약 10만 명 중 3명이 이 병에 걸린다.진단 시 평균 연령은 64세이며,[2][3] 이 병은 여성보다 남성에서 더 흔하게 발생한다.
징후 및 증상
일반적인 증상으로는 발작, 두통, 메스꺼움과 구토, 기억력 저하, 성격 변화, 기분 또는 집중력 변화, 국소 신경학적 문제가 있습니다.[14]생기는 증상의 종류는 종양의 병리적인 특성보다는 종양의 위치에 따라 달라진다.종양이 빠르게 증상을 일으키기 시작할 수 있지만, 때때로 엄청난 [citation needed]크기에 이를 때까지 무증상 상태입니다.
위험요소
대부분의 경우 원인은 [2]불분명하다.약 5%는 저급성 [14]성상세포종으로 알려진 또 다른 유형의 뇌종양에서 발생한다.
유전학
특이한 위험인자에는 신경섬유종증, Li-Fraumeni 증후군, 결핵성 경화증 또는 Turcot [14]증후군과 같은 유전적 질환이 포함된다.이전의 방사선 치료도 [2][3]위험합니다.알 수 없는 이유로,[15] 그것은 남성들에게서 더 흔하게 발생한다.
환경의
다른 연관성에는 흡연, 살충제, 석유 정제 또는 고무 [14]제조에 종사하는 것이 포함된다.
교아세포종은 SV40,[16] HHV-6 [17][18]및 사이토메갈로바이러스와 [19]관련되어 있습니다.
다른.
경화된 육류의 섭취가 위험 요소인지 알아보기 위해 연구가 이루어졌다.2013년 [20]현재 확인된 위험은 없습니다.마찬가지로, 의료 영상, 포름알데히드 및 가정 내 휴대폰 및 전기 배선과 같은 주거용 전자기장에서의 방사선 피폭은 위험 인자로 연구되었다.2015년 현재 GBM의 [14][21][22]원인은 밝혀지지 않았습니다.
병인 발생
교모세포종의 세포 기원은 알려지지 않았다.교모세포와 교모세포종의 면역 유지 유사성 때문에 교모세포종과 같은 교모종은 교모세포형 세포에서 유래하는 것으로 오랫동안 추정되어 왔다.보다 최근의 연구는 성세포, 올리고덴드로사이트 전구세포, 신경줄기세포가 모두 [23][24]기원의 세포 역할을 할 수 있다는 것을 시사한다.
교아세포종은 무아세포로 둘러싸인 괴사조직의 작은 영역의 존재로 특징지어진다.이러한 특징과 과형성 혈관의 존재는 종양을 이러한 특징이 [citation needed]없는 3급 성상세포종과 구별한다.
GBM은 보통 뇌백질에서 형성되고, 빠르게 성장하며, 증상을 일으키기 전에 매우 커질 수 있습니다.낮은 등급의 성상세포종 또는 무아세포종의 변성 후 10% 미만이 더 느리게 형성된다.이것은 2차 GBM이라고 불리며 젊은 환자(평균 45세 대 62세)[25]에게 더 흔하다.종양은 뇌수막 또는 심실벽으로 확장되어 뇌척수액(CSF)에 높은 단백질 함량(> 100mg/dl)을 초래할 수 있으며, 10~100개의 세포(주로 림프구)가 가끔 발생한다.CSF에서 운반되는 악성 세포는 척수로 퍼지거나(희소하게) 뇌수막 교종증을 일으킬 수 있습니다.그러나 중추신경계를 넘어 GBM이 전이되는 것은 극히 드문 일이다.GBM의 약 50%는 반구의 두 개 이상의 엽을 차지하거나 양쪽을 차지합니다.이러한 유형의 종양은 보통 대뇌에서 발생하며 나비(양측) 교종을 [26]생성하면서 뇌량을 가로질러 전형적인 침윤을 보일 수 있습니다.
교아세포종 분류
뇌종양 분류는 전통적으로 헤마톡실린-에오신 절개로 측정되는 거시적 수준의 조직병리학에 기초해 왔다.세계보건기구(WHO[27])는 1979년에 첫 표준 분류를 발표했고 그 이후로는 그렇게 하고 있다.WHO의 2007년 중추신경계[28] 종양 분류는 주로 현미경 검사 특징에 기초한 마지막 분류였다.새로운 2016년 WHO 중추신경계[29] 종양 분류는 패러다임의 변화였다.종양의 일부는 세포 형태학뿐만 아니라 유전자 구성으로도 정의되었다.
교종의 등급은 중요하게 변화하였고 교아종은 현재 주로 IDH-야생형 또는 IDH 돌연변이인 이소시트레이트탈수소효소(IDH) 돌연변이의 상태에 따라 분류되었다.
| IDH야생교아세포종 | IDH변성교아세포종 | |
|---|---|---|
| 동의어 | 원발성 교아세포종 | 이차 교아세포종 |
| 전구 병변 | 식별된 de novo | 확산성 성상세포종 무지아세포종 |
| 교아종 비율 | ~90% | ~10% |
| 진단시 중위연령 | 최대 62년 | 최대 44년 |
| 남성: 여성 비율 | 1.42:1 | 1.05:1 |
| 진단 시 임상 기록의 중앙 길이 | 4개월 | 15개월 |
| 전체 생존 중위수 | ||
| 수술+방사선치료 | 9.9개월 | 24개월 |
| 수술+방사선치료+화학치료 | 15개월 | 31개월 |
| 위치 | 초천장기 | 우선 정면 |
| 네크로시스 | 광범위한 | 제한적 |
| TERT 프로모터 돌연변이 | 72% | 26% |
| TP53 돌연변이 | 27% | 81% |
| ATRX 돌연변이 | 특출한 | 71% |
| EGFR 증폭 | 35% | 특출한 |
| PTEN 돌연변이 | 24% | 특출한 |
분자 변화
유전자 [31]발현을 기반으로 네 가지 아종의 교아종이 확인되었다.
- 클래식:이 아형의 약 97%는 표피성장인자수용체(EGFR) 유전자의 여분의 복제를 가지고 있으며, 대부분은 EGFR의 정상 발현보다 높은 발현을 가지고 있는 반면, 교아종에서 종종 돌연변이가 일어나는 유전자 TP53(p53)은 이 [32]아형에서 거의 변이되지 않는다.염색체 10의 헤테로 접합성 손실은 염색체 7 [33]증폭과 함께 고전적인 아형에서도 자주 나타난다.
- 엎드린 자세의 아형은 TP53(p53)과 PDGFRA에서는 a형 혈소판 유래 성장인자 수용체를 코드하는 유전자, IDH1에서는 이소시트레이트탈수소효소-1을 코드하는 유전자의 변화율이 높은 경우가 많다.
- 간엽성 아형은 NF1의 높은 돌연변이율 또는 다른 변화,[34] 신경섬유소 1을 코드하는 유전자는 EGFR 유전자의 변화가 적고 EGFR의 발현도 다른 유형보다 적은 것이 특징이다.
- 신경 아형은 NEFL, GABRA1, SYT1, SLC12A5와 같은 뉴런 마커의 발현으로 특징지어졌으며, 병리학적 [31][33]평가에서 종종 정상 세포로 나타났다.
교아세포종에서 많은 다른 유전자 변화가 설명되었으며, 그 대부분은 RB와 PI3K/AKT의 [35]두 가지 경로로 군집화된다.교아세포종은 이러한 경로의 각각 [6]68~78%와 88%에서 변화를 보인다.
또 다른 중요한 변화는 "자살" DNA 복구 효소인 MGMT의 메틸화이다.메틸화는 MGMT 유전자의 DNA 전사와 발현을 저해한다.MGMT 효소는 자살 복구 메커니즘으로 인해 하나의 DNA 알킬화만 복구할 수 있기 때문에 저장 용량이 낮고 MGMT 유전자 프로모터의 메틸화는 DNA 복구 [36][37]능력에 큰 영향을 미친다.MGMT 메틸화는 테모졸로미드와 [38]같은 DNA 손상 화학요법에 의한 치료에 대한 개선된 반응과 관련이 있다.
암줄기세포
전구 세포(교아세포종 암 줄기세포)와 유사한 성질을 가진 교아세포종 세포가 교아세포종에서 발견되었다.교모세포종의 확산성과 결합하면 수술로 완전히 제거하는 것이 어려우며, 따라서 기존의 치료에 대한 저항성과 높은 재발률의 [39]원인이 될 수 있다고 생각된다.교아세포종 암 줄기세포는 표면 수용체 CD133을 [40]발현하는 신경 전구 세포와 어느 정도 유사하다. CD44는 교아세포종 종양 [41]세포의 서브셋에서 암 줄기세포 마커로도 사용될 수 있다.교아세포종 암 줄기세포는 방사선 치료와 화학요법에 대한 내성을 높이는 것으로 보이며, 적어도 부분적으로 DNA 손상 [42]반응의 상향 조절에 의해 매개된다.
대사
IDH1 유전자는 이소질산탈수소효소 1을 암호화하여 교아세포종(1차 GBM: 5%, 2차 GBM > 80%)[37]에서 특이하게 돌연변이된다."온코메타볼라이트" D-2-히드록시글루타르산염의 매우 고농도를 생성하고 야생형 IDH1 효소의 기능을 조절하지 않음으로써 IDH1 야생형 교아세포종 또는 건강한 성세포에 비해 IDH1 돌연변이 교아세포종의 대사에 큰 변화를 일으킨다.무엇보다도, 그것은 글루타민이나 글루타메이트에 대한 교아종 세포의 에너지원에 [43]대한 의존도를 증가시킨다.IDH1 돌연변이 교아세포종은 글루탐산염에 대한 수요가 매우 높은 것으로 생각되며, 이 아미노산과 신경전달물질을 화학적인 신호로 사용한다.건강한 성상세포는 글루탐산염을 배출하기 때문에 IDH1 돌연변이 교아종 세포는 조밀한 종양 구조를 선호하지 않고 글루탐산염 농도가 높은 뇌의 건강한 부분으로 이동, 침입 및 분산된다.이것은 이러한 IDH1 변이 교아세포종의 [44]침습적 행동을 설명할 수 있다.
이온 채널
또한 GBM은 gBK 칼륨 채널 및 ClC-3 염화물 채널의 상향 조절을 포함하여 이온 채널을 인코딩하는 유전자의 수많은 변화를 보인다.이들 이온채널을 업 레귤레이션함으로써 교아종 종양세포는 세포막상에서의 이온이동 증가를 촉진하고, 그 결과 교아종세포가 세포용적을 매우 빠르게 변화시키는 삼투작용을 통해 HO운동을 증가시키도록2 가설화된다.이것은 세포 부피의 빠른 적응이 [45]뇌의 구불구불한 세포 외 매트릭스를 통해 움직임을 촉진할 수 있기 때문에 그들의 극도로 공격적인 행동에 도움이 됩니다.
마이크로RNA
2012년 현재, 보통 마이크로RNA인 RNA 간섭은 조직 배양, 병리 표본 및 교아세포종의 [46]전임상 동물 모델에서 조사되고 있다.또한 실험 관찰 결과 마이크로RNA-451은 배양된 교종[47] 세포에서 LKB1/AMPK 시그널링의 핵심 조절기이며 miRNA 클러스터링은 질병 [48]내 후생유전 경로를 제어한다.
종양 혈관 구조
GBM은 비정상적인 혈관에 의해 특징지어지며 형태학 [49]및 기능이 중단됩니다.혈관 구조의 높은 투과성과 낮은 관류는 종양 내 혈액 흐름을 흐트러지게 하고 저산소증을 증가시켜 면역 [49][50]억제와 같은 과정을 촉진함으로써 암 진행을 촉진시킬 수 있다.
진단.

MRI로 볼 때, 교아종들은 종종 링 강화 병변으로 나타난다.그러나 농양, 전이, 종기성 다발성 경화증 및 기타 실체와 같은 다른 병변도 유사한 [51]외관을 가질 수 있기 때문에 모양은 구체적이지 않다.의심되는 GBM을 CT 또는 MRI에서 최종 진단하려면 종양 절제 및 병리학적 확인을 통해 정위 조직검사 또는 개두술이 필요합니다.종양의 등급은 종양의 가장 악성적인 부분에 기초하기 때문에 조직검사나 소계 종양 절제술은 병변의 과소화를 초래할 수 있습니다.관류 MRI를 사용하여 종양 혈류를 영상화하고 MR 분광법으로 종양 대사물 농도를 측정하면 뇌혈량 증가와 콜린 피크 증가를 각각 보여 일부 사례에서 표준 MRI에 진단 가치를 추가할 수 있지만, 병리학은 진단과 분자 특성화의 황금 표준으로 남아 있습니다.를 클릭합니다.[citation needed]
1차 교아종과 2차 교아종을 구별하는 것은 중요하다.이러한 종양은 자연적으로 발생하거나([6]신생) 낮은 등급의 교종에서 각각 진행되었습니다.원발성 교아종은 예후가 더 나쁘고 종양 생물이 다르며 치료에 대한 반응이 다를 수 있어 환자의 예후와 [36]치료를 결정하는 데 중요한 평가입니다.2차 교아종의 80% 이상이 IDH1에서 돌연변이를 동반하는 반면, 이 돌연변이는 1차 교아종(5~10%)에서 드물다.따라서 IDH1 돌연변이는 조직병리학적으로 매우 유사하고 분자 바이오마커가 없는 구별은 신뢰할 [37]수 없기 때문에 1차 교아종과 2차 교아종을 구별하는 데 유용한 도구이다.
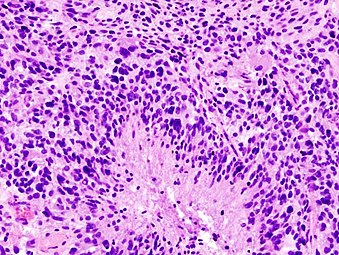
교아세포종의 조직병리학은 현저한 핵다형성의 높은 등급의 성상세포종, 다분열(흰색 화살표에 1개), 다핵세포(검은색 화살표에 1개)의 특징을 나타내며, H&E 염색에 분홍색 섬유질 배경에 무늬가 없는 배열이 있는 세포이다.
예방
교모세포종을 [3]예방할 수 있는 알려진 방법은 없다.다른 형태의 암과는 달리,[52] 대부분의 신경교종은 사전 경고 없이 발생하며 예방할 수 있는 알려진 방법이 없다.
치료
교아종 치료는 여러 가지 복잡한 요인 [53]때문에 어렵습니다.
- 종양 세포는 전통적인 치료법에 내성이 있다.
- 뇌는 전통적인 치료법에 의해 손상을 입기 쉽다.
- 뇌는 스스로 회복하는 능력이 제한되어 있다.
- 많은 약물이 종양에 작용하기 위해 혈액-뇌 장벽을 넘을 수 없다.
원발성 뇌종양의 치료는 완화의 치료(증상적)와 생존을 개선하기 위한 치료로 구성된다.
증상 요법
지원적 치료는 증상을 완화하고 환자의 신경학적 기능을 개선하는 데 초점을 맞추고 있다.주요 지지제는 항경련제와 코르티코스테로이드이다.
- 과거에 교아종 환자의 약 90%가 항경련제 치료를 받았으나, 약 40%만이 이 치료를 필요로 했다.최근 신경외과 의사들은 항경련제를 예방적으로 투여하지 말 것을 권고하고 있으며, 이 약을 [54]처방하기 전에 발작이 일어날 때까지 기다려야 한다.방사선과 동시에 페니트인을 투여받는 사람들은 다형 홍반이나 스티븐스 같은 심각한 피부 반응을 보일 수 있다.존슨 증후군
- 보통 덱사메타손인 코르티코스테로이드는 (혈액-뇌 장벽의 재배치를 통해) 구강 주변 부종을 감소시키고, 질량 효과를 감소시키고 두개 내 압력을 낮추며, 두통이나 졸음을 감소시킨다.
수술.
수술은 교모세포종의 첫 번째 치료 단계이다.평균 GBM 종양은 10개의 세포를 포함하며11, 수술 후 평균 10개의 세포로9 감소한다(99% 감소).수술의 이점은 병리학적 진단을 위한 절제, 질량 효과와 관련된 증상 완화, 방사선 치료와 화학 치료에 대한 2차 저항이 [citation needed]발생하기 전에 잠재적으로 질병을 제거하는 것을 포함한다.
종양 제거의 정도가 클수록 좋다.소급 분석에서 98% 이상의 종양을 제거하는 것은 98% 미만의 종양을 [55]제거하는 것보다 훨씬 더 긴 건강 시간과 관련이 있다.수술이 5-아미노레불린산으로 [56]알려진 형광 염료에 의해 유도된다면 종양의 거의 완전한 초기 제거 가능성은 증가할 수 있습니다.GBM 세포는 진단 시 뇌를 통해 광범위하게 침투하며, 모든 명백한 종양의 "완전 절제"에도 불구하고, GBM을 가진 대부분의 사람들은 나중에 원래 부위 근처나 뇌 내의 더 먼 곳에서 재발하는 종양이 발생한다.다른 양상, 전형적으로 방사선 및 화학요법은 재발하는 질병을 [citation needed]억제하고 늦추기 위해 수술 후에 사용된다.
방사선 치료
수술 후 방사선 치료는 교아종 환자의 주요 치료가 된다.일반적으로 테모졸로마이드를 [8]투여하는 것과 함께 실시됩니다.1970년대 초 실시된 중요한 임상시험에 따르면 방사선 치료나 비방사선 치료로 무작위 추출된 303GBM 환자 중 방사선을 투여받은 환자는 그렇지 [57]않은 환자보다 2배 이상 높은 중위 생존율을 보였다.후속 임상 연구는 수술의 등뼈에 이어 방사선을 이용하려고 시도했다.평균적으로 수술 후 방사선 치료는 종양의 크기를 10개의 세포로7 줄일 수 있다.전뇌 방사선 치료는 보다 정밀하고 표적화된 3차원 입체 방사선 [58]치료와 비교했을 때 개선되지 않는다.총 방사선량은 60-65 Gy로 [59]치료에 최적인 것으로 밝혀졌다.
GBM 종양은 방사선 치료에 강한 저산소증을 보이는 조직의 영역을 포함하는 것으로 잘 알려져 있다.화학요법 방사선감작제에 대한 다양한 접근법이 추구되어 왔지만 2016년 현재[update] 성공에는 한계가 있다.2010년 현재[update], 새로운 연구 접근법에는 방사선 [60]감작제로서 트랜스 나트륨 크로세틴산염과 같은 산소 확산 강화 화합물의 사용에 대한 임상 전 조사가 포함되었고, 2015년 현재[update] 임상 시험이 [61]진행 중이다.붕소 중성자 포획 요법은 교아세포종의 대체 치료법으로 테스트되었지만 일반적으로 사용되지 않는다.
화학 요법
대부분의 연구들은 화학요법의 추가에 아무런 이점이 없다는 것을 보여준다.그러나 표준 방사선 대 방사선 + 테모졸로마이드 화학요법에 무작위 추출된 참가자 575명을 대상으로 한 대규모 임상시험에서는 테모졸로마이드를 투여받은 그룹이 방사선만 [8][62]받은 그룹이 12.1개월이었던 것과 달리 14.6개월의 중위수에서 생존한 것으로 나타났다.이 치료법은 현재 [63][64]임상시험에 등록되지 않은 대부분의 교아종 환자들에게 표준적이다.테모졸로마이드는 종양세포를 방사선에 민감하게 함으로써 작용하는 것으로 보이며, MGMT 프로모터 메틸화에 [65]의한 종양에 더 효과적인 것으로 보인다.높은 등급의 교종에서 테모졸로마이드를 다량 투여하면 낮은 독성이 발생하지만 결과는 표준 [66]용량에 필적한다.베바시주맙과 같은 약물에 의한 항혈관신생요법은 증상을 조절하지만 교모세포종이 [67]있는 사람들의 전반적인 생존에는 영향을 미치지 않는 것으로 보인다.2019년 현재 항혈관신생 치료제의 전반적인 이점은 [67]불분명하다.새로 진단된 교아종 중 적당한 체격의 노인에서, 동시 및 보조 화학 방사선 치료는 최상의 생존을 제공하지만 방사선 치료만 [68]받는 것보다 혈액학적 부작용의 위험이 더 크다.
칸나비노이드류
카나비노이드(cannabinoids)의 효능은 종양학(테트라히드로카나비놀(THC) 또는 합성아날로그나빌론 캡슐을 통해)에서 알려져 있으며, 다른 한편으로 화학요법에 의해 유발되는 메스꺼움과 구토를 억제하고 식욕을 자극하고 번뇌감이나 실제 [69][70]통증을 감소시킨다.마우스 모델에서 악성 신경교종에서 성장과 혈관신생을 억제하는 그들의 능력이 [71][72]입증되었다.교아세포종이 재발한 말기 환자에 대한 THC 사용에 대한 시험 연구 결과는 더 [73]연구할 가치가 있는 것으로 보였다.미래 연구의 잠재적 방법은 카나비노이드가 마우스 모델에서 교아세포종의 종양 줄기세포를 공격할 수 있다는 발견에 달려 있으며, 그 결과 한편으로는 더 성숙하고, 더 치료 가능한 세포로 분화를 유도하고, 다른 한편으로는 종양 발생을 [74]억제할 수 있다.
기타 절차
대체 전기장 치료법은 새로[75] 진단되고 재발하는 [76]교아세포종에 대한 FDA의 승인을 받은 치료법이다.2015년에 새로 당뇨 진단을 받교아 종에서 교류 전계 요법 플러스 temozolomide의phase-III 때 반드시 무작위 대조 임상 실험에서 초기 결과와 전반적인 생존으로써 5개월 연속 개선 가장 큰 트라이를 나타내는 alone,[77][78]치료 temozolomide에 비해progression-free 생존에 3개월간의 개선 보도했다.에서 알이 [78]환경에서 생존율 향상을 보여주는 10년입니다.이러한 결과에도 불구하고, 이 접근법의 효율성은 [79]의학 전문가들 사이에서 여전히 논란이 되고 있다.그러나 대체 전계요법이 항암 효과를 발휘하는 기계적 기초와 진행 중인 두개외암의 3상 임상시험의 결과에 대한 이해를 증가시키면 [80]향후 교아세포종 치료를 위한 임상 수용 증가를 촉진할 수 있다.
텔아비브 대학의 연구는 P-셀렉틴 단백질의 약리학적, 분자적 억제가 교아세포종의 생쥐 모델에서 종양 성장을 감소시키고 생존을 증가시키는 것으로 나타났다.이 연구 결과는 crizanlizumab과 [81]같이 이 단백질을 억제하는 약으로 가능한 치료법을 제공할 수 있을 것이다.
예후
진단 후 가장 흔한 생존기간은 10~13개월이며, [2][5]5년 이상 생존하는 사람은 1~3% 미만이다.미국에서는 2012년부터 2016년까지 5년간 생존율이 6.[5]8%였다.치료를 받지 않으면 생존 기간은 [12]보통 3개월입니다.완치는 극히 드물지만 [82]보고된 바 있다.
연령(60세 이상)이 증가하면 예측 위험이 더 높아집니다.사망은 일반적으로 뇌부종에 의한 광범위한 종양 침윤과 두개내 [83]압력 상승에 기인한다.
양호한 초기 카르노프스키 성능 점수(KPS)와 MGMT 메틸화는 더 긴 [83]생존과 관련이 있습니다.MGMT 유전자의 프로모터가 메틸화되었는지 여부를 판정하기 위해 교아세포종에 대해 DNA 검사를 실시할 수 있다.메틸화 MGMT 프로모터를 가진 환자는 부분적으로 테모졸로마이드에 [84]대한 민감도가 증가하기 때문에 비메틸화 MGMT 프로모터를 가진 환자보다 생존 시간이 길다.교아종 환자의 또 다른 양성 예후 지표는 IDH1 [6]유전자의 돌연변이로, 이는 DNA 기반의 방법 또는 가장 일반적인 돌연변이에 대한 항체, 즉 IDH1-R132H를 [85]사용하여 면역조직화학에 의해 시험될 수 있다.
IDH1의 돌연변이 상태와 MGMT의 메틸화 상태를 2-유전자 예측기로 결합함으로써 더 많은 예후력을 얻을 수 있다.IDH1 돌연변이와 MGMT 메틸화를 모두 가진 환자는 생존시간이 가장 길고, IDH1 돌연변이 또는 MGMT 메틸화를 가진 환자는 중간 생존기간이며, 어느 한쪽의 유전적 사건이 없는 환자는 [36]생존시간이 가장 짧다.
수술, 방사선 치료,[83] 테모졸로미드 화학치료를 받는 환자들에게도 장기적인 이점이 있다.그러나 일부 환자들이 교모세포종으로 더 오래 살아남는 이유에 대해서는 많은 것이 알려져 있지 않다.50세 미만의 연령은 GBM의 장기 생존과 관련이 있으며, 테모졸로미드 화학요법 및 더 나은 KPS의 98% 이상의 절제 및 사용도 마찬가지입니다.최근의 연구는 젊은 나이가 훨씬 더 나은 예후와 관련이 있다는 것을 확인시켜주며, 40세 미만의 소수의 환자들이 인구 기반 치료를 달성한다는 것을 보여준다.치유는 사망 위험이 정상인구로 돌아왔을 때 일어나는 것으로 생각되며 GBM에서는 10년 [86]후에 일어나는 것으로 생각됩니다.
UCLA Neuro-oncology는 이 진단을 받은 환자의 실시간 [87]생존 데이터를 게시합니다.
2003년 연구에 따르면 GBM 예후는 KPS, 환자의 나이, [88]치료에 따라 세 개의 하위 그룹으로 나눌 수 있다.
| 재귀 분할 분석 (RPA) 클래스 | 정의. | 과거 중위수 생존 시간 | 과거 1년간의 생존 기간 | 과거 3년간의 서바이벌 | 과거 5년간의 생존 기간 |
|---|---|---|---|---|---|
| III | 연령 50 미만, KPS 90 90 | 17.1개월 | 70% | 20% | 14% |
| IV | 연령 50 미만, KPS 90 미만 | 11.2개월 | 46% | 7% | 4% |
| 연령 50 50, KPS 70 70, 신경학적 기능이 양호한 외과적 제거 | |||||
| V + VI | 연령 50 50, KPS 70 70, 신경기능 불량 외과적 제거 | 7.5개월 | 28% | 1% | 0% |
| 연령 50 50, KPS 70 70, 외과적 제거 없음 | |||||
| 연령 50세 이하, KPS 70세 미만 |
역학
지역별 빈도는 훨씬 [89]높을 수 있지만 [3]인구 10만명당 3명꼴로 발병한다.영국의 빈도는 1995년과 [90]2015년 사이에 두 배로 증가했다.
그것은 뇌수막종 [13]다음으로 흔한 중추신경계 암이다.그것은 [2][3]여자보다 남자에게서 더 흔하게 발생한다.진단 시 평균 연령은 [2][3]64세이지만, 2014년 광범위한 뇌종양 범주는 미국의 [91]20세 미만 인구에서 백혈병 다음으로 많았다.
역사
다형성교아종이라는 용어는 1926년 Percival Bailey와 Harvey Cushing에 의해 도입되었는데, 이는 종양이 아교세포의 원시 전구체(교아세포)[92]와 괴사, 출혈, 낭종(다형성교아종)의 존재로 인한 매우 다양한 외관으로부터 유래한다는 생각에 바탕을 두고 있다.
조사.
유전자 치료
교아종 치료방법으로 유전자 치료가 연구돼 2017년 현재 동물모델과 초기 임상시험은 성공했지만 교아종 3상 임상시험에서 실험한 유전자 치료제는 모두 실패했다.[93][94][95]과학자들은 핵 껍질 나노구조 LPLNP-PPT(긴 지속 발광 나노 입자)를 개발했다.PPT는 폴리에테르이미드, PEG 및 전사의 트랜스활성화제이며, TRAIL은 효과적인 유전자 전달 및 추적을 위한 인간 종양 괴사인자 관련 아포토시스 유도 배위자[96])로 양성 반응이 있다.이것은 암세포, 구체적으로는 교아종(glioblastoma)의 아포토시스를 유도하도록 코드화된 TRAIL 리간드입니다.이 연구는 2017년 임상시험 중이었지만 진단 및 치료 기능을 보여 줄기세포 기반 [97]치료에 대한 임상적 응용에 큰 관심을 불러일으킬 것이다.
온콜릭 비로테라피
용혈성 비로테라피는 임상 전 단계와 임상 단계에서 모두 연구되고 있는 새로운 치료법이다.단순 헤르페스 바이러스, 아데노바이러스, 폴리오바이러스, 그리고 레오바이러스를 포함한 몇몇 바이러스들은 현재 교아세포종 치료를 위한 임상시험의 1단계와 2단계에서 테스트되고 있으며 전반적인 [98]생존을 향상시키는 것으로 나타났다.
비강내 약물 전달
코에서 뇌로 직접 약물을 전달하는 것은 [99][100]뇌에서 더 높은, 그리고 더 효과적인 약물의 농도를 달성하기 위한 수단으로 연구되고 있다.브라질에서 교아세포종 환자를 대상으로 한 임상상 I/II 연구는 천연 화합물 페리릴 알코올을 에어로졸로서 비강 내 전달에 대해 조사했습니다.그 결과는[99][101][102] 고무적이었고, 2016년 현재 미국에서 [103]유사한 재판이 시작되었다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g h Young RM, Jamshidi A, Davis G, Sherman JH (June 2015). "Current trends in the surgical management and treatment of adult glioblastoma". Annals of Translational Medicine. 3 (9): 121. doi:10.3978/j.issn.2305-5839.2015.05.10. PMC 4481356. PMID 26207249.
- ^ a b c d e f g h i j k l m "Chapter 5.16". World Cancer Report 2014. World Health Organization. 2014. ISBN 978-9283204299.
- ^ a b c d e f g h i j k l m n o p q Gallego O (August 2015). "Nonsurgical treatment of recurrent glioblastoma". Current Oncology. 22 (4): e273–81. doi:10.3747/co.22.2436. PMC 4530825. PMID 26300678.
- ^ a b Hart MG, Garside R, Rogers G, Stein K, Grant R (April 2013). "Temozolomide for high grade glioma". The Cochrane Database of Systematic Reviews. 4 (4): CD007415. doi:10.1002/14651858.CD007415.pub2. PMC 6457743. PMID 23633341.
- ^ a b c d Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, Barnholtz-Sloan JS (November 2019). "CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2012-2016". Neuro-Oncology. 21 (Supplement 5): v1–v100. doi:10.1093/neuonc/noz150. PMC 6823730. PMID 31675094.
- ^ a b c d e Bleeker FE, Molenaar RJ, Leenstra S (May 2012). "Recent advances in the molecular understanding of glioblastoma". Journal of Neuro-Oncology. 108 (1): 11–27. doi:10.1007/s11060-011-0793-0. PMC 3337398. PMID 22270850.
- ^ "Chapter 3.8". World Cancer Report 2014. World Health Organization. 2014. ISBN 978-9283204299.
- ^ a b c Khosla D (February 2016). "Concurrent therapy to enhance radiotherapeutic outcomes in glioblastoma". Annals of Translational Medicine. 4 (3): 54. doi:10.3978/j.issn.2305-5839.2016.01.25. PMC 4740000. PMID 26904576.
- ^ Van Meir EG, Hadjipanayis CG, Norden AD, Shu HK, Wen PY, Olson JJ (2010). "Exciting new advances in neuro-oncology: the avenue to a cure for malignant glioma". CA: A Cancer Journal for Clinicians. 60 (3): 166–93. doi:10.3322/caac.20069. PMC 2888474. PMID 20445000.
- ^ McKenney, Anna Sophia; Weg, Emily; Bale, Tejus A.; Wild, Aaron T.; Um, Hyemin; Fox, Michael J.; Lin, Andrew; Yang, Jonathan T.; Yao, Peter; Birger, Maxwell L.; Tixier, Florent (2022-02-06). "Radiomic analysis to predict histopathologically confirmed pseudoprogression in glioblastoma patients". Advances in Radiation Oncology: 100916. doi:10.1016/j.adro.2022.100916. ISSN 2452-1094. S2CID 246647975.
- ^ Stupp, Roger; Hegi, Monika E.; Mason, Warren P.; Bent, Martin J. van den; Taphoorn, Martin JB; Janzer, Robert C.; Ludwin, Samuel K.; Allgeier, Anouk; Fisher, Barbara; Belanger, Karl; Hau, Peter (2009-05-01). "Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial". The Lancet Oncology. 10 (5): 459–466. doi:10.1016/S1470-2045(09)70025-7. ISSN 1470-2045. PMID 19269895.
- ^ a b Schapira AH (2007). Neurology and clinical neuroscience. Philadelphia: Mosby Elsevier. p. 1336. ISBN 978-0323070539. Archived from the original on 2017-07-29.
- ^ a b McNeill KA (November 2016). "Epidemiology of Brain Tumors". Neurologic Clinics. 34 (4): 981–98. doi:10.1016/j.ncl.2016.06.014. PMID 27720005.
- ^ a b c d e Alifieris C, Trafalis DT (August 2015). "Glioblastoma multiforme: Pathogenesis and treatment". Pharmacology & Therapeutics. 152: 63–82. doi:10.1016/j.pharmthera.2015.05.005. PMID 25944528.
- ^ Ohgaki H, Kleihues P (June 2005). "Population-based studies on incidence, survival rates, and genetic alterations in astrocytic and oligodendroglial gliomas". Journal of Neuropathology and Experimental Neurology. 64 (6): 479–89. doi:10.1093/jnen/64.6.479. PMID 15977639.
- ^ Vilchez RA, Kozinetz CA, Arrington AS, Madden CR, Butel JS (June 2003). "Simian virus 40 in human cancers". The American Journal of Medicine. 114 (8): 675–84. doi:10.1016/S0002-9343(03)00087-1. PMID 12798456.
- ^ Crawford JR, Santi MR, Thorarinsdottir HK, Cornelison R, Rushing EJ, Zhang H, et al. (September 2009). "Detection of human herpesvirus-6 variants in pediatric brain tumors: association of viral antigen in low grade gliomas". Journal of Clinical Virology. 46 (1): 37–42. doi:10.1016/j.jcv.2009.05.011. PMC 2749001. PMID 19505845.
- ^ Chi J, Gu B, Zhang C, Peng G, Zhou F, Chen Y, et al. (November 2012). "Human herpesvirus 6 latent infection in patients with glioma". The Journal of Infectious Diseases. 206 (9): 1394–98. doi:10.1093/infdis/jis513. PMID 22962688.
- ^ McFaline-Figueroa JR, Wen PY (February 2017). "The Viral Connection to Glioblastoma". Current Infectious Disease Reports. 19 (2): 5. doi:10.1007/s11908-017-0563-z. PMID 28233187. S2CID 30446699.
- ^ Huncharek M, Kupelnick B, Wheeler L (2003). "Dietary cured meat and the risk of adult glioma: a meta-analysis of nine observational studies". Journal of Environmental Pathology, Toxicology and Oncology. 22 (2): 129–37. doi:10.1615/JEnvPathToxOncol.v22.i2.60. PMID 14533876.
- ^ Kan P, Simonsen SE, Lyon JL, Kestle JR (January 2008). "Cellular phone use and brain tumor: a meta-analysis". Journal of Neuro-Oncology. 86 (1): 71–78. doi:10.1007/s11060-007-9432-1. PMID 17619826. S2CID 23460254.
- ^ Hardell L, Carlberg M, Hansson Mild K (August 2009). "Epidemiological evidence for an association between use of wireless phones and tumor diseases". Pathophysiology. 16 (2–3): 113–22. doi:10.1016/j.pathophys.2009.01.003. PMID 19268551.
- ^ Zong H, Verhaak RG, Canoll P (May 2012). "The cellular origin for malignant glioma and prospects for clinical advancements". Expert Review of Molecular Diagnostics. 12 (4): 383–94. doi:10.1586/erm.12.30. PMC 3368274. PMID 22616703.
- ^ Zong H, Parada LF, Baker SJ (January 2015). "Cell of origin for malignant gliomas and its implication in therapeutic development". Cold Spring Harbor Perspectives in Biology. 7 (5): a020610. doi:10.1101/cshperspect.a020610. PMC 4448618. PMID 25635044.
- ^ Ohgaki H, Kleihues P (December 2009). "Genetic alterations and signaling pathways in the evolution of gliomas". Cancer Science. 100 (12): 2235–41. doi:10.1111/j.1349-7006.2009.01308.x. PMID 19737147. S2CID 16742915.
- ^ Kazi, Aamish; Joshi, Priscilla; Kelkar, Abhimanyu; Mahajan, Mangal; Ghawate, Amit (2013). "MRI evaluation of pathologies affecting the corpus callosum: A pictorial essay". The Indian Journal of Radiology and Imaging. 23 (4): 321–332. doi:10.4103/0971-3026.125604. PMC 3932574. PMID 24604936.
- ^ Zülch KJ (1979). "Histological typing of tumours of the central nervous system". Geneva: World Health Organization. 21. OCLC 567810677.
- ^ Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, Burger PC, Jouvet A, et al. (August 2007). "The 2007 WHO classification of tumours of the central nervous system". Acta Neuropathologica. 114 (2): 97–109. doi:10.1007/s00401-007-0243-4. PMC 1929165. PMID 17618441.
- ^ Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. (June 2016). "The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary". Acta Neuropathologica. 131 (6): 803–20. doi:10.1007/s00401-016-1545-1. PMID 27157931.
- ^ de Vleeschouwer, Steven (ed.). Glioblastoma. Brisbane, Australia. ISBN 978-0-9944381-2-6. OCLC 1017991944.
- ^ a b Verhaak RG, Hoadley KA, Purdom E, Wang V, Qi Y, Wilkerson MD, et al. (January 2010). "Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1". Cancer Cell. 17 (1): 98–110. doi:10.1016/j.ccr.2009.12.020. PMC 2818769. PMID 20129251.
- ^ Hayden EC (January 2010). "Genomics boosts brain-cancer work". Nature. 463 (7279): 278. doi:10.1038/463278a. PMID 20090720.
- ^ a b Sasmita AO, Wong YP, Ling AP (February 2018). "Biomarkers and therapeutic advances in glioblastoma multiforme". Asia-Pacific Journal of Clinical Oncology. 14 (1): 40–51. doi:10.1111/ajco.12756. PMID 28840962.

- ^ Kuehn BM (March 2010). "Genomics illuminates a deadly brain cancer". JAMA. 303 (10): 925–7. doi:10.1001/jama.2010.236. PMID 20215599.
- ^ Bleeker FE, Lamba S, Zanon C, Molenaar RJ, Hulsebos TJ, Troost D, et al. (September 2014). "Mutational profiling of kinases in glioblastoma". BMC Cancer. 14 (1): 718. doi:10.1186/1471-2407-14-718. PMC 4192443. PMID 25256166.
- ^ a b c Molenaar RJ, Verbaan D, Lamba S, Zanon C, Jeuken JW, Boots-Sprenger SH, et al. (September 2014). "The combination of IDH1 mutations and MGMT methylation status predicts survival in glioblastoma better than either IDH1 or MGMT alone". Neuro-Oncology. 16 (9): 1263–73. doi:10.1093/neuonc/nou005. PMC 4136888. PMID 24510240.
- ^ a b c Molenaar RJ, Radivoyevitch T, Maciejewski JP, van Noorden CJ, Bleeker FE (December 2014). "The driver and passenger effects of isocitrate dehydrogenase 1 and 2 mutations in oncogenesis and survival prolongation". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1846 (2): 326–41. doi:10.1016/j.bbcan.2014.05.004. PMID 24880135.
- ^ Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M, et al. (March 2005). "MGMT gene silencing and benefit from temozolomide in glioblastoma" (PDF). The New England Journal of Medicine. 352 (10): 997–1003. doi:10.1056/NEJMoa043331. PMID 15758010.
- ^ Murat A, Migliavacca E, Gorlia T, Lambiv WL, Shay T, Hamou MF, et al. (June 2008). "Stem cell-related "self-renewal" signature and high epidermal growth factor receptor expression associated with resistance to concomitant chemoradiotherapy in glioblastoma". Journal of Clinical Oncology. 26 (18): 3015–24. doi:10.1200/JCO.2007.15.7164. PMID 18565887.
- ^ Gilbertson RJ, Rich JN (October 2007). "Making a tumour's bed: glioblastoma stem cells and the vascular niche". Nature Reviews. Cancer. 7 (10): 733–6. doi:10.1038/nrc2246. PMID 17882276. S2CID 2634215.
- ^ Brown DV, Stylli SS, Kaye AH, Mantamadiotis T (2019). "Multilayered Heterogeneity of Glioblastoma Stem Cells: Biological and Clinical Significance". Advances in Experimental Medicine and Biology. 1139: 1–21. doi:10.1007/978-3-030-14366-4_1. ISBN 978-3-030-14365-7. PMID 31134492.
- ^ Annovazzi, Laura; Mellai, Marta; Schiffer, Davide (2017-05-26). "Chemotherapeutic Drugs: DNA Damage and Repair in Glioblastoma". Cancers. 9 (6): 57. doi:10.3390/cancers9060057. ISSN 2072-6694. PMC 5483876. PMID 28587121.
- ^ van Lith SA, Navis AC, Verrijp K, Niclou SP, Bjerkvig R, Wesseling P, et al. (August 2014). "Glutamate as chemotactic fuel for diffuse glioma cells: are they glutamate suckers?". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1846 (1): 66–74. doi:10.1016/j.bbcan.2014.04.004. PMID 24747768.
- ^ van Lith SA, Molenaar R, van Noorden CJ, Leenders WP (December 2014). "Tumor cells in search for glutamate: an alternative explanation for increased invasiveness of IDH1 mutant gliomas". Neuro-Oncology. 16 (12): 1669–70. doi:10.1093/neuonc/nou152. PMC 4232089. PMID 25074540.
- ^ Molenaar RJ (2011). "Ion channels in glioblastoma". ISRN Neurology. 2011: 590249. doi:10.5402/2011/590249. PMC 3263536. PMID 22389824.
- ^ Møller HG, Rasmussen AP, Andersen HH, Johnsen KB, Henriksen M, Duroux M (February 2013). "A systematic review of microRNA in glioblastoma multiforme: micro-modulators in the mesenchymal mode of migration and invasion". Molecular Neurobiology. 47 (1): 131–44. doi:10.1007/s12035-012-8349-7. PMC 3538124. PMID 23054677.
- ^ Godlewski J, Nowicki MO, Bronisz A, Nuovo G, Palatini J, De Lay M, et al. (March 2010). "MicroRNA-451 regulates LKB1/AMPK signaling and allows adaptation to metabolic stress in glioma cells". Molecular Cell. 37 (5): 620–32. doi:10.1016/j.molcel.2010.02.018. PMC 3125113. PMID 20227367.
- ^ Bhaskaran V, Nowicki MO, Idriss M, Jimenez MA, Lugli G, Hayes JL, et al. (January 2019). "The functional synergism of microRNA clustering provides therapeutically relevant epigenetic interference in glioblastoma". Nature Communications. 10 (1): 442. Bibcode:2019NatCo..10..442B. doi:10.1038/s41467-019-08390-z. PMC 6347618. PMID 30683859.
- ^ a b Dimberg A (December 2014). "The glioblastoma vasculature as a target for cancer therapy". Biochemical Society Transactions. 42 (6): 1647–52. doi:10.1042/BST20140278. PMID 25399584.
- ^ Jain RK (June 2013). "Normalizing tumor microenvironment to treat cancer: bench to bedside to biomarkers". Journal of Clinical Oncology. 31 (17): 2205–18. doi:10.1200/JCO.2012.46.3653. PMC 3731977. PMID 23669226.
- ^ Smirniotopoulos JG, Murphy FM, Rushing EJ, Rees JH, Schroeder JW (2007). "Patterns of contrast enhancement in the brain and meninges". Radiographics. 27 (2): 525–51. doi:10.1148/rg.272065155. PMID 17374867.
- ^ "Gliomas Prevention". The James Cancer Hospital. Ohio State University. Retrieved October 9, 2021.
- ^ Lawson HC, Sampath P, Bohan E, Park MC, Hussain N, Olivi A, et al. (May 2007). "Interstitial chemotherapy for malignant gliomas: the Johns Hopkins experience". Journal of Neuro-Oncology. 83 (1): 61–70. doi:10.1007/s11060-006-9303-1. PMC 4086528. PMID 17171441.
- ^ Stevens GH (July 2006). "Antiepileptic therapy in patients with central nervous system malignancies". Current Neurology and Neuroscience Reports. 6 (4): 311–18. doi:10.1007/s11910-006-0024-9. PMID 16822352. S2CID 37712742.
- ^ Lacroix M, Abi-Said D, Fourney DR, Gokaslan ZL, Shi W, DeMonte F, et al. (August 2001). "A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival". Journal of Neurosurgery. 95 (2): 190–98. doi:10.3171/jns.2001.95.2.0190. PMID 11780887.
- ^ Stummer W, Pichlmeier U, Meinel T, Wiestler OD, Zanella F, Reulen HJ (May 2006). "Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial". The Lancet. Oncology. 7 (5): 392–401. doi:10.1016/S1470-2045(06)70665-9. PMID 16648043.
- ^ Walker MD, Alexander E, Hunt WE, MacCarty CS, Mahaley MS, Mealey J, et al. (September 1978). "Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial". Journal of Neurosurgery. 49 (3): 333–43. doi:10.3171/jns.1978.49.3.0333. PMID 355604.
- ^ Showalter TN, Andrel J, Andrews DW, Curran WJ, Daskalakis C, Werner-Wasik M (November 2007). "Multifocal glioblastoma multiforme: prognostic factors and patterns of progression". International Journal of Radiation Oncology, Biology, Physics. 69 (3): 820–24. doi:10.1016/j.ijrobp.2007.03.045. PMID 17499453.
- ^ Fulton DS, Urtasun RC, Scott-Brown I, Johnson ES, Mielke B, Curry B, et al. (September 1992). "Increasing radiation dose intensity using hyperfractionation in patients with malignant glioma. Final report of a prospective phase I-II dose response study". Journal of Neuro-Oncology. 14 (1): 63–72. doi:10.1007/BF00170946. PMID 1335044. S2CID 24245934.
- ^ Sheehan JP, Shaffrey ME, Gupta B, Larner J, Rich JN, Park DM (October 2010). "Improving the radiosensitivity of radioresistant and hypoxic glioblastoma". Future Oncology. 6 (10): 1591–601. doi:10.2217/fon.10.123. PMID 21062158.
- ^ 임상시험번호 NCT01465347 - 2016-02-01 "신규진단교아세포종(GBM) 내 병행방사선치료 및 테모졸로마이드의 안전성 및 유효성 연구" (ClinicalTrials.gov )
- ^ Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, et al. (European Organisation for Research Treatment of Cancer Brain Tumor Radiotherapy Groups, National Cancer Institute of Canada Clinical Trials Group) (March 2005). "Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma". The New England Journal of Medicine. 352 (10): 987–96. doi:10.1056/NEJMoa043330. PMID 15758009. S2CID 41340212.
- ^ Mason WP, Mirimanoff RO, Stupp R (2006). Radiotherapy with Concurrent and Adjuvant Temozolomide: A New Standard of Care for Glioblastoma Multiforme. Progress in Neurotherapeutics and Neuropsychopharmacology. Vol. 1. pp. 37–52. doi:10.1017/S1748232105000054. ISBN 978-0-521-86253-0. Archived from the original on 2015-03-17.
- ^ "Temozolomide Plus Radiation Helps Brain Cancer – National Cancer Institute". Archived from the original on August 15, 2007. Retrieved 2007-09-15.
- ^ Chamberlain MC, Glantz MJ, Chalmers L, Van Horn A, Sloan AE (March 2007). "Early necrosis following concurrent Temodar and radiotherapy in patients with glioblastoma". Journal of Neuro-Oncology. 82 (1): 81–83. doi:10.1007/s11060-006-9241-y. PMID 16944309. S2CID 6262668.
- ^ Dall'oglio S, D'Amico A, Pioli F, Gabbani M, Pasini F, Passarin MG, et al. (December 2008). "Dose-intensity temozolomide after concurrent chemoradiotherapy in operated high-grade gliomas". Journal of Neuro-Oncology. 90 (3): 315–19. doi:10.1007/s11060-008-9663-9. PMID 18688571. S2CID 21517366.
- ^ a b Ameratunga M, Pavlakis N, Wheeler H, Grant R, Simes J, Khasraw M (November 2018). "Anti-angiogenic therapy for high-grade glioma". The Cochrane Database of Systematic Reviews. 2018 (11): CD008218. doi:10.1002/14651858.CD008218.pub4. PMC 6516839. PMID 30480778.
The use of anti-angiogenic therapy does not significantly improve overall survival in newly diagnosed people with glioblastoma. Thus, there is insufficient evidence to support the use of anti-angiogenic therapy for people with newly diagnosed glioblastoma at this time.
- ^ Hanna C, Lawrie TA, Rogozińska E, Kernohan A, Jefferies S, Bulbeck H, et al. (March 2020). "Treatment of newly diagnosed glioblastoma in the elderly: a network meta-analysis". The Cochrane Database of Systematic Reviews. 2020 (3): CD013261. doi:10.1002/14651858.cd013261.pub2. PMC 7086476. PMID 32202316.
- ^ Hall W, Christie M, Currow D (January 2005). "Cannabinoids and cancer: causation, remediation, and palliation". The Lancet. Oncology. 6 (1): 35–42. doi:10.1016/S1470-2045(04)01711-5. PMID 15629274.
- ^ Guzmán M (October 2003). "Cannabinoids: potential anticancer agents". Nature Reviews. Cancer. 3 (10): 745–55. doi:10.1038/nrc1188. PMID 14570037. S2CID 7868655.
- ^ Massi P, Vaccani A, Ceruti S, Colombo A, Abbracchio MP, Parolaro D (March 2004). "Antitumor effects of cannabidiol, a nonpsychoactive cannabinoid, on human glioma cell lines". The Journal of Pharmacology and Experimental Therapeutics. 308 (3): 838–45. doi:10.1124/jpet.103.061002. PMID 14617682. S2CID 580653.
- ^ Blázquez C, Casanova ML, Planas A, Gómez Del Pulgar T, Villanueva C, Fernández-Aceñero MJ, et al. (March 2003). "Inhibition of tumor angiogenesis by cannabinoids". FASEB Journal. 17 (3): 529–31. doi:10.1096/fj.02-0795fje. PMID 12514108. S2CID 15656361.
- ^ Guzmán M, Duarte MJ, Blázquez C, Ravina J, Rosa MC, Galve-Roperh I, et al. (July 2006). "A pilot clinical study of Delta9-tetrahydrocannabinol in patients with recurrent glioblastoma multiforme". British Journal of Cancer. 95 (2): 197–203. doi:10.1038/sj.bjc.6603236. PMC 2360617. PMID 16804518.
- ^ Aguado T, Carracedo A, Julien B, Velasco G, Milman G, Mechoulam R, et al. (March 2007). "Cannabinoids induce glioma stem-like cell differentiation and inhibit gliomagenesis". The Journal of Biological Chemistry. 282 (9): 6854–62. doi:10.1074/jbc.M608900200. PMID 17202146.
- ^ "FDA approves expanded indication for medical device to treat a form of brain cancer". Food and Drug Administration. Archived from the original on 23 March 2016. Retrieved 19 March 2016.
- ^ "FDA approval letter – NovoTTF-100A System" (PDF). www.fda.gov. Archived (PDF) from the original on 22 September 2015. Retrieved 26 December 2014.
- ^ Stupp R, Taillibert S, Kanner AA, Kesari S, Steinberg DM, Toms SA, et al. (December 2015). "Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A Randomized Clinical Trial". JAMA. 314 (23): 2535–43. doi:10.1001/jama.2015.16669. PMID 26670971.
- ^ a b Sampson JH (December 2015). "Alternating Electric Fields for the Treatment of Glioblastoma". JAMA. 314 (23): 2511–13. doi:10.1001/jama.2015.16701. PMID 26670969.
- ^ Wick W (March 2016). "TTFields: where does all the skepticism come from?". Neuro-Oncology. 18 (3): 303–05. doi:10.1093/neuonc/now012. PMC 4767251. PMID 26917587.
- ^ Rominiyi, Ola; Vanderlinden, Aurelie; Clenton, Susan Jane; Bridgewater, Caroline; Al-Tamimi, Yahia; Collis, Spencer James (2020-11-04). "Tumour treating fields therapy for glioblastoma: current advances and future directions". British Journal of Cancer. 124 (4): 697–709. doi:10.1038/s41416-020-01136-5. ISSN 1532-1827. PMC 7884384. PMID 33144698.
- ^ Yeini, Eilam; Ofek, Paula; Pozzi, Sabina; Albeck, Nitzan; Ben-Shushan, Dikla; Tiram, Galia; Golan, Sapir; Kleiner, Ron; Sheinin, Ron; Israeli Dangoor, Sahar; Reich-Zeliger, Shlomit (2021-03-26). "P-selectin axis plays a key role in microglia immunophenotype and glioblastoma progression". Nature Communications. 12 (1): 1912. Bibcode:2021NatCo..12.1912Y. doi:10.1038/s41467-021-22186-0. ISSN 2041-1723. PMC 7997963. PMID 33771989.
- ^ Caruso R, Pesce A, Wierzbicki V (2017-02-20). "A very rare case report of long-term survival: A patient operated on in 1994 of glioblastoma multiforme and currently in perfect health". International Journal of Surgery Case Reports. 33: 41–43. doi:10.1016/j.ijscr.2017.02.025. PMC 5338899. PMID 28273605.
- ^ a b c Krex D, Klink B, Hartmann C, von Deimling A, Pietsch T, Simon M, et al. (October 2007). "Long-term survival with glioblastoma multiforme". Brain. 130 (Pt 10): 2596–606. doi:10.1093/brain/awm204. PMID 17785346.
- ^ Martinez R, Schackert G, Yaya-Tur R, Rojas-Marcos I, Herman JG, Esteller M (May 2007). "Frequent hypermethylation of the DNA repair gene MGMT in long-term survivors of glioblastoma multiforme". Journal of Neuro-Oncology. 83 (1): 91–93. doi:10.1007/s11060-006-9292-0. PMID 17164975. S2CID 34370292.
- ^ Preusser M, Wöhrer A, Stary S, Höftberger R, Streubel B, Hainfellner JA (August 2011). "Value and limitations of immunohistochemistry and gene sequencing for detection of the IDH1-R132H mutation in diffuse glioma biopsy specimens". Journal of Neuropathology and Experimental Neurology. 70 (8): 715–23. doi:10.1097/NEN.0b013e31822713f0. PMID 21760534.
- ^ Smoll NR, Schaller K, Gautschi OP (2012). "The cure fraction of glioblastoma multiforme". Neuroepidemiology. 39 (1): 63–69. doi:10.1159/000339319. PMID 22776797.
- ^ Neurooncology.ucla.edu 를 참조해 주세요"University of California, Los Angeles Neuro-Oncology : How Our Patients Perform : Glioblastoma Multiforme [GBM]". Archived from the original on 2012-06-09..2010년 10월 19일에 취득.
- ^ Shaw EG, Seiferheld W, Scott C, Coughlin C, Leibel S, Curran W, Mehta M (2003). "Reexamining the radiation therapy oncology group (RTOG) recursive partitioning analysis (RPA) for glioblastoma multiforme (GBM) patients". International Journal of Radiation Oncology, Biology, Physics. 57 (2): S135–36. doi:10.1016/S0360-3016(03)00843-5.
- ^ Xu H, Chen J, Xu H, Qin Z (2017). "Geographic Variations in the Incidence of Glioblastoma and Prognostic Factors Predictive of Overall Survival in US Adults from 2004–2013". Frontiers in Aging Neuroscience. 9: 352. doi:10.3389/fnagi.2017.00352. PMC 5681990. PMID 29163134.
- ^ Philips A, Henshaw DL, Lamburn G, O'Carroll MJ (2018). "Brain Tumours: Rise in Glioblastoma Multiforme Incidence in England 1995–2015 Suggests an Adverse Environmental or Lifestyle Factor". Journal of Environmental and Public Health. 2018: 7910754. doi:10.1155/2018/7910754. PMC 6035820. PMID 30034480.
- ^ Siegel DA, Li J, Henley SJ, Wilson RJ, Lunsford NB, Tai E, Van Dyne EA (June 2018). "Geographic Variation in Pediatric Cancer Incidence – United States, 2003–2014". MMWR. Morbidity and Mortality Weekly Report. 67 (25): 707–13. doi:10.15585/mmwr.mm6725a2. PMC 6023185. PMID 29953430.
- ^ Bailey & Cushing:Glioma 그룹의 종양.[page needed] 1926년 필라델피아, JB 리핀콧.
- ^ Rajesh Y, Pal I, Banik P, Chakraborty S, Borkar SA, Dey G, et al. (May 2017). "Insights into molecular therapy of glioma: current challenges and next generation blueprint". Acta Pharmacologica Sinica. 38 (5): 591–613. doi:10.1038/aps.2016.167. PMC 5457688. PMID 28317871.
- ^ Tobias A, Ahmed A, Moon KS, Lesniak MS (February 2013). "The art of gene therapy for glioma: a review of the challenging road to the bedside". Journal of Neurology, Neurosurgery, and Psychiatry. 84 (2): 213–22. doi:10.1136/jnnp-2012-302946. PMC 3543505. PMID 22993449.
- ^ Fulci G, Chiocca EA (February 2007). "The status of gene therapy for brain tumors". Expert Opinion on Biological Therapy. 7 (2): 197–208. doi:10.1517/14712598.7.2.197. PMC 2819130. PMID 17250458.
- ^ Mukhtar, Mahwash; Bilal, Muhammad; Rahdar, Abbas; Barani, Mahmood; Arshad, Rabia; Behl, Tapan; Brisc, Ciprian; Banica, Florin; Bungau, Simona (20 November 2020). "Nanomaterials for Diagnosis and Treatment of Brain Cancer: Recent Updates". Chemosensors. MDPI AG. 8 (4): 117. doi:10.3390/chemosensors8040117. ISSN 2227-9040.
- ^ Wu SQ, Yang CX, Yan XP (March 2017). "A Dual-Functional Persistently Luminescent Nanocomposite Enables Engineering of Mesenchymal Stem Cells for Homing and Gene Therapy of Glioblastoma". Advanced Functional Materials. 27 (11): 1604992. doi:10.1002/adfm.201604992. S2CID 99147218.
- ^ Suryawanshi YR, Schulze AJ (2 July 2021). "Oncolytic Viruses for Malignant Glioma: On the Verge of Success?". Viruses. 13 (7): 1294. doi:10.3390/v13071294. PMC 8310195. PMID 34372501.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ a b van Woensel M, Wauthoz N, Rosière R, Amighi K, Mathieu V, Lefranc F, et al. (August 2013). "Formulations for Intranasal Delivery of Pharmacological Agents to Combat Brain Disease: A New Opportunity to Tackle GBM?". Cancers. 5 (3): 1020–48. doi:10.3390/cancers5031020. PMC 3795377. PMID 24202332.
- ^ Pardeshi CV, Belgamwar VS (July 2013). "Direct nose to brain drug delivery via integrated nerve pathways bypassing the blood-brain barrier: an excellent platform for brain targeting". Expert Opinion on Drug Delivery. 10 (7): 957–72. doi:10.1517/17425247.2013.790887. PMID 23586809. S2CID 8020921.
- ^ Peterson A, Bansal A, Hofman F, Chen TC, Zada G (February 2014). "A systematic review of inhaled intranasal therapy for central nervous system neoplasms: an emerging therapeutic option". Journal of Neuro-Oncology. 116 (3): 437–46. doi:10.1007/s11060-013-1346-5. PMID 24398618. S2CID 2414770.
- ^ Chen TC, Fonseca CO, Schönthal AH (2015). "Preclinical development and clinical use of perillyl alcohol for chemoprevention and cancer therapy". American Journal of Cancer Research. 5 (5): 1580–93. PMC 4497427. PMID 26175929.
- ^ 임상시험번호 NCT02704858 '재귀성 Gread IV Glioma의 안전성 및 유효성 연구' (영어)
외부 링크
- 미국 뇌종양학회 교아종 다형성체(GBM)에 관한 정보
- AFIP 코스 요강 – Astrocytoma WHO 채점 강의 자료