신경능
Neural crest| 신경능 | |
|---|---|
 | |
| 식별자 | |
| 메쉬 | D009432 |
| TE | crest_by_E5.0.2.1.0.2 E5.0.2.1.0.2 |
| FMA | 86666 |
| 해부학 용어 | |
신경능 세포는 배아 외배엽 배아층에서 발생하는 척추동물 특유의 일시적인 세포 집단으로, 멜라노사이트, 두개골 연골과 뼈, 평활근, 말초와 장내 신경 세포와 글리아를 [1][2]포함한 다양한 세포 계보를 생성한다.
위배 후 신경판과 비신경외배엽 경계에 신경능세포를 특정한다.신경조절 중에, 신경주름이라고도 알려진 신경판의 경계는 신경관을 [3]형성하기 위해 등쪽 중간선에 모입니다.그 후 신경관의 지붕판으로부터의 신경능 세포는 상피에서 간엽으로의 전이를 거쳐 신경상피에서 박리되어 다양한 세포 [1]타입으로 분화되는 외주를 통과한다.신경능의 출현은 척추동물의 진화에서 중요했다. 왜냐하면 많은 구조적인 유도체들이 척추동물의 [4]분지의 특징을 정의하기 때문이다.
신경능 발달의 기초는 유전자 조절 네트워크이며, 다능성과 이동 [5]능력과 같은 세포 특성을 부여하는 일련의 상호작용 신호, 전사 인자 및 다운스트림 이펙터 유전자로 설명된다.신경능 형성의 분자 메커니즘을 이해하는 것은 인간의 질병이 여러 세포 계통에 기여하기 때문에 인간의 질병에 대한 우리의 지식에 중요하다.신경능 발달의 이상은 전두골 이형성증, 바덴부르크-샤 증후군, 디조지 [1]증후군과 같은 상태를 포함하는 신경크리스토피증을 일으킨다.
따라서, 신경능 발달 메커니즘을 정의하는 것은 척추동물의 진화와 신경교리증에 대한 핵심 통찰력을 드러낼 수 있다.
역사
신경 볏은 신경판과 비신경 외배엽 [1]사이의 기원 때문에 1868년 빌헬름 히스에 의해 병아리 배아에서 "사이의 끈"으로 처음 설명되었습니다.그는 이 조직의 최종 목적지가 신경관의 양쪽 측면이었기 때문에 신경절 볏이라는 이름을 붙였습니다. 이 신경절은 척추신경절로 [6]분화되었습니다.20세기 전반 동안 신경능에 대한 연구의 대부분은 잘 알려진 논문으로 [7]Hörstadius (1950)에 의해 검토된 양서류 배아를 사용하여 이루어졌다.
세포표지 기술은 연구자들이 발달하는 배아를 통해 조직의 이동을 시각화할 수 있게 해주었기 때문에 신경능의 영역을 발전시켰다.1960년대에 웨스턴과 시본은 병아리와 양서류 배아에서 각각 삼중수소 티미딘으로 핵의 방사성 동위원소 표지를 사용했다.단, 라벨이 붙은 셀이 분할될 때마다 신호가 희석되기 때문에 이 방법에는 안정성의 단점이 있습니다.로다민 리시네이트 덱스트란과 바이탈 염료 diI와 같은 현대 세포 라벨링 기술 또한 일시적으로 신경 능선을 [6]표시하기 위해 개발되었다.
1969년 니콜 르 두아랭이 고안한 메추리-치크 표시 시스템은 신경능 세포를 [8][9]추적하는 데 사용되는 또 다른 기구 기술이었다.이식을 통해 생성된 키메라는 한 종의 신경능 세포를 다른 종의 주변 조직과 구별할 수 있게 했다.이 기술을 통해 여러 세대의 과학자들은 신경능 세포의 존재 발생을 확실하게 표시하고 연구할 수 있었다.
인덕션
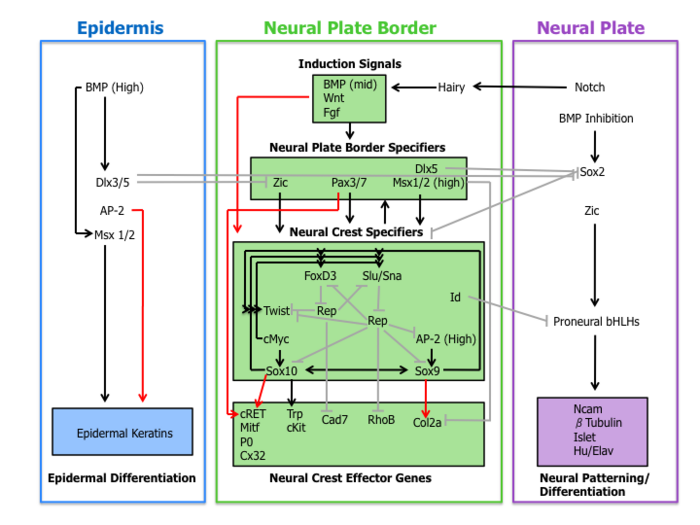
사건의 분자 캐스케이드는 신경 파고세포의 이동 및 다기능 특성을 확립하는 데 관여한다.이 유전자 조절 네트워크는 아래에 설명된 4개의 하위 네트워크로 세분될 수 있습니다.
유도 신호
우선 인접한 표피 및 Wnts, BMPs 및 Fgfs와 같은 기저 중배엽에서 분비되는 세포외 신호 분자는 신경유도 [1][4]중에 신경판으로부터 비신경외배엽(Epidermis)을 분리한다.
Wnt 시그널링은 기능 이득 및 기능 상실 실험을 통해 여러 종의 신경 파고 유도에서 입증되었다.이러한 관찰과 일관되게, 민달팽이의 프로모터 영역(신경 파고 특이 유전자)은 신경 파고 [10]사양에서 Wnt 시그널링의 직접적인 역할을 암시하는 Wnt 의존 표적 유전자의 활성화에 관여하는 전사 인자의 결합 부위를 포함한다.
신경 파고 형성에서 BMP의 현재 역할은 신경판의 유도와 관련이 있습니다.외배엽에서 확산되는 BMP 길항제들은 BMP 활성의 구배를 생성한다.이와 같이 신경정맥 계통은 신경판(저BMP)과 표피(고BMP)[1]의 발달에 필요한 중간 수준의 BMP 시그널링으로부터 형성된다.
근축 중배엽의 Fgf는 신경 파고 유도 신호의 소스로 제안되었습니다.연구진은 외배엽 탐사에서 지배 음성 Fgf 수용체의 발현이 근축 중배엽과 [11]재조합될 때 신경 파고 유도를 차단한다는 것을 증명했다.신경 파고 지정자 식에서 BMP, Wnt 및 Fgf 경로의 역할에 대한 이해는 불완전합니다.
신경판 테두리 지정자
신경판 경계를 확립하는 시그널링 이벤트는 여기서 신경판 경계 지정자로 설명되는 일련의 전사 인자의 발현으로 이어진다.이러한 분자에는 Wnts, BMP 및 Fgfs의 영향을 매개하는 Zic 계수, Pax3/7, Dlx5, Msx1/2가 포함됩니다.이들 유전자는 신경판 경계 영역에서 광범위하게 발현되며 진정한 신경능 [4]표식자의 발현보다 앞선다.
실험 증거는 이러한 전사 인자를 신경 파고 지정자의 업스트림에 배치한다.예를 들어 Xenopus에서는 Msx1은 Slug, Thengle 및 FoxD3의 [12]표현에 필요하고 충분합니다.또한 Pax3는 쥐 배아에서 [13]FoxD3 발현에 필수적이다.
신경 파고 지정자
신경판 경계특정자의 발현에 이어 Slug/Snail, FoxD3, Sox10, Sox9, AP-2 및 c-Myc를 포함한 유전자 집합이 있다.여기서 신경능 특정인자로 지정된 일련의 유전자는 신생 신경능 세포에서 활성화됩니다.적어도 Xenopus에서는 모든 신경 파고 지정자가 다른 모든 지정자의 발현에 필요하거나 충분하여 광범위한 교차 조절의 존재를 [4]증명한다.더욱이, 이 모델 유기체는 전사인자 Gli2가 중요한 [14]역할을 하면서 신경능의 규격에서 헤지호그 신호 경로의 역할을 설명하는 데 중요한 역할을 했다.
신경 파고 지정자의 엄격히 규제된 네트워크 외부에는 두 개의 다른 전사 인자 Twist(트위스트)와 Id(아이디)가 있습니다.bHLH 전사인 트위스트는 인두궁 구조의 [15]간엽 분화를 위해 필요하다.Id는 c-Myc의 직접적인 표적으로 신경능 줄기세포의 [16]유지에 중요한 것으로 알려져 있다.
신경능 이펙터 유전자
마지막으로 신경 파고 지정자는 이펙터 유전자의 발현을 활성화하여 이동 및 다능성과 같은 특정 특성을 부여합니다.Rho GTPases와 cadherins라는 두 개의 신경 파고 이펙터는 세포 형태와 접착 특성을 조절하여 박리 기능을 합니다.Sox9 및 Sox10은 Mitf, P0, Cx32, Trp 및 [4]cKit를 포함한 많은 세포 유형별 이펙터를 활성화하여 신경 파고 분화를 조절합니다.
이행
신경능 세포의 이동은 배측 신경관의 폐쇄로 시작되는 고도로 조정된 일련의 사건들을 포함한다.
델라미네이션
신경주름을 융합해 신경관을 만든 뒤 원래 신경판 테두리에 있던 세포가 신경능 [17]세포가 된다.이동을 시작하기 위해, 신경 파고 세포는 완전 또는 부분 상피-간막 전이(EMT)[18]를 포함하는 박리라고 불리는 과정을 거쳐야 합니다.박리(delamination)는 조직을 다른 집단으로 분리하는 것으로 정의됩니다. 이 경우 신경 파고세포는 주변 [19]조직과 분리됩니다.반대로, EMT는 상피에서 간엽 [18]표현형으로의 변화를 조정하는 일련의 사건이다.예를 들어 병아리 배아의 박리화는 SNAI2, FoxD3 등의 [19]전사인자를 촉진하는 EMT의 발현을 유도하는 BMP/Wnt 캐스케이드에 의해 유발된다.비록 모든 신경 파고세포가 EMT를 거치지만, 박리의 타이밍은 다른 유기체의 다른 단계에서 발생합니다: Xenopus laevis 배아에서는 신경판이 완전히 융합되지 않았을 때 발생하는 대규모 박리가 있는 반면, 병아리 배아에서는 신경 [19]접힘의 융합 중에 발생합니다.
박리 전에 추정신경 파고세포는 옥클루딘 등의 밀착단백질과 NCM 및 N-Cadherin [20]등의 세포접착분자에 의해 처음에는 인접세포에 고정된다.배꼽 발현 BMP는 아연 손가락 단백질 전사인자 달팽이, 민달팽이 및 [17]트위스트의 발현을 유도함으로써 박리를 개시한다.이러한 인자는 접착성을 [17][21]감소시키기 위해 폴리시알산 잔류물과 함께 N-Cadherin의 수식을 촉진할 뿐만 아니라 옥클루딘과 N-Cadherin의 발현을 감소시킴으로써 상피-간막 전이를 유도하는 데 직접적인 역할을 한다.신경 파고세포는 또한 ADAM10과 같은[22] 캐드헤린을 분해할 수 있는 단백질 분해효소를 발현하기 시작하고 신경 파고세포가 [20]빠져나갈 수 있도록 신경관의 기초 층을 분해하는 매트릭스 메탈로프로테아제(MMP)를 분비한다.또한 신경능 세포는 이동 [23]중에 콜라겐, 피브로넥틴, 그리고 라미닌을 포함한 세포외 기질 단백질과 결합하는 인테그린을 발현하기 시작합니다.일단 기저층이 투과성이 되면 신경능 세포는 배아 전체에 걸쳐 이동하기 시작할 수 있다.
이행
신경 파고세포 이동은 요골세포와 같은 신경 골격의 필요 없이 로스트랄에서 미달 방향으로 일어난다.이러한 이유로 파고세포 이동 과정을 "자유 이동"이라고 합니다.전구세포를 비계화하는 대신 신경능 이동은 EpB/EphrinB 및 세마포린/뉴로필린 시그널링을 통한 반발 유도, 세포외 매트릭스와의 상호작용 및 [17]상호접촉 억제의 결과이다.에프린 및 에프 단백질은 쌍방향 시그널링을 받을 수 있는 능력을 가지고 있는 반면, 신경 파고 세포 반발은 신경 파고 세포를 [23]가진 수용체 내에서 반응을 시작하기 위해 주로 전방 시그널링을 사용한다.급증하는 신경능 세포는 각 소마이트의 꼬리 절반에서 발현되는 에프린B 막 통과 배위자를 결합하는 수용체 티로신 키나아제인 EpB를 발현한다.이러한 두 도메인이 상호작용할 때, 그것은 수용체 티로신 인산화, rhoGTPases의 활성화, 그리고 그들을 밀어내도록 유도하는 파고세포 내의 궁극적인 세포골격 재배열을 유발한다.이 현상은 신경능 세포들이 각 소마이트의 [17]로스트랄 부분을 통해 흘러들어갈 수 있게 한다.
세마포린-뉴로필린 거부 시그널링은 EpB 시그널링과 상승 작용하여 생쥐의 소마이트의 로스트랄 절반을 따라 신경 파고세포를 유도한다.병아리 배아에서, 세마포린은 인두 아치를 통해 신경 능선 세포를 유도하기 위해 머리 부분에서 작용합니다.반발성 시그널링 위에 신경 파고세포는 β1 및 α4 인테그린을 발현하여 세포외 기질의 콜라겐, 라미닌 및 피브로넥틴과의 결합 및 유도 상호작용을 가능하게 한다.또한 파고세포는 중배엽 [17]등 다른 기원의 조직에 자유롭게 침입하면서 서로 고유의 접촉 억제를 가진다.소마이트의 반쪽을 통해 이동하는 신경능 세포는 말초 신경계의 감각 및 교감 신경 세포로 분화됩니다.신경능 세포들이 가는 또 다른 주요 경로는 표피와 피부조직 사이의 배측이다.이 경로를 통해 이동하는 세포는 진피의 색소 세포로 분화됩니다.BMP, Wnt, FGF, Hox 및 [20]Notch 등의 형태 유발 단서에 대한 시공간적 종속에 의해 최종 세포형으로의 신경 파고세포 분화 및 특이화가 편향된다.
임상적 의의
신경교정증은 배아발달 [24][25]과정에서의 신경능세포의 비정상적인 사양, 이동, 분화 또는 죽음에서 비롯된다.이 질병 그룹은 많은 신생아들에게 영향을 미치는 광범위한 선천적 기형으로 구성되어 있다.또한 신경능 형성에 영향을 미치는 유전적 결함 및 기형물질의 작용으로 인해 발생한다.
바르덴부르크 증후군
바덴버그 증후군은 신경능 세포 이동의 결함으로 인한 신경크리스톱병증이다.그 질환의 주요 특징으로는 압전증과 선천성 난청이 있다.피에발디즘의 경우, 무색의 피부 영역은 신경능 유래 색소를 생성하는 멜라노사이트가 전혀 [27]없기 때문에 발생한다.바덴부르크 증후군에는 네 가지 다른 유형이 있으며, 각각 뚜렷한 유전적, 생리학적 특징을 가지고 있다.유형 I과 II는 영향을 받은 개인의 가족 구성원이 디스토피아 [28]캔토럼을 가지고 있는지 여부에 따라 구분됩니다.III형은 상지의 이상을 일으킨다.마지막으로, 타입 IV는 또한 바덴부르크-샤 증후군으로 알려져 있으며, 피해를 입은 사람들은 바덴부르크 증후군과 히르슈스프룽 [29]증후군을 모두 보인다.I형 및 III형은 상염색체 우성 [27]유전되는 반면 II형 및 IV형은 상염색체 열성 유전 패턴을 나타낸다.전반적으로, 바덴버그 증후군은 희귀하며, 미국에서 약 2/10만 명의 발병률이 있다.모든 인종과 성별이 똑같이 [27]영향을 받는다.현재 바덴부르크 증후군에 대한 치료법이나 치료법은 없다.
히르슈스프룽병
또한 신경 파고세포의 발달과 이동과 관련된 결함에 관여하는 것은 허쉬스프룽병(HD 또는 HSCR)으로, 장 영역의 신경 지배력 부족을 특징으로 한다.이러한 신경의 부족은 대장의 확대, 장의 폐색, 그리고 심지어 성장 둔화와 같은 추가적인 생리적인 이상을 초래할 수 있다.건강한 발달에서, 신경능 세포는 내장으로 이동하여 장내 신경절을 형성합니다.이들 신경 파고세포의 장으로의 건강한 이동에 관여하는 유전자는 RET, GDNF, GFRα, EDN3, EDNB를 포함한다.RET는 수용체 티로신인산화효소(RTK)로 GDNF 및 GFRα EDN3 및 EDNB와 복합체를 형성한다.생쥐에서 이 신호가 흐트러지면, 무신경절증 또는 이러한 장내 신경절의 결핍이 발생한다.[30]
태아 알코올 스펙트럼 장애
태아 알코올 노출(PAE)은 발달 장애의 [31]가장 일반적인 원인 중 하나입니다.노출의 정도와 결과 이상 심각도에 따라 환자는 태아 알코올 스펙트럼 장애(FASD)라는 광범위한 라벨이 붙은 연속 질환 내에서 진단된다.심한 FASD는 짧은 안검열, 긴 윗입술, 매끄러운 인중을 포함한 특징적인 두개골 안면 이상에 의해 증명된 것처럼 신경 볏 이동을 손상시킬 수 있습니다.그러나 에탄올 결합의 혼합 특성으로 인해 이러한 이상이 발생하는 메커니즘은 여전히 불분명하다.에탄올에 노출된 생체내 발달 중인 제브라피쉬 배아뿐만 아니라 신경능 세포들의 세포 배양 탐사자들은 신경능 세포들의 이동에 의해 이동 세포의 수가 감소하고 이동 거리가 감소했음을 보여준다.이러한 변화 뒤에 있는 메커니즘은 잘 이해되지 않지만, 증거는 PAE가 세포 내 저장소에서 IP3로 매개되는 칼슘의 방출에 의해 야기되는 세포성 칼슘 수치 상승으로 인해 아포토시스를 증가시킬 수 있다는 것을 시사한다.또한 에탄올에 노출된 신경 파고세포의 생존력 감소는 산화적 스트레스 증가에 의해 야기된다는 것이 제안되었다.그럼에도 불구하고, 에탄올이 신경의 꼭대기 발달에 어떻게 영향을 미치는지에 대해서는 많은 발전이 남아 있습니다.예를 들어, 에탄올은 다른 것들보다 특정 신경능 세포에 차등적으로 영향을 미치는 것으로 보인다. 즉, PAE에서 두개골 안면 이상이 일반적인 반면, 신경능에서 유래한 색소 세포는 최소한의 [32]영향을 받는 것으로 보인다.
디조지 증후군
디조지 증후군은 인간 염색체 22의 작은 부분의 결실 또는 전위와 관련이 있다.이러한 결실은 측골 신경 파고세포의 이동 또는 발달을 방해할 수 있다.관찰된 일부 결함은 인두 주머니 시스템과 관련이 있으며, 인두 주머니 시스템은 로스트랄 이동성 파고세포로부터 도움을 받는다.디조지 증후군의 증상에는 선천적인 심장 결함, 안면 결함, 그리고 일부 신경 및 학습 장애가 포함됩니다.또한 22q11 결손 환자는 정신분열증과 조울증 [33]발병률이 더 높은 것으로 보고되었다.
배신 콜린스 증후군
Traving Collins Syndrome(TCS)는 초기 배아 단계에서 1, 2차 인두궁의 발달이 저하되어 궁극적으로 중하부 얼굴의 이상을 초래한다.TCS는 TCOF1 유전자의 미센스 돌연변이에 의해 발생하며, 이는 태생 중에 신경 파고세포가 아포토시스를 겪게 한다.optosis)를 겪게 한다.TCOF1 유전자의 돌연변이는 TCS에서의 역할에서 가장 잘 특징지어지지만, POLR1C 및 POLR1D 유전자의 돌연변이는 [34]TCS의 병인과도 관련이 있다.
셀 라인업
전후 축을 따라 서로 다른 위치에서 유래한 신경능 세포는 다양한 조직으로 발달한다.신경능의 이러한 영역은 두개골 신경능, 몸통 신경능, 미주신경 및 천골 신경능, 심장 신경능 등 4가지 주요 기능 영역으로 나눌 수 있습니다.
뇌신경능
두개골 신경능은 뒤쪽으로 이동하여 다양한 두개골 신경절과 두개골 안면 연골 및 [21]뼈로 구별되는 두개골 안면 간엽을 형성합니다.이 세포들은 인두 주머니와 아치 안으로 들어가 흉선, 중이와 턱의 뼈 그리고 치아 원시의 [35]치핵아세포에 기여합니다.
간선 신경능
간신경능은 두 개의 세포 [36]집단을 생성한다.멜라노사이트가 될 운명의 세포군 중 하나가 복부 중앙선을 향해 외배엽으로 배측으로 이동한다.두 번째 세포군은 각 공막의 앞부분을 통해 복측으로 이동한다.강막 안에 있는 세포는 등근신경절을 형성하는 반면, 복강으로 계속 되는 세포는 교감신경절, 부신수질, 그리고 [35]대동맥을 둘러싼 신경을 형성합니다.
미주신경 및 천골신경능
미주신경 및 천골 신경능 세포는 장신경계의 신경절과 부교감 [35]신경절로 발달합니다.
심신경능
심장 신경능은 일부 인두 아치의 멜라노사이트, 연골, 결합 조직 및 뉴런으로 발달합니다.또, 이 영역은,[35] 대동맥의 근결합 조직이나 폐순환을 대동맥으로부터 분할하는 격막의 일부와 같은 심장 영역을 발생시킨다.새로운 [37]연구에 따르면 심장의 반달 판막은 신경능 세포와 연관되어 있다.
진화
척추동물을 다른 척색체와 구별하는 몇 가지 구조는 신경능세포의 유도체로부터 형성된다.그들의 "새로운 머리" 이론에서, Gans와 Northcut은 신경능의 존재가 감각신경절과 두개골 골격과 같은 척추동물의 특정한 특징의 기초라고 주장한다.게다가, 이러한 특징의 출현은 포식 [38][39]생활을 가능하게 했기 때문에 척추동물의 진화에 중추적이었다.
하지만, 척추동물의 신경능을 고려한다고 해서 그것이 새로 생겨났다는 것을 의미하지는 않는다.대신, 기존 개발 규제 프로그램의 수정을 통해 새로운 구조가 발생하는 경우가 많다.예를 들어, 규제 프로그램은 새로운 상류 규제 기관의 공동 선택이나 새로운 하류 유전자 목표물의 채용에 의해 변경될 수 있으며, 따라서 기존 네트워크를 새로운 [40][41]맥락에서 배치할 수 있다.이 아이디어는 원좌표에서 신경판 경계 지정자의 보존을 보여주는 현장 교배 데이터에 의해 뒷받침되며, 이는 신경 파고 전구체 네트워크의 일부가 화음류의 [5]공통 조상에 존재했음을 시사한다.튜넛과 같은 일부 비거대동물 척색체에서는 척추동물의 신경능 세포와 유사한 세포 계통(멜라노사이트)이 확인되었다.이것은 척추동물과 [42]튜넛의 공통 조상에 기본적인 신경능이 존재했음을 암시한다.
신경 파고 유도체
Ectomesenchyme(또한 mesectoderm으로 알려져):.[43]odontoblasts, 치과 유두, 연골 두개(비낭., 메켈 연골, 공막 이소골, 방형, 관절 연골, 설골과 작은 기둥), 기관과 후두 연골, dermatocranium(뼈 막을 형성하는), 등 지느러미와 거북이 복갑(척추 동물 더 낮은), pericytes고 부드러운 근육 o.f가지 동맥과 정맥, 안근과 매직성 근육 힘줄, 두경부샘(뇌하수체, 침, 눈물, 흉선, 갑상선) 진피 결합조직 및 지방조직, 복부 목과 얼굴
말초신경계:배근신경절의 감각신경세포와 두부신경절(VII와 일부, V, IX, X), 수염의 [44][45]일부 메르켈세포, 자율신경절과 감각신경절의 위성신경절세포, 말초신경절의 슈반세포.
멜라노사이트, 홍채근육 및 색소세포, 심지어 일부 종양(유아기 흑색 신경외배엽종양 등)과 관련이 있다.
「 」를 참조해 주세요.
- 제1궁증후군
- DGCR2: 신경 파고세포 이동을 제어할 수 있습니다.
- 생식층에서 파생된 인간 세포 유형 목록
레퍼런스
- ^ a b c d e f Huang, X.; Saint-Jeannet, J.P. (2004). "Induction of the neural crest and the opportunities of life on the edge". Dev. Biol. 275 (1): 1–11. doi:10.1016/j.ydbio.2004.07.033. PMID 15464568.
- ^ Shakhova, Olga; Sommer, Lukas (2008). "Neural crest-derived stem cells". StemBook. Harvard Stem Cell Institute. doi:10.3824/stembook.1.51.1. PMID 20614636. Retrieved 27 December 2019.
- ^ 브루커, R.J. 2014, 생물학, 맥그로힐, 뉴욕, 뉴욕, 1084 제3판
- ^ a b c d e Meulemans, D.; Bronner-Fraser, M. (2004). "Gene-regulatory interactions in neural crest evolution and development". Dev Cell. 7 (3): 291–9. doi:10.1016/j.devcel.2004.08.007. PMID 15363405.
- ^ a b Sauka-Spengler, T.; Meulemans, D.; Jones, M.; Bronner-Fraser, M. (2007). "Ancient evolutionary origin of the neural crest gene regulatory network". Dev Cell. 13 (3): 405–20. doi:10.1016/j.devcel.2007.08.005. PMID 17765683.
- ^ a b Le Douarin, N.M. (2004). "The avian embryo as a model to study the development of the neural crest: a long and still ongoing story". Mech. Dev. 121 (9): 1089–102. doi:10.1016/j.mod.2004.06.003. PMID 15296974.
- ^ 회르스타디우스, S.(1950년)Neural Correst: 실험연구의 관점에서 본 그것의 특성과 파생상품.옥스포드 대학 출판부, 런던, 111.
- ^ Le Douarin, N.M. (1969). "Particularités du noyau interphasique chez la Caille japonaise (Coturnix coturnix japonica). Utilisation de ces particularités comme "marquage biologique" dans les recherches sur les interactions tissulaires et les migrations cellulaires au cours de l'ontogenèse"". Bull Biol Fr Belg. 103 (3): 435–52. PMID 4191116.
- ^ Le Douarin, N.M. (1973). "A biological cell labeling technique and its use in experimental embryology". Dev Biol. 30 (1): 217–22. doi:10.1016/0012-1606(73)90061-4. PMID 4121410.
- ^ Vallin, J.; et al. (2001). "Cloning and characterization of the three Xenopus slug promoters reveal direct regulation by Lef/beta-catenin signaling". J Biol Chem. 276 (32): 30350–8. doi:10.1074/jbc.M103167200. PMID 11402039.
- ^ Mayor, R.; Guerrero, N.; Martinez, C. (1997). "Role of FGF and noggin in neural crest induction". Dev Biol. 189 (1): 1–12. doi:10.1006/dbio.1997.8634. PMID 9281332.
- ^ Tribulo, C.; et al. (2003). "Regulation of Msx genes by Bmp gradient is essential for neural crest specification". Development. 130 (26): 6441–52. doi:10.1242/dev.00878. PMID 14627721.
- ^ Dottori, M.; Gross, M.K.; Labosky, P.; Goulding, M. (2001). "The winged-helix transcription factor Foxd3 suppresses interneuron differentiation and promotes neural crest cell fate". Development. 128 (21): 4127–4138. doi:10.1242/dev.128.21.4127. PMID 11684651.
- ^ Cerrizuela, Santiago; Vega-López, Guillermo A.; Palacio, María Belén; Tríbulo, Celeste; Aybar, Manuel J. (2018-12-01). "Gli2 is required for the induction and migration of Xenopus laevis neural crest". Mechanisms of Development. 154: 219–239. doi:10.1016/j.mod.2018.07.010. ISSN 0925-4773. PMID 30086335.
- ^ Vincentz, J.W.; et al. (2008). "An absence of Twist1 results in aberrant cardiac neural crest morphogenesis". Dev Biol. 320 (1): 131–9. doi:10.1016/j.ydbio.2008.04.037. PMC 2572997. PMID 18539270.
- ^ Light, W.; et al. (2005). "Xenopus Id3 is required downstream of Myc for the formation of multipotent neural crest progenitor cells". Development. 132 (8): 1831–41. doi:10.1242/dev.01734. PMID 15772131.
- ^ a b c d e f Sanes, Dan (2012). Development of the Nervous System, 3rd ed. Oxford: ELSEVIER INC. pp. 70–72. ISBN 978-0123745392.
- ^ a b Lamouille, Samy (2014). "Molecular mechanisms of epithelial–mesenchymal transition". Nature Reviews Molecular Cell Biology. 15 (3): 178–196. doi:10.1038/nrm3758. PMC 4240281. PMID 24556840.
- ^ a b c Theveneau, Eric (2012). "Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration" (PDF). Developmental Biology. 366 (1): 34–54. doi:10.1016/j.ydbio.2011.12.041. PMID 22261150.
- ^ a b c Kandel, Eric (2013). Principles of Neural Science. New York: The McGraw-Hill Companies, Inc. pp. 1197–1199. ISBN 978-0-07-139011-8.
- ^ a b L.A. 타니힐 (2008년)"고착여부: 신경능 발달에서 캐더린의 역할"셀 Adh Migr. 2, 223–30
- ^ Mayor, Roberto (2013). "The Neural Crest". Development. 140 (11): 2247–2251. doi:10.1242/dev.091751. PMID 23674598.
- ^ a b Sakuka-Spengler, Tatjana (2008). "A gene regulatory network orchestrates neural crest formation". Nature Reviews Molecular Cell Biology. 9 (7): 557–568. doi:10.1038/nrm2428. PMID 18523435. S2CID 10746234.
- ^ Vega-Lopez, Guillermo A.; Cerrizuela, Santiago; Tribulo, Celeste; Aybar, Manuel J. (2018-12-01). "Neurocristopathies: New insights 150 years after the neural crest discovery". Developmental Biology. The Neural Crest: 150 years after His' discovery. 444: S110–S143. doi:10.1016/j.ydbio.2018.05.013. ISSN 0012-1606. PMID 29802835.
- ^ Bolande, Robert P. (1974-07-01). "The neurocristopathies: A unifying concept of disease arising in neural crest maldevelopment". Human Pathology. 5 (4): 409–429. doi:10.1016/S0046-8177(74)80021-3. ISSN 0046-8177.
- ^ Cerrizuela, Santiago; Vega‐Lopez, Guillermo A.; Aybar, Manuel J. (2020-01-11). "The role of teratogens in neural crest development". Birth Defects Research. 112 (8): 584–632. doi:10.1002/bdr2.1644. ISSN 2472-1727. PMID 31926062. S2CID 210151171.
- ^ a b c Mallory, S.B.; Wiener, E; Nordlund, J.J. (1986). "Waardenburg's Syndrome with Hirschprung's Disease: A Neural Crest Defect". Pediatric Dermatology. 3 (2): 119–124. doi:10.1111/j.1525-1470.1986.tb00501.x. PMID 3952027. S2CID 23858201.
- ^ Arias, S (1971). "Genetic heterogeneity in the Waardenburg's syndrome". Birth Defects B. 07 (4): 87–101. PMID 5006208.
- ^ "바덴부르크 증후군"Genetics Home Reference.2012년 10월
- ^ Rogers, J. M. (2016). "Search for the missing lncs: gene regulatory networks in neural crest development and long non-coding RNA biomarkers of Hirschsprung's disease". Neurogastroenterol Motil. 28 (2): 161–166. doi:10.1111/nmo.12776. PMID 26806097. S2CID 12394126.
- ^ Sampson, P. D.; Streissguth, A. P.; Bookstein, F. L.; Little, R. E.; Clarren, S. K.; Dehaene, P.; Graham, J. M. Jr (1997). "The incidence of fetal alcohol syndrome and prevalence of the alcohol-related neurodevelopmental disorder". Teratology. 56 (5): 317–326. doi:10.1002/(SICI)1096-9926(199711)56:5<317::AID-TERA5>3.0.CO;2-U. PMID 9451756.
- ^ Smith, S. M.; Garic, A.; Flentke, G. R.; Berres, M. E. (2014). "Neural crest development in fetal alcohol syndrome". Birth Defects Research Part C: Embryo Today: Reviews. 102 (3): 210–220. doi:10.1002/bdrc.21078. PMC 4827602. PMID 25219761.
- ^ Scambler, Peter J. (2000). "The 22q11 deletion syndromes". Human Molecular Genetics. 9 (16): 2421–2426. doi:10.1093/hmg/9.16.2421. PMID 11005797.
- ^ Ahmed, M.; Ye, X.; Taub, P. (2016). "Review of the Genetic Basis of Jaw Malformations". Journal of Pediatric Genetics. 05 (4): 209–219. doi:10.1055/s-0036-1593505. PMC 5123890. PMID 27895973.
- ^ a b c d Gilbert, Scott F. (2000). "The Neural Crest".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Vega-Lopez, Guillermo A.; Cerrizuela, Santiago; Aybar, Manuel J. (2017). "Trunk neural crest cells: formation, migration and beyond". The International Journal of Developmental Biology. 61 (1–2): 5–15. doi:10.1387/ijdb.160408gv. ISSN 0214-6282. PMID 28287247.
- ^ Takamura, Kazushi; Okishima, Takahiro; Ohdo, Shozo; Hayakawa, Kunio (1990). "Association of cephalic neural crest cells with cardiovascular development, particularly that of the semilunar valves". Anatomy and Embryology. 182 (3): 263–72. doi:10.1007/BF00185519. PMID 2268069. S2CID 32986727.
- ^ Gans, C.; Northcutt, R. G. (1983). "Neural crest and the origin of vertebrates: A new head". Science. 220 (4594): 268–274. Bibcode:1983Sci...220..268G. doi:10.1126/science.220.4594.268. PMID 17732898. S2CID 39290007.
- ^ Northcutt, Glenn (2005). "The new head hypothesis revisited". Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 304B (4): 274–297. doi:10.1002/jez.b.21063. PMID 16003768.
- ^ Sauka-Spengler, T.; Bronner-Fraser, M. (2006). "Development and evolution of the migratory neural crest: a gene regulatory perspective". Curr Opin Genet Dev. 13 (4): 360–6. doi:10.1016/j.gde.2006.06.006. PMID 16793256.
- ^ Donoghue, P.C.; Graham, A.; Kelsh, R.N. (2008). "The origin and evolution of the neural crest". BioEssays. 30 (6): 530–41. doi:10.1002/bies.20767. PMC 2692079. PMID 18478530.
- ^ Abitua, P. B.; Wagner, E.; Navarrete, I. A.; Levine, M. (2012). "Identification of a rudimentary neural crest in a non-vertebrate chordate". Nature. 492 (7427): 104–107. Bibcode:2012Natur.492..104A. doi:10.1038/nature11589. PMC 4257486. PMID 23135395.
- ^ C. 칼하임과 N.M. 르 두아린(1998).Neural Crest (2판)영국 케임브리지 대학 출판부
- ^ Van Keymeulen, A; Mascre, G; Youseff, KK; et al. (October 2009). "Epidermal progenitors give rise to Merkel cells during embryonic development and adult homeostasis". J. Cell Biol. 187 (1): 91–100. doi:10.1083/jcb.200907080. PMC 2762088. PMID 19786578.
- ^ Szeder, V; Grim, M; Halata, Z; Sieber-Blum, M (January 2003). "Neural crest origin of mammalian Merkel cells". Dev. Biol. 253 (2): 258–63. doi:10.1016/s0012-1606(02)00015-5. PMID 12645929.
- ^ Lake, JI; Heuckeroth, RO (1 July 2013). "Enteric nervous system development: migration, differentiation, and disease". American Journal of Physiology. Gastrointestinal and Liver Physiology. 305 (1): G1–24. doi:10.1152/ajpgi.00452.2012. PMC 3725693. PMID 23639815.
외부 링크
- UNSW에서의 발생학 메모/ncrest
- ancil-445 at Neuro Names
- 미시간 대학교 다이어그램
- 병아리 내 Hox 도메인