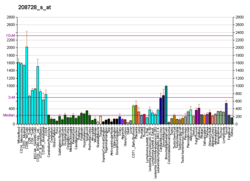
CDC42
CDC42세포분열조절단백질 42호몰로그(Cdc42라고도 함)는 세포주기에 관여하는 단백질이다.원래 S. 세레비시아(yeast)에서 세포분열의 중재자로 확인되었으며, 현재는 효모에서 포유류에 이르는 다양한 유기체의 다양한 신호 이벤트와 세포 과정에 영향을 미치는 것으로 알려져 있다.
함수
Human Cdc42는 Rho 계열의 작은 GTPase로 세포 형태학, 세포 이동, 내포증, 세포 주기 진행 등 다양한 세포 기능을 제어하는 신호 경로를 조절한다.[3]Ro GTPases는 세포-세포 접착과 이동의 기초가 되는 동적 액틴 세포골격계 조립과 재배치의 중심이다.활성화된 Cdc42는 p21 활성화 키나제 PAK1과 PAK2에 순응적 변화를[4] 일으켜 활성화되며, 이는 다시 액틴 재구성을 시작하고 세포 유착, 이동, 침투를 규제한다.[5]
구조
Cdc42는 A와 B 체인을 가진 호모디머다.[6]총 길이는 191개의 아미노산이며 이론적 중량은 21.33 kDa이다.[6]그것의 염기서열 영역에는 뉴클레오사이드 3인산수화효소를 포함하는 P-루프와 작은 GTP 결합 단백질 영역이 포함된다.[6]
Cdc42는 활성 GTP 바인딩 상태와 비활성 GDP 바인딩 상태 사이를 순환한다.이 과정은 무료 GTP를 위한 바운드 GDP의 교환을 촉진하는 구아닌 뉴클레오티드 교환 인자(Guanine nucleotide change factors, GTP 가수분해 활성을 증가시키는 GAPs, 그리고 GTPase로부터의 뉴클레오티드의 분리를 억제하는 GDP discolation 억제제들에 의해 규제된다.[7]
암에서의 역할
최근 cdc42는 암 진행을 적극적으로 돕는 것으로 나타났다.몇몇 연구들이 이것에 대한 기초를 확립했고 기초적인 메커니즘에 대한 가설을 세웠다.
Cdc42는 비소세포 폐암, 대장선암, 흑색종, 유방암, 고환암에서 과다압박된다.[8]단백질의 높아진 수치는 부정적인 환자 생존과 상관관계가 있다.또한 Cdc42는 G1-S 위상 진행과 유사분열 모두에 필요한 것으로 나타났으며, 전사 계수 SRF, STAT3, NFkB를 변조하기도 한다.[8]화학요법과 함께 Cdc42를 목표로 하는 것이 효과적인 암 치료 전략이 될 수 있다는 가설이 제기되어 왔다.
자궁경부암에서 Cdc42의 역할을 연구한 한 연구에서 면역항체화학은 정상 자궁경부조직, 자궁경부내강내신경종양증(CIN)Ⅰ 이하, CINII 이상, 자궁경부암조직 등 3가지 조직에서 Cdc42의 발현을 검출하는 데 사용되었다.[9]Cdc42 표현은 점차적으로 유의미한 차이를 보이며 증가되었고 Hela 세포에서 일반 세포보다 현저하게 높았다.Cdc42로 전염된 Hela 세포의 이동 능력은 비 전염 세포보다 높았다.[9]Cdc42의 과다압박은 Hela 세포에서 filopodia 형성을 촉진할 수 있다고 제안되었다.Cdc42 과다압박은 자궁경부암 세포의 이동 능력을 현저하게 향상시켰는데, 이는 가성형성 개선 때문일 수 있다.[9]
또 다른 연구에서는 Cdc42가 전이에 관여하는 것으로 알려진 접착수용체 β1 integin의 발현을 촉진해 새로운 조직에서 전이 종양을 시작하는 과정을 추진한다는 사실을 밝혀냈다.[10]Cdc42-deficient cells에서 β1 통합의 수준이 감소되었다.β1 통합체는 세포외 매트릭스와의 접착을 위해 중요하며, 내피세포에 대한 초기 부착에도 중요할 수 있다.β1 integrin을 쓰러뜨리면 암세포의 이동을 억제하는 반면, Cdc42 결핍 세포에서 integrin을 과도하게 누르는 것은 내피 침투를 회복시켰다.[10]Cdc42는 SRF라는 전사 계수를 활성화하여 β1 통합 식을 촉진했다.계속적으로 활성화된 형태의 전사 인자도 Cdc42가 부족한 암세포에 내피 삽입을 복원할 수 있었다.
정상암세포와 Cdc42-결손암세포도 생체내 비교됐다.두 종류의 세포가 모두 생쥐 꼬리 정맥에 주입되었을 때 제어 세포는 몇 분 안에 혈관 내피에 더 많이 퍼져 Cdc42가 세포이동을 보조한다는 것을 암시한다.[10]6주 후, 제어 셀은 Cdc42-결핍 세포보다 더 많은 전이를 생성했다.암세포를 침범하면 이웃 내피세포 사이에 도달하는 돌기가 나와 지하막과 접촉한다.암세포는 세포외 기질 위에 퍼져 내피세포가 수축하고 침입자들이 그들 사이에 자신을 삽입할 수 있게 한다.[10]Cdc42가 없는 상태에서 암세포가 지하 막에 퍼지지 못했고, Cdc42-결핍세포는 세포외 매트릭스 코팅 커버립에 접착력이 떨어지는 모습을 보였다.[10]따라서 Cdc42는 내피세포와 내피세포 이동 중 지하막 양쪽에 암세포의 부착을 촉진한다.
작은 분자억제제 AZA197은 KRAS 돌연변이 대장암 치료에서 Cdc42를 억제하는 데 사용되어 왔다.[11]AZA197 치료법에 의한 Cdc42 억제가 PAK1-ERK 신호를 통해 증식 및 친생 신호 경로를 억제하고 대장암 세포의 이동과 침투를 감소시킨다는 증거가 있었다.[11]생쥐의 경우 체내 전신 AZA197 치료는 1차 종양 성장을 감소시키고 생존을 연장시켰다.[11]Rho GTPase Cdc42 신호 경로를 대상으로 하는 치료법은 Cdc42를 과도하게 누르는 만성 대장암 환자, 특히 KRAS-mutant 병을 앓고 있는 환자의 치료에 효과적일 수 있다.
상호작용
CDC42는 다음과 상호 작용하는 것으로 나타났다.
- ARHGAP1,[12][13][14][15]
- ARHGDIA,[16][17]
- BAAP2,[18][19][20]
- BNIP2,[14][21][22]
- BNIPL,[23]
- CDC42EP2,[24][25]
- CDC42EP3,[24][26]
- ERRFI1,[27]
- GDI1,[28]
- IQGAP1,[15][29][30][31][32]
- IQGAP2,[33]
- ITSN1,[34][35]
- MAP3K10,[12]
- MAP3K11,[12][36]
- PAK1,[15][37]
- PAK2,[15][38][39]
- PAK4.[16][39][40]
- PAK7,[40][41]
- PARD6A,[42][43][44]
- PARD6B,[42][43][45]
- 인산염 D1,[46]
- 릭스[47][48][49]
- TRIP10,[50][51]
- WASL,[52][53]
- 비스콧 알드리히 [51][54][55][56]증후군 단백질
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG000070831 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Qadir MI, Parveen A, Ali M (October 2015). "Cdc42: Role in Cancer Management". Chemical Biology & Drug Design. 86 (4): 432–9. doi:10.1111/cbdd.12556. PMID 25777055. S2CID 33006765.
- ^ Bishop AL, Hall A (June 2000). "Rho GTPases and their effector proteins". The Biochemical Journal. 348 (2): 241–255. doi:10.1042/bj3480241. PMC 1221060. PMID 10816416.
- ^ Guo Y, Kenney SR, Muller CY, Adams S, Rutledge T, Romero E, Murray-Krezan C, Prekeris R, Sklar LA, Hudson LG, Wandinger-Ness A (October 2015). "R-Ketorolac Targets Cdc42 and Rac1 and Alters Ovarian Cancer Cell Behaviors Critical for Invasion and Metastasis". Molecular Cancer Therapeutics. 14 (10): 2215–27. doi:10.1158/1535-7163.MCT-15-0419. PMC 4596774. PMID 26206334.
- ^ a b c "PDB 1a4r structure summary". Protein Data Bank in Europe. EMBL-EBI. Retrieved 2016-04-22.
- ^ "CDC42 (cell division cycle 42 (GTP binding protein, 25kDa))". atlasgeneticsoncology.org. Retrieved 2016-04-22.
- ^ a b Stengel K, Zheng Y (September 2011). "Cdc42 in oncogenic transformation, invasion, and tumorigenesis". Cellular Signalling. 23 (9): 1415–23. doi:10.1016/j.cellsig.2011.04.001. PMC 3115433. PMID 21515363.
- ^ a b c Ye H, Zhang Y, Geng L, Li Z (February 2015). "Cdc42 expression in cervical cancer and its effects on cervical tumor invasion and migration". International Journal of Oncology. 46 (2): 757–63. doi:10.3892/ijo.2014.2748. PMID 25394485.
- ^ a b c d e Wilson JM, Menkhaus P, Gustin BW (May 1987). "Volume and outcome of coronary artery bypass graft surgery". JAMA. 257 (18): 2434–5. doi:10.1001/jama.1987.03390180052010. PMID 3494856.
- ^ a b c Zins K, Gunawardhana S, Lucas T, Abraham D, Aharinejad S (2013-01-01). "Targeting Cdc42 with the small molecule drug AZA197 suppresses primary colon cancer growth and prolongs survival in a preclinical mouse xenograft model by downregulation of PAK1 activity". Journal of Translational Medicine. 11: 295. doi:10.1186/1479-5876-11-295. PMC 4222769. PMID 24279335.
- ^ a b c Nagata K, Puls A, Futter C, Aspenstrom P, Schaefer E, Nakata T, Hirokawa N, Hall A (January 1998). "The MAP kinase kinase kinase MLK2 co-localizes with activated JNK along microtubules and associates with kinesin superfamily motor KIF3". The EMBO Journal. 17 (1): 149–58. doi:10.1093/emboj/17.1.149. PMC 1170366. PMID 9427749.
- ^ Li R, Zhang B, Zheng Y (December 1997). "Structural determinants required for the interaction between Rho GTPase and the GTPase-activating domain of p190". The Journal of Biological Chemistry. 272 (52): 32830–5. doi:10.1074/jbc.272.52.32830. PMID 9407060.
- ^ a b Low BC, Lim YP, Lim J, Wong ES, Guy GR (November 1999). "Tyrosine phosphorylation of the Bcl-2-associated protein BNIP-2 by fibroblast growth factor receptor-1 prevents its binding to Cdc42GAP and Cdc42". The Journal of Biological Chemistry. 274 (46): 33123–30. doi:10.1074/jbc.274.46.33123. PMID 10551883.
- ^ a b c d Zhang B, Chernoff J, Zheng Y (April 1998). "Interaction of Rac1 with GTPase-activating proteins and putative effectors. A comparison with Cdc42 and RhoA". The Journal of Biological Chemistry. 273 (15): 8776–82. doi:10.1074/jbc.273.15.8776. PMID 9535855.
- ^ a b Ewing RM, Chu P, Elisma F, Li H, Taylor P, Climie S, McBroom-Cerajewski L, Robinson MD, O'Connor L, Li M, Taylor R, Dharsee M, Ho Y, Heilbut A, Moore L, Zhang S, Ornatsky O, Bukhman YV, Ethier M, Sheng Y, Vasilescu J, Abu-Farha M, Lambert JP, Duewel HS, Stewart II, Kuehl B, Hogue K, Colwill K, Gladwish K, Muskat B, Kinach R, Adams SL, Moran MF, Morin GB, Topaloglou T, Figeys D (2007). "Large-scale mapping of human protein-protein interactions by mass spectrometry". Molecular Systems Biology. 3 (1): 89. doi:10.1038/msb4100134. PMC 1847948. PMID 17353931.
- ^ Gorvel JP, Chang TC, Boretto J, Azuma T, Chavrier P (January 1998). "Differential properties of D4/LyGDI versus RhoGDI: phosphorylation and rho GTPase selectivity". FEBS Letters. 422 (2): 269–73. doi:10.1016/S0014-5793(98)00020-9. PMID 9490022. S2CID 10817327.
- ^ Soltau M, Richter D, Kreienkamp HJ (December 2002). "The insulin receptor substrate IRSp53 links postsynaptic shank1 to the small G-protein cdc42". Molecular and Cellular Neurosciences. 21 (4): 575–83. doi:10.1006/mcne.2002.1201. PMID 12504591. S2CID 572407.
- ^ Krugmann S, Jordens I, Gevaert K, Driessens M, Vandekerckhove J, Hall A (October 2001). "Cdc42 induces filopodia by promoting the formation of an IRSp53:Mena complex". Current Biology. 11 (21): 1645–55. doi:10.1016/S0960-9822(01)00506-1. PMID 11696321. S2CID 11290377.
- ^ Miki H, Yamaguchi H, Suetsugu S, Takenawa T (December 2000). "IRSp53 is an essential intermediate between Rac and WAVE in the regulation of membrane ruffling". Nature. 408 (6813): 732–5. Bibcode:2000Natur.408..732M. doi:10.1038/35047107. PMID 11130076. S2CID 4426046.
- ^ Low BC, Seow KT, Guy GR (May 2000). "Evidence for a novel Cdc42GAP domain at the carboxyl terminus of BNIP-2". The Journal of Biological Chemistry. 275 (19): 14415–22. doi:10.1074/jbc.275.19.14415. PMID 10799524.
- ^ Low BC, Seow KT, Guy GR (December 2000). "The BNIP-2 and Cdc42GAP homology domain of BNIP-2 mediates its homophilic association and heterophilic interaction with Cdc42GAP". The Journal of Biological Chemistry. 275 (48): 37742–51. doi:10.1074/jbc.M004897200. PMID 10954711.
- ^ Qin W, Hu J, Guo M, Xu J, Li J, Yao G, Zhou X, Jiang H, Zhang P, Shen L, Wan D, Gu J (August 2003). "BNIPL-2, a novel homologue of BNIP-2, interacts with Bcl-2 and Cdc42GAP in apoptosis". Biochemical and Biophysical Research Communications. 308 (2): 379–85. doi:10.1016/S0006-291X(03)01387-1. PMID 12901880.
- ^ a b Joberty G, Perlungher RR, Macara IG (October 1999). "The Borgs, a new family of Cdc42 and TC10 GTPase-interacting proteins". Molecular and Cellular Biology. 19 (10): 6585–97. doi:10.1128/MCB.19.10.6585. PMC 84628. PMID 10490598.
- ^ Hirsch DS, Pirone DM, Burbelo PD (January 2001). "A new family of Cdc42 effector proteins, CEPs, function in fibroblast and epithelial cell shape changes". The Journal of Biological Chemistry. 276 (2): 875–83. doi:10.1074/jbc.M007039200. PMID 11035016.
- ^ Alberts AS, Bouquin N, Johnston LH, Treisman R (April 1998). "Analysis of RhoA-binding proteins reveals an interaction domain conserved in heterotrimeric G protein beta subunits and the yeast response regulator protein Skn7". The Journal of Biological Chemistry. 273 (15): 8616–22. doi:10.1074/jbc.273.15.8616. PMID 9535835.
- ^ Makkinje A, Quinn DA, Chen A, Cadilla CL, Force T, Bonventre JV, Kyriakis JM (June 2000). "Gene 33/Mig-6, a transcriptionally inducible adapter protein that binds GTP-Cdc42 and activates SAPK/JNK. A potential marker transcript for chronic pathologic conditions, such as diabetic nephropathy. Possible role in the response to persistent stress". The Journal of Biological Chemistry. 275 (23): 17838–47. doi:10.1074/jbc.M909735199. PMC 3668664. PMID 10749885.
- ^ Gibson RM, Wilson-Delfosse AL (October 2001). "RhoGDI-binding-defective mutant of Cdc42Hs targets to membranes and activates filopodia formation but does not cycle with the cytosol of mammalian cells". The Biochemical Journal. 359 (Pt 2): 285–94. doi:10.1042/0264-6021:3590285. PMC 1222146. PMID 11583574.
- ^ Kuroda S, Fukata M, Kobayashi K, Nakafuku M, Nomura N, Iwamatsu A, Kaibuchi K (September 1996). "Identification of IQGAP as a putative target for the small GTPases, Cdc42 and Rac1". The Journal of Biological Chemistry. 271 (38): 23363–7. doi:10.1074/jbc.271.38.23363. PMID 8798539.
- ^ Fukata M, Watanabe T, Noritake J, Nakagawa M, Yamaga M, Kuroda S, Matsuura Y, Iwamatsu A, Perez F, Kaibuchi K (June 2002). "Rac1 and Cdc42 capture microtubules through IQGAP1 and CLIP-170". Cell. 109 (7): 873–85. doi:10.1016/S0092-8674(02)00800-0. PMID 12110184. S2CID 15158637.
- ^ Hart MJ, Callow MG, Souza B, Polakis P (June 1996). "IQGAP1, a calmodulin-binding protein with a rasGAP-related domain, is a potential effector for cdc42Hs". The EMBO Journal. 15 (12): 2997–3005. doi:10.1002/j.1460-2075.1996.tb00663.x. PMC 450241. PMID 8670801.
- ^ Joyal JL, Annan RS, Ho YD, Huddleston ME, Carr SA, Hart MJ, Sacks DB (June 1997). "Calmodulin modulates the interaction between IQGAP1 and Cdc42. Identification of IQGAP1 by nanoelectrospray tandem mass spectrometry". The Journal of Biological Chemistry. 272 (24): 15419–25. doi:10.1074/jbc.272.24.15419. PMID 9182573.
- ^ Brill S, Li S, Lyman CW, Church DM, Wasmuth JJ, Weissbach L, Bernards A, Snijders AJ (September 1996). "The Ras GTPase-activating-protein-related human protein IQGAP2 harbors a potential actin binding domain and interacts with calmodulin and Rho family GTPases". Molecular and Cellular Biology. 16 (9): 4869–78. doi:10.1128/mcb.16.9.4869. PMC 231489. PMID 8756646.
- ^ Hussain NK, Jenna S, Glogauer M, Quinn CC, Wasiak S, Guipponi M, Antonarakis SE, Kay BK, Stossel TP, Lamarche-Vane N, McPherson PS (October 2001). "Endocytic protein intersectin-l regulates actin assembly via Cdc42 and N-WASP". Nature Cell Biology. 3 (10): 927–32. doi:10.1038/ncb1001-927. PMID 11584276. S2CID 22914248.
- ^ Snyder JT, Worthylake DK, Rossman KL, Betts L, Pruitt WM, Siderovski DP, Der CJ, Sondek J (June 2002). "Structural basis for the selective activation of Rho GTPases by Dbl exchange factors". Nature Structural Biology. 9 (6): 468–75. doi:10.1038/nsb796. PMID 12006984. S2CID 13161854.
- ^ Böck BC, Vacratsis PO, Qamirani E, Gallo KA (May 2000). "Cdc42-induced activation of the mixed-lineage kinase SPRK in vivo. Requirement of the Cdc42/Rac interactive binding motif and changes in phosphorylation". The Journal of Biological Chemistry. 275 (19): 14231–41. doi:10.1074/jbc.275.19.14231. PMID 10799501.
- ^ Seoh ML, Ng CH, Yong J, Lim L, Leung T (March 2003). "ArhGAP15, a novel human RacGAP protein with GTPase binding property". FEBS Letters. 539 (1–3): 131–7. doi:10.1016/S0014-5793(03)00213-8. PMID 12650940.
- ^ Stevens WK, Vranken W, Goudreau N, Xiang H, Xu P, Ni F (May 1999). "Conformation of a Cdc42/Rac interactive binding peptide in complex with Cdc42 and analysis of the binding interface". Biochemistry. 38 (19): 5968–75. doi:10.1021/bi990426u. PMID 10320322.
- ^ a b Abo A, Qu J, Cammarano MS, Dan C, Fritsch A, Baud V, Belisle B, Minden A (November 1998). "PAK4, a novel effector for Cdc42Hs, is implicated in the reorganization of the actin cytoskeleton and in the formation of filopodia". The EMBO Journal. 17 (22): 6527–40. doi:10.1093/emboj/17.22.6527. PMC 1171000. PMID 9822598.
- ^ a b Dan C, Nath N, Liberto M, Minden A (January 2002). "PAK5, a new brain-specific kinase, promotes neurite outgrowth in N1E-115 cells". Molecular and Cellular Biology. 22 (2): 567–77. doi:10.1128/MCB.22.2.567-577.2002. PMC 139731. PMID 11756552.
- ^ Pandey A, Dan I, Kristiansen TZ, Watanabe NM, Voldby J, Kajikawa E, Khosravi-Far R, Blagoev B, Mann M (May 2002). "Cloning and characterization of PAK5, a novel member of mammalian p21-activated kinase-II subfamily that is predominantly expressed in brain". Oncogene. 21 (24): 3939–48. doi:10.1038/sj.onc.1205478. PMID 12032833.
- ^ a b Joberty G, Petersen C, Gao L, Macara IG (August 2000). "The cell-polarity protein Par6 links Par3 and atypical protein kinase C to Cdc42". Nature Cell Biology. 2 (8): 531–9. doi:10.1038/35019573. PMID 10934474. S2CID 27139234.
- ^ a b Noda Y, Takeya R, Ohno S, Naito S, Ito T, Sumimoto H (February 2001). "Human homologues of the Caenorhabditis elegans cell polarity protein PAR6 as an adaptor that links the small GTPases Rac and Cdc42 to atypical protein kinase C". Genes to Cells. 6 (2): 107–19. doi:10.1046/j.1365-2443.2001.00404.x. PMID 11260256.
- ^ Qiu RG, Abo A, Steven Martin G (June 2000). "A human homolog of the C. elegans polarity determinant Par-6 links Rac and Cdc42 to PKCzeta signaling and cell transformation". Current Biology. 10 (12): 697–707. doi:10.1016/S0960-9822(00)00535-2. PMID 10873802. S2CID 14825707.
- ^ Neudauer CL, Joberty G, Macara IG (January 2001). "PIST: a novel PDZ/coiled-coil domain binding partner for the rho-family GTPase TC10". Biochemical and Biophysical Research Communications. 280 (2): 541–7. doi:10.1006/bbrc.2000.4160. PMID 11162552.
- ^ Walker SJ, Wu WJ, Cerione RA, Brown HA (May 2000). "Activation of phospholipase D1 by Cdc42 requires the Rho insert region". The Journal of Biological Chemistry. 275 (21): 15665–8. doi:10.1074/jbc.M000076200. PMID 10747870.
- ^ Nakazawa T, Watabe AM, Tezuka T, Yoshida Y, Yokoyama K, Umemori H, Inoue A, Okabe S, Manabe T, Yamamoto T (July 2003). "p250GAP, a novel brain-enriched GTPase-activating protein for Rho family GTPases, is involved in the N-methyl-d-aspartate receptor signaling". Molecular Biology of the Cell. 14 (7): 2921–34. doi:10.1091/mbc.E02-09-0623. PMC 165687. PMID 12857875.
- ^ Zhao C, Ma H, Bossy-Wetzel E, Lipton SA, Zhang Z, Feng GS (September 2003). "GC-GAP, a Rho family GTPase-activating protein that interacts with signaling adapters Gab1 and Gab2". The Journal of Biological Chemistry. 278 (36): 34641–53. doi:10.1074/jbc.M304594200. PMID 12819203.
- ^ Nakamura T, Komiya M, Sone K, Hirose E, Gotoh N, Morii H, Ohta Y, Mori N (December 2002). "Grit, a GTPase-activating protein for the Rho family, regulates neurite extension through association with the TrkA receptor and N-Shc and CrkL/Crk adapter molecules". Molecular and Cellular Biology. 22 (24): 8721–34. doi:10.1128/MCB.22.24.8721-8734.2002. PMC 139861. PMID 12446789.
- ^ Aspenström P (July 1997). "A Cdc42 target protein with homology to the non-kinase domain of FER has a potential role in regulating the actin cytoskeleton". Current Biology. 7 (7): 479–87. doi:10.1016/S0960-9822(06)00219-3. PMID 9210375. S2CID 14268690.
- ^ a b Tian L, Nelson DL, Stewart DM (March 2000). "Cdc42-interacting protein 4 mediates binding of the Wiskott-Aldrich syndrome protein to microtubules". The Journal of Biological Chemistry. 275 (11): 7854–61. doi:10.1074/jbc.275.11.7854. PMID 10713100.
- ^ Carlier MF, Nioche P, Broutin-L'Hermite I, Boujemaa R, Le Clainche C, Egile C, Garbay C, Ducruix A, Sansonetti P, Pantaloni D (July 2000). "GRB2 links signaling to actin assembly by enhancing interaction of neural Wiskott-Aldrich syndrome protein (N-WASp) with actin-related protein (ARP2/3) complex". The Journal of Biological Chemistry. 275 (29): 21946–52. doi:10.1074/jbc.M000687200. PMID 10781580.
- ^ Miki H, Sasaki T, Takai Y, Takenawa T (January 1998). "Induction of filopodium formation by a WASP-related actin-depolymerizing protein N-WASP". Nature. 391 (6662): 93–6. Bibcode:1998Natur.391...93M. doi:10.1038/34208. PMID 9422512. S2CID 4363890.
- ^ Kim AS, Kakalis LT, Abdul-Manan N, Liu GA, Rosen MK (March 2000). "Autoinhibition and activation mechanisms of the Wiskott-Aldrich syndrome protein". Nature. 404 (6774): 151–8. Bibcode:2000Natur.404..151K. doi:10.1038/35004513. PMID 10724160. S2CID 4416185.
- ^ Kolluri R, Tolias KF, Carpenter CL, Rosen FS, Kirchhausen T (May 1996). "Direct interaction of the Wiskott-Aldrich syndrome protein with the GTPase Cdc42". Proceedings of the National Academy of Sciences of the United States of America. 93 (11): 5615–8. Bibcode:1996PNAS...93.5615K. doi:10.1073/pnas.93.11.5615. PMC 39296. PMID 8643625.
- ^ Symons M, Derry JM, Karlak B, Jiang S, Lemahieu V, Mccormick F, Francke U, Abo A (March 1996). "Wiskott-Aldrich syndrome protein, a novel effector for the GTPase CDC42Hs, is implicated in actin polymerization". Cell. 84 (5): 723–34. doi:10.1016/S0092-8674(00)81050-8. PMID 8625410. S2CID 17838931.
외부 링크
| 위키미디어 커먼즈에는 CDC42와 관련된 미디어가 있다. |
- cdc42+GTP-binding+Protein(미국 국립 의학 라이브러리 의료 과목 제목)
- CDC42 셀 마이그레이션 게이트웨이에 링크가 있는 정보
- UCSC 게놈 브라우저의 인간 CDC42 게놈 위치 및 CDC42 유전자 세부 정보 페이지.