염화나트륨
Sodium chloride
 할라이트 형태의 염화나트륨 결정 | |
 보라색 나트륨, 녹색 염화물[1] 함유 결정구조 | |
| 이름들 | |
|---|---|
| IUPAC이름 염화나트륨 | |
기타이름
| |
| 식별자 | |
3D 모델(JSMO) | |
| 3534976 | |
| ChEBI | |
| 쳄블 | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.028.726 |
| EC 번호 |
|
| 13673 | |
| 케그 | |
| MeSH | 나트륨+염산염 |
펍켐 CID | |
| RTECS 번호 |
|
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| NaCl | |
| 어금니 질량 | 58.443 g/mol[2] |
| 외모 | 무색입방정[2] |
| 냄새 | 무취 |
| 밀도 | 2.17g/cm3[2] |
| 융점 | 800.7°C (1,473.3°F, 1,073.8K)[2] |
| 비등점 | 1,465°C (2,669°F; 1,738K)[2] |
| 360g/L (25°C)[2] | |
| 암모니아에 대한 용해도 | 21.5g/L |
| 메탄올에 대한 용해도 | 14.9g/L |
| -30.2·10cm−63/mol[3] | |
굴절률(nD) | 1.5441 (589 [4]nm에서) |
| 구조[5] | |
| 면심 입방체 (텍스트 참조), cF8 | |
| Fm3m (225번) | |
a = 오후 564.02 | |
공식 단위 (Z) | 4 |
| Na의+ 팔면체 팔면체의 Cl−. | |
| 열화학[6] | |
열용량 (C) | 50.5 J/(K·mol) |
어금니 엔트로피 (S⦵298) | 72.10 J/(K·mol) |
스덴탈피 형성 (δh) | −411.120 kJ/mol |
| 약리학 | |
| A12CA01(WHO) B05CB01(WHO) B05XA03(WHO) S01XA03(WHO) | |
| 유해성 | |
| NFPA 704 (파이어다이아몬드) | |
| 치사량 또는 농도(LD, LC): | |
LD50(중앙선량) | 3 g/kg (구강, 쥐)[7] |
| 관련화합물 | |
기타 음이온 | 플루오르화나트륨 브롬화나트륨 요오드화나트륨 아스타타이드나트륨 |
기타 양이온 | 염화리튬 염화칼륨 염화 루비듐 염화 세슘 염화 프랑슘 |
| 부가자료페이지 | |
| 염화나트륨(자료페이지) | |
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |
일반적으로 소금으로 알려진 염화나트륨/ˌsoədiˈm ɔːklɪraʊd/은 염화나트륨과 염화이온의 1:1 비율을 나타내는 화학식 NaCl의 이온성 화합물입니다.염화나트륨은 바닷물의 염도와 많은 다세포 생물의 세포외액의 가장 큰 원인이 되는 소금입니다.먹을 수 있는 형태로, 소금(테이블 솔트라고도 알려짐)은 보통 조미료와 식품 방부제로 사용됩니다.많은 양의 염화나트륨은 많은 산업 공정에서 사용되며, 추가 화학 합성을 위한 공급 원료로 사용되는 나트륨 및 염소 화합물의 주요 공급원입니다.염화나트륨의 또 다른 주요 적용은 영하의 날씨에 도로를 제빙하는 것입니다.
사용하다
국내에서 익숙한 소금 사용법 외에도 연간 약 2억 5천만 톤 생산(2008년 데이터)의 보다 지배적인 응용 분야로는 화학 물질 및 [9]제빙이 있습니다.
화학 함수
소금은, 직간접적으로,[10] 전세계 생산량의 대부분을 소비하는 많은 화학물질의 생산에 사용됩니다.
클로르알칼리 공업
염소와 수산화나트륨을 생산하는 산업 공정인 클로랄칼리 공정의 시작점입니다.
이 전기 분해는 수은 전지, 격막 전지 또는 막 전지 중 하나에서 수행됩니다.각각의 방법은 수산화나트륨으로부터 염소를 분리하는 다른 방법을 사용합니다.전기 분해의 높은 에너지 소비로 인해 다른 기술들이 개발 중에 있으며, 따라서 효율성의 작은 개선은 큰 경제적 보상을 가져올 수 있습니다.염소에는 PVC 열가소성 플라스틱 제조, 소독제 및 용매 등이 있습니다.
수산화나트륨은 종이, 비누, 알루미늄 등의 생산을 가능하게 하는 다양한 산업 분야에서 광범위하게 사용됩니다.
탄산음료 산업
염화나트륨은 탄산나트륨과 염화칼슘을 만드는 솔베이 공정에 사용됩니다.탄산나트륨은 유리, 중탄산나트륨, 염료뿐만 아니라 수많은 다른 화학물질들을 생산하는 데 사용됩니다.만하임 공정에서 염화나트륨은 황산나트륨과 염산을 생산하는 데 사용됩니다.
표준.
염화나트륨은 ASTM International이 만든 국제 표준 규격을 가지고 있습니다.표준은 ASTM E534-13으로 명명되었으며 염화나트륨의 화학적 분석을 위한 표준 시험 방법입니다.여기에 나열된 방법은 염화나트륨을 분석하여 의도된 용도와 용도에 적합한지 여부를 판단하는 절차를 제공합니다.
기타산업용
염화나트륨은 많이 사용되기 때문에 상대적으로 적은 양으로도 엄청난 양을 소비할 수 있습니다.석유 및 가스 탐사에서 소금은 유정 시추에서 시추 유체의 중요한 성분입니다.이 장치는 높은 다운웰 가스 압력을 극복하기 위해 드릴링 유체의 밀도를 증가시키고 응집시키는 데 사용됩니다.드릴이 염 형성물에 부딪힐 때마다,[9] 염은 염 지층 내에서의 용해를 최소화하기 위해 용액을 포화시키기 위해 드릴링 유체에 첨가됩니다.소금은 또한 콘크리트 시멘트 [10]케이싱의 경화를 증가시키는 데 사용됩니다.
직물과 염색에서 소금은 유기 오염물을 분리하고 염료 침전물의 "염분 제거"를 촉진하고 농축 염료와 혼합하여 표준화하는[clarification needed] 데 사용됩니다.그것의 주요 역할 중 하나는 [10]염료의 음전하 이온의 흡수를 촉진하기 위해 양전하를 제공하는 것입니다.
알루미늄, 베릴륨, 구리, 강철, 바나듐 가공에도 사용됩니다.펄프와 종이 산업에서 소금은 나무 펄프를 표백하는데 사용됩니다.염소산나트륨을 만드는 데도 쓰이는데 황산, 물과 함께 넣어 산소 기반의 우수한 표백 화학물질인 이산화염소를 제조합니다.제1차 세계대전 이후 독일에서 시작된 이산화염소 과정은 염소화된 표백화합물을 줄이거나 없애라는 환경적 압력 때문에 점점 더 대중화되고 있습니다.태닝과 가죽 처리에서, 동물의 가죽에 소금을 첨가하여 가죽 밑면의 미생물 활동을 억제하고 수분을 다시 [10]가죽 안으로 끌어들입니다.
고무 제조에서 소금은 부나, 네오프렌, 그리고 흰색 고무 타입을 만드는데 사용됩니다.염수와 황산은 [10][9]염소화된 부타디엔으로부터 만들어진 유화 라텍스를 응고시키는 데 사용됩니다.
또한 소금은 흙을 확보하고 고속도로가 건설되는 기초에 견고함을 주기 위해 첨가됩니다.소금은 습도와 교통 [10]부하의 변화에 의해 지표면에서 발생하는 이동의 영향을 최소화하는 역할을 합니다.
소금은 역사적으로 음식 보존의 효과적인 방법으로 만들 수 있는 흡습성 때문에 값싸고 안전한 흡습제로 사용되기도 합니다; 소금은 삼투압을 통해 박테리아로부터 물을 끌어내어 음식 부패의 주요 원천인 번식을 막습니다.비록 더 효과적인 건조제가 이용 가능할지라도, 사람들이 섭취하기에 안전한 것은 거의 없습니다.
연수
경수는 비누의 작용을 방해하고 가정 및 산업 장비 및 파이프에 알칼리 광물 퇴적물의 스케일 또는 막의 축적에 기여하는 칼슘 및 마그네슘 이온을 포함합니다.상업용 및 가정용 유연화 장치는 경도의 원인이 되는 이온을 제거하기 위해 이온 교환 수지를 사용합니다.이 수지들은 [10][9]염화나트륨을 사용하여 생성되고 재생됩니다.
로드솔트
소금의 두 번째 주요 용도는 도로의 결빙 및 결빙 방지를 위한 것으로, 두 가지 모두 그릿 통에서 그리고 겨울 서비스 차량에 의해 퍼집니다.강설에 대비하여 도로는 눈과 노면 사이의 결합을 방지하는 소금물(물에 소금을 농축한 용액)로 최적의 "안티 아이스(Anti-ice)" 상태입니다.이 절차는 눈이 내린 후 소금의 과도한 사용을 없앱니다.탈빙을 위해 소금물과 소금의 혼합물이 사용되며, 때때로 염화 칼슘 및/또는 염화 마그네슘과 같은 추가적인 제제가 사용됩니다.소금이나 소금물을 사용하면 -10 °C(14 °F) 이하에서는 효과가 없습니다.

영국의 제빙용 소금은 주로 체셔의 윈스포드에 있는 단일 광산에서 생산됩니다.유통 전에, 그것은 사용 전에 비축되어 있음에도 불구하고 암염이 그리팅 차량 밖으로 자유롭게 흘러나갈 수 있도록 해주는 항산화제로서 페로시아나이드 나트륨 100 ppm과 혼합됩니다.최근 몇 년간 이 첨가제는 식탁용 소금에도 사용되었습니다.총 비용을 줄이기 위해 도로 소금에 다른 첨가제들이 사용되었습니다.예를 들어, 미국에서는 사탕무 가공의 부산물 탄수화물 용액을 암염과 혼합하여 느슨한 암염 단독보다 도로 표면에 약 40% 더 잘 부착했습니다.도로에 더 오래 머물렀기 때문에 치료를 여러 번 반복할 필요가 없어 시간과 [10]비용을 절약할 수 있었습니다.
물리화학의 기술적 측면에서 볼 때, 물-염 혼합물의 최소 어는점은 23.31 wt%의 소금에 대해 -21.12 °C (-6.02 °F)입니다.그러나 이 농도 근처에서 얼리는 것은 매우 느려서 소금의 [11]약 25 중량%로 -22.4°C(-8.3°F)의 공융점에 도달할 수 있습니다.
환경영향
로드솔트는 결국 담수의 몸에 닿게 되고, 수중 식물과 동물들의 삼투조절 [12]능력을 방해함으로써 해를 끼칠 수 있습니다.해안 지역에 소금이 보편적으로 존재하는 것은 어떤 코팅 적용에서도 문제를 일으키는데, 갇힌 소금은 접착력에 큰 문제를 일으키기 때문입니다.해군 당국과 조선사들은 건조 중에 표면의 염분 농도를 관찰합니다.표면의 최대 염분 농도는 해당 권한과 용도에 따라 달라집니다.IMO 규정은 주로 사용되며 염 수준을 염화나트륨으로 측정되는 최대 50mg/m의2 가용성 염으로 설정합니다.이러한 측정은 Bresle 검정을 통해 수행됩니다.염도화(염도 증가, 담수 염도화 증후군) 및 그에 따른 금속 침출 증가는 북미 및 유럽 담수 [13]수로 전반에 걸쳐 진행 중인 문제입니다.
고속도로 제빙 작업에서 염류는 교량 데크, 자동차, 철근 및 전선, 도로 건설에 사용되는 비보호 강철 구조물의 부식과 관련이 있습니다.지표 유출, 차량 분사, 바람에 날린 소금은 토양, 도로변 식생, 지역 지표수 및 지하수 공급에도 영향을 미칩니다.비록 소금이 환경적으로 적재된 증거가 피크 사용 중에 발견되었지만, 봄비와 해빙기는 보통 소금을 [10]바른 지역의 나트륨 농도를 희석시킵니다.2009년 연구에 따르면 미니애폴리스-세인트 폴 메트로 지역에서 적용되고 있는 도로 염분의 약 70%가 지역 [14]유역에 그대로 남아 있는 것으로 나타났습니다.
대체
몇몇 기관들은 로드솔트 [15]대신 맥주, 당밀, 비트 주스를 대체하고 있습니다.항공사들은 [16]제빙을 위해 소금을 사용하는 용액보다 글리콜과 설탕을 더 많이 사용합니다.
식품산업과 농업
많은 미생물들은 염분이 있는 환경에서 살 수 없습니다: 물은 삼투에 의해 세포 밖으로 끌어 올려집니다.이러한 이유로 소금은 베이컨, 생선, 양배추와 같은 음식을 보존하는데 사용됩니다.
소금은 식품 생산자에 의해 또는 소비자에 의해 향미 증진제, 방부제, 결합제, 발효-조절 첨가제, 질감-조절제 및 발색제로서 식품에 첨가됩니다.식품 산업에서 소금 소비는 소비 내림차순으로 다른 식품 가공, 육류 포장, 통조림, 제빵, 유제품, 곡물 밀 제품으로 세분화됩니다.소금은 베이컨, 햄, 그리고 다른 가공육 제품들의 색깔 발달을 촉진시키기 위해 첨가됩니다.방부제로서, 소금은 박테리아의 성장을 억제합니다.소금은 소시지에서 결합제 역할을 하여 고기, 지방, 그리고 수분으로 이루어진 결합 젤을 형성합니다.소금은 향미 증진제와 연화제의 [10]역할도 합니다.
많은 유제품 산업에서, 소금은 색, 발효, 그리고 질감 조절제로서 치즈에 첨가됩니다.유제품 부문에는 크리머리 버터, 연유 및 증발 우유, 냉동 디저트, 아이스크림, 천연 치즈 및 가공 치즈 및 전문 유제품을 제조하는 회사가 포함됩니다.통조림에서 소금은 주로 향미 증진제와 방부제로 첨가됩니다.또한 다른 성분의 담체, 탈수제, 효소 억제제 및 텐더라이저로도 사용됩니다.빵 반죽의 발효 속도를 조절하기 위해 소금이 첨가됩니다.그것은 또한 글루텐(특정 반죽의 탄성 단백질-물 복합체)을 강화하고 구운 제품에 토핑을 하는 것과 같은 향미 증진제로 사용됩니다.식품 가공 카테고리에는 곡물 밀 제품도 포함되어 있습니다.이 제품들은 밀가루와 쌀을 도정하고 시리얼 아침 식품과 혼합 또는 준비된 밀가루를 제조하는 것으로 구성됩니다.소금은 또한 감자칩, 프레첼, 고양이와 개 [10]사료에 양념제로 사용됩니다.
염화나트륨은 발진을 유발하는 물질로서 수의학에서 사용됩니다.이것은 따뜻한 포화 용액으로 주어집니다.배출은 소량의 평염이나 소금 결정의 인두 배치에 의해서도 발생할 수 있습니다.
약
염화나트륨은 정맥 치료를 위한 주요 용액 중 하나로 물과 함께 사용됩니다.비강 스프레이에는 종종 식염수가 들어있습니다.
소방

염화나트륨은 마그네슘, 칼륨, 나트륨, NaK 합금(Class D) 등 가연성 금속 화재에 사용되는 소화기(Met-L-X, Super D)의 주요 소화제입니다.열가소성 분말을 방수제(금속 스테아레이트) 및 제진제(인산염 트리클리슘)와 함께 혼합물에 첨가하여 소화제를 형성합니다.불에 바르면 소금이 방열판처럼 작용해 불의 열을 발산하고 산소를 배제한 지각을 형성해 불을 끄게 됩니다.플라스틱 첨가제는 녹아서 타는 금속이 점화 온도 이하로 냉각될 때까지 크러스트의 무결성을 유지하도록 도와줍니다.이런 종류의 소화기는 1940년대 후반에 카트리지로 작동되는 장치로 발명되었지만, 저장된 압력 버전은 현재 인기가 있습니다.일반적인 크기는 휴대용 30파운드(14kg), 바퀴 달린 350파운드(160kg)[citation needed]입니다.
클렌저
적어도 중세 시대부터 사람들은 소금을 가정 표면에 문지르는 세정제로 사용해 왔습니다.그것은 또한 많은 브랜드의 샴푸, 치약, 그리고 일반적으로 얼음을 제거하는 도로와 얼음 조각에도 사용됩니다.
광용법
결함이 없는 NaCl 결정은 적외선에 대해 약 90%의 광학 투과율을 가지며, 구체적으로는 200 nm에서 20 μm 사이입니다.따라서 이들은 해당 스펙트럼 범위에서 작동하는 광학 부품(윈도우 및 프리즘)에 사용되었으며, 비흡수성 대안이 거의 존재하지 않으며, 미세한 비균질성이 없는 경우에 대한 요구 사항이 가시 범위보다 덜 엄격합니다.NaCl 결정은 가격이 저렴한 반면 부드럽고 흡습성이 좋습니다. 주위 공기에 노출되면 점차 "서리"로 덮입니다.이로 인해 건조한 환경, 진공 밀폐된 조립 구역 또는 프로토타이핑과 같은 단기 용도에 대한 NaCl의 적용이 제한됩니다.요즘은 기계적으로 더 강하고 수분에 덜 민감한 ZnSe(ZnSe)와 같은 물질이 적외선 스펙트럼 범위에 NaCl 대신 사용됩니다.
화학

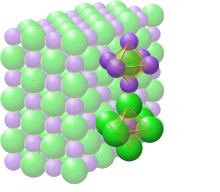
고체염화나트륨
고체 염화나트륨에서 각각의 이온은 정전기적인 지면에서 예상되는 바와 같이 반대되는 전하의 6개의 이온으로 둘러싸여 있습니다.주변 이온은 정팔면체의 꼭지점에 위치합니다.밀착 포장의 언어에서, 더 큰 염화 이온(크기[17] 167 pm)은 입방정렬로 배열되는 반면, 더 작은 나트륨 이온(116[17] pm)은 그들 사이의 모든 입방정렬 간격(팔면체 공극)을 채웁니다.이와 같은 기본 구조는 다른 많은 화합물에서 발견되며, 일반적으로 NaCl 구조 또는 암염 결정 구조로 알려져 있습니다.2원자 기저를 갖는 면심 입방체(fcc) 격자 또는 2개의 상호 침투 면심 입방체 격자로 나타낼 수 있습니다.첫 번째 원자는 각 격자점에 위치하고, 두 번째 원자는 FCC 단위 셀 가장자리를 따라 격자점 사이의 중간에 위치합니다.
고체 염화나트륨은 녹는점이 801°C이고 액체 염화나트륨은 1465°C에서 끓습니다.원자해상도 실시간 영상 촬영으로 [18]염화나트륨 결정핵 생성 초기 단계를 시각화할 수 있습니다.
온도에 따른 염화나트륨의 열전도율은 8K(-265.15°C; -445.27°F)에서 최대 2.03W/(cmK)이며 314K(41°C; 106°F)에서 0.069로 감소합니다.도핑에 [19]따라 감소하기도 합니다.

차가운(sub-freezing) 용액으로부터, 염은 수화수를 하이드로할라이트(이수질 NaCl·2)로 결정화합니다.H2O NaCl·2H2O).[21]
2023년 압력 하에서 염화나트륨이 수화물 NaCl·8.5를 형성할 수 있음을 발견했습니다.HO2 및 NaCl·13H2O.[22]
수용액

고체 내의+ Na와 Cl− 이온 사이의 인력은 매우 강하여 물과 같은 극성이 높은 용매만이 NaCl을 잘 녹입니다.
염화나트륨 골격은 물에 녹으면 Na와+ Cl− 이온이 극성 물 분자로 둘러싸이면서 붕괴됩니다.이 솔루션은 [Na(HO2)]8+ 공식을 가진 금속 아쿠아 복합체로 구성되며 Na-O 거리는 250pm입니다.염화 이온은 또한 강하게 용해되며, 각각은 평균 6개의 분자의 [23]물로 둘러싸여 있습니다.염화나트륨 용액은 순수한 물과는 매우 다른 성질을 가지고 있습니다.공융점은 염 23.31% 질량 분율에 대해 -21.12 °C(-6.02 °F)이고 포화 염 용액의 끓는점은 108.7 °C(227.7 °F)[11]에 가깝습니다.
염화나트륨 용액의 pH
염화나트륨 용액의 pH는 강산 HCl의 결합염기인 Cl이온의− 매우 약한 염기성 때문에 ≥7로 유지됩니다.즉, NaCl은 이온 강도 및 활성 계수의 영향을 무시할 수 있는 희석 용액에서 시스템 pH에[24] 영향을 미치지 않습니다.
| NaCl 용해도 (g NaCl / 25 °C(77 °F)[25]에서 용매 1 kg) | |
|---|---|
| 물. | 360 |
| 포름아미드 | 94 |
| 글리세린 | 83 |
| 프로필렌글리콜 | 71 |
| 포름산 | 52 |
| 암모니아액 | 30.2 |
| 메탄올 | 14 |
| 에탄올 | 0.65 |
| 디메틸포름아미드 | 0.4 |
| 프로판-1-올 | 0.124 |
| 설포란 | 0.05 |
| 부탄1올 | 0.05 |
| 프로판-2-올 | 0.03 |
| 펜탄-1-올 | 0.018 |
| 아세토니트릴 | 0.003 |
| 아세톤 | 0.00042 |
화학양론 및 구조 변형
일반 소금은 나트륨과 염소의 몰비가 1:1입니다.2013년에는 서로 다른 화학양론적 구조의 나트륨과 염화물의 화합물이 발견되었으며, 다섯 가지 새로운 화합물(예를 들어 NaCl3, NaCl2, NaCl32, NaCl3, NaCl7)이 예측되었습니다.그들 중 일부의 존재는 높은 압력과 다른 조건에서 실험적으로 확인되었습니다: 입방정계 및 입방정계 NaCl3, 2차원 금속 정방정계3 NaCl, 이국적인 육각형 NaCl.[26]이것은 화학적 직관에 위배되는 화합물이 주변이 아닌 [27]조건에서 간단한 시스템에서 가능하다는 것을 나타냅니다.
발생
세계 소금의 대부분은 바다에[citation needed] 녹습니다.지구의 지각에는 수용성 광물 할라이트(암염)로 적은 양이 존재하며 대기[citation needed] 중에는 부유 천일염 입자로 적은 양이 존재합니다.이 입자들은 바다 멀리 떨어진 곳에 있는 우세한 구름 응축 핵으로, 그렇지 않으면 오염되지 않은 [28]공기에서 구름을 형성할 수 있게 해줍니다.
생산.
소금은 현재 소금물 우물과 소금 호수에서 바닷물이나 소금물을 증발시켜 대량으로 생산되고 있습니다.암염의 채굴 또한 주요 공급원입니다.중국은 세계의 주요 [10]소금 공급국입니다.2017년 세계 생산량은 2억 8천만 톤으로 추정되었으며, 상위 5개 생산국은 중국(68.0), 미국(43.0), 인도(26.0), 독일(13.0), 캐나다(13.0)[29]입니다.소금은 칼륨 채굴의 부산물이기도 합니다.
참고 항목
- 생체염도
- 식용 소금(식용 소금)
- 염화나트륨의 광물형태인 할라이트
- 소금의 건강에 미치는 영향
- 염도
- 땅에 소금을 뿌리는 것
- 염독
참고문헌
- ^ "Sodium Chloride (NaCl) Crystal". PhysicsOpenLab. Retrieved 23 August 2021.
- ^ a b c d e f 헤인즈, 4.89
- ^ 헤인즈, 4.135
- ^ 헤인즈, 10.241
- ^ 헤인즈, 4.148
- ^ 헤인즈, 5.8
- ^ 염화나트륨. nlm.nih.gov
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, pp. 143 and 755, ISBN 9781405881180
- ^ a b c d 웨스트팔, 기스버트 외.(2002) 울만의 산업화학 백과사전, Wiley-VCH, Weinheim Doi: 10.1002/14356007.a24_317.pub4.
- ^ a b c d e f g h i j k l Kostick, Dennis S. (October 2010). "Salt" (PDF). U.S. Geological Survey, 2008 Minerals Yearbook.
- ^ a b Elvers, B. et al. (ed.) (1991) Ullmann의 산업화학 백과사전, 제5판A24권, Wiley, p. 319, ISBN 978-3-527-20124-2
- ^ Rastogi, Nina Shen (16 February 2010). "Salting the Earth". Slate. ISSN 1091-2339. Retrieved 11 March 2023.
- ^ "Saltier waterways are creating dangerous 'chemical cocktails'". phys.org.
- ^ "Most Road Salt Is Making It into Lakes And Rivers". www.sciencedaily.com. University of Minnesota. 20 February 2009. Retrieved 27 September 2015.
- ^ Casey, Michael. "Turning to beet juice and beer to address road salt danger". phys.org.
- ^ "EASA Cautions on Organic Salt Deicing Fluid". MRO Network. 9 December 2016.
- ^ a b R. D. Shannon (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ Nakamuro, Takayuki; Sakakibara, Masaya; Nada, Hiroki; Harano, Koji; Nakamura, Eiichi (2021). "Capturing the Moment of Emergence of Crystal Nucleus from Disorder". Journal of the American Chemical Society. 143 (4): 1763–1767. doi:10.1021/jacs.0c12100. PMID 33475359.
- ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. (2001). Alkali halides: a handbook of physical properties. Springer. pp. 65, 68. ISBN 978-3-540-42180-1.
- ^ Klewe, B; Pedersen (1974). "The crystal structure of sodium chloride dihydrate". Acta Crystallogr. B30 (10): 2363–2371. doi:10.1107/S0567740874007138.
- ^ Water-NaCl 위상도.Lide, CRC Handbook of Chemistry and Physics, 86 ed (2005-2006), CRC 페이지 8-71, 8-116
- ^ University of Washington. "Newly discovered form of salty ice could exist on surface of extraterrestrial moons". Phys.org.
- ^ 링컨, SF; Richens, D.T. and Sykes, A. G. (2003) "금속 아쿠아 이온" 종합 배위 화학 II 권 1, pp. 515-555. doi:10.1016/B0-08-043748-6/01055-0.
- ^ "Acidic, Basic, and Neutral Salts". Flinn Scientific Chem Fax. 2016. Retrieved 18 September 2018.
Neutralization of a strong acid and a strong base gives a neutral salt.
- ^ Burgess, J (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 978-0-85312-027-8.
- ^ Tikhomirova, K. A.; Tantardini, C.; Sukhanova, E. V.; Popov, Z. I.; Evlashin, S. A.; Tarkhov, M. A.; Zhdanov, V. L. (2020). "Exotic Two-Dimensional Structure: The first case of Hexagonal NaCl". The Journal of Physical Chemistry Letters. 11 (10): 3821–3827. doi:10.1021/acs.jpclett.0c00874. PMID 32330050. S2CID 216130640.
- ^ Zhang, W.; Oganov, A. R.; Goncharov, A. F.; Zhu, Q.; Boulfelfel, S. E.; Lyakhov, A. O.; Stavrou, E.; Somayazulu, M.; Prakapenka, V. B.; Konôpková, Z. (2013). "Unexpected Stable Stoichiometries of Sodium Chlorides". Science. 342 (6165): 1502–1505. arXiv:1310.7674. Bibcode:2013Sci...342.1502Z. doi:10.1126/science.1244989. PMID 24357316. S2CID 15298372.
- ^ Mason, B. J. (2006). "The role of sea-salt particles as cloud condensation nuclei over the remote oceans". Quarterly Journal of the Royal Meteorological Society. 127 (576): 2023–32. Bibcode:2001QJRMS.127.2023M. doi:10.1002/qj.49712757609. S2CID 121846285.
- ^ Bolen, Wallace P. (January 2018). "Salt" (PDF). U.S. Geological Survey, 2018 Mineral Commodity Summaries.
인용 출처
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
외부 링크
- 솔트 미국 지질조사 통계 및 정보
- "Using Salt and Sand for Winter Road Maintenance". Road Management Journal. December 1997. Archived from the original on 21 September 2016. Retrieved 13 February 2007.
- 계산기: NaCl 수용액(및 기타 염)의 표면장력, 밀도, 몰농도 및 몰농도
- JtBaker MSDS

![{\displaystyle {\ce {2 NaCl + 2 H2O ->[electrolysis] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6175336b0ecf3b2032d6a60ac2a534b10e6f61f3)






