헥사클로라이드 우라늄
Uranium hexachloride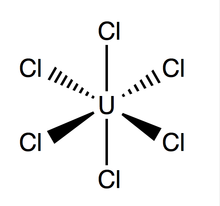 | |
| 이름 | |
|---|---|
| IUPAC 이름 염화 우라늄(VI) | |
| 기타 이름 헥사클로라이드 우라늄 과우라늄염화물 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
펍켐 CID | |
| |
| |
| 특성. | |
| UCl6 | |
| 어금질량 | 450.745 g/190 |
| 외관 | 짙은 녹색 결정체 고체 |
| 밀도 | 3600kg/m3 |
| 녹는점 | 177 °C(351 °F, 450 K) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
헥사클로라이드 우라늄(UCl6)은 +6 산화 상태의 우라늄의 무기 화학 화합물이다.[1][2] UCl은6 우라늄과 염소로 구성된 메탈할라이드다. 373.15K에서 1~3mmHg의 증기압력을 갖는 다발광 다크그린 결정체로 UCl은6 상온에서 진공, 건조한 공기, 질소, 헬륨에서 안정적이다.[3] 카본 사트라클로로이드(CCl4)에 용해된다. 다른 우라늄 할로겐화물에 비해 UCl에6 대해 알려진 것은 거의 없다.
구조 및 본딩
헥사클로로이드 우라늄은 점군 O를h 갖는 팔면 기하학을 가지고 있다. Its lattice (dimensions: 10.95 ± 0.02 Å x 6.03 ± 0.01 Å) is hexagonal in shape with three molecules per cell; the average theoretical U-Cl bond is 2.472 Å long (the experimental U-Cl length found by X-ray diffraction is 2.42 Å),[4] and the distance between two adjacent chlorine atoms is 3.65 Å.
화학적 특성
헥사클로로이드 우라늄은 고도로 흡습성이 높은 화합물로, 일반적인 대기 조건에 노출되면 쉽게 분해된다.[5] 따라서 진공 장치 또는 건조 박스에서 취급해야 한다.
열분해
UCl은6 120 °C~150 °C 사이의 온도까지 안정적이다. UCl의6 분해는 UCl의6 한 결정 형태에서 다른 보다 안정적인 형태로 고체 위상 전환을 초래한다.[6] 그러나 기체 UCl의6 분해는 UCl을5 생성한다. 이 반응에 대한 활성화 에너지는 몰 당 약 40 kcal이다.
- 2 UCl6 (g) → 2 UCl5 (s) + Cl2 (g)
용해성
UCl은6 매우 가용성 있는 화합물이 아니다. 그것은 갈색 용액을 주기 위해 CCl에서4 용해된다. 이소부틸브로마이드와 불소화탄소(CF716)에 약간 용해된다.[7]
| 용제 | 온도(°C) | UCl6/100g 용액 그램 |
|---|---|---|
| CCL4 | −18 | 2.64 |
| CCL4 | 0 | 4.9 |
| CCL4 | 20 | 7.8 |
| 6.6% Cl2 : 93.4% CCl4 | −20 | 2.4 |
| 12.5% Cl2 : 87.5% CCl4 | −20 | 2.23 |
| 12.5% Cl2 : 87.5% CCl4 | 0 | 3.98 |
| 리퀴드2 클 | −33 | 2.20 |
| CH3Cl | −24 | 1.16 |
| 벤젠 | 80 | 불용성 |
| 프레온 113 | 45 | 1.83 |
불화수소와의 반응
UCl을 상온에서6 정제된 무수액화수소불화수소(HF)와 반응하면 UF가5 생성된다.[8]
- 2 UCl6+ 10 HF → 2 UF5 + 10 HCl + Cl2
합성
헥사클로라이드 우라늄은 액체 CCl과4 뜨거운 염소(Cl2)를 혼합한 3산화 우라늄(UO3)의 반응으로 합성할 수 있다. UCl5 앞에서 반응이 진행되면 수율을 높일 수 있다.[9] UO는3 UCl로5 변환되며, 이는 다시 과잉 Cl과2 반응하여 UCl을6 형성한다. 반응이 일어나려면 상당한 양의 열이 필요하다. 온도 범위는 반응제 양(이상 온도 100°C - 125°C)에 따라 65°C에서 170°C까지이다. 반응은 쌓이는 압력을 견딜 수 있는 폐쇄된 기체밀폐용기(예: 글로브박스)에서 이루어진다.
1단계: 2 UO3 + 5Cl2 → 2 UCl5 + 32 O
2단계: 2 UCl5 + Cl2 → 2 UCl6
전체 반응: 2 UO3 + 6 Cl2 → 2 UCl6 + 3 O2
이 금속 헥사할라이드는 350°C에서 승화된 UCl4 위로 Cl2 가스를 불어 합성할 수도 있다.[10]
1단계: 2 UCl4 + Cl2 → 2 UCl5
2단계: 2 UCl5 + Cl2 → 2 UCl6
전체 반응: UCl4 + Cl2 → UCl6
참조
- ^ Zachariasen, W. H. (1948). "Crystal chemical studies of the 5f-series of elements. V. The crystal structure of uranium hexachloride". Acta Crystallographica. 1 (6): 285–287. doi:10.1107/S0365110X48000788.
- ^ Taylor, J. C.; Wilson, P. W. (1974). "Neutron and X-ray powder diffraction studies of the structure of uranium hexachloride". Acta Crystallographica Section B. 30 (6): 1481. doi:10.1107/S0567740874005115.
- ^ Van Dyke, R. E.; Evers, E. C. (1955). "Preparation of Uranium Hexachloride". Google Patents: 2.
- ^ Batista, E. R.; Martin, R. L.; Hay, P. J. (2004). "Density Functional Investigations of the Properties and Thermodynamics of UFn and UCln (n=1,...,6)". J. Chem. Phys. 121 (22): 11104–11. doi:10.1063/1.1811607. PMID 15634063.
- ^ Lipkin, D.; Wessman, S. (1955). "Process and Apparatus for protecting Uranium hexachloride from Deterioration and Contamination". Google Patents: 2.
- ^ Katz, J.J.; Rabinowitch,E. (1951). The Chemistry of Uranium. Ann Arbor: The McGraw-Hill Book Company.
- ^ Katz,J.J; Rabinowitch,E. (1951). The Chemistry of Uranium. Ann Arbor: The McGraw-Hill Book Company.
- ^ Katz,J.J; Rabinowitch,E. (1951). The Chemistry of Uranium. Ann Arbor: The McGraw-Hill Book Company.
- ^ Van Dyke, R. E.; Evers, E. C. (1955). "Preparation of Uranium Hexachloride". Google Patents: 2.
- ^ Thornton, G.; Edelstein, N.; Rösch, N.; Woodwark, D.R.; Edgell, R.G. (1979). "The Electronic Structure of UCl6: Photoelectron Spectra and Scattered Wave Xα Calculations". J. Chem. Phys. 70 (11): 6. Bibcode:1979JChPh..70.5218T. doi:10.1063/1.437313.


