염화 탄탈
Tantalum(V) chloride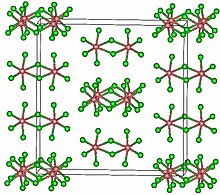 | |
| 이름 | |
|---|---|
| IUPAC 이름 염화 탄탈 오염화 탄탈 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| ECHA 정보 카드 | 100.028.869 |
| EC 번호 |
|
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| TaCl5 | |
| 몰 질량 | 358.213 g/g |
| 외모 | 백색 단사정계 결정[1] |
| 밀도 | 3.68 g/cm3 |
| 녹는점 | 216 °C (421 °F, 489 K) |
| 비등점 | 239.4°C(462.9°F, 512.5K)(분해) |
| 반응하다 | |
| 용해성 | 클로로포름, CCl4 |
자화율(δ) | +140.0×10cm−63/세로 |
| 구조. | |
| 단사정계, mS72 | |
| C2/m, 12호 | |
| 열화학 | |
표준 어금니 엔트로피 (S | 221.75 J K−1−1 몰 |
표준 엔탈피/ 형성 (δHf⦵298) | - 858.98 kJ/mol |
| 위험 요소 | |
| GHS 라벨링: | |
  | |
| 위험. | |
| H302, H314 | |
| P280, P305+P351+P338, P310 | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | 불연성 |
| 치사량 또는 농도(LD, LC): | |
LD50(중간선량) | 1900 mg/kg (구강, 쥐) |
| 안전 데이터 시트(SDS) | 외부 SDS |
| 관련 화합물 | |
기타 음이온 | 플루오르화 탄탈 브롬화 탄탈 요오드화 탄탈 |
기타 캐티온 | 바나듐(IV) 염화물 염화니오브 |
관련 화합물 | 염화탄탈(III)탄탈(Tantalum)IV) 염화물 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
염화탄탈(V)은 염화탄탈이라고도 하며 TaCl이라는 식으로5 이루어진 무기 화합물이다.그것은 흰 가루의 형태를 취하며 탄탈 화학에서 일반적으로 출발 재료로 사용됩니다.이는 쉽게 가수분해되어 염화탄탈(V) 옥시클로라이드(TaOCL3)를 형성하고 최종적으로는 오산화탄탈(TaO25)을 형성합니다. 따라서 무수 조건에서 공기 없는 기술을 사용하여 합성 및 조작해야 합니다.
구조.
TaCl은5 단사정계 공간군 C2/[2]m에서 결정화된다.10개의 염소 원자는 공통의 가장자리를 공유하는 한 쌍의 팔면체를 정의합니다.탄탈 원자는 팔면체의 중심을 차지하고 두 개의 염소 브리징 배위자에 의해 결합됩니다.이합체 구조는 복합화되지 않은 용매에 상당 부분 용해된 상태로 유지됩니다.그러나 증기 상태에서는 TaCl은5 단량체이다.이 단량체는 PCl과5 [3]같은 삼각쌍추체 구조를 채택하고 있다.
물리 속성
다음 일련의 방향족 탄화수소에 대해 5염화 탄탈의 용해도가 약간 증가합니다.
이는 용액의 색이 옅은 노란색에서 주황색으로 짙어지는 것에 반영된다.5염화탄탈은 방향족 탄화수소보다 시클로헥산 및 사염화탄소에 덜 용해된다.이러한 5염화 탄탈 용액은 전기 전도체 불량으로 알려져 이온화가 거의 이루어지지 않는다.TaCl은5 승화에 의해 정제되어 하얀 바늘이 된다.
합성
5염화탄탈은 170~250℃에서 분말 금속 탄탈과 염소 가스를 반응시켜 제조할 수 있다.이 반응은 400°[4]C에서 HCl을 사용하여 수행할 수도 있습니다.
- 2 Ta + 5 Cl2 → 2 TaCl5
- 2 Ta + 10 HCl → 2 TaCl5 + 5 H2
240°C에서 오산화탄탈과 염화티오닐의 반응으로도 제조할 수 있습니다.
- TaO25 + 5 SOCl2 → 2 TaCl5 + 5 SO2
5염화 탄탈은 시판되고 있으나, 시료는 가수분해로 생성된 옥시염화 탄탈(V)에3 오염될 수 있다.
반응
TaCl은5 전자 친화성이며 AlCl과 유사한3 Friedel-Crafts 촉매처럼 작동합니다.그것은 다양한 루이스 [5]기지와 부가물을 형성한다.
심플한 부가물
TaCl은5 에테르와 안정적인 복합체를 형성합니다.
- TaCl5 + RO2 → TaCl5(OR2)(R = Me, Et)
TaCl은5 또한 오염화 인 및 옥시염화 인과 반응하며, 옥시염화 인은 염화물 공여체로, 후자는 리간드로 작용하여 산소를 통해 결합합니다.
- TaCl5 + PCl5 → [ PCL+
4 ][ TaCl−
6 ] - TaCl5 + OPCl3 → [TaCl5(OPCl3)]
5염화 탄탈은 3차 아민과 반응하여 결정성 부가물을 생성한다.
- TaCl5 + 2 RN3 → [TaCl5(NR)]3
염화물 치환 반응
5염화 탄탈은 상온에서 과도한 트리페닐포스핀 산화물과 반응하여 다음과 같은 옥시염화물을 생성합니다.
- TaCl5 + 3 OPPh3 → [ TaOCL3 ( OPPH3 )x ]
TaCl과 알코올, 페놀, 카르복실산 등의 수산기 화합물 사이의5 부가물 추정 초기 형성은 염화수소를 제거하고 Ta-O 결합을 형성한다.
- TaCl5 + 3 HOEt → TaCl2 (OEt)3 + 3 HCl
HCl 수용체로서의 암모니아 존재 하에서 Ta(OEt)5의 형성에 의해 5개의 염화물 배위자가 모두 치환된다.마찬가지로5 TaCl은 무수 메탄올에서 리튬 메톡시드와 반응하여 관련 메톡시 유도체를 형성합니다.
- TaCl5 + 4 LiOME → Ta(OME)4Cl + 4 LiCl
암모니아는 대부분의 염화물 배위자를 TaCl에서5 대체하여 클러스터를 형성합니다.염화물은 1차 또는 2차 아민에 의해 더 느리게 치환되지만, 5개의 염화물 중심을 모두 아미도기로 치환하는 것은 펜타키스(디메틸아미드) 탄탈럼의 합성에 의해 설명되었듯이 리튬 디알킬아미드를 사용함으로써 이루어졌다.
- TaCl5 + 5 LiNMe2 → Ta(NMe2)5
알코올과 함께 오염화물은 반응하여 알콕시드를 생성한다.탄탈(V) 에톡시드의 제조에서 보듯이, 이러한 반응은 염기가 있는 상태에서 종종 수행됩니다.
- 10 EtOH + TaCl210 + 103 NH → Ta2(OET)10 + 10 NHCl4
5염화탄탈은 피리딘 등의 질소복소환에 의해 환원된다.
축소
염화탄탈(V)의 환원은 [TaCl618]4− 및 [TaCl614](HO2)4[6]를 포함한 음이온성 및 중성성 클러스터를 생성한다.

레퍼런스
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ Rabe, Susanne; Müller, Ulrich (2000). "Crystal structure of tantalum pentachloride, (TaCl5)2". Z. Kristallogr. - New Cryst. Struct. 215 (1): 1–2. doi:10.1515/ncrs-2000-0102.
- ^ F. Fairbrother (1967). The Chemistry of Niobium and Tantalum. Elsevier.
- ^ Young, Ralph C.; Brubaker, Carl H. (1952). "Reaction of Tantalum with Hydrogen Chloride, Hydrogen Bromide and Tantalum Pentachloride; Action of Hydrogen on Tantalum Pentachloride". Journal of the American Chemical Society. 74 (19): 4967. doi:10.1021/ja01139a524.
- ^ F. A. Cotton, G. Wilkinson, Advanced Meterphanical Chemistry, 뉴욕, Wiley, 1980.
- ^ Duraisamy, Thirumalai; Hay, Daniel N. T.; Messerle, Louis (2014). "Octahedral Hexatantalum Halide Clusters". Inorganic Syntheses: Volume 36. Inorganic Syntheses. Vol. 36. pp. 1–8. doi:10.1002/9781118744994.ch1. ISBN 9781118744994.
- ^ Thaxton, C. B.; Jacobson, R. A. (1971). "The Crystal Structure of H2(Ta6Cl18)(H2O)6". Inorganic Chemistry. 10: 1460–1463. doi:10.1021/ic50101a029.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크)
추가 정보
- Ozin, G. A.; Walton, R. A. (1970). "Vibrational spectra and structures of the 1:1 complexes of niobium and tantalum, pentachlorides and tantalum pentabromide with aceto-, perdeuterioaceto-, and propionitriles in the solid and solution states and a vibrational analysis of the species MX5, NC·CY3 (Y = H or D)". J. Chem. Soc. A: 2236–2239. doi:10.1039/j19700002236.
- Bullock, J. I.; Parrett, F. W.; Taylor, N. J. (1973). "Some metal halide–phosphorus halide–alkyl halide complexes. Part II. Reactions with niobium and tantalum pentachlorides and tungsten hexachloride". J. Chem. Soc., Dalton Trans. (5): 522–524. doi:10.1039/DT9730000522.
- Đorđević, C.; Katović, V. (1970). "Co-ordination complexes of niobium and tantalum. Part VIII. Complexes of niobium(IV), niobium(V), and tantalum(V) with mixed oxo, halogeno, alkoxy, and 2,2′-bipyridyl ligands". J. Chem. Soc. A: 3382–3386. doi:10.1039/j19700003382.
- Cowley, A.; Fairbrother, F.; Scott, N. (1958). "The halides of niobium (columbium) and tantalum. Part V. Diethyl ether complexes of the pentachlorides and pentabromides; the solubility of tantalum pentaiodide in ether". J. Chem. Soc.: 3133–3137. doi:10.1039/JR9580003133.



