비염화 트리르헤늄
Trirhenium nonachloride | |
| 이름 | |
|---|---|
| IUPAC 이름 염화 레늄(III) | |
| 기타 이름 트리클로라이드 레늄 | |
| 식별자 | |
3D 모델(JSmol) | |
| ECHA InfoCard | 100.033.610 |
| EC 번호 |
|
펍켐 CID | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| ReCl3 | |
| 어금질량 | 292.57 g/190 |
| 외관 | 적색, 결정, 비휘발성 고체 |
| 밀도 | 4800kg/m3 |
| 녹는점 | 해당 없음 |
| 비등점 | 500 °C(932 °F; 773 K) (손상) |
| 리옥쇼를23.2 형성하기 위해 가수분해한다. | |
| 구조 | |
| 림보헤드랄, hR72 | |
| R-3m, 166번 | |
| (솔루션 내 중성) (아세트산 중 황색) | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 부식성(C) |
| 안전 데이터 시트(SDS) | 외부 MSDS |
| 관련 화합물 | |
기타 음이온 | 트리브로미드 레늄 삼요오드화 레늄 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
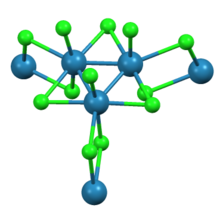
트리르헤늄 논아클로라이드는 ReCl이라는3 공식을 가진 화합물로, 때로는 ReCl이라고39 쓰기도 한다.그것은 일반적인 용매에서 용해되지 않는 검붉은색의 흡습성 고체다.이 화합물은 금속-금속 결합을 가진 성단 화합물의 초기 사례로서 무기화학사에서 중요하다.[1]다른 레늄 복합체의 합성을 위한 출발 재료로 사용된다.
구조 및 물리적 특성
X선 결정학에서 알 수 있듯이 트리르헤늄 논아클로라이드는 인접한 클러스터와 3개의 염화교량을 공유하는 ReCl312 하위유닛으로 구성된다.클러스터들의 상호연결된 네트워크는 시트를 형성한다.각 레센터 주변에는 리간드 7개, 브리징 염화염소 4개, 염화단말기 1개, 레레 본드 2개가 있다.[2]
산화열은 다음 식에 따라 평가된다.
- 1/3 ReCl39 + 4 OH− + 2 OCl− → REO4− + 2 HO2 + 5Cl−
이 과정의 엔탈피는 190.7 ± 0.2 kcal/mol이다.[2]
준비 및 반응
이 화합물은 1932년에 발견되었는데, 이 작업자들이 그 구조를 결정하지는 않았지만, 이것은 금속 염화물로는 이례적인 일이다.[3]트리르헤늄 논아클로라이드는 리르늄 펜타클로라이드 또는 헥사클로로헤닉(IV)산의 열분해로 효율적으로 제조된다.[4]
- 3 ReCl5 → ReCl39 + 3Cl2
샘플이 500 °C에서 진공 승화되면 결과 물질은 상대적으로 비활성이지만 부분 수화 물질은 합성적으로 더 유용할 수 있다.다른 합성 방법으로는 염화설프릴로 레늄을 치료하는 것이 있다.이 과정은 염화알루미늄을 첨가하여 수행되기도 한다.[2]또한 HCl에서 Re2(OCH23)4Cl을2 가열하여 얻는다.
- 3/2 Re2(OCH23)4Cl2 + 6 HCl → ReCl39 + 6 HOCH23
삼염화합물과 오염화합물의 반응으로 레늄 테트라클로로이드:
- 3 ReCl5 + ReCl39 → 6 ReCl4
참조
- ^ 코튼, F. A.; 월튼, R. A. "금속 원자 사이의 다중 결합" 옥스퍼드 (Oxford): 1993. ISBN0-19-855649-7.
- ^ a b c 콜튼, R.레늄과 테크네튬의 화학. 965.
- ^ 게일넌, W.; 윌루즈, F. W.; 빌츠. W.: 나흐르.이런, 와이스고팅겐 1932년, 579년.
- ^ Lincoln, R.; Wilkinson, G. (1980). Trirhenium Nonachloride. Inorg. Synth. Inorganic Syntheses. Vol. 20. pp. 44. doi:10.1002/9780470132517.ch12. ISBN 978-0-470-13251-7.