사염화 셀렌
Selenium tetrachloride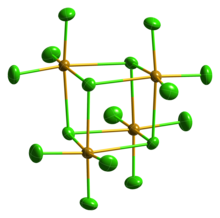 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 사염화 셀렌 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.030.036 |
| EC 번호 |
|
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| 세크루4 | |
| 몰 질량 | 220.771 g/g |
| 외모 | 흰색에서 노란색의 결정 |
| 밀도 | 2.6 g/cm3, 솔리드 |
| 녹는점 | 191.4°C에서의[1] 서브라이임 |
| 물에서 분해되다 | |
| 구조. | |
| 단사정계, mS80 | |
| C12/c1, No. 15 | |
| 시소(기상)[citation needed] | |
| 위험[2] 요소 | |
| GHS 라벨링: | |
   | |
| 위험. | |
| H301, H331, H373, H410 | |
| P260, , , , , , , , , , , , | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | 비고정적인 |
| 관련 화합물 | |
기타 음이온 | 사불화 셀레늄 사크롬화 셀렌 이산화 셀레늄 |
기타 캐티온 | 일산화 이염소 사염화황 사염화 텔루 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
사염화세렌은 식 중 SeCl로4 이루어진 무기화합물이다.이 화합물은 노란색에서 흰색의 휘발성 고체로 존재합니다.일반적으로 사용 가능한 두 가지 염화 셀레늄 중 하나이며, 다른 예로는 일염화 셀레늄인 SeCl이22 있습니다.SeCl은4 다른 셀레늄 화합물의 합성에 사용됩니다.
합성 및 구조
이 화합물은 셀레늄을 [3]염소로 처리하여 제조된다.반응하는 셀레늄을 가열하면 반응 플라스크에서 제품이 승화한다.사염화 셀레늄의 휘발성은 셀레늄의 정화에 이용될 수 있다.
Solid4 SeCl은 실제로 4중합체 큐베인형 클러스터입니다. 이 클러스터에서는 SeCl6 8면체의 Se 원자는 큐브의 네 모서리에 있고 브리징 Cl 원자는 나머지 네 모서리에 있습니다.브리징 Se-Cl 거리는 단말 Se-Cl 거리보다 길지만 모든 Cl-Se-Cl 각도는 약 90°[4]입니다.
SeCl은4 초가 분자의 VSEPR 규칙을 가르치는 예로 자주 사용되어 왔습니다.이와 같이, 한 사람은 4개의 결합을 예측하지만 5개의 전자 집단이 시소 기하학을 발생시킬 것이다.이것은 결정 구조에서는 분명히 해당되지 않는다.다른 사람들은 결정 구조를 SeCl과− Cl로 나타낼3+ 수 있다고 제안했습니다.이 공식은 Cl-Se-Cl 결합 각도가 약 109°인 SeCl3+ 양이온의 피라미드 형상을 예측한다.그러나, 이 분자는 가장 간단한 분자식으로는 최대 결합을 달성할 수 없는 상황의 훌륭한 예이다.브릿지 염화물의 비국재화 시그마 결합에 의한 테트라머(SeCl4)4[5]의 형성은 "고가의" 작은 분자보다 분명히 선호된다.가스4 SeCl에는 응축 시 재결합하는 SeCl과 염소가 포함되어2 있습니다.
반응
사염화 셀레늄은 트리페닐스티빈을 사용하여 이염화물로 환원할 수 있습니다.
- SeCl4 + SbPh3 → SeCl2 + ClsbPh23
사염화 셀렌은 물과 반응하여 셀렌산 및 [6][page needed]염산을 생성합니다.
- SeCl4 + 32 HO → HSeO23 + 4 HCl
이산화 셀레늄으로 처리하면 다음과 같은 염산 [6][page needed]셀레늄을 생성합니다.
- SeCl4 + SeO2 → 2 SeOCL2
레퍼런스
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. p. 487. ISBN 0-8493-0594-2. Retrieved 2008-07-02.
- ^ "323527 Selenium tetrachloride". Sigma-Aldrich. Retrieved 2008-07-02.
- ^ Nowak, H. G.; Suttle, J. F.; Parker, W. E.; Kleinberg, J. (1957). "Selenium (IV) Chloride". Inorganic Syntheses. Inorganic Syntheses. Vol. 5. p. 125. doi:10.1002/9780470132364.ch33. ISBN 9780470132364.
- ^ Christallstrucktur der stabilen Modifikation von SeCl4, Zeitschrift für Naturforschung, 36b, 1660, 1981
- ^ 웰스, 구조무기화학, 제5판, 옥스퍼드, 페이지 709, ISBN 0-19-855370-6
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.



