글루코르티코이드
Glucocorticoid| 글루코르티코이드 | |
|---|---|
| 마약류 | |
 | |
| 클래스 식별자 | |
| 동의어 | 코르티코스테로이드; 글루코코르티코스테로이드 |
| 사용하다 | 부신 부족, 알레르기, 염증, 자가면역 장애, 천식, 장기 이식 |
| ATC 코드 | H02AB |
| 생물학적 표적 | 글루코르티코이드수용체 |
| 케미컬 클래스 | 스테로이드 |
| 위키다타에서 | |
글루코코르티코이드(또는 덜 흔하게는 글루코코르티코스테로이드)는 스테로이드 호르몬의 일종인 코르티코스테로이드의 일종이다.글루코코르티코이드는 거의 모든 척추동물 세포에 존재하는 글루코코르티코이드 수용체에[1] 결합하는 코르티코스테로이드다.'글루코코르티코이드(glucocorticoid)'라는 명칭은 포르만테우(glucose + cortex + steroid)로 포도당 대사 조절, 부신피질 내 합성, 스테로이드 구조(오른쪽 구조 참조)의 역할로 구성되어 있다.
글루코코르티코이드(glucocorticoids)는 면역체계의 피드백 메커니즘의 일부로서, 염증 등 면역 기능의 특정 측면을 감소시킨다.따라서 그것들은 알레르기, 천식, 자가면역질환, 패혈증과 같은 과잉행동 면역체계에 의해 유발되는 질병을 치료하는데 의학에 사용된다.글루코코르티코이드에는 잠재적으로 유해한 부작용을 포함하여 다양한 (쾌적성) 효과가 있으며, 그 결과 카운터 상공에서 판매되는 경우는 거의 없다.[2]그들은 또한 암세포의 비정상적인 메커니즘의 일부를 간섭하기 때문에 암을 치료하기 위해 많은 양으로 사용된다.여기에는 림프구 증식에 대한 억제 효과, 림프구 및 백혈구 치료에서와 같은 억제 효과, 항암제의 부작용 완화 등이 포함된다.
글루코코르티코이드는 글루코코르티코이드 수용체에 결합하여 세포에 영향을 미친다.활성화된 글루코코르티코이드 수용체-글루코르티코이드 복합체는 핵에서 항염증 단백질의 발현을 상향 조절하고(트랜스프레프라고 하는 과정) 시토솔에서 다른 전사인자가 핵(트랜스프레프)으로 전이되는 것을 방지하여 시토솔에서 항염증 단백질의 발현을 억제한다.저항하다[2]
글루코코르티코이드(glucocorticoids)는 특정 수용체, 표적 세포, 효과에 의해 광물코르티코이드, 성 스테로이드와 구별된다.기술적 용어로 "코르티코스테로이드"는 글루코코르티코이드와 광물코르티코이드(둘 다 부신피질에서 생성되는 호르몬의 모사)를 모두 말하지만, 흔히 "글루코코르티코이드"의 동의어로 쓰인다.글루코코르티코이드는 주로 부신피질의 조나페시쿨라타에서 생성되는 반면, 미네랄로코르티코이드는 조나 글로머룰로사(Zona glomerulosa)에서 합성된다.
코티솔(또는 하이드로코르티손)은 가장 중요한 인간 글루코코르티코이드다.생명에 필수적이며, 다양한 중요한 심혈관계, 대사기능, 면역기능, 동종기능을 조절하거나 지원한다.다양한 합성 글루코코르티코이드들이 이용 가능하다; 이것들은 글루코코르티코이드 결핍의 대체 요법이나 신체의 면역 체계를 억제하기 위해 일반적인 의료 활동과 수많은 전문분야에 널리 이용되고 있다.
영향들
글루코코르티코이드 효과는 크게 면역학과 대사학의 두 가지 범주로 분류될 수 있다.게다가 글루코코르티코이드들은 태아의 발달과 체액 홈스테이시스에도 중요한 역할을 한다.
면역성이 있는
글루코코르티코이드 수용체와의 상호작용을 통해 기능하는 글루코코르티코이드(아래 세부사항 참조):
- 항균 단백질의 발현력을 높이다.
- 염증 단백질의 발현을 낮추다
글루코코르티코이드도 T 림프구의 발달과 동태현상에 역할을 하는 것으로 나타났다.이는 글루코코르티코이드에 대한 T세포 혈통의 민감도가 증가하거나 감소하는 유전자 변형 생쥐에서 나타났다.[4]
대사
"글루코코르티코이드"라는 이름은 이러한 호르몬들이 포도당 대사에 관여했다는 초기 관측에서 유래되었다.금식 상태에서 코티솔은 여러 과정을 자극하여 집단적으로 혈중 포도당 농도를 증가시키고 유지시킨다.
대사 효과:
- 특히 간에서 글루코네제지스의 자극:이 경로는 트리글리세라이드 붕괴에 따른 아미노산, 글리세롤과 같은 비헥소스 기질로부터 포도당을 합성하게 되며, 육식동물과 특정 초식동물에 특히 중요하다.글루코네제네시스(gluconeogenesis)에 관여하는 효소의 발현을 강화하는 것은 아마도 글루코코르티코이드의 가장 잘 알려진 대사 기능일 것이다.
- 열외 조직에서 아미노산 동원:이것들은 글루코네제네시스의 기질 역할을 한다.
- 근육 및 지방 조직에서 포도당 흡수 억제:포도당을 보존하기 위한 메커니즘
- 지방 조직의 지방 파괴 자극:지방분해에 의해 방출되는 지방산은 근육과 같은 조직의 에너지 생산에 사용되며, 방출된 글리세롤은 글루코네제네시스(gluconeogenesis)에 또 다른 기질을 제공한다.
- 나트륨 보유량 증가와 칼륨 배설은 고산염과 저칼륨혈증을[5] 유발한다.
- 헤모글로빈 농도가 증가하며, 대식세포 또는 다른 포식세포에 의한 적혈구 섭취의 방해로 인해 발생할 수 있다.[1]
- 비뇨기 요산[6] 증가
- 비뇨기 칼슘 증가 및 저칼슘혈증[7]
- 알칼리증[8]
- 백혈구증[9]
약물이나 과민성 항진증으로 인한 과도한 글루코코르티코이드 수치는 많은 시스템에 영향을 미친다.뼈 형성 억제, 칼슘 흡수 억제(둘 다 골다공증으로 이어질 수 있음), 상처 치유 지연, 근육 약화, 감염 위험 증가 등이 대표적인 예다.이러한 관찰은 글루코코르티코이드에 대한 다수의 덜 극적인 생리학적 역할을 시사한다.[4]
발달
글루코코르티코이드는 태아 발달에 여러 가지 영향을 미친다.중요한 예는 폐의 성숙과 자궁외 폐 기능에 필요한 계면활성제의 생산을 촉진하는 그들의 역할이다.코르티코트로핀 방출 호르몬 유전자(아래 참조)에 균질장애가 있는 생쥐는 생후 폐 미성숙으로 사망한다.또한 글루코코르티코이드는 말단 성숙을 시작하고, 액손과 덴드라이트를 개조하며, 세포 생존에[8] 영향을 줌으로써 정상적인 뇌 발달에 필요하며, 해마 발달에도 역할을 할 수 있다.글루코코르티코이드는 Na+/K+/ATPase, 영양분 전달체, 소화 효소의 성숙을 자극하여 기능하는 위장 시스템의 개발을 촉진한다.글루코코르티코이드도 글로머 여과율을 높여 신생아의 신장계 발전을 지원한다.
아루살과 인식

글루코코르티코이드는 해마, 편도, 전두엽에 작용한다.아드레날린과 함께, 이것들은 긍정적이거나 부정적이거나 강한 감정과 관련된 사건들의 섬광기억의 형성을 강화한다.[9]이것은 글루코코르티코이드나 노르아드레날린 활동을 차단함으로써 감정적으로 관련되는 정보의 리콜을 손상시킨 연구에서 확인되었다.추가 출처들은 높은 코티솔 수치를 동반한 공포 학습이 이 기억의 더 나은 결합을 가지고 있다는 것을 보여주었다. (이 효과는 남성들에게 더 중요했다.)[better source needed]글루코코르티코이드가 기억력에 미치는 영향은 해마 형성의 CA1 영역에 특히 손상이 있기 때문일 수 있다.
여러 동물 연구에서 장기간의 스트레스(글루코코르티코이드 수치의 장기적 증가를 초래함)는 뇌의 이 부위의 뉴런이 파괴되는 것을 보여주었고, 이는 기억력 저하로 연결되었다.[5][10][6]
글루코코르티코이드도 경계(주의력결핍장애)와 인지(기억)에도 상당한 영향을 미치는 것으로 나타났다.연구 결과 글루코코르티코이드 대 메모리 성능의 순환 수준이 예크스-도슨 곡선처럼 U 패턴을 거꾸로 따라간다는 사실이 밝혀졌기 때문에 이는 예크스-도슨 곡선을 따르는 것으로 보인다.예를 들어 장기전위제(LTP, 장기기억제 형성 과정)는 글루코코르티코이드 수치가 약간 상승했을 때 최적인 반면, 부신절제술(저글루코코르티코이드 상태) 후 또는 외생 글루코르티코이드 투여 후(고글루코르티코이드 상태) 후 LTP의 현저한 감소가 관찰된다.글루코코르티코이드의 높은 수준은 감정적으로 자극하는 사건을 위해 기억력을 향상시키지만, 스트레스/감정적 자극의 근원과 관계없는 물질의 기억력 저하를 초래하는 경우가 더 많다.[11]기억력 통합에 대한 글루코코르티코이드의 용량 의존적 강화 효과와 대조적으로, 이러한 스트레스 호르몬은 이미 저장된 정보의 검색을 억제하는 것으로 나타났다.[7]천식과 항염증 약물과 같은 글루코코르티코이드 약물에 장기간 노출되면 "스테로이드 치매"[14]로 알려진 질환을 [12][13]치료하는 동안 그리고 치료 후에 기억력과 주의력에 결손이 발생하는 것으로 나타났다.
체액상동맥류
글루코코르티코이드는 심방 내성 펩타이드(ANP)에 대한 신체의 작용을 조절함으로써 세포외 유체 부피의 정상화를 돕기 위해 주변부뿐만 아니라 중앙에서도 작용할 수 있다.중심적으로 글루코코르티코이드들은 탈수증을 억제하여 수분섭취를 유발할 수 있고,[15] 주변적으로 글루코코르티코이드들은 강력한 이뇨작용을 유발할 수 있다.[16]
작용기전
불활성화
글루코코르티코이드는 리간드 결합에 의해 활성화되는 핵수용체의 일종인 세포설 글루코르티코이드 수용체에 결합한다.호르몬이 해당 수용체에 결합한 후 새로 형성된 복합체는 세포핵으로 스스로 반투명하게 되는데, 여기서 대상 유전자의 촉진자 부위에서 글루코르티코이드 반응 요소에 결합하여 유전자 발현 조절을 하게 된다.이 과정을 일반적으로 전사적 활성화 또는 불능화라고 한다.[17][18]
이러한 상향 조절 유전자에 의해 암호화된 단백질은 예를 들면 다음과 같은 광범위한 효과를 가진다.[18]
- 항염증 – 리포코르틴 I, p11/calpactin 결합 단백질, 분비물 백혈구 프로테아제 억제제 1(SLPI), 미토겐 활성 단백질 키나제인산효소(MAPK 인산효소)
- 글루코네제네시스 증가 – 글루코네제 6-타아제 및 타이로신 아미노트란스페라제
트랜스프레션
반대 메카니즘을 전사적 억압, 즉 트랜스프레션이라고 한다.이 메커니즘에 대한 고전적인 이해는 활성화된 글루코코르티코이드 수용체가 다른 전사 인자가 결합되는 동일한 부위에서 DNA에 결합되어 그 인자의 활동을 통해 전승되는 유전자의 전사를 방지한다는 것이다.[17][18]이러한 현상이 일어나는 동안, 결과는 모든 세포 유형과 조건에 대해 일관되지 않는다; 일반적으로 받아들여지는, 전압을 위한 일반적인 메커니즘은 없다.[18]
전사가 억제되는 곳에서 새로운 메커니즘이 발견되고 있지만, 활성화된 글루코코르티코이드 수용체는 DNA와 상호작용을 하는 것이 아니라 다른 전사인자와 직접 상호작용하여 간섭하거나, 다른 전사인자의 기능을 방해하는 다른 단백질과 상호작용을 하고 있다.이 후자의 메커니즘은 활성화된 글루코르티코이드 수용체가 NF-164B를 방해하는 가장 가능성이 높은 방법인 것으로 보인다. 즉, 히스톤 디아세틸라제를 모집하여 NF-164B가 결합해야 하는 염색체 구조의 폐쇄로 이어진다.[17][18]
논에노믹 효과
활성 글루코코르티코이드 수용체는 전사에 대한 어떠한 영향과도 무관한 것으로 실험적으로 입증된 효과를 가지고 있으며, 활성화된 글루코코르티코이드 수용체를 다른 단백질이나 mRNA와 직접 결합하는 것에 의해서만 기인할 수 있다.[17][18]
예를 들어 비활성 글루코코르티코이드 수용체에 결합하는 Src키나아제는 글루코코르티코이드 수용체에 결합하면 분비되며, 인포릴레이는 염증, 표피 성장인자에 중요한 수용체로부터 어댑터 단백질을 대체하여 그 활성도를 감소시켜 결과적으로 아르의 생성을 감소시킨다.아키돈산 - 주요 염증 분자.이것은 글루코코르티코이드들이 항염증 효과를 가지는 하나의 메커니즘이다.[17]
약리학
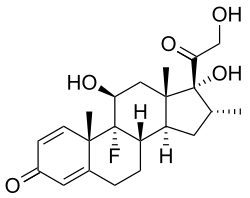
코티솔보다 훨씬 강력한 다양한 합성 글루코코르티코이드들이 치료용으로 만들어졌다.이들은 약물역동학(흡수인자, 반감기, 분포량, 간격)과 약물역학(예: 미네랄로코르티코이드 활성의 용량: 나트륨(Na+)과 물의 보유, 신생리학)에서 모두 다르다.장에 쉽게 스며들기 때문에 주로 (입으로) os당 투여하지만, 피부에 국소적으로 침투하는 등의 다른 방법으로도 투여된다.그들 중 90% 이상이 서로 다른 혈장 단백질을 결합하지만, 서로 다른 결합 특이성으로 결합한다.내생성 글루코코르티코이드와 일부 합성 코르티코이드들은 단백질 트랜스코르틴(코르티코스테로이드 결합 글로불린이라고도 함)과 친화력이 높은 반면, 이들 모두는 알부민을 결합한다.간에서는 황산염이나 글루쿠론산과 결합하여 빠르게 대사하며, 소변에서 분비된다.
글루코코르티코이드 효력, 효과 지속시간, 겹치는 미네랄로코르티코이드 효력은 다양하다.코티솔은 글루코코르티코이드 효능에 대한 비교 기준이다.하이드로코르티손(Hydrocortisone)은 코티솔의 약제 조제에 사용되는 이름이다.
아래의 데이터는 구강 투여에 관한 것이다.경구 효력은 상당한 양(일부 경우에는 최대 50%까지)이 순환에 이르지 못할 수 있기 때문에 장구 효력보다 적을 수 있다.프루드로코르티손 아세테이트와 디옥시코르티코스테론 아세테이트는 정의상 글루코코르티코이드보다는 미네랄로코르티코이드지만, 그것들은 사소한 글루코코르티코이드 효능을 가지고 있으며 미네랄로코르티코이드 효능에 대한 관점을 제공하기 위해 이 표에 포함되어 있다.
| 이름 | 글루코르티코이드 효력 | 미네랄코르티코이드 효력 | 터미널 반감기(시간) |
|---|---|---|---|
| 코티솔 (하이드로코르티손) | 1 | 1 | 8 |
| 코티손 | 0.8 | 0.8 | 8 |
| 프레드니손 | 3.5–5 | 0.8 | 16–36 |
| 프레드니솔론 | 4 | 0.8 | 16–36 |
| 메틸프레드니솔론 | 5–7.5 | 0.5 | 18–40 |
| 덱사메타손 | 25–80 | 0 | 36–54 |
| 베타메타손 | 25–30 | 0 | 36–54 |
| 트라이암시놀론 | 5 | 0 | 12–36 |
| 디플라자코트 | 6.5 | - | 1.3 |
| 프루드로코르티손 아세테이트 | 15 | 200 | 24 |
| 디옥시코르티코스테론 아세테이트 | 0 | 20 | - |
| 알도스테론 | 0.3 | 200-1000 | - |
| 베클로메타손 | 8개의 스프레이가 하루에 한번 14mg의 프레드니손에 상당하는 매일 4회 분무 | - | - |
치료용
글루코코르티코이드는 부신 부족 시 저용량에 사용될 수 있다.훨씬 더 많은 용량에서 구강이나 흡입된 글루코코르티코이드는 다양한 알레르기, 염증, 자가면역 장애를 억제하는 데 사용된다.흡입된 글루코코르티코이드는 천식에 대한 두 번째 치료법이다.급성 이식 거부반응과 이식 대 숙주 질환을 예방하기 위해 이식 후 면역억제제로도 투여한다.그럼에도 불구하고, 그들은 감염을 예방하지 않고 또한 나중에 회복되는 과정을 억제한다.새롭게 부상하는 증거는 이뇨제와 나트륨 펩타이드에 대한 신장 반응성을 증가시키기 위해 심장마비 치료에 글루코코르티코이드들이 사용될 수 있다는 것을 보여주었다.글루코코르티코이드는 역사적으로 염증 조건에서의 통증 완화에 사용된다.[23][24][25]그러나, 코르티코스테로이드들은 통증 완화에 제한적인 효능을 보이고, 건병 치료에서 사용될 수 있는 잠재적인 부작용들을 보여준다.[26]
대체
어떤 글루코코르티코이드도 일반 코티솔 생산과 거의 동일한 글루코코코르티코이드 효과를 제공하는 선량으로 투여할 수 있다. 이를 생리학적, 대체적 또는 유지 관리 투여라고 한다.이것은 대략 6–12 mg/m/day2 hydrocortisone (m은2 신체 표면적(BSA)을 가리키며, 신체 크기의 척도로서, 평균 남성의 BSA는 1.9 m이다2.
치료면역억제
글루코코르티코이드는 면역억제를 유발하며, 이 효과의 치료적 구성요소는 주로 B세포와 T세포 모두를 포함한 림프구의 기능과 수의 감소에 있다.
이러한 면역억제의 주요 메커니즘은 활성 B세포의 핵인자 카파-라이트 체인-엔핸서의 억제를 통해서이다.NF-κB는 면역 반응을 촉진하는 많은 매개체(즉, 사이토카인)와 단백질(즉, 접착 단백질)의 합성에 관여하는 중요한 전사 요인이다.그러므로 이 전사 인자의 억제는 면역 체계가 반응을 일으킬 수 있는 능력을 약화시킨다.[2]
글루코코르티코이드는 사이토카인 IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IFN-에 대해 암호화하는 유전자를 억제하여 세포 매개 면역성을 억제하는데, 그 중 가장 중요한 유전자는 IL-2이다.사이토카인 생산량이 적으면 T세포 증식이 줄어든다.[27]
그러나 글루코코르티코이드는 T세포 증식을 감소시킬 뿐만 아니라 또 다른 잘 알려진 효과인 글루코르티코이드 유도 사멸을 초래한다.그 효과는 아직 흉선 안에 있는 미성숙 T세포에서 더 두드러지지만 말초 T세포도 영향을 받는다.이 글루코코르티코이드 민감도를 조절하는 정확한 메커니즘은 Bcl-2 유전자에 있다.[28]
글루코코르티코이드도 또한 고음 면역력을 억제하여 고음 면역 결핍을 일으킨다.글루코코르티코이드는 B세포가 더 적은 양의 IL-2 수용체와 IL-2 수용체를 표현하게 한다.이것은 B세포 복제확장과 항체합성을 감소시킨다.또한 IL-2의 양이 줄어들어 T 림프구 세포가 더 적게 활성화된다.
면역세포에서 글루코코르티코이드가 fc 수용체 발현에 미치는 영향은 복잡하다.덱사메타손은 IFN 감마파가 중성미자에서 Fc 감마 RI의 발현을 자극하는 한편 반대로 단세포의 증가를 유발한다.[29]글루코코르티코이드도 대식세포에서 Fc 수용체의 발현을 감소시킬 수 있지만,[30] 이전 연구에서 이 규정을 뒷받침하는 증거가 의문시되었다.[31]대식세포에서 Fc 수용체 발현 효과가 중요한 것은 오판세포의 포자세포증(Phagocytosis)에 필요하기 때문이다.fc 수용체가 대식세포에 의해 파괴 대상 세포에 부착된 항체를 결합하기 때문이다.
항염증
글루코코르티코이드는 염증의 원인과 상관없이 강력한 항염증이다. 그들의 주된 항염증 메커니즘은 지포코르틴-1 (annexin-1) 합성이다.리포코르틴-1은 둘 다 인광산화효소 A2를 억제하여 아이코사노이드 생성을 차단하고, 각종 백혈구 염증 증상(피막접착, 이주, 화학작용을 억제하며, 혈소판증, 호흡기 파열 등)을 억제한다.즉 글루코코르티코이드는 면역반응을 억제할 뿐만 아니라 염증인 프로스타글란딘과 백혈병이라는 두 가지 주요 산물을 억제한다.그들은 인광산화효소 A2 수준뿐만 아니라 사이클록시제네제/PGE 이소머라아제(COX-1과 COX-2) 수준에서도 프로스타글란딘 합성을 억제하며,[32] 후자의 효과는 NSAIDs와 매우 유사하므로 항염증 효과를 강화한다.
또 글루코코르티코이드도 사이클록시제네아제 발현을 억제한다.[33]
항염화제로 시판되는 글루코코르티코이드들은 종종 비염의 코 스프레이나 천식의 흡입기와 같은 국소적 제형이 된다.이러한 준비는 대상 영역에만 영향을 미쳐 부작용이나 잠재적 상호작용을 줄일 수 있다는 장점이 있다.이 경우 사용되는 주요 화합물은 베클로메타손, 부데소니드, 플루티카손, 미메타손, 시클레소니드 등이다.비염에서는 스프레이를 사용한다.천식의 경우, 글루코코르티코이드는 계량제 또는 건조 분말 흡입기로 흡입제로 투여된다.[34]드물지만 방사선 유발 갑상선염 증상은 구강 글루코코르티코이드로 치료한 적이 있다.[35]
고알도스테론주의
글루코코르티코이드(glukocorticoids)는 가족성 과발도스테론 유형 1의 관리에 사용될 수 있다.그러나 그것들은 유형 2 조건에서 사용하기에는 효과적이지 않다.
저항
예를 들어, 심각한 천식 환자의 25%가 스테로이드에 반응하지 않을 수 있다.이는 유전적 소인, 염증의 원인에 대한 지속적인 노출(알레르기겐 등), 글루코코르티코이드를 우회하는 면역학적 현상, 그리고 약동학적 장애(불완전한 흡수 또는 가속화된 배설이나 신진대사)의 결과일 수 있다.[27]
심부전
글루코코르티코이드(glukocorticoids)는 이뇨제에 대한 신장 반응성을 촉진하기 위해 분해된 심장 장애 치료에 사용될 수 있으며, 특히 루프 이뇨제를 다량 투여한 내화 이뇨 저항성을 가진 심부전 환자에게는 더욱 그러하다.[36][37][38][39][40][41][42]
부작용
현재 사용되고 있는 글루코코르티코이드 약물은 선택적으로 작용하지 않기 때문에 장기적으로는 많은 건강한 아나볼릭 과정을 손상시킬 수 있다.이를 예방하기 위해 최근 글루코코르티코이드 약물을 선별적으로 작용시키는 정교한 작업에 많은 연구가 집중되고 있다.부작용은 다음과 같다.
- 면역결핍(아래 섹션 참조)
- 글루코네제네시스증 증가, 인슐린 저항성, 포도당 내성("스테로이드 당뇨병") 저하로 인한 고혈당증, 당뇨병 환자에 주의
- 피부 취약성 증가, 타박상 발생
- 장내 칼슘 흡수량[43] 감소로 인한 마이너스 칼슘 밸런스
- 스테로이드 유도 골다공증: 골밀도 감소(골다공증, 골절증, 높은 골절위험, 느린 골절수리)
- 내장 및 트렁크 지방 증착(중앙 비만) 및 식욕 자극으로 인한 체중 증가; 코르티코스테로이드 유도 지방질증후군 참조
- 장기간 또는 과다한 사용으로 인한 고질혈증(외생 쿠싱 증후군이라고도 함)
- 기억력 및 주의력 결핍[44] 장애
- 부신부전증(오래 사용하다가 테이퍼 없이 갑자기 멈춘 경우)
- 근육 및 힘줄 파괴(단백질 분해), 약점, 근육량 감소 및 보수[45][26]
- 말라르 지방 패드의 확장 및 피부 속 작은 혈관 확장
- 경막외부 공간[46] 내 지방질증
- 중추신경계에 미치는 흥분효과(이포리아, 정신이상)
- 월경기의 무배란, 불규칙성
- 성장 실패, 지연된 사춘기
- 혈장 아미노산 증가, 요소 형성 증가, 음질소 균형
- 안압 상승에 따른 녹내장
- 백내장
- 국소 스테로이드 중독
높은 용량에서 하이드로코르티손(코르티솔)과 미네랄로코르티코이드 효력이 현저한 글루코코르티코이드 역시 미네랄로코르티코르티코이드 효과를 발휘할 수 있지만, 생리학적 용량에서 이는 미네랄로코르티코르티코이드 표적조직에서 11β-히드록시스테로이드 디드로제2(11β-HSD2)에 의한 코티솔의 급속한 저하에 의해 방지된다.미네랄코르티코이드 효과는 염분과 수분 보유, 세포외 유체 부피 확장, 고혈압, 칼륨 고갈, 대사 알칼리증 등을 포함할 수 있다.
면역결핍증
글루코코르티코이드는 면역억제를 유발하여 중성미자의 기능 및/또는 수를 감소시키고, 림프구(B세포와 T세포 모두 포함), 단세포, 대식세포, 피부의 해부학적 장벽 기능을 감소시킨다.[47]이 억제는 충분히 크면 T세포결핍, 구강면역결핍, 중성미자 등 면역결핍의 발현을 유발할 수 있다.
| 박테리아 | |
|---|---|
| 곰팡이 | |
| 바이러스 | |
| 기타 |
철수
위에 열거한 효과 외에도 단 며칠간 고선량 글루코코르티코이드의 사용이 환자의 부신 억제 호르몬을 생성하기 시작하여 저선량 코티코트로핀 방출 호르몬을 억제하여 전뇌 뇌하수체에 의한 부신 항산화 호르몬의 생성을 억제하게 된다.[19]장기간 억제가 진행되면 부신 위축증(생리적으로 수축)이 나타나며 외생 글루코르티코이드의 단종 후 완전한 기능을 회복하는 데 수개월이 걸릴 수 있다.
이 회복기 동안 환자는 질병과 같은 스트레스 시기에는 부신 부족에 취약하다.억제 용량과 부신 회복 시간은 매우 다양하지만, 잠재적 부신 억제 및 회복량을 추정하여 환자에 대한 위험을 줄이기 위한 임상 지침이 고안되었다.다음은 한 가지 예다.
- 환자가 5일 이하 동안 매일 고선량 투여를 받은 경우 갑자기 중단(부신부전증인 경우 생리학적 대체물로 감소)할 수 있다.완전한 부신 회복은 일주일 후에 일어난다고 가정할 수 있다.
- 고선량을 6일에서 10일 동안 사용한 경우 즉시 대체 선량으로 줄이고 4일 동안 더 가늘어진다.부신회복은 스테로이드제 완성이후 2주에서 4주 이내에 발생한다고 가정할 수 있다.
- 11~30일 동안 고선량을 사용한 경우 즉시 교체할 수 있도록 두 번으로 줄인 다음 4일마다 25%씩 줄이십시오.선량이 교체의 절반 미만일 때 완전히 중단한다.완전한 부신 회복은 철수가 완료된 후 1~3개월 이내에 이루어져야 한다.
- 고선량을 30일 이상 사용한 경우 즉시 두 번의 교체로 선량을 줄이고 교체에 도달할 때까지 매주 25%씩 줄이십시오.그런 다음 아침 단 하루 복용량으로 경구 하이드로코르티손이나 코르티손으로 바꾸고, 매주 2.5mg씩 점차 감소한다.아침 선량이 교체선량보다 작을 경우 아침 선량 전에 0800 코티솔 수치를 확인하여 정상적인 기저 부신 기능의 반환을 기록할 수 있다. 0800 코티솔이 10μg/dl일 때 약물 사용을 중지한다.장기간의 억제성 외생 스테로이드 후에 완전한 부신 회복 시간을 예측하는 것은 어렵다; 어떤 사람들은 거의 1년이 걸릴지도 모른다.
- 스테로이드제가 투여되는 기본 조건의 플레어업에는 위에서 설명한 것보다 더 점진적인 테이퍼가 필요할 수 있다.
참고 항목
- 코르티코스테로이드 목록
- 코르티코스테로이드 순환 케탈 목록
- 코르티코스테로이드 에스테르 목록
- 아미노글루테시미드 블록 글루코르티코이드 분비물
- GITR(글루코르티코이드 유도 TNF 수용체)
- 글루코르티코이드수용체
- 면역억제제
- 막 글루코르티코이드수용체
- 메티라폰 블록 글루코르티코이드 분비물
- 선택적 글루코코르티코이드 수용체 작용제
- 국소 스테로이드
- 스테로이드 위축증
- 국소 스테로이드 철수
- 비스테로이드성 항염증제(NSAID)
참조
- ^ a b Pelt AC (2011). Glucocorticoids: effects, action mechanisms, and therapeutic uses. Hauppauge, N.Y.: Nova Science. ISBN 978-1617287589.
- ^ a b c Rhen T, Cidlowski JA (Oct 2005). "Antiinflammatory action of glucocorticoids--new mechanisms for old drugs". The New England Journal of Medicine. 353 (16): 1711–23. doi:10.1056/NEJMra050541. PMID 16236742.
- ^ Häggström, Mikael; Richfield, David (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ a b Pazirandeh A, Xue Y, Prestegaard T, Jondal M, Okret S (May 2002). "Effects of altered glucocorticoid sensitivity in the T cell lineage on thymocyte and T cell homeostasis". FASEB Journal. 16 (7): 727–9. doi:10.1096/fj.01-0891fje. PMID 11923224. S2CID 23891076.
- ^ a b Carlson NR (2010). Physiology of Behavior (11th ed.). New York: Allyn & Bacon. p. 605. ISBN 978-0-205-23939-9.
- ^ a b Sapolsky RM (October 1994). "Glucocorticoids, stress and exacerbation of excitotoxic neuron death". Seminars in Neuroscience. 6 (5): 323–331. doi:10.1006/smns.1994.1041.
- ^ a b de Quervain DJ, Roozendaal B, McGaugh JL (Aug 1998). "Stress and glucocorticoids impair retrieval of long-term spatial memory". Nature. 394 (6695): 787–90. Bibcode:1998Natur.394..787D. doi:10.1038/29542. PMID 9723618. S2CID 4388676.
- ^ a b Lupien SJ, McEwen BS, Gunnar MR, Heim C (Jun 2009). "Effects of stress throughout the lifespan on the brain, behaviour and cognition". Nature Reviews. Neuroscience. 10 (6): 434–45. doi:10.1038/nrn2639. PMID 19401723. S2CID 205504945.
- ^ a b Cahill L, McGaugh JL (Jul 1998). "Mechanisms of emotional arousal and lasting declarative memory". Trends in Neurosciences. 21 (7): 294–9. doi:10.1016/s0166-2236(97)01214-9. PMID 9683321. S2CID 29839557.
- ^ Belanoff JK, Gross K, Yager A, Schatzberg AF (2001). "Corticosteroids and cognition". Journal of Psychiatric Research. 35 (3): 127–45. doi:10.1016/S0022-3956(01)00018-8. PMID 11461709.
- ^ Lupien SJ, Maheu F, Tu M, Fiocco A, Schramek TE (Dec 2007). "The effects of stress and stress hormones on human cognition: Implications for the field of brain and cognition". Brain and Cognition. 65 (3): 209–37. doi:10.1016/j.bandc.2007.02.007. PMID 17466428. S2CID 5778988.
- ^ Wolkowitz OM, Lupien SJ, Bigler ED (Jun 2007). "The "steroid dementia syndrome": a possible model of human glucocorticoid neurotoxicity". Neurocase. 13 (3): 189–200. doi:10.1080/13554790701475468. PMID 17786779. S2CID 39340010.
- ^ Norra C, Arndt M, Kunert HJ (Jan 2006). "Steroid dementia: an overlooked diagnosis?". Neurology. 66 (1): 155, author reply 155. doi:10.1212/01.wnl.0000203713.04232.82. PMID 16401879.
- ^ Varney NR, Alexander B, MacIndoe JH (Mar 1984). "Reversible steroid dementia in patients without steroid psychosis". The American Journal of Psychiatry. 141 (3): 369–72. doi:10.1176/ajp.141.3.369. PMID 6703100.
- ^ Liu C, Guan J, Kang Y, Xiu H, Chen Y, Deng B, Liu K (2010). "Inhibition of dehydration-induced water intake by glucocorticoids is associated with activation of hypothalamic natriuretic peptide receptor-A in rat". PLOS ONE. 5 (12): e15607. Bibcode:2010PLoSO...515607L. doi:10.1371/journal.pone.0015607. PMC 3004933. PMID 21187974.
- ^ Liu C, Chen Y, Kang Y, Ni Z, Xiu H, Guan J, Liu K (Oct 2011). "Glucocorticoids improve renal responsiveness to atrial natriuretic peptide by up-regulating natriuretic peptide receptor-A expression in the renal inner medullary collecting duct in decompensated heart failure". The Journal of Pharmacology and Experimental Therapeutics. 339 (1): 203–9. doi:10.1124/jpet.111.184796. PMID 21737535. S2CID 1892149.
- ^ a b c d e Revollo JR, Cidlowski JA (Oct 2009). "Mechanisms generating diversity in glucocorticoid receptor signaling". Annals of the New York Academy of Sciences. 1179 (1): 167–78. Bibcode:2009NYASA1179..167R. doi:10.1111/j.1749-6632.2009.04986.x. PMID 19906239. S2CID 28995545.
- ^ a b c d e f Newton R, Holden NS (Oct 2007). "Separating transrepression and transactivation: a distressing divorce for the glucocorticoid receptor?". Molecular Pharmacology. 72 (4): 799–809. doi:10.1124/mol.107.038794. PMID 17622575. S2CID 52803631.
- ^ a b Nicolaides NC, Pavlaki AN, Maria Alexandra MA, Chrousos G (2018). "Glucocorticoid Therapy and Adrenal Suppression". In Feingold KR, Anawalt B, Boyce A, et al. (eds.). Endotext. MDText.com. PMID 25905379.
- ^ Liapi, C; Chrousos, GP (1992). "Glucocorticoids". In Yaffe, SJ; Aranda, JV (eds.). Pediatric Pharmacology: Therapeutic Principles in Practice (2nd ed.). Philadelphia: Saunders. pp. 466–475. ISBN 978-0721629711.
- ^ Leung DY, Hanifin JM, Charlesworth EN, Li JT, Bernstein IL, Berger WE, Blessing-Moore J, Fineman S, Lee FE, Nicklas RA, Spector SL (Sep 1997). "Disease management of atopic dermatitis: a practice parameter. Joint Task Force on Practice Parameters, representing the American Academy of Allergy, Asthma and Immunology, the American College of Allergy, Asthma and Immunology, and the Joint Council of Allergy, Asthma and Immunology. Work Group on Atopic Dermatitis" (PDF). Annals of Allergy, Asthma & Immunology. 79 (3): 197–211. doi:10.1016/S1081-1206(10)63003-7. PMID 9305225. Archived from the original (PDF) on 2016-04-21.
- ^ USA (2021-08-09). "Deflazacort Versus Other Glucocorticoids: A Comparison". Ncbi.nlm.nih.gov. Retrieved 2022-02-11.
- ^ Tarner IH, Englbrecht M, Schneider M, van der Heijde DM, Müller-Ladner U (2012). "The role of corticosteroids for pain relief in persistent pain of inflammatory arthritis: a systematic literature review". The Journal of Rheumatology. Supplement. 90: 17–20. doi:10.3899/jrheum.120337. PMID 22942324. S2CID 31663619.
- ^ Haywood A, Good P, Khan S, Leupp A, Jenkins-Marsh S, Rickett K, Hardy JR (2015). "Corticosteroids for the management of cancer-related pain in adults" (PDF). The Cochrane Database of Systematic Reviews. 2021 (4): CD010756. doi:10.1002/14651858.CD010756.pub2. hdl:10072/134448. PMC 8127040. PMID 25908299.
- ^ Chowdhury R, Naaseri S, Lee J, Rajeswaran G (2014). "Imaging and management of greater trochanteric pain syndrome". Postgraduate Medical Journal. 90 (1068): 576–81. doi:10.1136/postgradmedj-2013-131828. PMID 25187570. S2CID 24344273.
- ^ a b Mohamadi A, Chan JJ, Claessen FM, Ring D, Chen NC (January 2017). "Corticosteroid Injections Give Small and Transient Pain Relief in Rotator Cuff Tendinosis: A Meta-analysis". Clinical Orthopaedics and Related Research. 475 (1): 232–243. doi:10.1007/s11999-016-5002-1. PMC 5174041. PMID 27469590.
- ^ a b Leung DY, Bloom JW (Jan 2003). "Update on glucocorticoid action and resistance". The Journal of Allergy and Clinical Immunology. 111 (1): 3–22, quiz 23. doi:10.1067/mai.2003.97. PMID 12532089.
- ^ Banuelos J, Shin S, Cao Y, Bochner BS, Morales-Nebreda L, Budinger GR, Zhou L, Li S, Xin J, Lingen MW, Dong C, Schleimer RP, Lu NZ (Jan 2016). "BCL-2 protects human and mouse Th17 cells from glucocorticoid-induced apoptosis". Allergy. 71 (5): 640–50. doi:10.1111/all.12840. PMC 4844778. PMID 26752231.
- ^ Pan LY, Mendel DB, Zurlo J, Guyre PM (1990). "Regulation of the steady state level of Fc gamma RI mRNA by IFN-gamma and dexamethasone in human monocytes, neutrophils, and U-937 cells". Journal of Immunology. 145 (1): 267–75. PMID 2141616.
- ^ Ruiz P, Gomez F, King M, Lopez R, Darby C, Schreiber AD (1991). "In vivo glucocorticoid modulation of guinea pig splenic macrophage Fc gamma receptors". The Journal of Clinical Investigation. 88 (1): 149–57. doi:10.1172/JCI115271. PMC 296015. PMID 1829095.
- ^ Werb Z (1980). "Hormone receptors and normal regulation of macrophage physiological function". In van Furth R (ed.). Mononuclear phagocytes functional aspects. The Hague: M. Nijhoff. p. 825. ISBN 978-94-009-8793-7.
Glucocorticoids may also decrease the number of Fc receptors on macrophages, but this immunosuppressive function is controversial because of the lack of sensitivity in Fc receptor techniques and the high concentration of glucocorticoids used in previous experiments.
- ^ Goppelt-Struebe M, Wolter D, Resch K (Dec 1989). "Glucocorticoids inhibit prostaglandin synthesis not only at the level of phospholipase A2 but also at the level of cyclo-oxygenase/PGE isomerase". British Journal of Pharmacology. 98 (4): 1287–95. doi:10.1111/j.1476-5381.1989.tb12676.x. PMC 1854794. PMID 2514948.
- ^ Jun SS, Chen Z, Pace MC, Shaul PW (Feb 1999). "Glucocorticoids downregulate cyclooxygenase-1 gene expression and prostacyclin synthesis in fetal pulmonary artery endothelium". Circulation Research. 84 (2): 193–200. doi:10.1161/01.RES.84.2.193. PMID 9933251.
- ^ Flower R, Rang HP, Dale MM, Ritter JM (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 978-0-443-06911-6.
- ^ Mizokami, Tetsuya; Hamada, Katsuhiko; Maruta, Tetsushi; Higashi, Kiichiro; Tajiri, Junichi (September 2016). "Painful Radiation Thyroiditis after 131I Therapy for Graves' Hyperthyroidism: Clinical Features and Ultrasonographic Findings in Five Cases". European Thyroid Journal. 5 (3): 201–206. doi:10.1159/000448398. ISSN 2235-0640. PMC 5091234. PMID 27843811.
- ^ Rado JP, Blumenfeld G, Hammer S (Nov 1959). "The effect of prednisone and 6-methylprednisolone on mercurial diuresis in patients with refractory cardiac edema". The American Journal of the Medical Sciences. 238 (5): 542–51. doi:10.1097/00000441-195911000-00003. PMID 14435747. S2CID 38687480.
- ^ Riemer AD (Apr 1958). "Application of the newer corticosteroids to augment diuresis in congestive heart failure". The American Journal of Cardiology. 1 (4): 488–96. doi:10.1016/0002-9149(58)90120-6. PMID 13520608.
- ^ Newman DA (Feb 1959). "Reversal of intractable cardiac edema with prednisone". New York State Journal of Medicine. 59 (4): 625–33. PMID 13632954.
- ^ Zhang H, Liu C, Ji Z, Liu G, Zhao Q, Ao YG, Wang L, Deng B, Zhen Y, Tian L, Ji L, Liu K (Sep 2008). "Prednisone adding to usual care treatment for refractory decompensated congestive heart failure". International Heart Journal. 49 (5): 587–95. doi:10.1536/ihj.49.587. PMID 18971570.
- ^ Liu C, Liu G, Zhou C, Ji Z, Zhen Y, Liu K (Sep 2007). "Potent diuretic effects of prednisone in heart failure patients with refractory diuretic resistance". The Canadian Journal of Cardiology. 23 (11): 865–8. doi:10.1016/s0828-282x(07)70840-1. PMC 2651362. PMID 17876376.
- ^ Liu C, Chen H, Zhou C, Ji Z, Liu G, Gao Y, Tian L, Yao L, Zheng Y, Zhao Q, Liu K (Oct 2006). "Potent potentiating diuretic effects of prednisone in congestive heart failure". Journal of Cardiovascular Pharmacology. 48 (4): 173–6. doi:10.1097/01.fjc.0000245242.57088.5b. PMID 17086096. S2CID 45800521.
- ^ Massari F, Mastropasqua F, Iacoviello M, Nuzzolese V, Torres D, Parrinello G (Mar 2012). "The glucocorticoid in acute decompensated heart failure: Dr Jekyll or Mr Hyde?". The American Journal of Emergency Medicine. 30 (3): 517.e5–10. doi:10.1016/j.ajem.2011.01.023. PMID 21406321.
- ^ Gennari C (May 1993). "Differential effect of glucocorticoids on calcium absorption and bone mass". British Journal of Rheumatology. 32 Suppl 2: 11–4. doi:10.1093/rheumatology/32.suppl_2.11. PMID 8495275.
- ^ Keenan PA, Jacobson MW, Soleymani RM, Mayes MD, Stress ME, Yaldoo DT (Dec 1996). "The effect on memory of chronic prednisone treatment in patients with systemic disease". Neurology. 47 (6): 1396–402. doi:10.1212/WNL.47.6.1396. PMID 8960717. S2CID 20430943.
- ^ Gelber JD (January 2017). "CORR Insights: Corticosteroid Injections Give Small and Transient Pain Relief in Rotator Cuff Tendinosis: A Meta-analysis". Clinical Orthopaedics and Related Research. 475 (1): 244–246. doi:10.1007/s11999-016-5044-4. PMC 5174046. PMID 27572298.
- ^ Koch CA, Doppman JL, Patronas NJ, Nieman LK, Chrousos GP (Apr 2000). "Do glucocorticoids cause spinal epidural lipomatosis? When endocrinology and spinal surgery meet". Trends in Endocrinology and Metabolism. 11 (3): 86–90. doi:10.1016/S1043-2760(00)00236-8. PMID 10707048. S2CID 31233438.
- ^ a b Klein NC, Go CH, Cunha BA (Jun 2001). "Infections associated with steroid use". Infectious Disease Clinics of North America. 15 (2): 423–32, viii. doi:10.1016/s0891-5520(05)70154-9. PMID 11447704.
추가 읽기
- Wolkowitz OM, Burke H, Epel ES, Reus VI (Oct 2009). "Glucocorticoids. Mood, memory, and mechanisms". Annals of the New York Academy of Sciences. 1179: 19–40. doi:10.1111/j.1749-6632.2009.04980.x. PMID 19906230.




