MAPK 인산염
MAPK phosphataseMKP(MAPK Phosphatases)는 미토겐 활성 단백질 키나제(MAPK) 신호 감응에 관련된 가장 큰 종류의 인산염이다.[1][2]MAPK 신호 전달 경로는 개발 및 전생의 여러 특징을 규제한다.[3][4]이것은 유전자 조절, 세포 증식, 프로그램된 세포 죽음과 스트레스 반응을 포함할 수 있다.[5]그러므로 MAPK 인산염은 이러한 경로의 중요한 조절기 성분이다.
함수
MAPK 인산염은 진핵생물에서만 발견되며 부정적인 피드백으로 작용하도록 MAP 키나아제를 부정적으로 규제한다.[5]MKP는 또한 Treonine과 MAPKs 활성화 사이트에 있는 Tyrosine 잔여물을 탈인산화하여 MAPK를 비활성화하기 때문에 이중특이성인산화효소(DUSP)[6]로도 알려져 있다.[7]MKP는 C-terminus에 촉매 영역이 있고 N-terminus에 규제 영역이 있다.[8]MAPK가 MKP에 바인딩되는 위치는 MKP의 N단자 근처에서 발견된다.이 결합은 MKP 결합 부분의 양전하 잔류물과 MAPK 결합 사이트의 음전하 잔류물의 정전기 상호작용에 기인한다.[9]
분류
3개의 하위 등급으로 세분될 수 있는 10개의 주요 MKP가[10] 있는데, 이것은 그들의 게놈 구조 또는 그들이 결합하는 기질 유형(MAPK)을 대표한다.[11]여기에는 부분군 1에 속하는 DUSP1, DUSP2, DUSP4 및 DUSP5가 포함된다. DUSP6, DUSP7, DUSP9 및 DUSP10은 부분군 2에 속한다.DUSP8과 DUSP16은 부분군 3에 속하며, 이러한 부분군은 MKP의 게놈 구조에 기초한다.[12]최신 MKP-8은 총 MKP를 11개로 늘리고, MKP-8은 p38키나제를 억제하는 역할을 한다.[13]
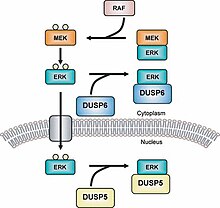
이중 특이성 인산염(DUSPEX)도 단백질 티로신 인산염 계열에 속한다.[14]MKP는 타입 I, II, III로 분류되는데, 타입 I MKP가 핵 지역에 위치하는 경우 타입 II는 세포질 영역에 위치하며 타입 III는 핵 및 세포질 영역에 위치한다.[15]이 세 가지 유형의 MKP의 서로 다른 위치 때문에 다른 유형의 신호를 발생시킬 수 있다.예를 들어 MKP-1(유형 I MKP)은 MAPKs의 하위 세포군을 비활성화하여 유전자 발현을 제어한다.[16]LXXLL 모티브(GFP-MKP-147-367)가 없으면 MKP-1은 핵 내부에서 국소화할 수 없으며 CH2A 도메인보다 먼저 나타난다.[17]최신 MKP, MKP-8은 세포의[18] 핵 영역에 위치하기 때문에 그룹 I에 속한다. 최근의 연구는 히스톤 디아세틸라제 이소성형(HDAC1, -2, -3) 디아세틸레이트 MKP-1과 이러한 변환 후 수정은 MAPK 신호와 선천적인 면역 신호를 증가시킨다는 것을 보여준다.[19]
N-단자 영역은 각 MKP 간에 상당히 구별되지만, 일반적으로 모두 CH2 도메인을 포함한다.[20]MKP-1에서 MAPK는 N-터미널에 위치한 CH2A와 CHB 도메인 사이에 있는 활성 사이트에 바인딩된다.[21][22]
타입 II MKP의 예로는 ERK2를 퇴적시켜 세포질 영역에 고정시킴으로써 ERK2의 활동을 조절하는 MKP-3가 있다.[23]MKP-3도 인광화 여부와 상관없이 ERK2에 바인딩한다.[24]MKP-4는 타입 I에 속하는 또 다른 MKP로, 태반, 신장, 배아 간세포에서만 발견되기 때문에 이 부분군의 다른 MKP와는 구별된다.[25]MKP-5는 p38과 SPK/JNK에 구체적으로 결합하는 타입 III MKP로 세포질 및 세포핵 영역에서 모두 발견된다.[26]MKP-5는 심장, 폐, 간, 신장, 골격근 세포에만 위치한다.[27]비정형 MKPs라는 그룹에 속하는 MKP도 있다.예를 들어 Pepina H1 관련(VHR)은 DUSP 영역만 가지고 있기 때문에 비정형 MKP이다.[28]VHR은 림프체와 조혈세포에서만 발견되며, T세포 수용체에서는 ERK1/2와 JNKs를 비활성화한다.[29]VHR은 또한 세포 주기 구속을 유도한다.[30][31]
| 이름 | Alt. 이름 | 하위 그룹 |
|---|---|---|
| DUSP1 | MKP-1 | I |
| DUSP2 | I | |
| DUSP4 | MKP-2 | I |
| DUSP5 | I | |
| 도스프6 | MKP-3 | II |
| DUSP7 | II | |
| DUSP8 | III | |
| DUSP9 | MKP-4 | II |
| DUSP10 | MKP-5 | ? |
| DUSP14 | MKP-6 | ? |
| DUSP16 | MKP-7 | III |
| 도스프26 | MKP-8 | I |
참조
- ^ 미국 국립 의학 도서관의 MAPK+인산염 환자 표제(MesH)
- ^ Dickinson, Robin J.; Keyse, Stephen M. (15 November 2006). "Diverse physiological functions for dual-specificity MAP kinase phosphatases". J Cell Sci. 119 (22): 4607–4615. doi:10.1242/jcs.03266. PMID 17093265.
- ^ Caunt, Christopher J.; Keyse, Stephen M. (January 2013). "Dual-specificity MAP kinase phosphatases (MKPs)". FEBS Journal. 280 (2): 489–504. doi:10.1111/j.1742-4658.2012.08716.x. PMC 3594966. PMID 22812510.
- ^ Low, Heng Boon; Zhang, Yongliang (2016). "Regulatory Roles of MAPK Phosphatases in Cancer". Immune Network. 16 (2): 85–98. doi:10.4110/in.2016.16.2.85. PMC 4853501. PMID 27162525.
- ^ a b Chang, Lufen; Karin, Michael (1 March 2001). "Mammalian MAP kinase signalling cascades". Nature. 410 (6824): 37–40. doi:10.1038/35065000. PMID 11242034.
- ^ Comalada, Mònica; Lloberas, Jorge; Celada, Antonio (1 August 2012). "MKP-1: A critical phosphatase in the biology of macrophages controlling the switch between proliferation and activation". European Journal of Immunology. 42 (8): 1938–1948. doi:10.1002/eji.201242441. PMID 22865045.
- ^ Kondoh, Kunio; Nishida, Eisuke (1 August 2007). "Regulation of MAP kinases by MAP kinase phosphatases". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1773 (8): 1227–1237. doi:10.1016/j.bbamcr.2006.12.002. PMID 17208316.
- ^ Dickinson, Robin J.; Keyse, Stephen M. (15 November 2006). "Diverse physiological functions for dual-specificity MAP kinase phosphatases". J Cell Sci. 119 (22): 4607–4615. doi:10.1242/jcs.03266. PMID 17093265.
- ^ Theodosiou, Aspasia; Ashworth, Alan (1 January 2002). "MAP kinase phosphatases". Genome Biology. 3 (7): reviews3009.1–reviews3009.10. doi:10.1186/gb-2002-3-7-reviews3009. ISSN 1465-6906. PMC 139386. PMID 12184814.
- ^ Caunt, Christopher J; Keyse, Stephen M (7 November 2016). "Dual-specificity MAP kinase phosphatases (MKPs)". The FEBS Journal. 280 (2): 489–504. doi:10.1111/j.1742-4658.2012.08716.x. ISSN 1742-464X. PMC 3594966. PMID 22812510.
- ^ Theodosiou, Aspasia; Ashworth, Alan (1 January 2002). "MAP kinase phosphatases". Genome Biology. 3 (7): reviews3009.1–reviews3009.10. doi:10.1186/gb-2002-3-7-reviews3009. PMC 139386. PMID 12184814.
- ^ Theodosiou, Aspasia; Ashworth, Alan (1 January 2002). "MAP kinase phosphatases". Genome Biology. 3 (7): reviews3009.1–reviews3009.10. doi:10.1186/gb-2002-3-7-reviews3009. PMC 139386. PMID 12184814.
- ^ Vasudevan, Sanjeev A.; Skoko, John; Wang, Kuan; Burlingame, Susan M.; Patel, Parul N.; Lazo, John S.; Nuchtern, Jed G.; Yang, Jianhua (6 May 2005). "MKP-8, a novel MAPK phosphatase that inhibits p38 kinase". Biochemical and Biophysical Research Communications. 330 (2): 511–518. doi:10.1016/j.bbrc.2005.03.028. PMID 15796912.
- ^ Jeffrey, Kate L.; Camps, Montserrat; Rommel, Christian; Mackay, Charles R. (May 2007). "Targeting dual-specificity phosphatases: manipulating MAP kinase signalling and immune responses". Nature Reviews Drug Discovery. 6 (5): 391–403. doi:10.1038/nrd2289. PMID 17473844.
- ^ Kondoh, Kunio; Nishida, Eisuke (1 August 2007). "Regulation of MAP kinases by MAP kinase phosphatases". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1773 (8): 1227–1237. doi:10.1016/j.bbamcr.2006.12.002. PMID 17208316.
- ^ Wu, J. J.; Zhang, L.; Bennett, A. M. (16 May 2005). "The Noncatalytic Amino Terminus of Mitogen-Activated Protein Kinase Phosphatase 1 Directs Nuclear Targeting and Serum Response Element Transcriptional Regulation". Molecular and Cellular Biology. 25 (11): 4792–4803. doi:10.1128/MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.-
- ^ Wu, J. J.; Zhang, L.; Bennett, A. M. (16 May 2005). "The Noncatalytic Amino Terminus of Mitogen-Activated Protein Kinase Phosphatase 1 Directs Nuclear Targeting and Serum Response Element Transcriptional Regulation". Molecular and Cellular Biology. 25 (11): 4792–4803. doi:10.1128/MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.
- ^ Vasudevan, Sanjeev A.; Skoko, John; Wang, Kuan; Burlingame, Susan M.; Patel, Parul N.; Lazo, John S.; Nuchtern, Jed G.; Yang, Jianhua (6 May 2005). "MKP-8, a novel MAPK phosphatase that inhibits p38 kinase". Biochemical and Biophysical Research Communications. 330 (2): 511–518. doi:10.1016/j.bbrc.2005.03.028. PMID 15796912.
- ^ Jeong, Y; Du, R; Zhu, X (2014). "Histone deacetylase isoforms regulate innate immune responses by deacetylating mitogen-activated protein kinase phosphatase-1". J Leukoc Biol. 95 (4): 651–9. doi:10.1189/jlb.1013565. PMID 24374966.
- ^ Wu, JJ; Zhang, L; Bennett, AM (2005). "The Noncatalytic Amino Terminus of Mitogen-Activated Protein Kinase Phosphatase 1 Directs Nuclear Targeting and Serum Response Element Transcriptional Regulation". Molecular and Cellular Biology. 25 (11): 4792–4803. doi:10.1128/MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.
- ^ Wu, J. J.; Zhang, L.; Bennett, A. M. (16 May 2005). "The Noncatalytic Amino Terminus of Mitogen-Activated Protein Kinase Phosphatase 1 Directs Nuclear Targeting and Serum Response Element Transcriptional Regulation". Molecular and Cellular Biology. 25 (11): 4792–4803. doi:10.1128/MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.
- ^ BARDWELL, A. Jane; ABDOLLAHI, Mahsa; BARDWELL, Lee (15 March 2003). "Docking sites on mitogen-activated protein kinase (MAPK) kinases, MAPK phosphatases and the Elk-1 transcription factor compete for MAPK binding and are crucial for enzymic activity". Biochemical Journal. 370 (3): 1077–1085. doi:10.1042/BJ20021806. PMC 1223246. PMID 12529172.
- ^ Karlsson, Maria; Mathers, Joanne; Dickinson, Robin J.; Mandl, Margret; Keyse, Stephen M. (1 October 2004). "Both Nuclear-Cytoplasmic Shuttling of the Dual Specificity Phosphatase MKP-3 and Its Ability to Anchor MAP Kinase in the Cytoplasm Are Mediated by a Conserved Nuclear Export Signal". Journal of Biological Chemistry. 279 (40): 41882–41891. doi:10.1074/jbc.M406720200. ISSN 0021-9258. PMID 15269220.
- ^ Camps, M. (22 May 1998). "Catalytic Activation of the Phosphatase MKP-3 by ERK2 Mitogen-Activated Protein Kinase". Science. 280 (5367): 1262–1265. doi:10.1126/science.280.5367.1262. PMID 9596579.
- ^ Muda, M.; Boschert, U.; Smith, A.; Antonsson, B.; Gillieron, C.; Chabert, C.; Camps, M.; Martinou, I.; Ashworth, A.; Arkinstall, S. (21 February 1997). "Molecular Cloning and Functional Characterization of a Novel Mitogen-activated Protein Kinase Phosphatase, MKP-4". Journal of Biological Chemistry. 272 (8): 5141–5151. doi:10.1074/jbc.272.8.5141. PMID 9030581.
- ^ Tanoue, T. (9 July 1999). "Molecular Cloning and Characterization of a Novel Dual Specificity Phosphatase, MKP-5". Journal of Biological Chemistry. 274 (28): 19949–19956. doi:10.1074/jbc.274.28.19949. PMID 10391943.
- ^ Kondoh, Kunio; Nishida, Eisuke (1 August 2007). "Regulation of MAP kinases by MAP kinase phosphatases". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1773 (8): 1227–1237. doi:10.1016/j.bbamcr.2006.12.002. PMID 17208316.
- ^ Kondoh, Kunio; Nishida, Eisuke (1 August 2007). "Regulation of MAP kinases by MAP kinase phosphatases". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1773 (8): 1227–1237. doi:10.1016/j.bbamcr.2006.12.002. PMID 17208316.
- ^ Alonso, A.; Saxena, M.; Williams, S.; Mustelin, T. (20 November 2000). "Inhibitory Role for Dual Specificity Phosphatase VHR in T Cell Antigen Receptor and CD28-induced Erk and Jnk Activation". Journal of Biological Chemistry. 276 (7): 4766–4771. doi:10.1074/jbc.M006497200. PMID 11085983.
- ^ Rahmouni, Souad; Cerignoli, Fabio; Alonso, Andres; Tsutji, Toshiya; Henkens, Rachel; Zhu, Changjun; Louis-dit-Sully, Christine; Moutschen, Michel; Jiang, Wei; Mustelin, Tomas (9 April 2006). "Loss of the VHR dual-specific phosphatase causescell-cycle arrest and senescence". Nature Cell Biology. 8 (5): 524–531. doi:10.1038/ncb1398. PMID 16604064.
- ^ Rahmouni, Souad; Cerignoli, Fabio; Alonso, Andres; Tsutji, Toshiya; Henkens, Rachel; Zhu, Changjun; Louis-dit-Sully, Christine; Moutschen, Michel; Jiang, Wei; Mustelin, Tomas (1 May 2006). "Loss of the VHR dual-specific phosphatase causes cell-cycle arrest and senescence". Nature Cell Biology. 8 (5): 524–531. doi:10.1038/ncb1398. ISSN 1465-7392. PMID 16604064.