부정맥 유발 심근증
Arrhythmogenic cardiomyopathy| 부정맥 유발 심근증 | |
|---|---|
| 기타 이름 | 부정맥 유발 우심실 심근증(ARVC), 부정맥 유발 우심실 이형성/심실 이형성증(ARVD/C), 우심실 이형성(Right Sycle Dyclosmic Dyposismiscy) |
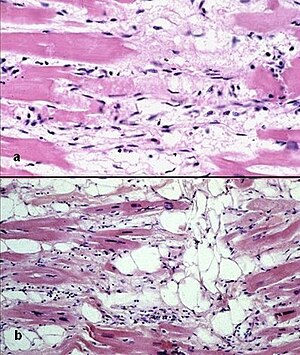 | |
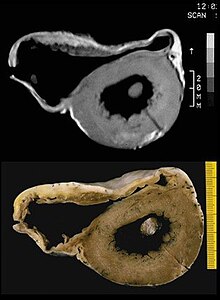
| ARVC/D의 대표적인 미시사적 특징. 조기 섬유화와 아디포시세포 침투(하부)로 진행 중인 근소세포 사망(상부) | |
| 전문 | 심장학 |
부정맥 유발 심근병증(ACM), 부정맥 유발 우심실 이형성증(ARVD), 부정맥 유발 우심실 심근병증(ARVC)은 유전성 심장질환이다.[1]
ACM은 세포를 서로 연결하는 심장 근육 세포 표면의 부분인 데스모솜으로 알려진 심장 근육 부분(심근 또는 심장 근육이라고도 함)의 유전적 결함으로 인해 발생한다. 데스모솜은 여러 개의 단백질로 구성되어 있고, 그러한 단백질들 중 다수는 해로운 돌연변이를 가질 수 있다.
좌심실 배타적 좌심실 질환 사례가 보고됐지만 이 질환은 주로 우심실이 관여하는 비허혈성 심근증의 일종이다. 심실의 자유벽을 수반하는 저동맥 부위가 특징이며, 심근의 섬유 지방 대체, 우심실에서 흔히 발생하는 관련 부정맥이 있다. 명칭 ARVD는 현재 ACM이 심실벽의 이형화를 수반하지 않기 때문에 부적절하고 오해의 소지가 있는 것으로 생각된다. 좌심실에서 발원한 ACM의 경우는 ARVC라는 명칭을 포기하게 되었다.
ACM은 Naxos병이라고 불리는 자가 열성 질환에서 확산된 야자낭성 각질 및 양털 털과 연관되어 발견될 수 있는데, 이 유전적 이상은 또한 압력 스트레스에 가장 많이 노출된 피부의 표피층의 무결성에 영향을 줄 수 있기 때문이다.[2]: 513 [3]
ACM은 어린이와 청소년들에게 심실 부정맥의 중요한 원인이다. 그것은 주로 남성에게서 나타나며, 30-50%의 경우 가족 분포를 가지고 있다.
징후 및 증상
부정맥 유발 심근병증에 걸린 사람들은 심장의 구조에 중대한 이상이 있음에도 불구하고 전혀 증상이 없을 수 있다.[4] 만약 증상이 나타난다면, 초기 증상은 종종 비정상적인 심장 박동(부정맥)으로 인한 것이며, 부정맥 유발 심근병증에서는 두근거림 또는 정전의 형태를 취할 수 있다.[5] 갑작스러운 죽음은 어떠한 선행 증상도 없이 ACM의 첫 번째 제시일 수 있다.[4] 이러한 증상은 종종 청소년기와 초기 성인기에 나타나지만, ACM의 징후는 유아에게 거의 보이지 않을 수 있다.
ACM이 진행됨에 따라, 심실 내의 근육 조직은 팽창하고 약해질 수 있다. 우심실은 전형적으로 먼저 약해져 피로와 발목 부기로 이어진다. 두 개의 심실이 모두 관련된 질병의 후기에는 특히 평평하게 누워 있을 때 호흡곤란이 발생할 수 있다.[4]
ACM의 첫 번째 임상 증상은 보통 청소년기와 초기 성인기에 나타난다. 그러나, 드물게, ACM의 징후는 유아에게서 입증되었다.
유전학
ACM은 대개 자기 지배적 패턴으로 유전되며, 그 패턴은 가변적이다. ACM에 감염된 사람의 30-50%만이 이 질병과 관련된 염색체 위치의 알려진 유전적 돌연변이 중 하나에 양성반응을 보일 것이다.[6][7] 새로운 연구들은 데스모솜 단백질을 위한 유전자 부호화에서 돌연변이(점점 돌연변이)가 이 질병의 발병의 주요 원인임을 보여주었다. 최근 데스민 DES 유전자의 돌연변이가 ACM을 유발할 수 있다는 것이 밝혀졌다.[8] 데스민은 중간 필라멘트 단백질로 데스모솜과 연결되어 있다. 다른 DES 돌연변이는 데스민과 관련 단백질의 비정상적인 집적을 야기한다.[9] 관통부는 일반적으로 20-35%이지만 이탈리아에서는 상당히 높다. 7개의 유전자 로키가 ACM에 관련되어 있다. 병원체 발생이 관련된 다른 위치에 따라 다른지 여부는 불분명하다. 표준 유전자 검사 검사는 현재 예술 심혈관 연구 센터와 병원의 다른 상태에서 검사되고 평가된다. 유형에는 다음이 포함된다.
| 유형 | 오밈 | 유전자 | 로커스 | 참조 |
|---|---|---|---|---|
| ARVD1lpl | 107970 | TGFB3 | 14Q23-Q24 | [10] |
| ARVD2 | 600996 | RYR2 | 1Q42-Q43 | [11] |
| ARVD3 | 602086 | ? | 14Q12-Q22 | |
| ARVD4 | 602087 | ? | 2q32.1-q32.3 | |
| ARVD5 | 604400 | TMEM43 | 3p23 | [12][13] |
| ARVD6 | 604401 | ? | 10p14-p12 | |
| ARVD7 | 609160 | DES | 10Q22.3 | [14][8][15] |
| ARVD8 | 607450 | DSP | 6p24 | [16] |
| ARVD9 | 609040 | PKP2 | 12p11 | [17] |
| ARVD10 | 610193 | DSG2 | 18Q12.1-Q12 | [18][19][20] |
| ARVD11 | 610476 | DSC2 | 18Q12.1 | [21][22][23] |
| ARVD12 | 611528 | 주프 | 17Q21년 | [24][25] |
| ILK | 11p15.4 | [26] | ||
| LMNA | [27] |
병생성
ACM의 병원생성은 대체로 알려져 있지 않다. 세포사멸 프로그램(프로그래밍된 세포사멸)이 큰 역할을 하는 것으로 보인다. 이전에는 우심실만 관여한다고 생각했지만, 최근 코호트에서는 좌심실 질환과 이심실 질환의 사례가 많이 나타나고 있다. 질병과정은 심막하부에서 시작되어 심내막 표면 쪽으로 진행되어 투과적 관여(아마도 심실의 동맥 확장)로 이어진다. 잔류 심근은 심실하와 심실의 삼베쿨레에 국한된다. 이 삼베술래들은 비대해질 수 있다.
동맥류 확장증은 부검의 50%에서 나타난다. 그것은 대개 횡격막, 비정형, 불순형 영역(이형성증의 삼각형이라고 알려져 있다)에서 발생한다. 좌심실은 50~67%의 개인과 관련되어 있다. 좌심실이 관련되면 대개 질병의 진행에 늦고, 좋지 않은 예후를 내포한다.
ACM에서 볼 수 있는 병리학적 패턴은 지방 침투와 섬유질 침투다.
지방 침투
첫 번째 지방 침투는 우심실에 국한된다. 이것은 심근의 부분적 또는 거의 완전한 치환과 벽의 얇아지지 않은 지방 조직을 포함한다. 그것은 주로 RV의 비정형 및 비정형 영역을 포함한다. 좌심실과 심실중격막은 보통 살려둔다. 지방 침투에서는 염증성 침투가 보이지 않는다. 지방 침투 사례의 50%에서 근세포(심초음파 세포) 퇴화와 사망의 증거가 있다.
섬유질 침투
두 번째, 섬유질 침투는 섬유질 조직으로 근세포들을 대체하는 것을 포함한다. 뭉치는 심근염은 현미경 검사에서 염증성 침투(대부분 T세포)가 보이는 경우 3분의 2까지 관여한다. 심근 위축은 상해와 사멸에 기인한다. 이것은 RV 자유벽의 얇아짐을 초래한다 (< 3 mm 두께>까지) 근세포는 섬유지방 조직으로 대체된다. 우선 관련된 지역은 RV 유입관, RV 유출관, RV 첨탑 등이다. 그러나 LV 프리월드는 경우에 따라 관련될 수 있다. 심실중격막의 관여는 드물다. 관련 부위는 동맥류가 형성되기 쉽다.
운동의 역할
최근, 일부 연구들은 격렬한 운동을 병의 가속화된 진행을 위한 새로운 위험으로 밝혀냈다. 301명의 환자에 대한 한 소급 연구는 격렬한 신체 활동에 참여하는 하위 집단(예를 들어 프로 운동선수)이 다른 모집단에 비해 증상 발생이 더 빠르고 사망률이 더 이른다는 것을 결정적으로 보여주었다.[28]
심실 부정맥
ACM에 의한 심실 부정맥은 일반적으로 병든 우심실에서 발생한다. 부정맥의 종류는 빈번한 조기 심실 콤플렉스(PVC)부터 심실빈맥(VT)부터 심실세동(VF)까지 다양하다.
심실 부정맥의 시작 인자가 불분명하지만, 촉발된 활동이나 재진입 때문일 수 있다.
심실 부정맥은 보통 운동과 관련이 있어 카테콜아민에 민감하다는 것을 시사한다. 심실 박자는 전형적으로 오른쪽 축 편차를 가진다. 심실 빈맥의 다중 형태는 동일한 개인에 존재할 수 있으며, 이는 다중 부정맥 유발 집중 또는 경로를 제안한다.
우심실유출관(RVOT) 빈맥은 ACM을 가진 개인에서 볼 수 있는 가장 흔한 VT이다. 이 경우, EKG는 하한축의 좌측다발 분기블록(LBBB) 형태학을 나타낸다.
진단
ACM으로 인한 심실 빈맥에 대한 차등 진단은 다음과 같다.
ACM 진단을 위해 심전도(EKG), 심초음파, 우심실 혈관 조영, 심장 MRI, 유전자 검사 등 다수의 임상 검사가 채용된다.
심전도
ARVD를 가진 사람의 90%가 약간의 심전도 이상을 가지고 있다. ACM에서 볼 수 있는 가장 일반적인 EKG 이상은 V에서1 V까지3 리드의 T파 반전이다. 단, 이는 비특이적인 발견으로 우측다발지점블록(RBBB), 여성, 12세 미만 아동에서는 정상적인 변형으로 볼 수 있다.
RBBB 자체는 ACM을 가진 개인에서 자주 볼 수 있다. 이는 오른쪽 묶음 가지의 어떤 본질적인 이상이 아니라 우심실의 활성화가 지연되었기 때문일 수 있다.
엡실론 파동은 ACM이 있는 파동의 약 50%에서 발견된다. 이것은 QRS 단지의 단자 노치로 설명된다. 그것은 심실 내 전도가 느려졌기 때문이다. 엡실론 파형은 표면 EKG에서 볼 수 있지만 신호 평균 EKG에서 더 흔히 볼 수 있다.
ACM 설정에서 표면 EKG에서 보이는 심실 외피는 일반적으로 좌다발 분기 블록(LBBB) 형태학이며 QRS 축은 -90~+110도이다. 엑토픽 비트의 기원은 보통 지방 변성의 세 가지 영역 중 하나('이형성 장애의 트라이앵글'), 즉 RV 유출로, RV 유입로, RV 에이펙스(RV acex)에서 비롯된다.
신호 평균 심전도(SAECG)는 ACM이 있는 개인의 늦은 전위와 엡실론 파동을 감지하는 데 사용된다.
심초음파
심장 초음파 검사에서 종이처럼 얇은 RV가 없는 벽으로 확장된 저동맥 우심실이 나타날 수 있다. RV의 팽창은 삼첨판 환원(tricuspid valve annulus)의 확장을 유발하며, 삼첨판 역류(tricuspid regurgation)의 후속으로 발생한다. 역설적인 중격운동도 존재할 수 있다.
MRI
RV 자유벽의 지방 침투는 심장 MRI에서 볼 수 있다. 지방은 T1-가중 영상에서 강도를 높였다. 그러나 정상 심장과 인접한 곳에서 흔히 볼 수 있는 심장내 지방과 심막내 지방을 구별하기는 어려울 수 있다. 또한 삼추하부위는 지방이 풍부한 심실설탕과 구별하기 어려울 수 있다.
심장 MRI는 RV 자유벽의 극한 박막과 유사점을 시각화할 수 있다. 그러나 정상적인 RV 자유벽은 두께가 약 3mm일 수 있으므로 시험의 민감도가 떨어질 수 있다.
혈관조영술
우심실 혈관조영술은 ACM 진단을 위한 금본위주로 간주된다. ACM과 일치하는 소견은 RV의 비정형, 무정형 및 미분압 부위로 국부적으로 국부화된 유사 또는 이상유동학이다. 특수성은 90%이지만, 검정은 관찰자에 의존한다.
생검
우심실의 경정맥 생검은 ACM의 경우 매우 구체적일 수 있지만 감도는 낮다. 거짓 양성에는 장기간의 과도한 알코올 사용과 듀첸이나 베커 근위축증 등 심실의 지방 침투가 있는 다른 조건들이 포함된다.
그러나 허위의 부정은 흔한데, 왜냐하면 질병은 전형적으로 심피막에서 심내막으로 진행되기 때문이다(심내막에서 조직검사가 나오는 경우), 그리고 질병의 부분적인 성질을 가지고 있다. 또한 이 질환 과정에서 흔히 볼 수 있는 종이박막 우심실 프리월(paper-thinic free wall) 때문에 대부분의 생검 시료를 심실세중으로부터 채취하는데, 이 질환 과정에는 일반적으로 관여하지 않는다.
ACM과 일치하는 생체검사 검체는 지방 3% 이상, 섬유조직 40%, 그리고 <45% 균세포>를 가질 것이다.
지방 또는 섬유질 조직에 의한 RV 심근의 전체 두께 치환에 대한 사후 모체 조직학적 실증 실험은 ACM과 일치한다.
유전자 검사
ACM은 침투력이 감소된 자가 우성 특성이다. ACM 환자의 약 40~50%는 데스모솜의 여러 유전자 부호화 성분 중 하나에서 돌연변이가 확인되는데, 이는 ACM의 진단을 확인하는 데 도움이 될 수 있다.[29] ACM은 자가 우성 특성이기 때문에 ACM 환자의 자녀는 질병을 유발하는 돌연변이를 물려받을 확률이 50%에 이른다. 유전자 검사로 돌연변이가 확인될 때마다 가족별 유전자 검사를 통해 질병에 걸릴 위험이 있는 친척과 그렇지 않은 친척을 구별할 수 있다. ACM 유전자 검사는 임상적으로 이용할 수 있다.[30]
진단 기준
ACM에는 병리학적 특징이 없다. ACM의 진단은 주요 기준과 사소한 기준의 조합에 기초한다. ACM을 진단하려면 2개의 주요 기준 또는 1개의 주요 기준과 2개의 사소한 기준 또는 4개의 사소한 기준이 필요하다.[31]
주요기준
- 우심실기능장애
- LV 손상이 거의 없거나 전혀 없는 RV 방출 비율의 심각한 확장 및 감소
- 국부적 RV 동맥류
- RV의 심한 세그먼트 확장
- 조직 특성화
- 심내막내막생검시 심근의 섬유지방교체
- 심전도 이상
- 엡실론 파동(V1 – V3)
- V1 – V에서3 QRS의 국부적 연장(>110ms)
- 우측 번들 분기 블록(RBBB)이 없는 12세 이상 개인에서 V1 -V의3 반전 T파
- 좌다발 분기 블록(LBBB) 형태학, 우월한 축을 가진 심실 빈맥
- 가족력
- 가족 질환이 임상 또는 부검 또는 수술에서 확인됨
부기준
- 우심실기능장애
- 일반 LV를 사용한 경미한 전역 RV 확장 및/또는 방출 비율 감소
- RV의 경미한 세그먼트 확장
- 국부적 RV 하이포키인시스
- 조직 특성화
- 심전도 이상
관리
ACM 관리의 목표는 갑작스러운 심장사망 발생률을 줄이는 것이다. 이에 따라 임상적 딜레마가 발생한다. 가족 검진 중 진단을 받은 무증상 환자를 예방하는 방법.
ACM을 가진 특정 집단은 갑작스러운 심장 마비의 위험성이 높은 것으로 간주된다. 관련 특성은 다음과 같다.
- 영나이
- 경쟁 스포츠 활동
- 악성 가족사
- 우심실 방출 분율이 감소된 광범위한 RV 질환.
- 좌심실 관여
- 싱코페
- 심실부정맥 발생
관리 옵션에는 약리학적, 외과적, 카테터 절제술 및 이식 가능한 심장세동기-제세동기의 배치가 포함된다.
치료 옵션을 결정하기 전에 추가 예후 정보에 대해 전기생리학 실험실에서 프로그래밍된 전기 자극을 수행할 수 있다. 프로그램된 자극의 목표는 다음을 포함한다.
- 질병의 부정맥 유발 잠재력 평가
- 지속적 VT의 혈류역학적 결과 평가
- 반정맥류 페이싱을 통해 VT가 중단될 수 있는지 여부를 결정한다.
선택한 관리 옵션과 상관없이, 개인은 일반적으로 격렬한 운동, 심장 자극제(즉 카페인, 니코틴, 사이비페데드린) 및 알코올을 피하는 등 라이프스타일 변경을 받는 것이 좋다.
신체 활동과 운동과 관련해서는 ARVC 환자는 물론 병원성 ARVC 관련 데스모자 돌연변이의 유전자 매개체가 경쟁 스포츠에 참여해서는 안 된다. 이러한 환자들은 자신의 운동 프로그램을 여가 활동으로 제한하고 임상 감시를 계속해야 한다.[32]
약물
ACM의 약리학적 관리에는 부정맥 억제와 혈전 형성 방지가 포함된다.
베타 차단제 겸 클래스 III 부정맥 방지제인 소탈롤은 ACM에서 가장 효과적인 부정맥 방지제다. 사용되는 다른 부정맥 방지제로는 아미오다론과 재래식 베타 차단제(즉: 메토프로롤)가 있다. 부정맥 방지제를 사용할 경우 부정맥 사건의 감소를 보여주기 위해 연속적인 보행 홀터 모니터링에 의해 그 효능을 안내해야 한다.
다른 심근 요법에서는 효소 억제제(ACE 억제제)를 변환하는 안지오텐신(Angiotensin transformation effectors, ACE 억제제)이 진행을 늦추는 것으로 잘 알려져 있지만, ACM에는 도움이 된다는 것이 입증되지 않았다.
우심실의 이질적 부분을 가진 RV 방출 분율이 감소된 개인은 혈전 형성과 후속 폐색전증을 예방하기 위해 와파린을 사용한 장기 항응고 효과를 볼 수 있다.
카테터 절제
카테터 절제술은 난치성 심실빈맥 치료에 사용될 수 있다. 성공률이 60~90%에 이른다.[33] 불행히도 병의 진행적 특성 때문에 새로운 부정맥 유발 집중이 생기면서 재발(재발율 60%)이 흔하다. 카테터 절제 징후에는 약물-환상 VT와 ICD 배치 후 VT가 빈번하게 재발하여 ICD가 자주 배출되는 경우가 있다.
이식성심장충격기-제세동기
ICD는 갑작스러운 심장 마비에 가장 효과적인 예방책이다. ICD의 엄청난 비용 때문에, 그들은 ACM을 가진 모든 개인에게 일상적으로 배치되지 않는다.
ACM 설정에서 ICD 배치를 위한 표시는 다음과 같다.
- VT 또는 VF로 인한 심정지
- 프로그램된 자극 중에 유도할 수 없는 증상 VT
- 프로그램된 자극 유도 약물 치료 실패
- VT의 내구성 저하로 심각한 RV 개입
- 직계 가족 급사
ICD는 일반적으로 우심실에 대한 양방향 접근을 통해 배치되기 때문에 ICD 배치 및 후속 조치와 관련된 합병증이 있다.
RV 자유벽이 극도로 얇아지기 때문에 이식 시 RV를 천공할 수 있어 심막 탐포네이드가 발생할 가능성이 있다. 이 때문에 제세동기의 납을 심실중격막에 놓으려는 모든 시도가 이루어진다.
성공적인 이식 후, 병의 진행적 특성은 납 배치 부위의 섬유질 대체로 이어질 수 있다. 이는 개인의 전기적 활동(잠재적으로 VT 또는 VF를 감지하지 못하게 함)을 강조할 수 있고 심실의 속도를 조절할 수 없게 할 수 있다.
심장 이식
심장 이식은 ACM에서 수행될 수 있다. 질병과 관련된 부정맥이 걷잡을 수 없는 상태인지, 약리학적 치료로는 관리가 불가능한 심각한 양심실 심부전이 있는지는 알 수 있다.
패밀리 스크리닝
모든 1급 가족 구성원은 ACM 검사를 받아야 한다. 이것은 상속의 패턴을 확립하는 데 사용된다. 달리 명시되지 않는 한, 심사는 10대부터 시작해야 한다. 선별 시험에는 다음이 포함된다.
예후
ACM을 가진 개인에게는 긴 무증상 리드 타임이 있다. 이것은 유전적으로 전염되는 질병이지만, 10대의 개인들은 검사 테스트에서 ACM의 어떤 특성도 가지고 있지 않을 수 있다.
많은 사람들은 심실 빈맥과 관련된 증상들을 가지고 있다. 예를 들어, 팔 떨림, 가벼운 머리, 또는 싱코페와 같은. 다른 사람들은 하지 부종이나 간증상 효소로 인한 간 충혈과 같은 우심실 기능 부전과 관련된 증상과 징후를 가지고 있을 수 있다.
ACM은 진행성 질환이다. 시간이 지남에 따라 우심실이 더욱 관여하게 되어 우심실 기능 부전으로 이어진다. 좌심실 기능장애가 있기 전에 우심실이 고장날 것이다. 그러나 개인이 명백한 우심실 장애의 징후를 보일 때쯤이면 좌심실의 조직적 관여가 있을 것이다. 결국 좌심실도 관여하게 되어 양심실 기능 부전으로 이어진다. 울혈성 심부전, 심방세동, 혈전증 발생률 증가 등 좌심실 기능 부전의 징후와 증상이 뚜렷해질 수 있다.
역학
ACM의 유병률은 미국의 일반 인구에서 약 1만분의 1로, 일부 연구에서는 1천분의 1 정도로 일반적일 수 있다고 제시했지만, ACM의 유병률은 약 1만분의 1이다. 최근 200분의 1이 ACM에 걸리기 쉬운 돌연변이의 매개체로 밝혀졌다.[34] 이러한 발견과 다른 증거에 기초하여, 환자가 결국 ACM의 징후와 증상을 발생시키려면 대부분의 환자에게서 다른 유전자, 운동 생활습관, 특정 바이러스에 대한 노출 등과 같은 추가 요인이 필요할 수 있다고 생각된다.[35] 그것은 젊은이들의 모든 갑작스러운 심장 사망의 17%를 차지한다. 이탈리아에서는 유병률이 40/1만 명에 달해 젊은 인구의 갑작스러운 심장 마비의 가장 흔한 원인이 되고 있다.[36]
사회와 문화
주목할 만한 사례
- 콜럼버스 크루의 미드필더 커크 우르소는 2012년 8월 5일 친구들과 함께 쓰러졌고 1시간 후에 사망선고를 받았다. 나중에 부검을 통해 그 병이 유력한 범인이라는 것이 밝혀졌다.[37][38]
- 세비야 FC와 스페인 국제 왼쪽 윙백 안토니오 푸에르타가 여러 차례 심장마비를 겪은 지 사흘 만인 2007년 8월 28일 22세의 나이로 이 병으로 사망했다.[39][40]
- 영국인 맷 개즈비 역시 2006년 9월 9일 하로게이트 타운과의 컨퍼런스 노스 경기에서 힝클리 유나이티드에서 뛰던 중 투구에 쓰러진 뒤 병세로 사망했다.[41][42]
- 파트리지 패밀리의 역할로 가장 잘 알려진 미국의 아역 여배우 수잔 크로는 2015년 52세의 나이로 갑자기 사망했다.[43]
- 제임스 테일러 잉글리시 국제 크리켓 선수,[44] 2016년 4월 은퇴
- 미국 모델인 Krissy Taylor는 1995년 7월 2일 플로리다의 가족 집에서 사망했다. 그녀의 공식적인 사망 원인은 심장 부정맥과 심한 천식이었는데, 그 중 후자는 그녀가 진단을 받은 적이 없었다. 그녀의 가족은 독립된 전문가들로 하여금 그녀의 심장 근육의 조직 샘플을 검사하게 했고 그들은 가장 유력한 사망 원인이 ACM의 진단 누락이라고 결론지었다.
- 조던 보이드(1997~2013)는 캐나다 주니어 하키 선수다. 2013년 훈련소 붕괴로 세상을 떠난 뒤 사후 진단을 받았다.[45]
참고 항목
참조
- ^ Pilichou, Kalliopi; Thiene, Gaetano; Bauce, Barbara; Rigato, Ilaria; Lazzarini, Elisabetta; Migliore, Federico; Perazzolo Marra, Martina; Rizzo, Stefania; Zorzi, Alessandro; Daliento, Luciano; Corrado, Domenico; Basso, Cristina (2 April 2016). "Arrhythmogenic cardiomyopathy". Orphanet Journal of Rare Diseases. 11 (1): 33. doi:10.1186/s13023-016-0407-1. PMC 4818879. PMID 27038780.
- ^ Freedberg IM, Fitzpatrick TB (2003). Fitzpatrick's Dermatology in General Medicine (6th ed.). McGraw-Hill. ISBN 978-0-07-138076-8.
- ^ James WD, Berger TG, Elston DM, Odom RB (2006). Andrews' Diseases of the Skin: Clinical Dermatology (10th ed.). Saunders. ISBN 978-0-7216-2921-6.
- ^ a b c Corrado, Domenico; Basso, Cristina; Judge, Daniel P. (2017-09-15). "Arrhythmogenic Cardiomyopathy". Circulation Research. 121 (7): 784–802. doi:10.1161/CIRCRESAHA.117.309345. ISSN 1524-4571. PMC 4818879. PMID 28912183.
- ^ Corrado, Domenico; Link, Mark S.; Calkins, Hugh (2017-01-05). "Arrhythmogenic Right Ventricular Cardiomyopathy". The New England Journal of Medicine. 376 (1): 61–72. doi:10.1056/NEJMra1509267. ISSN 1533-4406. PMID 28052233.
- ^ Cox MG, van der Zwaag PA, van der Werf C, van der Smagt JJ, Noorman M, Bhuiyan ZA, Wiesfeld AC, Volders PG, van Langen IM, Atsma DE, Dooijes D, van den Wijngaard A, Houweling AC, Jongbloed JD, Jordaens L, Cramer MJ, Doevendans PA, de Bakker JM, Wilde AA, van Tintelen JP, Hauer RN (June 2011). "Arrhythmogenic right ventricular dysplasia/cardiomyopathy: pathogenic desmosome mutations in index-patients predict outcome of family screening: Dutch arrhythmogenic right ventricular dysplasia/cardiomyopathy genotype-phenotype follow-up study". Circulation. 123 (23): 2690–700. doi:10.1161/circulationaha.110.988287. PMID 21606396.
- ^ Fressart V, Duthoit G, Donal E, Probst V, Deharo JC, Chevalier P, Klug D, Dubourg O, Delacretaz E, Cosnay P, Scanu P, Extramiana F, Keller D, Hidden-Lucet F, Simon F, Bessirard V, Roux-Buisson N, Hebert JL, Azarine A, Casset-Senon D, Rouzet F, Lecarpentier Y, Fontaine G, Coirault C, Frank R, Hainque B, Charron P (June 2010). "Desmosomal gene analysis in arrhythmogenic right ventricular dysplasia/cardiomyopathy: spectrum of mutations and clinical impact in practice". Europace. 12 (6): 861–8. doi:10.1093/europace/euq104. PMID 20400443.
- ^ a b Klauke B, Kossmann S, Gaertner A, Brand K, Stork I, Brodehl A, Dieding M, Walhorn V, Anselmetti D, Gerdes D, Bohms B, Schulz U, Zu Knyphausen E, Vorgerd M, Gummert J, Milting H (December 2010). "De novo desmin-mutation N116S is associated with arrhythmogenic right ventricular cardiomyopathy". Human Molecular Genetics. 19 (23): 4595–607. doi:10.1093/hmg/ddq387. PMID 20829228.
- ^ Brodehl A, Hedde PN, Dieding M, Fatima A, Walhorn V, Gayda S, Šarić T, Klauke B, Gummert J, Anselmetti D, Heilemann M, Nienhaus GU, Milting H (May 2012). "Dual color photoactivation localization microscopy of cardiomyopathy-associated desmin mutants". The Journal of Biological Chemistry. 287 (19): 16047–57. doi:10.1074/jbc.M111.313841. PMC 3346104. PMID 22403400.
- ^ Beffagna G, Occhi G, Nava A, Vitiello L, Ditadi A, Basso C, Bauce B, Carraro G, Thiene G, Towbin JA, Danieli GA, Rampazzo A (February 2005). "Regulatory mutations in transforming growth factor-beta3 gene cause arrhythmogenic right ventricular cardiomyopathy type 1". Cardiovascular Research. 65 (2): 366–73. doi:10.1016/j.cardiores.2004.10.005. PMID 15639475.
- ^ Milting H, Lukas N, Klauke B, Körfer R, Perrot A, Osterziel KJ, Vogt J, Peters S, Thieleczek R, Varsányi M (August 2006). "Composite polymorphisms in the ryanodine receptor 2 gene associated with arrhythmogenic right ventricular cardiomyopathy". Cardiovascular Research. 71 (3): 496–505. doi:10.1016/j.cardiores.2006.04.004. PMID 16769042.
- ^ Merner ND, Hodgkinson KA, Haywood AF, Connors S, French VM, Drenckhahn JD, Kupprion C, Ramadanova K, Thierfelder L, McKenna W, Gallagher B, Morris-Larkin L, Bassett AS, Parfrey PS, Young TL (April 2008). "Arrhythmogenic right ventricular cardiomyopathy type 5 is a fully penetrant, lethal arrhythmic disorder caused by a missense mutation in the TMEM43 gene". American Journal of Human Genetics. 82 (4): 809–21. doi:10.1016/j.ajhg.2008.01.010. PMC 2427209. PMID 18313022.
- ^ Christensen AH, Andersen CB, Tybjaerg-Hansen A, Haunso S, Svendsen JH (September 2011). "Mutation analysis and evaluation of the cardiac localization of TMEM43 in arrhythmogenic right ventricular cardiomyopathy". Clinical Genetics. 80 (3): 256–64. doi:10.1111/j.1399-0004.2011.01623.x. PMID 21214875. S2CID 5617616.
- ^ Protonotarios, Alexandros; Brodehl, Andreas; Asimaki, Angeliki; Jager, Joanna; Quinn, Ellie; Stanasiuk, Caroline; Ratnavadivel, Sandra; Futema, Marta; Akhtar, Mohammed M.; Gossios, Thomas D.; Ashworth, Michael (December 2020). "The novel desmin variant p.Leu115Ile is associated with a unique form of biventricular Arrhythmogenic Cardiomyopathy". Canadian Journal of Cardiology. 37 (6): 857–866. doi:10.1016/j.cjca.2020.11.017. PMID 33290826.
- ^ Bermúdez-Jiménez FJ, Carriel V, Brodehl A, Alaminos M, Campos A, Schirmer I, Milting H, Abril BÁ, Álvarez M, López-Fernández S, García-Giustiniani D, Monserrat L, Tercedor L, Jiménez-Jáimez J (April 2018). "Novel Desmin Mutation p.Glu401Asp Impairs Filament Formation, Disrupts Cell Membrane Integrity, and Causes Severe Arrhythmogenic Left Ventricular Cardiomyopathy/Dysplasia". Circulation. 137 (15): 1595–1610. doi:10.1161/CIRCULATIONAHA.117.028719. PMID 29212896.
- ^ Bauce B, Basso C, Rampazzo A, Beffagna G, Daliento L, Frigo G, Malacrida S, Settimo L, Danieli G, Thiene G, Nava A (August 2005). "Clinical profile of four families with arrhythmogenic right ventricular cardiomyopathy caused by dominant desmoplakin mutations". European Heart Journal. 26 (16): 1666–75. doi:10.1093/eurheartj/ehi341. PMID 15941723.
- ^ Gerull B, Heuser A, Wichter T, Paul M, Basson CT, McDermott DA, Lerman BB, Markowitz SM, Ellinor PT, MacRae CA, Peters S, Grossmann KS, Drenckhahn J, Michely B, Sasse-Klaassen S, Birchmeier W, Dietz R, Breithardt G, Schulze-Bahr E, Thierfelder L (November 2004). "Mutations in the desmosomal protein plakophilin-2 are common in arrhythmogenic right ventricular cardiomyopathy". Nature Genetics. 36 (11): 1162–4. doi:10.1038/ng1461. PMID 15489853.
- ^ Pilichou K, Nava A, Basso C, Beffagna G, Bauce B, Lorenzon A, Frigo G, Vettori A, Valente M, Towbin J, Thiene G, Danieli GA, Rampazzo A (March 2006). "Mutations in desmoglein-2 gene are associated with arrhythmogenic right ventricular cardiomyopathy". Circulation. 113 (9): 1171–9. doi:10.1161/CIRCULATIONAHA.105.583674. PMID 16505173.
- ^ Awad MM, Dalal D, Cho E, Amat-Alarcon N, James C, Tichnell C, Tucker A, Russell SD, Bluemke DA, Dietz HC, Calkins H, Judge DP (July 2006). "DSG2 mutations contribute to arrhythmogenic right ventricular dysplasia/cardiomyopathy". American Journal of Human Genetics. 79 (1): 136–42. doi:10.1086/504393. PMC 1474134. PMID 16773573.
- ^ Brodehl, Andreas; Meshkov, Alexey; Myasnikov, Roman; Kiseleva, Anna; Kulikova, Olga; Klauke, Bärbel; Sotnikova, Evgeniia; Stanasiuk, Caroline; Divashuk, Mikhail; Pohl, Greta Marie; Kudryavtseva, Maria (2021-04-06). "Hemi- and Homozygous Loss-of-Function Mutations in DSG2 (Desmoglein-2) Cause Recessive Arrhythmogenic Cardiomyopathy with an Early Onset". International Journal of Molecular Sciences. 22 (7): 3786. doi:10.3390/ijms22073786. ISSN 1422-0067. PMC 8038858. PMID 33917638.
- ^ Brodehl, Andreas; Weiss, Jürgen; Debus, Jana Davina; Stanasiuk, Caroline; Klauke, Bärbel; Deutsch, Marcus André; Fox, Henrik; Bax, Jördis; Ebbinghaus, Hans; Gärtner, Anna; Tiesmeier, Jens (April 2020). "A homozygous DSC2 deletion associated with arrhythmogenic cardiomyopathy is caused by uniparental isodisomy". Journal of Molecular and Cellular Cardiology. 141: 17–29. doi:10.1016/j.yjmcc.2020.03.006. PMID 32201174.
- ^ Heuser A, Plovie ER, Ellinor PT, Grossmann KS, Shin JT, Wichter T, Basson CT, Lerman BB, Sasse-Klaassen S, Thierfelder L, MacRae CA, Gerull B (December 2006). "Mutant desmocollin-2 causes arrhythmogenic right ventricular cardiomyopathy". American Journal of Human Genetics. 79 (6): 1081–8. doi:10.1086/509044. PMC 1698714. PMID 17186466.
- ^ Syrris P, Ward D, Evans A, Asimaki A, Gandjbakhch E, Sen-Chowdhry S, McKenna WJ (November 2006). "Arrhythmogenic right ventricular dysplasia/cardiomyopathy associated with mutations in the desmosomal gene desmocollin-2". American Journal of Human Genetics. 79 (5): 978–84. doi:10.1086/509122. PMC 1698574. PMID 17033975.
- ^ Antoniades L, Tsatsopoulou A, Anastasakis A, Syrris P, Asimaki A, Panagiotakos D, Zambartas C, Stefanadis C, McKenna WJ, Protonotarios N (September 2006). "Arrhythmogenic right ventricular cardiomyopathy caused by deletions in plakophilin-2 and plakoglobin (Naxos disease) in families from Greece and Cyprus: genotype-phenotype relations, diagnostic features and prognosis". European Heart Journal. 27 (18): 2208–16. doi:10.1093/eurheartj/ehl184. PMID 16893920.
- ^ Asimaki A, Syrris P, Wichter T, Matthias P, Saffitz JE, McKenna WJ (November 2007). "A novel dominant mutation in plakoglobin causes arrhythmogenic right ventricular cardiomyopathy". American Journal of Human Genetics. 81 (5): 964–73. doi:10.1086/521633. PMC 2265660. PMID 17924338.
- ^ Brodehl A, Rezazadeh S, Williams T, Munsie NM, Liedtke D, Oh T, Ferrier R, Shen Y, Jones SJ, Stiegler AL, Boggon TJ, Duff HJ, Friedman JM, Gibson WT, Childs SJ, Gerull B (February 2019). "Mutations in ILK, encoding integrin-linked kinase, are associated with arrhythmogenic cardiomyopathy". Translational Research. 208: 15–29. doi:10.1016/j.trsl.2019.02.004. PMC 7412573. PMID 30802431.
- ^ Forleo C, Carmosino M, Resta N, Rampazzo A, Valecce R, Sorrentino S, Iacoviello M, Pisani F, Procino G, Gerbino A, Scardapane A, Simone C, Calore M, Torretta S, Svelto M, Favale S (2015). "Clinical and functional characterization of a novel mutation in lamin a/c gene in a multigenerational family with arrhythmogenic cardiac laminopathy". PLOS ONE. 10 (4): e0121723. Bibcode:2015PLoSO..1021723F. doi:10.1371/journal.pone.0121723. PMC 4383583. PMID 25837155.
- ^ Mazzanti, Andrea; Ng, Kevin; Faragli, Alessandro; Maragna, Riccardo; Chiodaroli, Elena; Orphanou, Nicoletta; Monteforte, Nicola; Memmi, Mirella; Gambelli, Patrick (December 2016). "Arrhythmogenic Right Ventricular Cardiomyopathy". Journal of the American College of Cardiology. 68 (23): 2540–2550. doi:10.1016/j.jacc.2016.09.951. PMID 27931611.
- ^ Sen-Chowdhry S, Syrris P, McKenna WJ (November 2007). "Role of genetic analysis in the management of patients with arrhythmogenic right ventricular dysplasia/cardiomyopathy". Journal of the American College of Cardiology. 50 (19): 1813–21. doi:10.1016/j.jacc.2007.08.008. PMID 17980246.
- ^ ARVD/C 유전자 검사 개요
- ^ Marcus, Frank I. (2010). "Diagnosis of Arrhythmogenic Right Ventricular Cardiomyopathy/Dysplasia Proposed Modification of the Task Force Criteria". Circulation. 121 (13): 1533–1541. doi:10.1161/CIRCULATIONAHA.108.840827. PMC 2860804. PMID 20172911.
- ^ Pelliccia, A (2019). "Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies,myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology (EAPC)". European Heart Journal. 40 (1): 19–33. doi:10.1093/eurheartj/ehy730. PMID 30561613.
- ^ Fontaine G, Tonet J, Gallais Y, Lascault G, Hidden-Lucet F, Aouate P, Halimi F, Poulain F, Johnson N, Charfeddine H, Frank R (November 2000). "Ventricular tachycardia catheter ablation in arrhythmogenic right ventricular dysplasia: a 16-year experience". Current Cardiology Reports. 2 (6): 498–506. doi:10.1007/s11886-000-0034-1. PMID 11203287. S2CID 31406061.
- ^ Lahtinen AM, Lehtonen E, Marjamaa A, Kaartinen M, Heliö T, Porthan K, Oikarinen L, Toivonen L, Swan H, Jula A, Peltonen L, Palotie A, Salomaa V, Kontula K (August 2011). "Population-prevalent desmosomal mutations predisposing to arrhythmogenic right ventricular cardiomyopathy". Heart Rhythm. 8 (8): 1214–21. doi:10.1016/j.hrthm.2011.03.015. PMID 21397041.
- ^ 제인 R. 운동 상태와 부정맥 유발 우심실 이형증/심장병증: 생리학적 관찰부터 병리학적 설명까지. 가설 2010, 8(1): e2. – 자세한 내용은 http://www.hypothesisjournal.com/?p=844#sthash.aB859Jm2.dpuf를 참조하십시오.
- ^ Corrado D, Fontaine G, 부정맥 유발 우측 심실 이형성/심실병증 국제 등록 필요. 순환하다. 2000; 101: e101-e106
- ^ Jardy A. "Crew midfielder Kirk Urso, 22, dies after being rushed to hospital from bar". The Columbus Dispatch. The Dispatch Printing Company. Retrieved 21 September 2012.
- ^ Jardy A. "Coroner: Crew's Urso died of a preexisting heart condition". The Columbus Dispatch. The Dispatch Printing Company. Retrieved 21 September 2012.
- ^ "Sevilla star suffers heart attack". BBC Sport. 2007-08-25. Retrieved 2007-08-25.
- ^ 세비야별은 붕괴 후 죽는다.
- ^ "Cause of Death". Cardiac Inherited Disease Group. Archived from the original on 2006-08-18. Retrieved 2006-10-31.
- ^ "Shock at star player's death". icBirmingham.co.uk. 11 September 2006. Retrieved 2007-11-26.
- ^ 검시관은 Suzanne Crough가 희귀한 심장 질환으로 사망했다고 말했다.; 2015년 10월 27일에 접속했다.
- ^ "James Taylor: England & Nottinghamshire batsman forced to retire". BBC Sport. 2016-04-12. Retrieved 2016-05-15.
- ^ The life and career of Jordan Boyd NHL Home Team Heroes, retrieved 2019-10-14
외부 링크
| 위키미디어 커먼스는 부정맥 유발 우심실 이형성증과 관련된 미디어를 보유하고 있다. |