폐
Lung 호흡기가 보이는 사람의 폐와 엽마다 다른 색을 나타내는 그림 | |
 사람의 폐는 심장과 흉강의 훌륭한 혈관을 측면에 두고 있습니다. | |
| 세부 사항 | |
|---|---|
| 시스템. | 호흡기 |
| 식별자 | |
| 라틴어 | 풀모 |
| 그리스어 | πνεύμ ων(pneum 켜기) |
| MeSH | D008168 |
| TA98 | A06.5.01.001 |
| TA2 | 3265 |
| 해부학 용어 [위키데이터 편집] | |
폐는 인간과 일부 달팽이와 소수의 물고기를 포함한 대부분의 다른 동물에서 호흡기의 가장 중요한 기관입니다. 포유류와 대부분의 다른 척추동물에서, 두 개의 폐는 심장 양쪽의 등뼈 근처에 위치합니다. 호흡기에서 그들의 기능은 공기에서 산소를 추출하여 혈류로 전달하고, 가스 교환 과정에서 혈류에서 이산화탄소를 대기로 방출하는 것입니다. 얇고 매끄럽고 촉촉한 흉막은 호흡 시 폐와 흉벽 사이의 마찰을 줄여주고, 쉽고 간편하게 폐를 움직일 수 있게 해주는 역할을 합니다.
호흡은 다른 종의 다른 근육 시스템에 의해 구동됩니다. 포유류, 파충류 그리고 새들은 호흡을 지원하고 육성하기 위해 그들의 다른 근육을 사용합니다. 이전 네발동물에서 공기는 협측 펌핑을 통해 인두 근육에 의해 폐로 이동되었으며, 이 메커니즘은 양서류에서 여전히 볼 수 있습니다. 인간의 경우 호흡을 추동하는 호흡의 주요 근육은 횡격막입니다. 폐는 또한 사람의 말을 포함한 목소리 소리를 가능하게 하는 공기 흐름을 제공합니다.
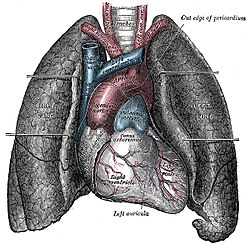
인간은 두 개의 폐를 가지고 있는데, 하나는 왼쪽에 있고 하나는 오른쪽에 있습니다. 가슴의 흉강 내에 위치합니다. 오른쪽 폐는 왼쪽보다 크고 무거워 가슴에 공간을 심장과 공유합니다. 폐의 무게는 약 1.3킬로그램입니다. 폐는 기관에서 시작하여 기관지와 세기관지로 분기되는 하부 호흡기의 일부이며, 전도 영역을 통해 호흡되는 공기를 받아들입니다. 도체 영역은 말단 세기관지에서 끝납니다. 이들은 호흡기 영역의 호흡 세기관지로 나뉘며, 이 세기관지는 폐포를 포함하는 폐포낭을 생성하는 폐포관으로 나뉘며, 여기서 가스 교환이 이루어집니다. 폐포는 호흡 세기관지와 폐포관의 벽에도 드문드문 존재합니다. 함께 폐는 약 2,400 킬로미터(1,500 마일)의 기도와 3억에서 5억 개의 폐포를 가지고 있습니다. 각 폐는 흉막이라고 불리는 두 개의 막으로 구성된 흉막 주머니 안에 둘러싸여 있습니다. 이 막은 흉막액 막에 의해 분리되어 있는데, 이 막은 큰 마찰 없이 호흡이 일어나는 동안 내막과 외막이 서로 미끄러지도록 합니다. 안쪽 흉막은 또한 각각의 폐를 엽이라고 불리는 부분으로 나눕니다. 오른쪽 폐에는 3개의 엽이 있고 왼쪽에는 2개의 엽이 있습니다. 엽은 기관지 폐 분절과 폐엽으로 더 나뉩니다. 폐는 독특한 혈액 공급을 가지고 있는데, 산소를 공급받고 이산화탄소를 배출하기 위한 목적으로 폐 순환에서 심장으로부터 탈산소화된 혈액을 공급받고, 기관지 순환에서 폐 조직에 산소화된 혈액을 별도로 공급합니다. 탈산소화된 혈액은 심장에서 폐동맥을 거쳐 폐로 이동하여 폐포의 모세혈관에서 산소화됩니다. 혈액이 산소화된 후 폐정맥을 통해 심장으로 돌아와 신체의 나머지 부분으로 보내집니다.[1][2]
폐의 조직은 폐렴과 폐암을 포함한 여러 호흡기 질환의 영향을 받을 수 있습니다. 만성폐쇄성폐질환은 만성기관지염, 폐기종 등이 있으며 흡연이나 유해물질 노출과 관련이 있을 수 있습니다. 석탄 먼지, 석면 섬유, 결정성 실리카 먼지 등의 물질에 의해 다수의 직업성 폐질환이 발생할 수 있습니다. 기관지염과 같은 질병은 호흡기에도 영향을 미칠 수 있습니다. 폐와 관련된 의학 용어는 종종 폐학에서와 같이 라틴어의 폐(pulmonarius)에서 또는 폐렴에서와 같이 폐렴(그리스어의 ωνμ πνεύ "폐"에서)에서 시작됩니다.
배아 발달에서, 폐는 소화기의 상부를 형성하는 관인 앞창자(foregut)의 아웃터치(outouching)로서 발달하기 시작합니다. 폐가 형성되면 태아는 액체로 가득 찬 양수 주머니에 갇혀 호흡 기능을 하지 못합니다. 혈액은 또한 동맥관을 통해 폐에서 우회됩니다. 그러나 태어나면 공기가 폐를 통과하기 시작하고, 전환관이 닫히기 때문에 폐가 호흡하기 시작합니다. 폐는 유아기에만 완전히 발달합니다.
구조.
해부학

폐는 갈비뼈 우리의 심장 양쪽에 있는 가슴에 위치합니다. 그것들은 꼭대기에 좁고 둥근 꼭짓점이 있고 횡격막의 볼록한 표면에 놓여 있는 넓은 오목한 밑 부분이 있는 원뿔 모양입니다.[3] 폐의 꼭짓점은 목의 뿌리까지 뻗어 첫 번째 갈비뼈의 흉골 끝 바로 위에 도달합니다. 폐는 늑골 케이지의 등뼈 가까이에서 가슴 앞쪽으로, 기관 하부에서 횡격막 아래로 뻗어 있습니다.[3]
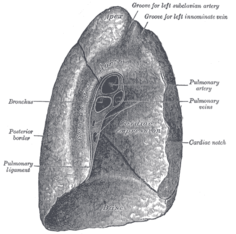
왼쪽 폐는 심장과 공간을 공유하며, 이를 수용하기 위해 왼쪽 폐의 심장 노치라고 불리는 경계에 움푹 들어간 곳이 있습니다.[4][5] 폐의 앞쪽과 바깥쪽은 갈비뼈와 마주보고 있는데, 갈비뼈는 표면에 가벼운 움푹 들어간 곳을 만듭니다. 폐의 안쪽 표면은 가슴의 중앙을 향하며, 심장, 거대한 혈관, 기관이 두 개의 주요 기관지로 나뉘는 카리나와 마주보고 있습니다.[5] 심장 인상은 심장에 기대어 휴식을 취하는 폐의 표면에 형성된 움푹 들어간 곳입니다.
두 폐는 혈관과 기도가 폐의 뿌리를 구성하는 폐로 들어가는 힐룸(hilum)이라고 불리는 중심 불경기를 가지고 있습니다.[6] 힐룸에는 기관지 폐 림프절도 있습니다.[5]
폐는 폐 흉막으로 둘러싸여 있습니다. 흉막은 두 개의 장막인데, 바깥쪽 두정 흉막은 늑골 케이지의 내벽을 따라 배열되어 있고 안쪽 내장 흉막은 폐의 표면을 직접적으로 따라 배열되어 있습니다. 흉막 사이에는 윤활성 흉수의 얇은 층을 포함하는 흉막 공동이라고 불리는 잠재적인 공간이 있습니다.
로브스
| 우폐 | 좌폐 |
|---|---|
위쪽의
가운데
더 낮게
| 위쪽의
링굴라
더 낮게
|
각각의 폐는 내장 흉막이 균열로 들어가면서 엽이라고 불리는 부분으로 나누어져 있습니다. 엽은 분절로 나뉘며, 분절은 소엽으로 더 나뉘게 됩니다. 오른쪽 폐에는 3개의 엽이 있고 왼쪽 폐에는 2개의 엽이 있습니다.
균열
산전 초기 발달에서 엽기관지를 분할하는 내장 흉막의 침윤에 의해 균열이 형성되고 폐를 엽으로 절단하여 확장에 도움을 줍니다.[8][9] 오른쪽 폐는 수평균열과 비스듬한균열에 의해 3개의 엽으로 나뉩니다. 왼쪽 폐는 오른쪽 폐의 비스듬한 균열과 밀접하게 정렬된 비스듬한 균열에 의해 두 개의 엽으로 나뉩니다. 오른쪽 폐에서 상부 수평 균열은 상부(상부) 로브와 중간 로브를 분리합니다. 아래쪽으로 비스듬히 뻗은 샛길은 아래쪽 엽과 중간엽 및 위쪽 엽을 분리합니다.[3][9]
균열의 변화는 불완전하게 형성되거나 아지고스 균열에서와 같이 추가 균열로 존재하거나 존재하지 않는 경우가 상당히 일반적입니다. 불완전한 균열은 일부 폐 부피 감소 절차에서 원하지 않는 엽 간의 공기 흐름인 엽 간 측부 환기의 원인이 됩니다.[8]
세그먼트(Segments)
주기관지 또는 일차기관지는 힐룸에서 폐로 들어가고 처음에는 폐의 각 로브에 공기를 공급하는 로바기관지로도 알려진 이차기관지로 분기됩니다. 소엽 기관지는 분절 기관지라고도 알려진 3차 기관지로 분기되며, 이것들은 기관지 폐 분절이라고 알려진 소엽의 추가 분할에 공기를 공급합니다. 각 기관지폐 분절에는 고유한 (분절적) 기관지와 동맥 공급 장치가 있습니다.[10] 왼쪽 폐와 오른쪽 폐에 대한 세그먼트가 표에 나와 있습니다.[7] 분절 해부학은 폐의 질병 과정을 국소화하는 데 임상적으로 유용합니다.[7] 세그먼트는 주변 조직에 심각한 영향을 주지 않고 외과적으로 제거할 수 있는 이산 단위입니다.[11]
우폐
오른쪽 폐는 왼쪽보다 엽과 분절이 더 많습니다. 1개의 비스듬한 것과 1개의 수평한 것, 2개의 균열에 의해 상엽, 중엽, 하엽의 3개의 엽으로 나뉩니다.[12] 상부 수평 균열은 상부와 중엽을 분리합니다. 그것은 폐의 뒤쪽 경계 근처의 아래쪽 비스듬한 균열에서 시작하고, 앞으로 수평으로 달리면 네 번째 늑골 연골의 흉골 끝과 같은 높이에서 앞쪽 경계를 자릅니다. 종격동 표면에서는 힐룸까지 거슬러 올라갈 수 있습니다.[3] 아래쪽의 비스듬한 샛길은 아래쪽을 중간엽과 위쪽엽에서 분리하고 왼쪽 폐의 비스듬한 샛길과 밀접하게 정렬되어 있습니다.[3][9]
오른쪽 폐의 종격동 표면은 주변의 여러 구조물에 의해 움푹 들어가 있습니다. 심장은 심장 인상이라고 불리는 인상에 자리잡고 있습니다. 폐의 힐룸 위에는 아지고스 정맥을 위한 아치형 홈이 있고, 이 위에는 상대정맥과 우측 상대정맥을 위한 넓은 홈이 있고, 이 뒤에는 폐의 상부에 상대정맥을 위한 홈이 있고, 폐의 상부에는 상대정맥을 위한 홈이 있습니다. 힐룸과 폐인대 뒤쪽에는 식도를 위한 홈이 있고, 식도 홈의 하부 근처에는 심장으로 들어가기 전에 하대정맥을 위한 더 깊은 홈이 있습니다.[5]
오른쪽 폐의 무게는 개인에 따라 다르며, 표준 기준 범위는 남성의 경우 155–720 g(0.342–1.587 lb),[13] 여성의 경우 100–590 g(0.22–1.30 lb)입니다.[14]
좌폐
왼쪽 폐는 두 개의 엽, 즉 상엽과 하엽으로 나뉘는데, 이 엽은 늑골에서 하엽의 종격동 표면까지 뻗어 있습니다.[3] 왼쪽 폐는 오른쪽과 달리 중엽이 없지만, 상엽의 돌출부인 링굴라를 가지고 있습니다. 그것의 이름은 "작은 혀"를 의미합니다. 왼쪽 폐의 링굴라는 오른쪽 폐의 중엽과 해부학적으로 평행한 역할을 하며, 두 부위 모두 유사한 감염과 해부학적 합병증을 일으키기 쉽습니다.[15][16] 링굴라에는 두 개의 기관지폐 분절이 있습니다: 상부와 하부.[3]
왼쪽 폐의 종격동 표면은 심장이 앉는 곳에 심장의 인상이 큽니다. 이것은 심장이 왼쪽으로 돌출되는 오른쪽 폐의 그것보다 더 깊고 큽니다.[5]
같은 표면에 대동맥 아치의 바로 위에는 잘 표시된 곡선 홈이 있고 그 아래에는 하행 대동맥의 홈이 있습니다. 대동맥 아치에서 분기된 왼쪽 쇄골하 동맥은 아치에서 폐 정점 근처까지의 홈에 위치합니다. 동맥 앞쪽과 폐 가장자리 근처에 있는 얕은 홈이 왼쪽 상완정맥에 자리잡고 있습니다. 식도는 폐 기저부에 더 넓은 얕은 인상을 가질 수 있습니다.[5]
표준 기준 범위에서 왼쪽 폐의 무게는 남성의 경우 110–675 g (0.243–1.488 lb),[13] 여성의 경우 105–515 g (0.231–1.135 lb)입니다.[14]
일러스트레이션
-
흉부 CT(축상 폐창)
-
흉부 CT(관상 폐창)
-
흉부 CT(축상 폐창)
-
흉부 CT(관상 폐창)
-
칸 아카데미의 "폐를 만나다"
-
폐 의학 비디오
-
폐엽과 샛길의 3D 해부학적 구조입니다.
미세해부학

폐는 하부 호흡기의 일부이며 기관에서 분기될 때 기관지 기도를 수용합니다. 기관지 기도는 폐의 기능적 조직(실질)을 구성하는 폐포와 정맥, 동맥, 신경, 림프관에서 끝납니다.[5][17] 기관과 기관지는 점막과 점막하층에 림프 모세혈관의 플렉스를 가지고 있습니다. 더 작은 기관지는 림프 모세혈관의 단일층을 가지고 있으며 폐포에는 없습니다.[18] 폐에는 신체의 다른 기관 중 가장 큰 림프 배수 시스템이 공급됩니다.[19] 각각의 폐는 내장 흉막의 장막으로 둘러싸여 있는데, 내장 흉막은 폐의 물질에 붙어 있는 느슨한 결합 조직의 기저층을 가지고 있습니다.[20]
결합조직


폐의 결합 조직은 모세혈관과 폐포벽 사이에 개재된 탄성 섬유와 콜라겐 섬유로 이루어져 있습니다. 엘라스틴은 세포외기질의 핵심 단백질로 탄성섬유의 주성분입니다.[21] 엘라스틴은 폐 순응성으로 알려진 호흡과 관련된 지속적인 스트레칭에 필요한 탄력성과 회복력을 제공합니다. 또한 필요한 탄성 반동을 담당합니다. 엘라스틴은 폐포의 개구, 폐포 접합부와 같은 스트레스가 높은 부위에 더 집중되어 있습니다.[21] 결합 조직은 모든 폐포를 연결하여 스폰지와 같은 모양을 가진 폐 실질을 형성합니다. 폐포에는 콘의 구멍으로 알려진 서로 연결된 공기 통로가 벽에 있습니다.[22]
호흡상피
기관, 기관지, 세기관지를 포함한 모든 하부 호흡기에는 호흡기 상피가 늘어서 있습니다. 이것은 점액의 주성분인 점액, 섬모세포, 기저세포, 그리고 기저세포와 유사한 작용을 하는 말단 세기관지-클럽 세포와 대식세포를 생성하는 잔세포가 산재된 섬모 상피입니다. 상피세포와 호흡기 전체의 점막하샘은 기도 표면액(ASL)을 분비하는데, 그 구성은 엄격하게 조절되고 점막 제거가 얼마나 잘 작동하는지를 결정합니다.[23]
폐 신경내분비 세포는 폐포 상피를 포함한 호흡기 상피 전체에서 발견되지만 [24]전체 상피 집단의 약 0.5%에 불과합니다.[25] PNEC는 특히 기도 접합점에 초점을 맞춘 내배된 기도 상피 세포입니다.[25] 이 세포들은 폴리펩티드 제품뿐만 아니라 세로토닌, 도파민, 노르에피네프린을 생산할 수 있습니다. 폐 신경내분비 세포의 세포질 과정은 기도 내강으로 확장되어 영감을 받은 가스의 구성을 감지할 수 있습니다.[26]
기관지 기도
기관지에는 연골의 불완전한 기관 고리와 그것들을 열어두는 더 작은 연골 판들이 있습니다.[27]: 472 세기관지는 연골을 지탱하기에는 너무 좁고 벽은 평활근이며, 이것은 주로 상피에만 있는 좁은 호흡 세기관지에는 거의 없습니다.[27]: 472 말단 세기관지에 연골이 없기 때문에 막성 세기관지라는 대체 이름이 붙습니다.[28]

호흡기계
호흡기의 전도 영역은 그들이 호흡 세기관지로 분기할 때 말단 세기관지에서 끝납니다. 이것은 호흡 세기관지, 폐포관, 폐포낭, 폐포를 포함하는 아시누스라고 불리는 말단 호흡 장치의 시작을 나타냅니다.[29] 아시누스는 직경이 최대 10mm입니다.[30] 원발성 폐소엽은 호흡 기관의 말단에 있는 폐의 부분입니다.[31] 따라서 폐포관, 주머니 및 폐포는 포함되지만 호흡 세기관지는 포함되지 않습니다.[32]
2차 폐소엽으로 설명되는 단위는 폐소엽 또는 호흡소엽으로 가장 많이 언급되는 소엽입니다.[27]: 489 [33] 이 소엽은 도움 없이 볼 수 있는 폐의 가장 작은 구성 요소인 이산 단위입니다.[31] 2차 폐소엽은 30~50개의 1차 소엽으로 구성될 가능성이 높습니다.[32] 소엽은 호흡 세기관지로 분기되는 말단 세기관지에 의해 공급됩니다. 호흡 세기관지는 각 부비강에 폐포를 공급하고 폐동맥 가지를 동반합니다. 각 소엽은 소엽간 격막으로 둘러싸여 있습니다. 각각의 부비동은 소엽간 중격에 의해 불완전하게 분리됩니다.[30]
호흡 기관은 두 개 이상의 폐포를 포함하는 폐포낭으로 이어지는 폐포관을 생성합니다.[22] 폐포의 벽은 매우 얇아 확산 속도가 빠릅니다. 폐포에는 콘의 구멍으로 알려진 작은 공기 통로가 벽에 서로 연결되어 있습니다.[22]
폐포


폐포는 두 종류의 폐포 세포와 폐포 대식세포로 구성됩니다. 두 가지 유형의 세포는 I형 세포와 II형 세포[34](폐세포라고도 함)로 알려져 있습니다.[5] I형과 II형은 벽과 폐포 중격을 구성합니다. I형 세포는 각 폐포의 표면적의 95%를 제공하고 평평하며("squamous"), II형 세포는 일반적으로 폐포의 모서리에 모여 정육면체 모양을 갖습니다.[35] 그럼에도 불구하고 세포는 대략 1:1 또는 6:4의 비율로 발생합니다.[34][35]
I형은 폐포벽 구조를 구성하는 편평 상피세포입니다. 가스 교환을 쉽게 할 수 있는 매우 얇은 벽을 가지고 있습니다.[34] I형 세포는 또한 각 폐포를 분리하는 폐포 중격을 구성합니다. 중격은 상피 안감 및 관련 기저막으로 구성됩니다.[35] I형 세포는 분열할 수 없으며, 결과적으로 II형 세포와의 분화에 의존합니다.[35]
II형은 더 크고 폐포를 따라 배열되며 상피 내막액, 폐 계면활성제를 생성하고 분비합니다.[36][34] II형 세포는 I형 세포로 분열하고 분화할 수 있습니다.[35]
폐포 대식세포는 면역체계에서 중요한 역할을 합니다. 그들은 혈관에서 밀려나온 헐렁한 적혈구를 포함하여 폐포에 침착되는 물질을 제거합니다.[35]
미생물군
폐에는 기도 상피세포와 상호작용하는 폐 미생물로 알려진 미생물이 많이 존재하는데, 이는 항상성을 유지하는 데 있어 아마도 중요한 상호작용입니다. 미생물군은 건강한 사람들에게서 복잡하고 역동적이며 천식과 COPD와 같은 질병에서 변화합니다. 예를 들어, 라이노바이러스 감염 후 COPD에서 상당한 변화가 일어날 수 있습니다.[37] 미생물군에서 균총으로 흔히 발견되는 곰팡이 속에는 칸디다, 말라세지아, 사카로미세스, 아스페르길루스 등이 있습니다.[38][39]
호흡기
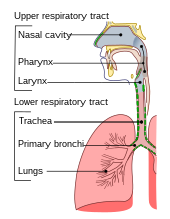
하부 호흡기는 호흡기의 일부로, 폐를 포함한 기관과 이 아래의 구조로 이루어져 있습니다.[34] 기관은 인두로부터 공기를 받아 오른쪽과 왼쪽 일차 기관지로 갈라지는 곳으로 내려갑니다. 이들은 오른쪽 폐와 왼쪽 폐에 공기를 공급하여 폐의 엽을 위한 2차 및 3차 기관지로, 그리고 호흡 기관지가 될 때까지 점점 더 작은 기관지로 갈라집니다. 이들은 차례로 폐포관을 통해 공기를 폐포로 공급하고, 여기서 가스의 교환이 이루어집니다.[34] 산소는 숨을 들이마시고, 폐포의 벽을 통해 주변의 모세혈관과 순환계로 확산되며,[22] 이산화탄소는 혈액에서 폐로 확산되어 배출됩니다.
폐의 총 표면적의 추정치는 50에서 75 제곱 미터(540에서 810 평방 피트)까지 다양합니다.[34][35] 이것은 종종 교과서와 언론에서 "테니스 코트 크기"[35][40][41]라고 인용되지만 실제로는 단일 코트의 절반도 되지 않습니다.[42]
전도 영역의 기관지는 기도를 열어두기 위해 유리질 연골로 보강됩니다. 세기관지는 연골이 없고 대신 평활근으로 둘러싸여 있습니다.[35] 공기는 37°C(99°F)로 데워지고, 전도 구역에 의해 가습 및 세척됩니다. 통로를 따라 늘어선 호흡기 상피의 섬모에 의해 공기 중의 입자가 제거되며,[43] 이 과정을 점막의 섬모 제거라고 합니다.
기도의 평활근에 있는 폐 신장 수용체는 강력한 흡기 동안 폐가 과도하게 팽창하는 것을 방지하는 Hering-Breuer reflex로 알려진 반사를 시작합니다.
혈액공급

폐에는 기관지와 폐 순환에 의해 제공되는 이중 혈액 공급이 있습니다.[6] 기관지 순환은 대동맥을 빠져나가는 기관지 동맥을 통해 폐의 기도로 산소화된 혈액을 공급합니다. 일반적으로 세 개의 동맥이 있는데, 왼쪽 폐에 두 개, 오른쪽에 하나가 있고, 그것들은 기관지와 세기관지를 따라 분기됩니다.[34] 폐순환은 탈산소화된 혈액을 심장에서 폐로 운반하고 산소화된 혈액을 심장으로 되돌려 몸의 나머지 부분에 공급합니다.[34]
폐의 혈액량은 평균 약 450밀리리터로 전체 순환계 혈액량의 약 9%입니다. 이 수량은 일반 볼륨의 1/2에서 2배 사이에서 쉽게 변동할 수 있습니다. 또한 출혈을 통해 혈액이 손실될 경우 폐에서 나온 혈액이 자동으로 전신순환으로 옮겨지면서 부분적으로 보상할 수 있습니다.[44]
신경공급
폐는 자율신경계의 신경에 의해 공급됩니다. 부교감 신경계로부터의 입력은 미주신경을 통해 발생합니다.[6] 아세틸콜린에 자극을 받으면 기관지와 세기관지를 둘러싸고 있는 평활근의 수축을 일으키고, 분비선의 분비를 증가시킵니다.[45][page needed] 폐는 또한 호흡기의 베타 2 부신 수용체에 작용하는 노르에피네프린으로부터 교감음을 가지고 있는데, 이것은 기관지 확장을 유발합니다.[46]
호흡의 작용은 뇌간에 있는 호흡 중추가 경추신경총에서 횡격막까지 프레닉 신경을 따라 보내는 신경 신호 때문에 일어납니다.[47]
변화
폐의 엽은 해부학적 변화를 겪습니다.[48] 오른쪽 폐의 25%에서 수평 간열공이 불완전하거나, 심지어는 전체 사례의 11%에서 부재하는 것으로 나타났습니다. 왼쪽 폐와 오른쪽 폐의 각각 14%와 22%에서도 부속기류 균열이 발견되었습니다.[49] 왼쪽 폐의 21%~47%에서 비스듬한 샛길이 불완전한 것으로 나타났습니다.[50] 경우에 따라 균열이 없거나 추가로 발생하여 단 2개의 엽이 있는 오른쪽 폐 또는 3개의 엽이 있는 왼쪽 폐가 발생합니다.[48]
특히 중앙 기도 분기에서 기도 분기 구조의 변화가 발견되었습니다. 이 변이는 성인기의 COPD 발병과 관련이 있습니다.[51]
발전
인간의 폐의 발달은 후두기관 홈에서 일어나 태아에서 몇 주에 걸쳐 그리고 출생 후 몇 년 동안 성숙하게 발달합니다.[52]
호흡기를 구성하는 후두, 기관, 기관지 및 폐는 배 쪽에서 앞장의 꼬리 부분으로 나타나는 폐 싹에서 배 쪽으로 배아 발생[53] 4주 동안 형성되기 시작합니다.[54]

호흡기는 가지 구조를 가지고 있으며, 호흡기 나무라고도 합니다.[55] 배아에서 이 구조는 가지 형태 형성 과정에서 발달하며,[56] 가지 끝이 반복적으로 갈라지면서 생성됩니다. 폐의 발달에서 상피는 (다른 기관들과 마찬가지로) 분지관을 형성합니다. 폐는 좌우 대칭을 이루고 기관지 봉오리로 알려진 각각의 봉오리는 기관지가 되는 관 모양의 상피로 자라납니다. 각각의 기관지는 세기관지로 갈라집니다.[57] 분기는 각 튜브의 끝이 분기되는 결과입니다.[55] 분지 과정은 기관지, 세기관지, 그리고 궁극적으로 폐포를 형성합니다.[55] 폐에서 분기 형태 형성과 대부분 관련된 네 가지 유전자는 세포간 신호 전달 단백질 – 음파 고슴도치 (SHH), 섬유아세포 성장 인자 FGF10 및 FGFR2b, 뼈 형태 발생 단백질 BMP4입니다. FGF10이 가장 중요한 역할을 하는 것으로 보입니다. FGF10은 상피 분지에 필요한 파라크린 신호전달 분자로, SHH는 FGF10을 억제합니다.[55][57] 폐포의 발달은 다른 메커니즘에 의해 영향을 받아 계속되는 분기가 중단되고 말단 끝이 확장되어 폐포를 형성합니다.
4주차가 끝날 때 폐의 싹은 두 개로 나뉘는데, 기관의 양쪽에 있는 오른쪽과 왼쪽 일차 기관지 싹입니다.[58][59] 5주차 동안 오른쪽 싹은 3개의 2차 기관지 싹으로, 왼쪽 가지는 2개의 2차 기관지 싹으로 갈라집니다. 이것들은 오른쪽에 3개, 왼쪽에 2개의 폐엽을 발생시킵니다. 다음 주에 2차 싹은 각각 10개 정도씩 3차 싹으로 갈라집니다.[59] 6주차부터 16주차까지는 폐포를 제외한 폐의 주요 요소들이 나타납니다.[60] 16주부터 26주까지 기관지 비대와 폐 조직이 고도로 혈관화됩니다. 세기관지와 폐포관도 발달합니다. 26주차까지 말단 세기관지는 두 개의 호흡 세기관지로 분기되었습니다.[61] 출생까지 26주차에 걸쳐 있는 기간 동안 중요한 혈액-공기 장벽이 세워집니다. 폐 계면활성제를 분비하는 II형 폐포세포와 함께 가스 교환이 이루어질 특수한 I형 폐포세포가 나타납니다. 계면활성제는 공기-폐포 표면의 표면 장력을 줄여 폐포낭의 팽창을 가능하게 합니다. 폐포낭은 폐포관 끝에 형성된 원시 폐포를 포함하고 있으며,[62] 7개월경에 출현하여 제한된 호흡이 가능하고 미숙아가 생존할 수 있는 시점을 나타냅니다.[52]
비타민A 결핍증
발달 중인 폐는 특히 비타민 A 수준의 변화에 취약합니다. 비타민 A 결핍은 폐의 상피 내벽과 폐 실질의 변화와 관련이 있습니다. 이것은 폐의 정상적인 생리를 방해하고 호흡기 질환에 걸리기 쉽습니다. 비타민 A의 심각한 영양 결핍은 폐포 벽(septa)의 형성을 감소시키고 호흡 상피의 현저한 변화를 초래합니다; 세포외 기질과 기저막의 단백질 함량의 변화가 관찰됩니다. 세포외 기질은 폐의 탄력성을 유지하며, 기저막은 폐포 상피와 연관되어 있으며 혈액-공기 장벽에서 중요합니다. 결핍은 기능적 결함 및 질병 상태와 관련이 있습니다. 비타민 A는 출생 후 몇 년 동안 지속되는 폐포 발달에 중요합니다.[63]
출생후
태어날 때 아기의 폐는 폐에서 분비되는 액체로 채워져 있고 부풀지 않습니다. 출생 후 영아의 중추신경계는 온도와 환경의 갑작스러운 변화에 반응합니다. 그러면 분만 후 약 10초 이내에 첫 호흡이 시작됩니다.[64] 태어나기 전에 폐는 태아의 폐액으로 가득 차 있습니다.[65] 첫 호흡 후에는 유체가 빠르게 몸에 흡수되거나 숨을 내쉰다. 폐 혈관의 저항이 감소하여 가스 교환을 위한 표면적이 증가하고 폐는 자발적으로 숨을 쉬기 시작합니다. 이것은 폐 조직으로 들어가는 혈액의 양을 증가시키는 다른 변화를 동반합니다.[64]
태어날 때 폐는 성인 폐 폐포의 약 6분의 1만 존재할 정도로 매우 발달되지 않았습니다.[52] 폐포는 성인 초기까지 계속 형성되고, 폐의 재생에서 필요할 때 형성되는 능력을 볼 수 있습니다.[66][67] 폐포 중격은 발달된 폐의 단일 네트워크 대신 이중 모세혈관 네트워크를 가지고 있습니다. 모세혈관 네트워크가 성숙해야 폐가 정상적인 성장 단계에 진입할 수 있습니다. 폐포 수의 초기 성장에 이어 폐포가 커지는 또 다른 단계가 있습니다.[68]
기능.
가스교환
폐의 주요 기능은 폐와 혈액 사이의 가스 교환입니다.[69] 폐포 및 폐 모세관 가스는 얇은 혈액-공기 장벽을 가로질러 평형을 이룹니다.[36][70][71] 이 얇은 막(약 0.5~2μm 두께)은 약 3억 개의 폐포로 접혀져 가스 교환이 일어날 수 있는 매우 넓은 표면적(70~145m2 사이의 추정치)을 제공합니다.[70][72]

폐는 스스로 호흡할 수 있도록 팽창할 수 없으며, 흉강의 부피가 증가할 때만 팽창합니다.[73] 이것은 그림과 같이 횡격막의 수축을 통해 호흡하는 근육과 늑간 근육이 갈비뼈를 위로 당깁니다.[74] 숨을 내쉬는 동안 근육이 이완되면서 폐를 쉬게 합니다.[75] 이 시점에서 폐에는 성인 인간의 경우 약 2.5~3.0리터의 부피를 갖는 공기의 기능적 잔류 용량(FRC)이 포함되어 있습니다.[75]
숨을 몰아쉬는 동안 목과 복부에 많은 보조 근육이 동원되고, 숨을 내쉬는 동안 갈비뼈가 아래로 당겨지면서 흉강의 부피가 줄어듭니다.[75] 지금은 FRC가 감소했지만, 폐를 완전히 비울 수 없기 때문에 여전히 약 1리터의 잔류 공기가 남아 있습니다.[75] 폐의 부피와 용량을 평가하기 위해 폐 기능 검사를 수행합니다.
보호.
폐는 감염으로부터 보호하는 몇 가지 특징을 가지고 있습니다. 호흡기는 호흡기 상피나 호흡기 점막이 늘어서 있고, 리드미컬하게 박동하고 점액을 운반하는 섬모라고 불리는 머리카락 모양의 돌기가 있습니다. 이러한 점막 제거는 공기 매개 감염에 대한 중요한 방어 시스템입니다.[36] 흡입된 공기 중의 먼지 입자와 박테리아는 기도의 점막 표면에 걸리게 되고, 섬모의 리드미컬한 상향 박치기 작용에 의해 인두 쪽으로 올라갑니다.[35][76]: 661–730 폐의 안감은 또한 호흡기 감염으로부터 보호하는 면역글로불린 A를 분비합니다.[76] 잔 세포는 점액을[35] 분비하고, 점액은 방어, 항단백질분해효소, 항산화제와 같은 여러 항균 화합물을 포함합니다.[76] 점액 점도를 조절할 수 있는 것으로 제안된 폐 이온 세포라고 불리는 희귀한 유형의 특수 세포가 설명되었습니다.[77][78][79] 또한 폐의 안감에는 대식세포, 식균작용이라고 알려진 과정에서 폐로 들어가는 잔해와 미생물을 집어삼키고 파괴하는 면역세포, 그리고 T세포와 B세포와 같은 적응 면역계의 구성 요소를 활성화하기 위한 항원을 제시하는 수지상 세포도 포함되어 있습니다.[76]
호흡기의 크기와 공기의 흐름은 또한 더 큰 입자로부터 폐를 보호합니다. 더 작은 입자는 구강과 구강 뒤에 오로인두에 침착되고 더 큰 입자는 흡입 후 코털에 갇힙니다.[76]
다른.
폐에는 호흡 기능 외에도 여러 가지 다른 기능이 있습니다. 그들은 항상성 유지에 관여하여 레닌-안지오텐신 시스템의 일부로서 혈압 조절에 도움을 줍니다. 혈관 내벽은 안지오텐신 I에서 안지오텐신 II로의 전환을 촉매하는 효소인 안지오텐신 전환 효소(ACE)를 분비합니다.[80] 폐는 호흡할 때 이산화탄소를 배출함으로써 혈액의 산-염기 항상성에 관여합니다.[73][81]
폐는 또한 보호 역할을 합니다. 몇몇 종류의 프로스타글란딘, 류코트리엔, 세로토닌 및 브래디키닌과 같은 혈액 매개 물질은 폐를 통해 배설됩니다.[80] 약물 및 기타 물질은 폐에서 흡수, 변형 또는 배설될 수 있습니다.[73][82] 폐는 정맥의 작은 혈전을 걸러내고 동맥으로 들어가 뇌졸중을 일으키는 것을 막습니다.[81]
폐는 또한 목소리의 생성을 위한 공기와 공기 흐름,[73][83] 한숨과 헐떡임과 같은 다른 언어 소통을 제공함으로써 언어에 중추적인 역할을 합니다.
연구에 따르면 혈액 혈소판 생성에 있어 폐의 역할을 제안합니다.[84]
유전자 및 단백질 발현
인간 세포에는 약 2만 개의 단백질 코딩 유전자가 발현되며 이 유전자의 거의 75%가 정상 폐에서 발현됩니다.[85][86] 이 중 200개 미만의 유전자가 폐에서 더 구체적으로 발현되며, 20개 미만의 유전자는 폐 특이성이 높습니다. 폐 특이적 단백질의 가장 높은 발현은 SFTPA1,[36] SFTPB 및 SFTPC와 같은 다양한 계면활성제 단백질과 II형 폐렴구균에서 발현되는 납신입니다. 폐에서 발현이 증가된 다른 단백질은 섬모세포의 dynein 단백질 DNAH5와 기도 점막의 점액 분비 잔 세포의 분비된 SCGB1A1 단백질입니다.[87]
임상적 의의
폐는 다양한 질병과 장애에 의해 영향을 받을 수 있습니다. 폐 의학은 폐와 호흡기를 포함하는 호흡기 질환을 다루는 의학 전문 분야입니다.[88] 흉부외과는 폐 부피 감소 수술, 소엽 절제술, 폐렴 절제술, 폐 이식술 등 폐의 수술을 다룹니다.[89]
염증과 감염
폐 조직의 염증 상태는 폐렴, 호흡기는 기관지염과 세기관지염, 폐 흉막염을 둘러싸고 있는 흉막입니다. 염증은 보통 세균이나 바이러스로 인한 감염으로 발생합니다. 폐 조직에 다른 원인에 의해 염증이 생기는 것을 폐렴이라고 합니다. 세균성 폐렴의 주요 원인 중 하나는 결핵입니다.[76] 만성 감염은 면역 결핍 환자에서 종종 발생하며 폐에 아스페르길루스 푸미가투스에 의한 곰팡이 감염을 포함할 수 있습니다.[76][90] 미국에서 특정 종의 쥐는 급성 호흡곤란 증후군(ARDS)과 유사한 증상으로 치료할 수 없는 한타바이러스 폐증후군을 유발할 수 있는 한타바이러스를 인간에게 전염시킬 수 있습니다.[91]
알코올은 폐에 영향을 미치고 염증성 알코올성 폐 질환을 일으킬 수 있습니다. 알코올에 급성으로 노출되면 호흡기 상피의 섬모 박동을 자극합니다. 그러나 만성적인 노출은 점막 섬모 제거(MCC)를 감소시키는 섬모 반응을 둔감하게 하는 효과가 있습니다. MCC는 오염물질과 병원체로부터 보호하는 선천적인 방어 시스템으로, 이것이 파괴되면 폐포 대식세포의 수가 감소합니다. 그 다음 염증 반응은 사이토카인의 방출입니다. 또 다른 결과는 감염에 취약하다는 것입니다.[92][93]
혈액공급의 변화

폐색전증은 폐동맥에 걸리는 혈전입니다. 대부분의 색전증은 다리의 심부정맥 혈전증 때문에 발생합니다. 폐색전증은 환기/관류 스캔, 폐동맥 CT 스캔 또는 D-dimer와 같은 혈액 검사를 사용하여 조사할 수 있습니다.[76] 폐고혈압은 폐동맥 초기에 압력이 증가하는 것을 설명하는데, 이는 다양한 원인을 가지고 있습니다.[76] 폐와 신장의 작은 혈관에 염증을 일으키는 다발혈관염을 동반한 육아종증과 같은 다른 희귀 질환들도 폐의 혈액 공급에 영향을 미칠 수 있습니다.[76]
폐 타박상은 흉부 외상으로 인한 타박상입니다. 폐포의 출혈로 인해 호흡을 방해할 수 있는 체액이 축적되고, 이는 경미하거나 심각할 수 있습니다. 폐의 기능은 흉막강 흉수의 유체로부터 압박을 받거나 공기(기흉), 혈액(혈흉) 또는 더 희귀한 원인들과 같은 다른 물질들에 의해서도 영향을 받을 수 있습니다. 이러한 검사는 흉부 X선 또는 CT 스캔을 사용하여 검사할 수 있으며, 근본적인 원인을 파악하고 치료할 때까지 수술용 배수구를 삽입해야 할 수 있습니다.[76]
폐색성 폐질환


만성 기관지염, 폐기종 등을 포함하는 천식, 기관지확장증, 만성 폐쇄성 폐질환(COPD) 등은 모두 기도 폐쇄를 특징으로 하는 폐쇄성 폐질환입니다. 이는 기관지 나무의 수축으로 인해 염증으로 인해 폐포로 들어갈 수 있는 공기의 양을 제한합니다. 폐색성 폐질환은 증상 때문에 확인되고 폐활량 측정 등 폐기능 검사로 진단되는 경우가 많습니다.
많은 폐쇄성 폐질환은 유발인자(먼지 진드기나 흡연과 같은)를 피하고 기관지 확장제와 같은 증상 조절, 심한 경우 염증 억제(코르티코스테로이드를 통한 것과 같은)를 통해 관리됩니다. 만성 기관지염과 폐기종의 흔한 원인은 흡연이며, 기관지확장증의 흔한 원인으로는 심각한 감염과 낭포성 섬유증이 있습니다. 천식의 확실한 원인은 아직 밝혀지지 않았지만 다른 아토피 질환과 연관성이 있습니다.[76][94]
폐포 조직의 분해는 종종 담배 흡연의 결과로 폐기종으로 이어지는데, 이는 COPD로 발전할 수 있을 정도로 심각해질 수 있습니다. 엘라스타제는 폐의 결합 조직에서 엘라스틴을 분해하여 폐기종을 유발하기도 합니다. 급성기 단백질인 알파-1 항트립신에 의해 엘라스타제가 억제되고, 이에 결핍이 생기면 폐기종이 생길 수 있습니다. 흡연으로 인한 지속적인 스트레스로 기도 기저세포가 흐트러져 상피 장벽을 복구하는 데 필요한 재생 능력을 잃게 됩니다. 분해된 기저 세포는 COPD의 특징인 주요 기도 변화에 책임이 있는 것으로 보이며, 스트레스가 지속되면 악성 변형을 겪을 수 있습니다. 폐기종의 초기 발생은 작은 기도의 기도 상피의 초기 변화를 중심으로 한다는 연구 결과가 나왔습니다.[95] 기저 세포는 흡연자가 임상적으로 정의된 COPD로 전환하는 과정에서 더욱 퇴화됩니다.[95]
제한성 폐질환
일부 유형의 만성 폐 질환은 호흡에 관여하는 폐 조직의 양이 제한되기 때문에 제한성 폐 질환으로 분류됩니다. 여기에는 폐에 장기간 염증이 있을 때 발생할 수 있는 폐 섬유증이 포함됩니다. 폐의 섬유화는 기능하는 폐 조직을 섬유 결합 조직으로 대체합니다. 이는 석탄 노동자의 진폐, 자가 면역 질환과 같은 다양한 직업성 폐 질환이나 약물에 대한 반응이 더 드물기 때문일 수 있습니다.[76] 자발적인 호흡으로 생명을 유지하기에 충분하지 않은 중증 호흡 장애는 적절한 공기 공급을 보장하기 위해 기계적 환기를 사용해야 할 수 있습니다.
암
폐암은 폐 조직에서 직접 발생하거나 신체의 다른 부분에서 전이되어 발생할 수 있습니다. 원발성 종양은 소세포 또는 비소세포 폐암으로 설명되는 두 가지 주요 유형이 있습니다. 암의 주요 위험 요소는 흡연입니다. 암이 확인되면 CT 스캔과 같은 스캔을 사용하여 병기를 결정하고 조직검사에서 조직 샘플을 채취합니다. 암은 종양을 제거하거나 방사선 치료, 화학 요법 또는 이들의 조합을 사용하거나 증상 조절을 목적으로 하여 외과적으로 치료될 수 있습니다.[76] 미국에서는 고위험군을 대상으로 폐암 검진을 권장하고 있습니다.[96]
선천성 장애
선천성 질환으로는 낭포성 섬유증, 폐 저형성증([97]폐의 불완전 발육) 선천성 횡경막 탈장, 폐 계면활성제 결핍으로 인한 유아 호흡곤란 증후군 등이 있습니다. 아지고 로브는 선천적인 해부학적 변형으로 대개 효과가 없지만 흉강경 시술에서 문제를 일으킬 수 있습니다.[98]
흉막공간압력
기흉(collax, collaped lung)은 흉막 공간에서 비정상적으로 공기가 모여 흉벽에서 폐가 분리되는 현상을 말합니다. 폐는 흉막 공간 내부의 기압에 대해 팽창할 수 없습니다. 이해하기 쉬운 예로는 흉벽에 천자를 내면서 발생하는 것처럼 외부에서 흉막 공간으로 공기가 들어가는 외상성 기흉이 있습니다. 마찬가지로, 스쿠버 다이버들이 폐를 완전히 부풀린 채 숨을 참으며 상승하는 경우 에어 포낭(alveoli)이 터지고 흉막 공간으로 고압의 공기가 새어나갈 수 있습니다.
검토.
호흡곤란, 기침 등의 호흡기 증상에 따른 신체검사의 일환으로 폐검사를 시행할 수 있습니다. 이 검사에는 촉진 및 청진이 포함됩니다.[100] 청진기를 이용하여 들을 수 있는 폐의 부위를 폐장이라고 하는데, 이것이 후폐장, 측폐장, 전폐장입니다. 뒷전은 뒤에서 들을 수 있으며, 아래 엽(뒷전의 4분의 3을 차지함); 앞전(앞전)은 다른 4분의 1을 차지함; 그리고 축삭 아래의 측면 필드, 설측의 왼쪽 겨드랑이, 중간 우엽의 오른쪽 겨드랑이를 포함합니다. 전방 필드도 전방에서 청진할 수 있습니다.[101] 청진의 삼각형으로 알려진 영역은 뒤쪽에 근육이 얇아져 있어 청취율이 향상됩니다.[102] 폐 검사 중에 들리는 비정상적인 호흡음은 폐 상태의 존재를 나타낼 수 있습니다. 예를 들어, 천명음은 일반적으로 천식 및 COPD와 관련이 있습니다.
기능 테스트
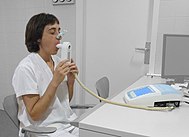
폐 기능 검사는 사람이 여러 상황에서 숨을 들이마시고 내쉬는 능력을 평가하여 수행됩니다.[103] 휴식 중인 사람이 들이마시고 내쉬는 공기량은 조석량(보통 500~750mL)이고, 호흡 예비량과 호흡 예비량은 각각 사람이 강제로 들이마시고 내쉬는 추가량입니다. 강제 영감과 만료의 합계는 사람의 중요한 능력입니다. 강제로 숨을 내쉬고 나서도 모든 공기가 폐에서 배출되는 것은 아닙니다. 나머지 공기를 잔량이라고 합니다. 이러한 용어를 함께 폐 부피라고 합니다.[103]
폐혈류측정기는 기능적 잔류 용량을 측정하는 데 사용됩니다.[104] 사람은 총 기능 용량의 최대 80%까지만 숨을 쉴 수 있기 때문에 숨을 내쉬는 것에 의존하는 테스트로는 기능 잔여 용량을 측정할 수 없습니다.[105] 총 폐활량은 사람의 나이, 키, 몸무게, 성별에 따라 다르며 일반적으로 4~6리터 사이입니다.[103] 암컷은 수컷보다 용량이 20~25% 낮은 경향이 있습니다. 키가 큰 사람은 키가 작은 사람보다 총 폐활량이 더 큰 경향이 있습니다. 흡연자는 비흡연자에 비해 수용 능력이 낮습니다. 얇은 사람은 용량이 더 큰 경향이 있습니다. 폐활량은 신체 훈련으로 40%까지 증가시킬 수 있지만, 대기 오염에 노출되면 효과가 수정될 수 있습니다.[105][106]
다른 폐 기능 검사로는 호흡 측정, 흡입 및 호기할 수 있는 공기의 양(부피) 및 흐름 측정이 있습니다. 최대로 내뿜을 수 있는 숨의 양을 활력소라고 합니다. 특히 사람이 1초 안에 숨을 얼마나 내쉴 수 있는지(강제 호기량(FEV1)이라고 함)는 총 숨을 얼마나 내쉴 수 있는지(FEV)의 비율입니다. 이 비율, FEV1/FEV 비율은 폐 질환이 제한적인지 폐쇄적인지를 구별하는 데 중요합니다.[76][103] 또 다른 검사는 폐의 확산 능력에 대한 검사입니다 – 이것은 공기에서 폐 모세혈관의 혈액으로 가스가 전달되는 것을 측정한 것입니다.
다른 동물들
새들


새의 폐는 비교적 작지만 몸의 많은 부분을 통해 뻗어 있는 8~9개의 공기주머니와 연결되어 있고, 차례로 뼈 안의 공기 공간과 연결되어 있습니다. 흡입 시 공기는 새의 기관을 통해 공기 주머니로 이동합니다. 그런 다음 공기는 뒤에 있는 공기 주머니에서 비교적 크기가 고정되어 있는 폐를 통해 앞쪽에 있는 공기 주머니로 계속 이동합니다. 여기서 공기가 뿜어져 나옵니다. 이러한 고정된 크기의 폐는 대부분의 다른 동물에서 볼 수 있는 "종족형 폐"와 구별되어 "순환형 폐"라고 불립니다.[107][109]
새의 폐는 파라브론치라고 불리는 수백만 개의 작은 평행 통로를 포함하고 있습니다. 작은 통로의 벽에서 방사되는 작은 주머니들은 다른 폐의 폐포와 같이 단순한 확산에 의한 가스 교환의 장소입니다.[109] 파라브론치와 그 심방 주위의 혈류는 가스 교환의 교차 전류 과정을 형성합니다(오른쪽 그림 참조).[107][108]
공기를 담고 있는 공기 주머니는 벽이 얇음에도 불구하고 혈관이 잘 형성되지 않아 가스 교환에 크게 기여하지 않습니다. 흉곽과 복부의 부피 변화로 공기 주머니가 팽창하고 수축합니다. 이 부피 변화는 흉골과 갈비뼈의 움직임에 의해 발생하며 이 움직임은 종종 비행 근육의 움직임과 동기화됩니다.[110]
공기의 흐름이 단방향인 파라브론치를 팔로풀모닉 파라브론치라고 하며 모든 새에서 발견됩니다. 그러나 일부 새들은 추가적으로 파라브론치의 공기 흐름이 양방향인 폐 구조를 가지고 있습니다. 이것들은 네오풀모닉 파라브론치라고 불립니다.[109]
파충류
대부분의 파충류들의 폐는 중앙을 흐르는 하나의 기관지를 가지고 있고, 그 기관으로부터 수많은 가지들이 폐를 통해 개별 주머니로 뻗어나갑니다. 이 주머니들은 포유류의 폐포와 비슷하지만, 그 수는 훨씬 더 크고 더 적습니다. 이것들은 폐에 스폰지 같은 질감을 줍니다. 투아타라, 뱀 및 일부 도마뱀의 폐는 일반적인 양서류와 유사하게 구조가 더 단순합니다.[110]
뱀과 사지가 없는 도마뱀은 보통 오른쪽 폐만 주요 호흡 기관으로 가지고 있고, 왼쪽 폐는 크게 줄어들거나 아예 없습니다. 그러나 암피스베니안은 왼쪽 폐가 주요하고 오른쪽 폐가 감소하거나 없는 반대의 배열을 가지고 있습니다.[110]
악어와 모니터 도마뱀 모두 새와 비슷한 폐를 가지고 있어 단방향 기류를 제공하고 공기 주머니까지 가지고 있습니다.[111] 지금은 멸종된 익룡들은 이러한 종류의 폐를 더욱 정교하게 다듬어, 날개 막으로 에어삭을 확장시켰고, 론코덱테스, 투푸수아라, 아즈다르코이드의 경우 뒷다리를 확장했습니다.[112]
파충류의 폐는 일반적으로 축 방향 근육과 협측 펌핑에 의해 구동되는 갈비뼈의 팽창과 수축을 통해 공기를 공급받습니다. 악어들은 또한 횡경막이라고 불리는 치골(골반의 일부)에 고정된 근육에 의해 간이 뒤로 당겨지는 간 피스톤 방식에 의존하는데,[113] 이는 다시 악어의 흉강에 음압을 만들어 공기가 보일의 법칙에 의해 폐로 이동할 수 있게 합니다. 갈비뼈를 움직일 수 없는 거북이들은 대신 앞다리와 가슴둘레를 이용해 공기를 폐 안팎으로 몰아냅니다.[110]
양서류

대부분의 개구리와 다른 양서류의 폐는 단순하고 풍선 모양이며, 가스 교환은 폐의 외부 표면에만 국한되어 있습니다. 이것은 그다지 효율적이지는 않지만, 양서류는 대사 요구량이 적고 물 속에서 피부를 가로질러 확산되어 이산화탄소를 빠르게 처리할 수 있으며, 같은 방법으로 산소 공급을 보충할 수도 있습니다. 양서류는 양압 시스템을 사용하여 공기를 폐로 전달하고, 협측 펌핑을 통해 공기를 폐로 강제로 내립니다. 이것은 대부분의 고등 척추동물들이 음압에 의해 구동되는 호흡 시스템을 사용하여 늑골 케이지를 확장하여 폐가 팽창되는 것과 구별됩니다.[114] 협측 펌핑에서는 구강 바닥이 낮아져 구강을 공기로 채웁니다. 그리고 나서 목 근육은 목구멍을 두개골의 아래쪽으로 눌러 공기를 폐로 강제로 집어넣습니다.[115]
작은 크기와 결합된 피부 전체의 호흡 가능성 때문에 알려진 폐가 없는 사지동물은 모두 양서류입니다. 도롱뇽 종의 대부분은 폐가 없는 도롱뇽으로 피부와 입 안에 있는 조직을 통해 호흡합니다. 이것은 반드시 그들의 크기를 제한합니다: 모두 작고 다소 실 같은 외모로 신체 부피에 비해 피부 표면을 극대화합니다.[116] 다른 알려진 폐가 없는 사지동물로는 보르네오 납작머리 개구리와[117] 맹장 동물인 아트레토초아나 아이셀티가 있습니다.[118]
양서류의 폐는 일반적으로 외벽 주위에 몇 개의 좁은 내부 벽(septa)의 연조직을 가지고 있어 호흡 표면적이 증가하고 폐가 벌집처럼 보입니다. 일부 도롱뇽에서는 이것들조차 부족하고, 폐는 부드러운 벽을 가지고 있습니다. 뱀과 마찬가지로 맹장류에서는 오른쪽 폐만 크기나 발달에 도달합니다.[110]
물고기.
폐는 실러캔스, 비셔, 폐어 세 그룹의 물고기에서 발견됩니다. 사지동물과 마찬가지로, 그러나 방광이 있는 물고기와 달리, 입구는 식도의 복부 쪽에 있습니다. 실러캔스는 지방 기관으로 둘러싸인 비기능적이고 짝을 이루지 않은 흔적 폐를 가지고 있습니다.[119] 폐를 가진 유일한 가오리 지느러미 물고기 그룹인 비셔는 한 쌍의 속이 빈 방추형 주머니를 가지고 있으며, 여기서 가스 교환은 그들의 내부 표면적을 증가시키는 매우 평평한 주름에서 발생합니다. 폐어의 폐는 사지동물의 폐와 더 유사합니다. 실질 중격의 정교한 네트워크가 있으며, 그들을 수많은 호흡실로 나뉩니다.[120][121] 호주의 폐어에는 비록 두 개의 엽으로 나누어져 있지만 단 하나의 폐만 있습니다. 그러나 다른 폐어들은 두 개의 폐를 가지고 있습니다. 호주산을 포함한 모든 폐어류에서 폐는 몸의 등 위쪽에 위치하며 연결관은 식도 주위와 위쪽으로 휘어져 있습니다. 혈액 공급도 식도를 중심으로 꼬여 폐가 원래 다른 척추동물처럼 복부 쪽에서 진화했음을 시사합니다.[110]
무척추동물

일부 무척추동물은 척추동물의 폐와 유사한 호흡 목적을 수행하지만 진화론적으로 관련이 없는 폐와 유사한 구조를 가지고 있습니다. 거미나 전갈과 같은 일부 거미류는 대기 가스 교환에 사용되는 책 폐라고 불리는 구조를 가지고 있습니다. 거미의 어떤 종은 4쌍의 책 폐를 가지고 있지만 대부분은 2쌍을 가지고 있습니다.[122] 전갈들은 책의 폐로 공기가 들어가기 위해 몸에 나선형을 가지고 있습니다.[123]
코코넛 크랩은 지상에 있고 공기를 호흡하기 위해 가지각류 폐라고 불리는 구조물을 사용합니다.[124] 그들은 수영을 할 수 없고 물에 빠질 수 있지만 기본적인 아가미 세트를 가지고 있습니다. 그들은 육지에서 숨을 쉴 수 있고 물속에서 숨을 참을 수 있습니다.[125] 가지각류 폐는 육지 생활을 가능하게 하기 위한 물 생활에서, 또는 물고기에서 양서류에 이르기까지 발달 적응 단계로 간주됩니다.[126]
풀모네이트는 대부분 육지 달팽이와 민달팽이로 맨틀 공동에서 간단한 폐가 발달했습니다. 기흉이라고 불리는 외부에 위치한 구멍은 공기가 맨틀 공동 폐로 들어갈 수 있게 해줍니다.[127][128]
진화적 기원
오늘날의 육상 척추동물의 폐와 오늘날의 물고기의 가스 방광은 초기 물고기가 산소가 부족한 조건에서 공기를 꿀꺽꿀꺽 마실 수 있도록 식도의 아웃포켓으로서 단순한 주머니에서 진화한 것으로 여겨집니다.[129] 이 아웃포켓팅은 뼈가 많은 생선에서 처음 발생했습니다. 대부분의 가오리 지느러미 물고기에서 주머니는 폐쇄된 가스 방광으로 진화한 반면, 많은 잉어, 송어, 청어, 메기, 뱀장어는 주머니가 식도에 열려 있는 물리적 상태를 유지했습니다. 가(gar), 비키르(bichir), 보우핀(bowfin) 및 엽지느러미 물고기와 같은 더 기본적인 뼈 물고기에서 방광은 주로 폐 기능을 하도록 진화했습니다.[129] 엽지느러미 물고기는 육지에 사는 네발동물을 낳았습니다. 따라서 척추동물의 폐는 물고기의 가스 방광과 상동이지만 아가미와는 상동입니다.[130]
참고 항목
참고문헌
- ^ Association, American Lung. "How Lungs Work". www.lung.org. Retrieved 2023-11-18.
- ^ Tucker, William D.; Weber, Carly; Burns, Bracken (2023), "Anatomy, Thorax, Heart Pulmonary Arteries", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 30521233, retrieved 2023-11-18
- ^ a b c d e f g Drake, Richard L.; Vogl, Wayne; Mitchell, Adam W.M. (2014). Gray's anatomy for students (3rd ed.). Edinburgh: Churchill Livingstone/Elsevier. pp. 167–174. ISBN 978-0-7020-5131-9.
- ^ Betts, J. Gordon (2013). Anatomy & physiology. OpenStax College, Rice University. pp. 787–846. ISBN 978-1-938168-13-0. Retrieved 11 August 2014.
- ^ a b c d e f g h Standring, Susan (2008). Borley, Neil R. (ed.). Gray's Anatomy: The Anatomical Basis of Clinical Practice (40th ed.). Edinburgh: Churchill Livingstone/Elsevier. pp. 992–1000. ISBN 978-0-443-06684-9. Alt URL
- ^ a b c Moore, K (2018). Clinically oriented anatomy (8th ed.). Wolters Kluwer. pp. 333–339. ISBN 9781496347213.
- ^ a b c Arakawa, H; Niimi, H; Kurihara, Y; Nakajima, Y; Webb, WR (December 2000). "Expiratory high-resolution CT: diagnostic value in diffuse lung diseases". American Journal of Roentgenology. 175 (6): 1537–1543. doi:10.2214/ajr.175.6.1751537. PMID 11090370.
- ^ a b Koster, TD; Slebos, DJ (2016). "The fissure: interlobar collateral ventilation and implications for endoscopic therapy in emphysema". International Journal of Chronic Obstructive Pulmonary Disease. 11: 765–73. doi:10.2147/COPD.S103807. PMC 4835138. PMID 27110109.
- ^ a b c Hacking, Craig; Knipe, Henry. "Lung fissures". Radiopaedia. Retrieved 8 February 2016.
- ^ Jones, Jeremy. "Bronchopulmonary segmental anatomy Radiology Reference Article Radiopaedia.org". radiopaedia.org.
- ^ Tortora, Gerard (1987). Principles of anatomy and physiology (5th ed.). New York: Harper and Row. p. 564. ISBN 978-0-06-350729-6.
- ^ Chaudhry R, Bordoni B (Jan 2019). "Anatomy, Thorax, Lungs". StatPearls [Internet]. PMID 29262068.
- ^ a b Molina, D. Kimberley; DiMaio, Vincent J.M. (December 2012). "Normal Organ Weights in Men". The American Journal of Forensic Medicine and Pathology. 33 (4): 368–372. doi:10.1097/PAF.0b013e31823d29ad. PMID 22182984. S2CID 32174574.
- ^ a b Molina, D. Kimberley; DiMaio, Vincent J. M. (September 2015). "Normal Organ Weights in Women". The American Journal of Forensic Medicine and Pathology. 36 (3): 182–187. doi:10.1097/PAF.0000000000000175. PMID 26108038. S2CID 25319215.
- ^ Yu, J.A.; Pomerantz, M; Bishop, A; Weyant, M.J.; Mitchell, J.D. (2011). "Lady Windermere revisited: Treatment with thoracoscopic lobectomy/segmentectomy for right middle lobe and lingular bronchiectasis associated with non-tuberculous mycobacterial disease". European Journal of Cardio-Thoracic Surgery. 40 (3): 671–675. doi:10.1016/j.ejcts.2010.12.028. PMID 21324708.
- ^ Ayed, A.K. (2004). "Resection of the right middle lobe and lingula in children for middle lobe/lingula syndrome". Chest. 125 (1): 38–42. doi:10.1378/chest.125.1.38. PMID 14718418. S2CID 45666843.
- ^ Young B, Lowe JS, Stevens A, Heath JW (2006). Wheater's functional histology : a text and colour atlas. Deakin PJ (illust) (5th ed.). [Edinburgh?]: Churchill Livingstone/Elsevier. pp. 234–250. ISBN 978-0-443-06850-8.
- ^ "The Lymphatic System – Human Anatomy". Retrieved 8 September 2017.
- ^ Saladin, Kenneth S. (2011). Human anatomy (3rd ed.). New York: McGraw-Hill. p. 634. ISBN 9780071222075.
- ^ Dorland (2011-06-09). Dorland's Illustrated Medical Dictionary (32nd ed.). Elsevier. p. 1077. ISBN 978-1-4160-6257-8. Retrieved 11 February 2016.
- ^ a b Mithieux, Suzanne M.; Weiss, Anthony S. (2005). "Elastin". Fibrous Proteins: Coiled-Coils, Collagen and Elastomers. Advances in Protein Chemistry. Vol. 70. pp. 437–461. doi:10.1016/S0065-3233(05)70013-9. ISBN 9780120342709. PMID 15837523.
- ^ a b c d Pocock, Gillian; Richards, Christopher D. (2006). Human physiology : the basis of medicine (3rd ed.). Oxford: Oxford University Press. pp. 315–318. ISBN 978-0-19-856878-0.
- ^ Stanke, F (2015). "The Contribution of the Airway Epithelial Cell to Host Defense". Mediators Inflamm. 2015: 463016. doi:10.1155/2015/463016. PMC 4491388. PMID 26185361.
- ^ Van Lommel, A (June 2001). "Pulmonary neuroendocrine cells (PNEC) and neuroepithelial bodies (NEB): chemoreceptors and regulators of lung development". Paediatric Respiratory Reviews. 2 (2): 171–6. doi:10.1053/prrv.2000.0126. PMID 12531066.
- ^ a b Garg, Ankur; Sui, Pengfei; Verheyden, Jamie M.; Young, Lisa R.; Sun, Xin (2019). "Consider the lung as a sensory organ: A tip from pulmonary neuroendocrine cells". Organ Development. Current Topics in Developmental Biology. Vol. 132. pp. 67–89. doi:10.1016/bs.ctdb.2018.12.002. ISBN 9780128104897. PMID 30797518. S2CID 73489416.
- ^ Weinberger, S; Cockrill, B; Mandel, J (2019). Principles of pulmonary medicine (Seventh ed.). Elsevier. p. 67. ISBN 9780323523714.
- ^ a b c Hall, John (2011). Guyton and Hall textbook of medical physiology (12th ed.). Philadelphia: Saunders/Elsevier. ISBN 978-1-4160-4574-8.
- ^ Abbott, Gerald F.; Rosado-de-Christenson, Melissa L.; Rossi, Santiago E.; Suster, Saul (November 2009). "Imaging of Small Airways Disease". Journal of Thoracic Imaging. 24 (4): 285–298. doi:10.1097/RTI.0b013e3181c1ab83. PMID 19935225. S2CID 10249069.
- ^ Weinberger, Steven (2019). Principles of Pulmonary Medicine. Elsevier. p. 2. ISBN 9780323523714.
- ^ a b Hochhegger, B (June 2019). "Pulmonary Acinus: Understanding the Computed Tomography Findings from an Acinar Perspective". Lung. 197 (3): 259–265. doi:10.1007/s00408-019-00214-7. hdl:10923/17852. PMID 30900014. S2CID 84846517.
- ^ a b Gray, Henry; Standring, Susan; Anhand, Neel, eds. (2021). Gray's Anatomy: the anatomical basis of clinical practice (42nd ed.). Amsterdam: Elsevier. p. 1028. ISBN 978-0-7020-7705-0.
- ^ a b Goel, A. "Primary pulmonary lobule". Retrieved 12 July 2019.
- ^ Gilcrease-Garcia, B; Gaillard, Frank. "Secondary pulmonary lobule". radiopaedia.org. Retrieved 10 August 2019.
- ^ a b c d e f g h i Stanton, Bruce M.; Koeppen, Bruce A., eds. (2008). Berne & Levy physiology (6th ed.). Philadelphia: Mosby/Elsevier. pp. 418–422. ISBN 978-0-323-04582-7.
- ^ a b c d e f g h i j k Pawlina, W (2015). Histology a Text & Atlas (7th ed.). Wolters Kluwer Health. pp. 670–678. ISBN 978-1-4511-8742-7.
- ^ a b c d Srikanth, Lokanathan; Venkatesh, Katari; Sunitha, Manne Mudhu; Kumar, Pasupuleti Santhosh; Chandrasekhar, Chodimella; Vengamma, Bhuma; Sarma, Potukuchi Venkata Gurunadha Krishna (16 October 2015). "In vitro generation of type-II pneumocytes can be initiated in human CD34+ stem cells". Biotechnology Letters. 38 (2): 237–242. doi:10.1007/s10529-015-1974-2. PMID 26475269. S2CID 17083137.
- ^ Hiemstra, PS; McCray PB, Jr; Bals, R (April 2015). "The innate immune function of airway epithelial cells in inflammatory lung disease". The European Respiratory Journal. 45 (4): 1150–62. doi:10.1183/09031936.00141514. PMC 4719567. PMID 25700381.
- ^ Cui L, Morris A, Ghedin E (2013). "The human mycobiome in health and disease". Genome Med. 5 (7): 63. doi:10.1186/gm467. PMC 3978422. PMID 23899327.
- ^ Richardson, M; Bowyer, P; Sabino, R (1 April 2019). "The human lung and Aspergillus: You are what you breathe in?". Medical Mycology. 57 (Supplement_2): S145–S154. doi:10.1093/mmy/myy149. PMC 6394755. PMID 30816978.
- ^ Miller, Jeff (11 April 2008). "Tennis Courts and Godzilla: A Conversation with Lung Biologist Thiennu Vu". UCSF News & Media. Retrieved 2020-05-05.
- ^ "8 Interesting Facts About Lungs". Bronchiectasis News Today. 2016-10-17. Retrieved 2020-05-05.
- ^ Notter, Robert H. (2000). Lung surfactants: basic science and clinical applications. New York: Marcel Dekker. p. 120. ISBN 978-0-8247-0401-8. Retrieved 2008-10-11.
- ^ Jiyuan Tu; Kiao Inthavong; Goodarz Ahmadi (2013). Computational fluid and particle dynamics in the human respiratory system (1st ed.). Dordrecht: Springer. pp. 23–24. ISBN 9789400744875.
- ^ Guyton, A; Hall, J (2011). Medical Physiology. Saunders/Elsevier. p. 478. ISBN 9781416045748.
- ^ Levitzky, Michael G. (2013). "Chapter 2. Mechanics of Breathing". Pulmonary physiology (8th ed.). New York: McGraw-Hill Medical. ISBN 978-0-07-179313-1.
- ^ Johnson M (January 2006). "Molecular mechanisms of beta(2)-adrenergic receptor function, response, and regulation". The Journal of Allergy and Clinical Immunology. 117 (1): 18–24, quiz 25. doi:10.1016/j.jaci.2005.11.012. PMID 16387578.
- ^ Tortora, G; Derrickson, B (2011). Principles of Anatomy & Physiology. Wiley. p. 504. ISBN 9780470646083.
- ^ a b Moore, K (2018). Clinically oriented anatomy (8th ed.). Wolters Kluwer. p. 342. ISBN 9781496347213.
- ^ "Variations in the lobes and fissures of lungs – a study in South Indian lung specimens". European Journal of Anatomy. 18 (1): 16–20. 2019-06-09. ISSN 1136-4890.
- ^ Meenakshi, S; Manjunath, KY; Balasubramanyam, V (2004). "Morphological variations of the lung fissures and lobes". The Indian Journal of Chest Diseases & Allied Sciences. 46 (3): 179–82. PMID 15553206.
- ^ Marko, Z (2018). "Human lung development:recent progress and new challenges". Development. 145 (16): dev163485. doi:10.1242/dev.163485. PMC 6124546. PMID 30111617.
- ^ a b c Sadler, T. (2010). Langman's medical embryology (11th ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 204–207. ISBN 978-0-7817-9069-7.
- ^ Moore, K.L.; Persaud, T.V.N. (2002). The Developing Human: Clinically Oriented Embryology (7th ed.). Saunders. ISBN 978-0-7216-9412-2.
- ^ Hill, Mark. "Respiratory System Development". UNSW Embryology. Retrieved 23 February 2016.
- ^ a b c d Miura, T (2008). "Modeling Lung Branching Morphogenesis". Multiscale Modeling of Developmental Systems. Current Topics in Developmental Biology. Vol. 81. pp. 291–310. doi:10.1016/S0070-2153(07)81010-6. ISBN 9780123742537. PMID 18023732.
- ^ Ochoa-Espinosa, A; Affolter, M (1 October 2012). "Branching morphogenesis: from cells to organs and back". Cold Spring Harbor Perspectives in Biology. 4 (10): a008243. doi:10.1101/cshperspect.a008243. PMC 3475165. PMID 22798543.
- ^ a b Wolpert, Lewis (2015). Principles of development (5th ed.). Oxford University Press. pp. 499–500. ISBN 978-0-19-967814-3.
- ^ Sadler, T. (2010). Langman's medical embryology (11th ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 202–204. ISBN 978-0-7817-9069-7.
- ^ a b Larsen, William J. (2001). Human embryology (3. ed.). Philadelphia: Churchill Livingstone. p. 144. ISBN 978-0-443-06583-5.
- ^ Kyung Won, Chung (2005). Gross Anatomy (Board Review). Hagerstown, MD: Lippincott Williams & Wilkins. p. 156. ISBN 978-0-7817-5309-8.
- ^ Larsen, William J. (2001). Human embryology (3. ed.). Philadelphia: Churchill Livingstone. p. 134. ISBN 978-0-443-06583-5.
- ^ Alberts, Daniel (2012). Dorland's illustrated medical dictionary (32nd ed.). Philadelphia: Saunders/Elsevier. p. 56. ISBN 978-1-4160-6257-8.
- ^ Timoneda, Joaquín; Rodríguez-Fernández, Lucía; Zaragozá, Rosa; Marín, M.; Cabezuelo, M.; Torres, Luis; Viña, Juan; Barber, Teresa (21 August 2018). "Vitamin A Deficiency and the Lung". Nutrients. 10 (9): 1132. doi:10.3390/nu10091132. PMC 6164133. PMID 30134568.
- ^ a b "Changes in the newborn at birth". MedlinePlus Medical Encyclopedia.
- ^ O'Brodovich, Hugh (2001). "Fetal lung liquid secretion". American Journal of Respiratory Cell and Molecular Biology. 25 (1): 8–10. doi:10.1165/ajrcmb.25.1.f211. PMID 11472968.
- ^ Schittny, JC; Mund, SI; Stampanoni, M (February 2008). "Evidence and structural mechanism for late lung alveolarization". American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (2): L246–254. CiteSeerX 10.1.1.420.7315. doi:10.1152/ajplung.00296.2007. PMID 18032698.
- ^ Schittny, JC (March 2017). "Development of the lung". Cell and Tissue Research. 367 (3): 427–444. doi:10.1007/s00441-016-2545-0. PMC 5320013. PMID 28144783.
- ^ Burri, PH (1984). "Fetal and postnatal development of the lung". Annual Review of Physiology. 46: 617–628. doi:10.1146/annurev.ph.46.030184.003153. PMID 6370120.
- ^ Tortora, G; Anagnostakos, N (1987). Principles of Anatomy and Physiology. Harper and Row. p. 555. ISBN 978-0-06-350729-6.
- ^ a b Williams, Peter L; Warwick, Roger; Dyson, Mary; Bannister, Lawrence H. (1989). Gray's Anatomy (37th ed.). Edinburgh: Churchill Livingstone. pp. 1278–1282. ISBN 0443-041776.
- ^ "Gas Exchange in humans". Retrieved 19 March 2013.
- ^ Tortora, G; Anagnostakos, N (1987). Principles of Anatomy and Physiology. Harper and Row. p. 574. ISBN 978-0-06-350729-6.
- ^ a b c d Levitzky, Michael G. (2013). "Chapter 1. Function and Structure of the Respiratory System". Pulmonary physiology (8th ed.). New York: McGraw-Hill Medical. ISBN 978-0-07-179313-1.
- ^ Tortora, Gerard J.; Anagnostakos, Nicholas P. (1987). Principles of anatomy and physiology (Fifth ed.). New York: Harper & Row, Publishers. p. 567. ISBN 978-0-06-350729-6.
- ^ a b c d Tortora, Gerard J.; Anagnostakos, Nicholas P. (1987). Principles of anatomy and physiology (Fifth ed.). New York: Harper & Row, Publishers. pp. 556–582. ISBN 978-0-06-350729-6.
- ^ a b c d e f g h i j k l m n o Brian R. Walker; Nicki R. Colledge; Stuart H. Ralston; Ian D. Penman, eds. (2014). Davidson's principles and practice of medicine. Illustrations by Robert Britton (22nd ed.). Churchill Livingstone/Elsevier. ISBN 978-0-7020-5035-0.
- ^ Montoro, Daniel T; Haber, Adam L; Biton, Moshe; Vinarsky, Vladimir; Lin, Brian; Birket, Susan E; Yuan, Feng; Chen, Sijia; Leung, Hui Min; Villoria, Jorge; Rogel, Noga; Burgin, Grace; Tsankov, Alexander M; Waghray, Avinash; Slyper, Michal; Waldman, Julia; Nguyen, Lan; Dionne, Danielle; Rozenblatt-Rosen, Orit; Tata, Purushothama Rao; Mou, Hongmei; Shivaraju, Manjunatha; Bihler, Hermann; Mense, Martin; Tearney, Guillermo J; Rowe, Steven M; Engelhardt, John F; Regev, Aviv; Rajagopal, Jayaraj (2018). "A revised airway epithelial hierarchy includes CFTR-expressing ionocytes". Nature. 560 (7718): 319–324. Bibcode:2018Natur.560..319M. doi:10.1038/s41586-018-0393-7. PMC 6295155. PMID 30069044.
- ^ Plasschaert, LW; Zillionis, R; Choo-Wing, R; Savova, V; Knehr, J; Roma, G; Klein, AM; Jaffe, AB (2018). "A single-cell atlas of the airway epithelium reveals the CFTR-rich pulmonary ionocyte". Nature. 560 (7718): 377–381. Bibcode:2018Natur.560..377P. doi:10.1038/s41586-018-0394-6. PMC 6108322. PMID 30069046.
- ^ "CF Study Finds New Cells Called Ionocytes Carrying High levels of CFTR Gene". Cystic Fibrosis News Today. 3 August 2018.
- ^ a b Walter F. Boron (2004). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. p. 605. ISBN 978-1-4160-2328-9.
- ^ a b Hoad-Robson, Rachel; Kenny, Tim. "The Lungs and Respiratory Tract". Patient.info. Patient UK. Archived from the original on 15 September 2015. Retrieved 11 February 2016.
- ^ Smyth, Hugh D.C. (2011). "Chapter 2". Controlled pulmonary drug delivery. New York: Springer. ISBN 978-1-4419-9744-9.
- ^ Mannell, Robert. "Introduction to Speech Production". Macquarie University. Retrieved 8 February 2016.
- ^ "An overlooked role for lungs in blood formation". 2017-04-03.
- ^ "The human proteome in lung – The Human Protein Atlas". www.proteinatlas.org. Retrieved 2017-09-25.
- ^ Uhlén, Mathias; Fagerberg, Linn; Hallström, Björn M.; Lindskog, Cecilia; Oksvold, Per; Mardinoglu, Adil; Sivertsson, Åsa; Kampf, Caroline; Sjöstedt, Evelina; Asplund, Anna; Olsson, IngMarie; Edlund, Karolina; Lundberg, Emma; Navani, Sanjay; Szigyarto, Cristina Al-Khalili; Odeberg, Jacob; Djureinovic, Dijana; Takanen, Jenny Ottosson; Hober, Sophia; Alm, Tove; Edqvist, Per-Henrik; Berling, Holger; Tegel, Hanna; Mulder, Jan; Rockberg, Johan; Nilsson, Peter; Schwenk, Jochen M.; Hamsten, Marica; Feilitzen, Kalle von; Forsberg, Mattias; Persson, Lukas; Johansson, Fredric; Zwahlen, Martin; Heijne, Gunnar von; Nielsen, Jens; Pontén, Fredrik (23 January 2015). "Tissue-based map of the human proteome". Science. 347 (6220): 1260419. CiteSeerX 10.1.1.665.2415. doi:10.1126/science.1260419. PMID 25613900. S2CID 802377.
- ^ Lindskog, Cecilia; Fagerberg, Linn; Hallström, Björn; Edlund, Karolina; Hellwig, Birte; Rahnenführer, Jörg; Kampf, Caroline; Uhlén, Mathias; Pontén, Fredrik; Micke, Patrick (28 August 2014). "The lung‐specific proteome defined by integration of transcriptomics and antibody‐based profiling". The FASEB Journal. 28 (12): 5184–5196. doi:10.1096/fj.14-254862. PMID 25169055.
- ^ American College of Physicians. "Pulmonology". ACP. Archived from the original on 9 September 2015. Retrieved 9 February 2016.
- ^ "The Surgical Specialties: 8 – Cardiothoracic Surgery". Royal College of Surgeons. Retrieved 9 February 2016.
- ^ "Aspergilloma". Medical Dictionary. TheFreeDictionary.
- ^ "Clinical Manifestation Hantavirus DHCPP CDC". www.cdc.gov. 21 February 2019. Retrieved 7 January 2023.
- ^ Arvers, P (December 2018). "[Alcohol consumption and lung damage: Dangerous relationships]". Revue des maladies respiratoires. 35 (10): 1039–1049. doi:10.1016/j.rmr.2018.02.009. PMID 29941207. S2CID 239523761.
- ^ Slovinsky, WS; Romero, F; Sales, D; Shaghaghi, H; Summer, R (November 2019). "The involvement of GM-CSF deficiencies in parallel pathways of pulmonary alveolar proteinosis and the alcoholic lung". Alcohol (Fayetteville, N.Y.). 80: 73–79. doi:10.1016/j.alcohol.2018.07.006. PMC 6592783. PMID 31229291.
- ^ Galli, Elena; Gianni, Simona; Auricchio, Giovanni; Brunetti, Ercole; Mancino, Giorgio; Rossi, Paolo (2007-09-01). "Atopic dermatitis and asthma". Allergy and Asthma Proceedings. 28 (5): 540–543. doi:10.2500/aap2007.28.3048. ISSN 1088-5412. PMID 18034972.
- ^ a b Crystal, RG (15 December 2014). "Airway basal cells. The "smoking gun" of chronic obstructive pulmonary disease". American Journal of Respiratory and Critical Care Medicine. 190 (12): 1355–62. doi:10.1164/rccm.201408-1492PP. PMC 4299651. PMID 25354273.
- ^ "Lung Cancer Screening". U.S. Preventative Services Task Force. 2013. Archived from the original on 2010-11-04. Retrieved 2016-07-10.
- ^ Cadichon, Sandra B. (2007), "Chapter 22: Pulmonary hypoplasia", in Kumar, Praveen; Burton, Barbara K. (eds.), Congenital malformations: evidence-based evaluation and management
- ^ Sieunarine, K.; May, J.; White, G.H.; Harris, J.P. (August 1997). "Anomalous azygos vein: a potential danger during endoscopic thoracic sypathectomy". ANZ Journal of Surgery. 67 (8): 578–579. doi:10.1111/j.1445-2197.1997.tb02046.x. PMID 9287933.
- ^ Bintcliffe, Oliver; Maskell, Nick (8 May 2014). "Spontaneous pneumothorax" (PDF). BMJ. 348: g2928. doi:10.1136/bmj.g2928. PMID 24812003. S2CID 32575512. Archived (PDF) from the original on 2022-10-09.
- ^ Weinberger, Steven; Cockrill, Barbara; Mandell, J (2019). Principles of Pulmonary Pathology. Elsevier. p. 30. ISBN 9780323523714.
- ^ "Lung examination". meded.ucsd.edu. Retrieved 31 August 2019.
- ^ Malik, N; Tedder, BL; Zemaitis, MR (January 2021). Anatomy, Thorax, Triangle of Auscultation. PMID 30969656.
- ^ a b c d Kim E., Barrett (2012). "Chapter 34. Introduction to Pulmonary Structure and Mechanics". Ganong's review of medical physiology (24th ed.). New York: McGraw-Hill Medical. ISBN 978-0-07-178003-2.
- ^ Criée, C.P.; Sorichter, S.; Smith, H.J.; Kardos, P.; Merget, R.; Heise, D.; Berdel, D.; Köhler, D.; Magnussen, H.; Marek, W.; Mitfessel, H.; Rasche, K.; Rolke, M.; Worth, H.; Jörres, R.A. (July 2011). "Body plethysmography – Its principles and clinical use". Respiratory Medicine. 105 (7): 959–971. doi:10.1016/j.rmed.2011.02.006. PMID 21356587.
- ^ a b Applegate, Edith (2014). The Anatomy and Physiology Learning System. Elsevier Health Sciences. p. 335. ISBN 978-0-323-29082-1.
- ^ Laeremans, M (2018). "Black Carbon Reduces the Beneficial Effect of Physical Activity on Lung Function". Medicine and Science in Sports and Exercise. 50 (9): 1875–1881. doi:10.1249/MSS.0000000000001632. hdl:10044/1/63478. PMID 29634643. S2CID 207183760.
- ^ a b c Ritchson, G. "BIO 554/754 – Ornithology: Avian respiration". Department of Biological Sciences, Eastern Kentucky University. Retrieved 2009-04-23.
- ^ a b Scott, Graham R. (2011). "Commentary: Elevated performance: the unique physiology of birds that fly at high altitudes". Journal of Experimental Biology. 214 (15): 2455–2462. doi:10.1242/jeb.052548. PMID 21753038.
- ^ a b c Maina, John N. (2005). The lung air sac system of birds development, structure, and function; with 6 tables. Berlin: Springer. pp. 3.2–3.3 "Lung", "Airway (Bronchiol) System" 66–82. ISBN 978-3-540-25595-6.
- ^ a b c d e f Romer, Alfred Sherwood; Parsons, Thomas S. (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. pp. 330–334. ISBN 978-0-03-910284-5.
- ^ "Unidirectional airflow in the lungs of birds, crocs…and now monitor lizards!?". Sauropod Vertebra picture of the week. 2013-12-11. Retrieved 9 February 2016.
- ^ Claessens, Leon P.A.M.; O'Connor, Patrick M.; Unwin, David M.; Sereno, Paul (18 February 2009). "Respiratory Evolution Facilitated the Origin of Pterosaur Flight and Aerial Gigantism". PLOS ONE. 4 (2): e4497. Bibcode:2009PLoSO...4.4497C. doi:10.1371/journal.pone.0004497. PMC 2637988. PMID 19223979.
- ^ Munns, SL; Owerkowicz, T; Andrewartha, SJ; Frappell, PB (1 March 2012). "The accessory role of the diaphragmaticus muscle in lung ventilation in the estuarine crocodile Crocodylus porosus". The Journal of Experimental Biology. 215 (Pt 5): 845–852. doi:10.1242/jeb.061952. PMID 22323207.
- ^ Janis, Christine M.; Keller, Julia C. (2001). "Modes of ventilation in early tetrapods: Costal aspiration as a key feature of amniotes". Acta Palaeontologica Polonica. 46 (2): 137–170.
- ^ Brainerd, E. L. (December 1999). "New perspectives on the evolution of lung ventilation mechanisms in vertebrates". Experimental Biology Online. 4 (2): 1–28. doi:10.1007/s00898-999-0002-1. S2CID 35368264.
- ^ Duellman, W.E.; Trueb, L. (1994). Biology of amphibians. illustrated by L. Trueb. Johns Hopkins University Press. ISBN 978-0-8018-4780-6.
- ^ Bickford, David (April 15, 2008). "First Lungless Frog Discovered in Indonesia". Scientific American.
- ^ Wilkinson, M.; Sebben, A.; Schwartz, E.N.F.; Schwartz, C.A. (April 1998). "The largest lungless tetrapod: report on a second specimen of (Amphibia: Gymnophiona: Typhlonectidae) from Brazil". Journal of Natural History. 32 (4): 617–627. doi:10.1080/00222939800770321.
- ^ 실러캔스의 흔적폐와 척추동물 간의 폐 다양성을 이해하기 위한 시사점: 새로운 관점과 열린 질문
- ^ 어류생리학 백과사전: 게놈에서 환경으로
- ^ 나일강 폐부의 신경전달물질 위치와 신경전달물질 위치에 관한 연구
- ^ "book lung anatomy". Encyclopædia Britannica. Retrieved 2016-02-24.
- ^ "spiracle anatomy". Encyclopædia Britannica. Retrieved 2016-02-24.
- ^ Farrelly CA, Greenaway P (2005). "The morphology and vasculature of the respiratory organs of terrestrial hermit crabs (Coenobita and Birgus): gills, branchiostegal lungs and abdominal lungs". Arthropod Structure & Development. 34 (1): 63–87. doi:10.1016/j.asd.2004.11.002.
- ^ Burggren, Warren W.; McMahon, Brian R. (1988). Biology of the Land Crabs. Cambridge University Press. p. 25. ISBN 978-0-521-30690-4.
- ^ Burggren, Warren W.; McMahon, Brian R. (1988). Biology of the Land Crabs. Cambridge University Press. p. 331. ISBN 978-0-521-30690-4.
- ^ 육지 달팽이( & 기타 풀모나타 아류 & 소르베콘차 클레이드의 공기 호흡기). 워싱턴 주립대 트라이시티 자연사 박물관에서. 2016년 2월 25일 접속. http://shells.tricity.wsu.edu/ArcherdShellCollection/Gastropoda/Pulmonates.html Wayback Machine에서 아카이브된 2018-11-09
- ^ Hochachka, Peter W. (2014). Mollusca: Metabolic Biochemistry and Molecular Biomechanics. Academic Press. ISBN 978-1-4832-7603-8.
- ^ a b Colleen Farmer (1997). "Did lungs and the intracardiac shunt evolve to oxygenate the heart in vertebrates" (PDF). Paleobiology. 23 (3): 358–372. Bibcode:1997Pbio...23..358F. doi:10.1017/S0094837300019734. S2CID 87285937. Archived from the original (PDF) on 2010-06-11.
- ^ Longo, Sarah; Riccio, Mark; McCune, Amy R (June 2013). "Homology of lungs and gas bladders: Insights from arterial vasculature". Journal of Morphology. 274 (6): 687–703. doi:10.1002/jmor.20128. PMID 23378277. S2CID 29995935.