엘라스틴
Elastin| 엘라스틴 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 별칭 | 트로포엘라스티넬라스틴ELN | ||||||
| 외부 ID | 진카드: [1] | ||||||
| 직교체 | |||||||
| 종 | 인간 | 마우스 | |||||
| 엔트레스 |
|
| |||||
| 앙상블 |
|
| |||||
| 유니프로트 |
| ||||||
| RefSeq(mRNA) |
|
| |||||
| RefSeq(단백질) |
|
| |||||
| 위치(UCSC) | n/a | n/a | |||||
| PubMed 검색 | n/a | n/a | |||||
| 위키다타 | |||||||
| |||||||
엘라스틴은 세포외 기질의 핵심 단백질이다.[1] 신축성이 뛰어나며 결합조직에 있어 체내의 많은 조직들이 스트레칭이나 수축 후 형태를 재개할 수 있다. 엘라스틴은 찌르거나 꼬집었을 때 피부가 원래 위치로 돌아가도록 돕는다. 엘라스틴은 척추동물의 체내에서 중요한 하중을 견디는 조직으로 기계적 에너지가 필요한 곳에 사용된다. 인간에서 엘라스틴은 ELN 유전자에 의해 암호화된다.[2]
함수
ELN 유전자는 탄성섬유의 두 성분 중 하나인 단백질을 암호화한다. 인코딩된 단백질에는 글리신, 프롤라인 등 소수성 아미노산이 풍부해 리신 잔류물 사이에 교차연계가 있는 이동 소수성 영역을 형성한다.[3] 이 유전자에 대해 서로 다른 ISO 양식을 인코딩하는 다중 대본 변형이 발견되었다.[3] 엘라스틴의 수용성 전구체는 트로포엘라스틴이다.[4] 무질서의 특성화는 탄성 반동의 엔트로피 주도 메커니즘과 일치한다. 순응장애는 엘라스틴 구조와 기능의 구성적 특징이라고 결론지었다.[5]
임상적 유의성
이 유전자의 삭제와 돌연변이는 과발상 대동맥협착증(SVAS)과 자가 우성인 커티스 락사와 관련이 있다.[3] 엘라스틴에 관련된 다른 결함으로는 마르판 증후군, α-안티트립신1 결핍에 의한 폐기종, 아테롬화, 부스케-올렌도르프 증후군, 멘크스 증후군, 가독산토마 탄력증, 윌리엄스 증후군 등이 있다.[6]
탄성증
엘라스틴 증상은 조직에서 엘라스틴이 축적되는 것으로, 와우 퇴행성 질환의 일종이다.[7] 원인은 다양하지만, 가장 흔한 원인은 피부의 액티닉 엘라스토시스(actinic elastosis)라고도 하며, 이는 광학이라고 알려진 공정인 태양 노출의 장기화와 과다로 인해 발생한다. 피부 탄력증의 흔치 않은 원인으로는 용탄성 천공, 석회성 천공, 선형 초점 탄력증 등이 있다.[7]
| 조건 | 특색 있는 기능 | 조직병리학 |
|---|---|---|
| 액티닉 엘라스토시스 (가장 흔한, 태양열 용융증이라고도 함) | 유두 진피와 망상 진피의 콜라겐 섬유 대체 엘라스틴 |  |
| 탄수화 천공 세르피기노사 | 퇴화된 탄성 섬유 및 트랜스피더 천공 운하(이미지 지점 중 하나에서 화살표)[8] | 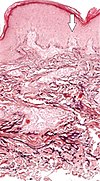 |
| 천공 석회증 | 진피에 있는 짧은 탄성섬유의 뭉침.[8] |  |
| 선형초점탄성증 | 파편화된 탄성 물질은 유두 진피 내에 축적되고 탄성 섬유는 경피적으로 제거된다.[8] |  |
구성
체내에서 엘라스틴은 보통 결합조직의 다른 단백질과 연관된다. 체내의 탄성섬유는 아모르퍼스 엘라스틴과 섬유질 섬유질의 혼합물이다. 두 성분 모두 글리신, 발레린, 알라닌, 프롤라인과 같은 작은 아미노산으로 주로 만들어진다.[6][9] 총 엘라스틴은 정상 개간동맥에서 건조된 탈색동맥의 무게의 58~75%에 이른다.[10] 신선조직과 소화조직의 비교를 보면 35% 변형률에서 동맥하중의 최소 48%가 엘라스틴에 의해 운반되며, 동맥조직의 경직성 변화의 최소 43%는 엘라스틴 강성의 변화에 기인한다.[11]
조직 분포
엘라스틴은 혈류량을 돕는 압력파 전파 매개체로 동맥에서 중요한 기능을 하며 특히 대동맥과 같은 큰 탄력혈관에 풍부하다. 엘라스틴은 또한 폐, 탄력인대, 탄력연골, 피부, 방광에서도 매우 중요하다. 그것은 턱이 없는 물고기 위에 있는 모든 척추동물들에게 존재한다.[12]
특성.
엘라스틴은 인간에게 78년 이상의 반감기를 가진 매우 장수 단백질이다.[13]
임상연구
엘라스틴 섬유 생산을 가능하게 하기 위해 인간 트로포아스틴 재조합을 사용하여 상처와 흉터에서의 피부 유연성을 개선할 수 있는 타당성이 연구되었다.[14][15] 재조합 인간 트로포아스틴을 피하 주사하여 신선한 상처에 주입한 후 흉터나 최종 흉터의 유연성은 개선되지 않은 것으로 밝혀졌다.[14][15]
생합성
트로포엘라스틴 전구체
엘라스틴은 많은 작은 수용성 전구체 트로포엘라스틴 단백질 분자(50~70kDa)를 서로 연결하여 최종적으로는 불용성, 내구성 복합체를 만든다. 연결되지 않은 트로포엘라스틴 분자는 세포에 의해 합성된 직후, 세포외 매트릭스로 내보낸 후 엘라스틴 섬유로 교차 연결되기 때문에 세포에서는 일반적으로 사용할 수 없다.[16]
각 트로포엘라스틴은 36개의 작은 도메인으로 구성되어 있으며, 각각 랜덤 코일 순응에서 약 2 kDa의 무게가 나간다. 단백질은 서로 교차하는 소수성 영역과 소수성 영역으로 구성되는데, 이 영역은 별도의 엑손에 의해 인코딩되므로 트로포엘라스틴의 도메인 구조가 유전자의 엑손 조직을 반영한다. 친수성 영역에는 성숙한 엘라스틴이 형성되는 동안 교차 연계에 관여하는 라이스-알라(KA)와 라이스-프로(KP) 모티브가 포함되어 있다. KA 도메인에서 리신 잔여물은 2개 또는 3개의 알라닌 잔류물(예: AAAKAA)으로 분리된 쌍이나 삼중으로 발생하는 반면 KP 도메인에서 리신 잔류물은 주로 프롤라인 잔류물(예: KPLKP)으로 분리된다.
집계
트로포엘라스틴은 공동 보존이라고 불리는 과정에서 소수성 영역 사이의 상호작용 때문에 생리학적 온도로 집적된다. 이 과정은 되돌릴 수 있고 열역학적으로 제어되며 단백질의 갈라짐이 필요하지 않다. 코아세베이트는 돌이킬 수 없는 상호연결에 의해 풀리지 않게 된다.
크로스링크링
성숙한 엘라스틴 섬유를 만들기 위해 트로포엘라스틴 분자는 그들의 리신 잔여물을 통해 데스모신과 이소드모신 교차연결 분자와 교차연결을 한다. 교차연결을 수행하는 효소는 생체내 치치바빈 피리딘 합성반응을 이용한 리실 산화효소다.[17]
분자생물학
포유류에서, 게놈은 ELN이라고 불리는 트로포엘라스틴을 위한 하나의 유전자만을 포함하고 있다. 인간 ELN 유전자는 7번 염색체에서 45kb의 분절이며, 거의 700개의 인트로에 의해 34개의 엑손들이 방해를 받았으며, 첫 번째 엑손은 세포외 국소화를 할당하는 신호 펩타이드였다. 인트론의 수가 많은 것은 유전자의 재조합이 유전자의 불안정성에 기여하여 SVAS와 같은 질병으로 이어질 수 있음을 시사한다. 트로포엘라스틴 mRNA의 표현은 적어도 8개의 서로 다른 전사 시작 사이트에서 매우 규제된다.
엘라스틴의 조직별 변형은 트로포엘라스틴 유전자의 대체적 스플라이싱에 의해 생성된다. 적어도 11개의 알려진 인간 트로포엘라스틴 이소성형이 있다. 이러한 등소 형태는 개발 규제 하에 있지만 동일한 개발 단계에서 조직들 간에 최소한의 차이가 있다.[6]
참고 항목
참조
- ^ Mithieux, SM; Weiss, AS (2005). "Elastin". Advances in Protein Chemistry. 70: 437–61. doi:10.1016/S0065-3233(05)70013-9. ISBN 9780120342709. PMID 15837523.
- ^ Curran, Mark E.; Atkinson, Donald L.; Ewart, Amanda K.; Morris, Colleen A.; Leppert, Mark F.; Keating, Mark T. (9 April 1993). "The elastin gene is disrupted by a translocation associated with supravalvular aortic stenosis". Cell. 73 (1): 159–168. doi:10.1016/0092-8674(93)90168-P. PMID 8096434. S2CID 8274849.
- ^ a b c "Entrez Gene: elastin".
- ^ "Elastin (ELN)". Retrieved 31 October 2011.
- ^ Muiznieks LD, Weiss AS, Keeley FW (Apr 2010). "Structural disorder and dynamics of elastin". Biochemistry and Cell Biology. 88 (2): 239–50. doi:10.1139/o09-161. PMID 20453927.
- ^ a b c Vrhovski, Bernadette; Weiss, Anthony S. (15 November 1998). "Biochemistry of tropoelastin". European Journal of Biochemistry. 258 (1): 1–18. doi:10.1046/j.1432-1327.1998.2580001.x. PMID 9851686.
- ^ a b Beth Wright. "Elastosis". DermNet NZ.
- ^ a b c Hosen, Mohammad J.; Lamoen, Anouck; De Paepe, Anne; Vanakker, Olivier M. (2012). "Histopathology of Pseudoxanthoma Elasticum and Related Disorders: Histological Hallmarks and Diagnostic Clues". Scientifica. 2012: 1–15. doi:10.6064/2012/598262. ISSN 2090-908X. PMC 3820553. PMID 24278718.
-Creative Commons Attribution 3.0 Unported 라이센스 - ^ Kielty CM, Sherratt MJ, Shuttleworth CA (Jul 2002). "Elastic fibres". Journal of Cell Science. 115 (Pt 14): 2817–28. doi:10.1242/jcs.115.14.2817. PMID 12082143.
- ^ Fischer GM, Llaurado JG (Aug 1966). "Collagen and elastin content in canine arteries selected from functionally different vascular beds". Circulation Research. 19 (2): 394–399. doi:10.1161/01.res.19.2.394. PMID 5914851.
- ^ Lammers SR, Kao PH, Qi HJ, Hunter K, Lanning C, Albietz J, Hofmeister S, Mecham R, Stenmark KR, Shandas R (Oct 2008). "Changes in the structure-function relationship of elastin and its impact on the proximal pulmonary arterial mechanics of hypertensive calves". American Journal of Physiology. Heart and Circulatory Physiology. 295 (4): H1451–9. doi:10.1152/ajpheart.00127.2008. PMC 2593497. PMID 18660454.
- ^ Sage EH, Gray WR (1977). "Evolution of elastin structure". Elastin and Elastic Tissue. Advances in Experimental Medicine and Biology. Vol. 79. pp. 291–312. doi:10.1007/978-1-4684-9093-0_27. ISBN 978-1-4684-9095-4. PMID 868643.
- ^ Toyama, Brandon H.; Hetzer, Martin W. (January 2013). "Protein homeostasis: live long, won't prosper". Nature Reviews. Molecular Cell Biology. 14 (1): 55–61. doi:10.1038/nrm3496. ISSN 1471-0072. PMC 3570024. PMID 23258296.
- ^ a b Souto, Maria C. (9 January 2020). "New Nanotechnologies for the Treatment and Repair of Skin Burns Infections". International Journal of Molecular Sciences. 21 (2): 393. doi:10.3390/ijms21020393. PMC 7013843. PMID 31936277.
- ^ a b Xie, Hua (1 September 2017). "Treatment of Burn and Surgical Wounds With Recombinant Human Tropoelastin Produces New Elastin Fibers in Scars". Journal of Burn Care & Research. 38 (5): e859–e867. doi:10.1097/BCR.0000000000000507. PMID 28221299. S2CID 39251937. Retrieved 20 August 2020.
- ^ Valenzuela, Cristian D.; Wagner, Willi L.; Bennett, Robert D.; Ysasi, Alexandra B.; Belle, Janeil M.; Molter, Karen; Straub, Beate K.; Dong, Wang; Chen, Zi; Ackermann, Maximilian; Tsuda, Akira; Mentzer, Steven J. (April 2017). "Extracellular Assembly of the Elastin Cable Line Element in the Developing Lung". The Anatomical Record. 300 (9): 1670–1679. doi:10.1002/ar.23603. PMC 6315300. PMID 28380679.
- ^ Umeda H, Takeuchi M, Suyama K (Apr 2001). "Two new elastin cross-links having pyridine skeleton. Implication of ammonia in elastin cross-linking in vivo". The Journal of Biological Chemistry. 276 (16): 12579–12587. doi:10.1074/jbc.M009744200. PMID 11278561.
추가 읽기
- Jan SL, Chan SC, Fu YC, Lin SJ (Jun 2009). "Elastin gene study of infants with isolated congenital ductus arteriosus aneurysm". Acta Cardiologica. 64 (3): 363–9. doi:10.2143/ac.64.3.2038023. PMID 19593948. S2CID 31411296.
- Keeley FW, Bellingham CM, Woodhouse KA (Feb 2002). "Elastin as a self-organizing biomaterial: use of recombinantly expressed human elastin polypeptides as a model for investigations of structure and self-assembly of elastin". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 357 (1418): 185–9. doi:10.1098/rstb.2001.1027. PMC 1692930. PMID 11911775.
- Choudhury R, McGovern A, Ridley C, Cain SA, Baldwin A, Wang MC, Guo C, Mironov A, Drymoussi Z, Trump D, Shuttleworth A, Baldock C, Kielty CM (Sep 2009). "Differential regulation of elastic fiber formation by fibulin-4 and -5". The Journal of Biological Chemistry. 284 (36): 24553–67. doi:10.1074/jbc.M109.019364. PMC 2782046. PMID 19570982.
- Hubmacher D, Cirulis JT, Miao M, Keeley FW, Reinhardt DP (Jan 2010). "Functional consequences of homocysteinylation of the elastic fiber proteins fibrillin-1 and tropoelastin". The Journal of Biological Chemistry. 285 (2): 1188–98. doi:10.1074/jbc.M109.021246. PMC 2801247. PMID 19889633.
- Coolen NA, Schouten KC, Middelkoop E, Ulrich MM (Jan 2010). "Comparison between human fetal and adult skin". Archives of Dermatological Research. 302 (1): 47–55. doi:10.1007/s00403-009-0989-8. PMC 2799629. PMID 19701759.
- McGeachie M, Ramoni RL, Mychaleckyj JC, Furie KL, Dreyfuss JM, Liu Y, Herrington D, Guo X, Lima JA, Post W, Rotter JI, Rich S, Sale M, Ramoni MF (Dec 2009). "Integrative predictive model of coronary artery calcification in atherosclerosis". Circulation. 120 (24): 2448–54. doi:10.1161/CIRCULATIONAHA.109.865501. PMC 2810344. PMID 19948975.
- Yoshida T, Kato K, Yokoi K, Oguri M, Watanabe S, Metoki N, Yoshida H, Satoh K, Aoyagi Y, Nishigaki Y, Nozawa Y, Yamada Y (Aug 2009). "Association of genetic variants with chronic kidney disease in individuals with different lipid profiles". International Journal of Molecular Medicine. 24 (2): 233–46. doi:10.3892/ijmm_00000226. PMID 19578796.
- Akima T, Nakanishi K, Suzuki K, Katayama M, Ohsuzu F, Kawai T (Nov 2009). "Soluble elastin decreases in the progress of atheroma formation in human aorta". Circulation Journal. 73 (11): 2154–62. doi:10.1253/circj.cj-09-0104. PMID 19755752.
- Chen Q, Zhang T, Roshetsky JF, Ouyang Z, Essers J, Fan C, Wang Q, Hinek A, Plow EF, Dicorleto PE (Oct 2009). "Fibulin-4 regulates expression of the tropoelastin gene and consequent elastic-fibre formation by human fibroblasts". The Biochemical Journal. 423 (1): 79–89. doi:10.1042/BJ20090993. PMC 3024593. PMID 19627254.
- Tintar D, Samouillan V, Dandurand J, Lacabanne C, Pepe A, Bochicchio B, Tamburro AM (Nov 2009). "Human tropoelastin sequence: dynamics of polypeptide coded by exon 6 in solution" (PDF). Biopolymers. 91 (11): 943–52. doi:10.1002/bip.21282. PMID 19603496.
- Dyksterhuis LB, Weiss AS (Jun 2010). "Homology models for domains 21-23 of human tropoelastin shed light on lysine crosslinking". Biochemical and Biophysical Research Communications. 396 (4): 870–3. doi:10.1016/j.bbrc.2010.05.013. PMID 20457133.
- Romero R, Velez Edwards DR, Kusanovic JP, Hassan SS, Mazaki-Tovi S, Vaisbuch E, Kim CJ, Chaiworapongsa T, Pearce BD, Friel LA, Bartlett J, Anant MK, Salisbury BA, Vovis GF, Lee MS, Gomez R, Behnke E, Oyarzun E, Tromp G, Williams SM, Menon R (May 2010). "Identification of fetal and maternal single nucleotide polymorphisms in candidate genes that predispose to spontaneous preterm labor with intact membranes". American Journal of Obstetrics and Gynecology. 202 (5): 431.e1–34. doi:10.1016/j.ajog.2010.03.026. PMC 3604889. PMID 20452482.
- Fan BJ, Figuieredo Sena DR, Pasquale LR, Grosskreutz CL, Rhee DJ, Chen TC, Delbono EA, Haines JL, Wiggs JL (Sep 2010). "Lack of association of polymorphisms in elastin with pseudoexfoliation syndrome and glaucoma". Journal of Glaucoma. 19 (7): 432–436. doi:10.1097/IJG.0b013e3181c4b0fe. PMC 6748032. PMID 20051886.
- Bertram C, Hass R (Oct 2009). "Cellular senescence of human mammary epithelial cells (HMEC) is associated with an altered MMP-7/HB-EGF signaling and increased formation of elastin-like structures". Mechanisms of Ageing and Development. 130 (10): 657–69. doi:10.1016/j.mad.2009.08.001. PMID 19682489. S2CID 46477586.
- Roberts KE, Kawut SM, Krowka MJ, Brown RS, Trotter JF, Shah V, Peter I, Tighiouart H, Mitra N, Handorf E, Knowles JA, Zacks S, Fallon MB (Jul 2010). "Genetic risk factors for hepatopulmonary syndrome in patients with advanced liver disease". Gastroenterology. 139 (1): 130–9.e24. doi:10.1053/j.gastro.2010.03.044. PMC 2908261. PMID 20346360.
- Rosenbloom J (Dec 1984). "Elastin: relation of protein and gene structure to disease". Laboratory Investigation. 51 (6): 605–23. PMID 6150137.
- Bax DV, Rodgers UR, Bilek MM, Weiss AS (Oct 2009). "Cell adhesion to tropoelastin is mediated via the C-terminal GRKRK motif and integrin alphaVbeta3". The Journal of Biological Chemistry. 284 (42): 28616–23. doi:10.1074/jbc.M109.017525. PMC 2781405. PMID 19617625.
- Rodriguez-Revenga L, Iranzo P, Badenas C, Puig S, Carrió A, Milà M (Sep 2004). "A novel elastin gene mutation resulting in an autosomal dominant form of cutis laxa". Archives of Dermatology. 140 (9): 1135–9. doi:10.1001/archderm.140.9.1135. PMID 15381555.
- Micale L, Turturo MG, Fusco C, Augello B, Jurado LA, Izzi C, Digilio MC, Milani D, Lapi E, Zelante L, Merla G (Mar 2010). "Identification and characterization of seven novel mutations of elastin gene in a cohort of patients affected by supravalvular aortic stenosis". European Journal of Human Genetics. 18 (3): 317–23. doi:10.1038/ejhg.2009.181. PMC 2987220. PMID 19844261.
- Tzaphlidou M (2004). "The role of collagen and elastin in aged skin: an image processing approach". Micron. 35 (3): 173–7. doi:10.1016/j.micron.2003.11.003. PMID 15036271.
외부 링크
- 미국 국립 의학 도서관의 엘라스틴 제목(MesH)
- 역사학 이미지: 21402loa – 보스턴 대학교 역사학 학습 시스템
- Williams 또는 Williams-Beuren Syndrome에 대한 GeneReviews/NIH/NCBI/UW 입력
- 엘라스틴 단백질
- 마이크로파이브릴
이 기사는 공공영역에 있는 미국 국립 의학 도서관의 텍스트를 통합하고 있다.




