만성폐쇄성폐질환
Chronic obstructive pulmonary disease| 만성폐쇄성폐질환 | |
|---|---|
| 기타 이름 | 만성폐쇄성폐질환(COLD), 만성폐쇄 기도질환(COAD) |
 | |
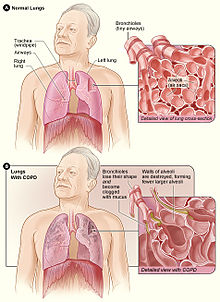
| 중심성 폐기종을 보이는 폐의 부분으로서, 대개 흡연에 의해 야기되는 로불 중심에 확대된 공기공간과 COPD의 주요 특징 | |
| 전문 | 풀몬학 |
| 증상 | 호흡곤란, 만성 기침[1] |
| 합병증 | 불안, 우울증, 폐심장질환, 기흉[2][1] |
| 평상시 시작 | 35세[1] 이상 |
| 기간 | 장기[1] |
| 원인들 | 흡연, 대기오염, 유전학[3] |
| 진단법 | 스피로메트리[4] |
| 차등진단 | 천식, 울혈성 심부전, 기관지확장, 결핵, 말기 기관지염, 확산판브론치올염[5] |
| 예방 | 금연, 실내외 대기질 개선, 담배 규제 방안[3][6] |
| 치료 | 폐 재활, 장기 산소 치료, 폐 용적 감소[6] |
| 약물 | 흡입 기관지 소독기 및 스테로이드제[6] |
| 빈도 | 1억 7,450만 (2015년)[7] |
| 죽음 | 320만(2019년)[3] |
만성폐쇄성폐질환(COPD)은 예방이 가능하고 치료가 가능한 진행성폐질환의 일종이다. COPD는 장기 호흡기 증상과 기류 제한이 특징이다.[8] 주요 증상으로는 호흡곤란과 점액이 나오거나 나오지 않을 수 있는 기침 등이 있다.[4] COPD는 걷기나 드레싱 등 일상 활동이 어려워지면서 점차 악화된다.[3]
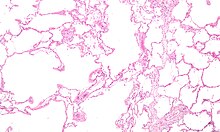
COPD의 가장 흔한 두 가지 질환은 폐기종과 만성 기관지염이며, 이들은 전통적인 COPD 표현형이다.[9] 폐기종은 벽이 파괴되어 폐 조직에 영구적인 손상을 입히는 확장된 공기공간(alveoli)으로 정의된다. 만성 기관지염은 2년 동안 매년 최소 3개월 이상 지속되는 생산적인 기침으로 정의된다. 이 두 조건 모두 COPD로 분류되지 않은 경우 공기 흐름 제한 없이 존재할 수 있다. 폐기종은 기류를 제한할 수 있는 구조적 이상 중 하나일 뿐 상당한 수의 사람에게 기류 제한 없이 존재할 수 있다.[10][11] 만성 기관지염은 항상 공기 흐름의 제한을 초래하지는 않지만 COPD 발병 위험을 피우는 젊은이들의 경우는 높다.[12] 과거 COPD의 많은 정의에는 폐기종, 만성기관지염 등이 포함되었지만, 이러한 정의는 GOLD 보고서 정의에 포함되지 않았다.[8] 폐기종과 만성 기관지염은 COPD의 지배적인 표현형으로 남아있지만 그것들 사이에 종종 겹치는 경우가 있으며, 다른 표현형들도 많이 설명되어 왔다.[9][13]
COPD의 가장 흔한 원인은 흡연이다. 기타 위험요인으로는 실내외 오염, 곡물에서 나오는 먼지와 같은 직업상 자극성 물질에 대한 노출, 카드뮴 먼지나 연기, 유전학 등이 있다.[12][14] 개발도상국에서 실내 공기오염의 공통원인은 석탄의 사용이며, 요리와 난방을 위한 연료로 나무나 마른똥과 같은 바이오매스다.[15][12] 유럽 도시에 사는 대부분의 사람들은 해로운 수준의 대기 오염에 노출되어 있다.[16] 이 진단은 경동맥 측정에 의해 측정된 기류 불량에 기초한다.[4]
대부분의 COPD 사례는 흡연과 실내외 오염물질 등 위험요인에 대한 노출을 줄임으로써 막을 수 있다.[17] 치료는 악화되는 속도를 늦출 수 있지만, 어떤 약이든 장기적인 폐 기능 저하를 변화시킬 수 있다는 결정적인 증거는 없다.[6] COPD 치료에는 금연, 예방접종, 폐재활, 흡입기관지질기, 코르티코스테로이드 등이 포함된다.[6] 어떤 사람들은 장기 산소 치료, 폐 용적 감소, 폐 이식 등의 혜택을 볼 수 있다.[18] 급성악화기, 약물 사용 증가, 항생제, 코르티코스테로이드, 입원 등이 필요할 수 있다.[19]
2015년 기준 COPD는 약 1억7,750만 명(전 세계 인구의 2.4%)의 영향을 받았다.[7] 그것은 일반적으로 35-40세 이상의 남성과 여성에게서 발생한다.[1][3] 2019년 320만 명의 사망자를 냈는데, 이는 1990년 240만 명의 사망자에서 80%나 증가한 것이다.[3][20][21] 위험요인에 대한 지속적인 노출과 인구 고령화로 사망자는 더 늘어날 것으로 예상된다.[8] 2010년 미국의 경제 비용은 321억 달러(약 3조2000억 원)로 책정됐으며 2020년에는 490억 달러(약 490억 원)까지 오를 것으로 전망된다.[22] 영국에서는 이 비용이 연간 38억 파운드로 추산된다.[23]
징후 및 증상
호흡곤란
COPD의 주요 증상은 만성적이고 점진적인 호흡곤란으로 이 질환의 가장 큰 특징이다. 호흡곤란(호흡곤란)은 종종 관련 불안과 경험하는 장애의 수준을 책임지는 가장 고통스러운 증상이다.[4] 헐떡이는 증상, 그리고 숨가쁜 것과 관련된 가슴 조이는 증상은 하루 또는 며칠 사이에 변동될 수 있으며, 항상 존재하는 것은 아니다. 가슴의 팽팽함은 종종 노력 뒤에 온다.[4] COPD가 더 발달한 많은 사람들은 호흡곤란을 개선할 수 있는 청순 입술을 통해 숨을 쉰다.[24] 호흡곤란이 신체활동 감소의 원인이 되는 경우가 많고, 신체활동량이 적은 것은 더 나쁜 결과와 관련이 있다.[25][26] 심하고 매우 심한 경우에는 지속적인 피로감, 체중감량, 근육감소, 거식증이 있을 수 있다. COPD를 앓고 있는 사람들은 치료를 받기 전에 종종 호흡곤란과 잦은 감기가 증가했다.[4]
기침
COPD의 첫 번째 증상은 만성 기침으로 가래로서 점액이 생산될 수도 있고 그렇지 않을 수도 있다. 가래는 가래가 간헐적으로 나올 수 있고, 사회적 또는 문화적 요인에 따라 삼켜지거나 뱉어질 수 있으며, 따라서 평가하기가 항상 쉬운 것은 아니다. 그러나 동반되는 생산적인 기침은 30%의 사례에서만 볼 수 있다. 때때로 기침이 없을 때 기류가 제한될 수 있다.[4] 증상은 보통 아침에 더 심하다.[27]
만성적인 생산적인 기침은 점액 과다 분비 결과인데, 매년 3개월 이상 지속되면 만성 기관지염으로 정의된다.[12] 만성 기관지염은 COPD의 제한된 기류 진단 이전에 발생할 수 있다.[8] COPD에 걸린 일부 사람들은 이러한 증상을 흡연으로 인한 결과 때문이라고 한다. 심한 COPD에서 심한 기침은 늑골 골절이나 잠깐의 의식 상실로 이어질 수 있다.[4]
악화
급성 악화는 며칠 동안 지속되는 징후와 증상이 갑자기 악화되는 것이다. 주요 증상은 호흡곤란이 증가하며, 다른 증상은 과도한 점액, 기침 증가, 헉헉거림이다. 흔히 볼 수 있는 표지판은 에어 트랩이다.[28] 일반적으로 악화되는 원인은 바이러스성 감염이며, 가장 흔히 발생하는 감기다.[12] 일반적인 감기는 보통 겨울 달과 관련이 있지만 언제든지 발생할 수 있다.[29] 다른 호흡기 감염은 박테리아일 수도 있고 때로는 바이러스 감염에 보조적일 수도 있다.[30] 가장 흔한 박테리아 감염은 해모필루스 인플루언스에 의해 발생한다.[31] 다른 위험으로는 실내 및 실외에서 담배 연기(능동적 및 수동적)와 환경 오염 물질에 대한 노출이 있다.[32] COVID-19 대유행 기간 동안 COPD의 병원 입원은 급격히 감소했으며 이는 배출량 감소와 깨끗한 공기 때문일 수 있다.[33] 이 기간 동안 감기·독감 감염 건수도 눈에 띄게 줄었다.[34]
산불로 인한 연기는 세계 많은 지역에서 증가하는 위험을 증명하고 있으며, 정부 기관들은 그들의 웹사이트에 보호 조언을 게재했다. 미국에서 EPA는 방진마스크를 사용하면 산불의 미세입자로부터 보호받을 수 없으며 대신 잘 맞는 입자마스크를 사용할 것을 권고한다.[35] 캐나다에서도 산불의 영향에 대해 이와 같은 충고가 제공되고 있다.[36] 호주에서 발생한 산불은 COPD에 대한 높은 위험 요소와 농부들에게 악화되고 있다.[37]
악화의 수는 질병의 어떤 단계와도 관련이 없는 것으로 보인다; 일년에 2개 이상 있는 사람들은 빈번한 악화의 원인으로 분류되며, 이는 질병 진행의 악화로 이어진다.[28]
COPD의 급성 악화는 종종 설명되지 않으며, 한 연구는 이러한 경우에 때때로 책임이 있는 폐색전증의 가능성을 강조한다. 증상으로는 흉부 통증, 감염 징후가 없는 심부전이 있을 수 있다. 그러한 색전체는 항응고제에 반응할 수 있다.[38]
기타조건
COPD는 종종 공유 위험 요인에 기인하는 여러 가지 다른 조건(부여)과 함께 발생한다. 공통적으로 나타나는 합병증은 심혈관 질환, 골격근 기능장애, 대사증후군, 골다공증, 우울증, 불안감, 폐암 등이다.[39] 대사증후군은 COPD에 걸린 사람의 최대 50%까지 영향을 미치는 것으로 보여지고 있으며, 결과에 상당한 영향을 미친다. COPD와 공동 엑스를 하는지, 병리학의 결과로 발전하는지 알 수 없다. 대사증후군은 그 자체로 질병률과 사망률이 높으며, COPD와 합병할 때 이 비율이 증폭된다. COPD에 걸린 대부분의 사람들은 호흡기 질환이 아닌 동반성 질환으로 사망한다.[40]
불안과 우울증은 종종 COPD의 합병증이다.[2][1] 다른 합병증으로는 삶의 질 저하와 장애 증가, 코르 풀모날, 폐렴을 포함한 빈번한 흉부 감염, 2차 다혈성 질환, 호흡기 장애, 기흉, 폐암, 그리고 캐시샤(근육 낭비) 등이 있다.[1][2][41]
인지장애는 기류에 영향을 미치는 다른 폐 질환에 대한 것과 마찬가지로 COPD에 걸린 사람들에게 흔하다. 인지장애는 일상 생활의 기본적인 활동에 대처하는 능력이 저하되는 것과 관련이 있다.[42]
COPD에 감염된 사람들은 입원 위험과 심각한 COVID-19에 걸릴 위험이 있지만 COVD에 감염된 사람들이 COVID-19에 걸릴 위험이 더 큰지는 불분명하다. COVID-19 증상을 악화로부터 구별하는 것은 어렵다; 가벼운 프로드롬 증상들이 그것의 인식을 지연시킬 수 있고, COVID-19의 미각이나 냄새의 상실을 포함하는 것이 의심되어야 한다.[33]
정의
과거 COPD의 많은 정의는 만성 기관지염과 폐기종을 포함했지만 GOLD 보고서 정의에는 포함되지 않았다.[8] 폐기종은 벽이 허물어져 폐조직이 영구적으로 손상되는 확장공기(alveoli)로 정의되며, 기류를 제한할 수 있는 구조적 이상 중 하나에 불과하다. 그 조건은 공기 흐름의 제한 없이 존재할 수 있지만 일반적으로 존재한다.[10] 만성 기관지염은 매년 최소 3개월 이상 2년간 지속되는 생산적인 기침으로 정의되지만 COPD 발생 위험이 크지만 항상 기류에 제한을 주지는 않는다.[12] 이러한 오래된 정의는 두 유형을 유형 A와 유형 B로 분류했다. A형은 분홍색 안색과 빠른 호흡수, 청순 입술 때문에 분홍색 복어로 알려진 폐기종이었다. B형은 산소 농도가 낮아 피부와 입술에 푸르스름한 빛깔을 유발하고 발목이 부어올라 청색 팽창제로 일컬어지는 만성 기관지염이었다.[43] 이러한 차이는 폐기종에서 뚜렷하게 나타나고 만성 기관지염의 결핍으로 인한 부수적 인공호흡의 유무에 기인한다고 제안되었다.[44] COPD를 가진 대부분의 사람들은 폐기종과 기도 질환의 결합을 가지고 있기 때문에 이 용어는 더 이상 유용한 것으로 받아들여지지 않았다.[43] 이것들은 현재 COPD의 두 가지 주요 표현형인 폐기종 표현형과 만성 기관지 표현형으로 인식되고 있다.[9]
하위 유형
전통적인 폐기물과 만성 기관지 표현형 두 가지는 고유한 근본적인 메커니즘으로 근본적으로 다른 조건이다.[9] 그 후 COPD가 더 복잡하다는 것을 인식하고 COPD의 다른 하위유형이나 표현유형을 다수 수용하게 된 위험요인과 임상과정이 서로 다른 다양한 장애군을 가지고 있다는 것을 인정하여 제안하였다.[45][46] 스피로메트리 대책은 표현형 정의에 미흡하며, 흉부 엑스레이, CT, MRI 스캔 등이 주로 채택됐다. 대부분의 COPD 사례들은 늦은 단계에서 진단되며 영상화 방법을 사용하면 더 일찍 검출하고 치료할 수 있을 것이다.[9]
다른 표현형식의 식별과 인식은 적절한 치료 접근법을 안내할 수 있다. 예를 들어, PDE4 억제제 로플루밀라스트는 만성-브론키아틱 표현형을 대상으로 한다.[47]
두 개의 염증성 표현형은 표현형 안정성을 보여준다; 중성지방성 염증성 표현형, 그리고 어시노필성 염증 표현형이다.[48] 구강 코르티코스테로이드의 사용보다는 단핵항체 메폴리주맙(Mepolizumab)이 어시노필성 염증성형 치료에 효과가 있는 것으로 나타났으나, 추가 연구가 요구되고 있다.[49]
또 다른 인식된 표현형태는 빈번한 악화작용이다.[50] 잦은 악화는 1년에 두 번 이상 악화되고 예후가 좋지 않으며, 적당히 안정된 표현형으로 묘사된다.[28]
심혈관 기능장애로 인한 폐혈관 COPD 표현형이 설명되어 왔다.[51] CFTR 기능 장애의 분자 표현형은 낭포성 섬유증과 공유된다.[13] 만성 기관지염과 기관지확장증의 복합 표현형은 최상의 치료법을 결정하는 데 있어 난이도가 높은 것으로 설명되어 왔다.[52]
유일한 유전자형은 알파-1 안티프립신 결핍증(AATD) 유전적 하위형이며, 이것은 특정한 치료법을 가지고 있다.[53]
원인
COPD가 발달한 원인은 폐를 자극하는 유해한 입자나 기체에 노출되어 여러 숙주요인과 상호작용하는 염증을 일으키기 때문이다. 그러한 노출은 유의적이거나 장기적일 필요가 있다.[8]
COPD 개발의 가장 중요한 위험요인은 담배연기지만, 중흡연자의 50% 미만이 COPD를 개발하기 때문에 실내외 오염물질, 알레르기 유발물질, 직업상 노출, 숙주요인 등의 다른 요인을 고려할 필요가 있다.[27][12] 숙주 요인은 유전적 민감성, 빈곤, 노화, 신체 불활성과 관련된 요인들을 포함한다. 천식과 결핵도 위험요인으로 인정받고 있다.[12] 유럽에서는 기도 과민반응이 흡연 다음으로 중요한 위험요인으로 평가된다.[12]
개발 중에 발생하는 기도 분기 변동의 주 요인이 설명되었다. 호흡나무는 유해물질의 필터로 어떤 변종이라도 이를 교란시킬 가능성이 있다. 변형은 만성 기관지염의 발병과 관련이 있고, 또 다른 변형은 폐기종이 발병하는 것과 관련이 있는 것으로 밝혀졌다. 중앙 기도의 분기 변형은 COPD의 향후 개발을 위한 민감성 증가와 특히 관련이 있다. FGF10에서 변종 유전적 연관성이 발견되기도 했다.[54][55]
알코올 남용은 알코올성 폐질환을 유발할 수 있으며 COPD의 독립적 위험요인으로 보인다.[56][57] 점액성 간극은 알코올에 만성적으로 노출되어 방해를 받고 대식세포 활동이 감소하며 염증 반응이 촉진된다.[58][57] 그 손상은 흡연과 결합할 때 COVID-19를 포함한 감염에 대한 민감성으로 이어진다.[59] 흡연은 COVID-19 개발에서 인정된 요소인 ACE2의 발현을 강화하도록 유도한다.[56]
흡연석을 부탁해요.
전 세계적으로 COPD의 주요 위험요인은 흡연자와 전직 흡연자에게서 COPD 발생률이 증가하는 흡연이다.[8] 흡연자 중 약 20%가 COPD에 걸려 중흡연자의 경우 50% 미만으로 증가한다.[60][8] COPD가 있는 미국과 영국의 경우, 80~95%가 현재 흡연자 또는 이전 흡연자들이다.[60][61][62] 몇몇 연구는 여성이 남성보다 담배 연기의 해로운 영향에 더 민감하다는 것을 보여준다.[63] 같은 양의 흡연에 대해서는 여성이 남성보다 COPD 발생 위험이 높다.[64] 비흡연자의 경우, 간접흡연(간접흡연)에 노출되는 것이 담배 연기로 인한 전 세계 800만 명 이상의 사망으로 120만 명이 사망하는 원인이다.[65] 임신 중이나 어린 시절에 담배를 피우는 여성은 나중에 자녀에서 COPD가 발병하는 위험 요인이다.[66]
시가, 파이프, 수도관, 후카 사용과 같은 다른 종류의 담배 연기 또한 위험을 준다.[12] 수도관이나 후카 담배는 담배 피우는 것만큼 해롭거나 더 해롭다.[67]
마리화나는 두 번째로 흔한 훈제 물질이지만, 마리화나의 사용을 COPD와 연관짓는 증거는 매우 제한적이다. 제한된 증거는 마리화나가 폐 기능 저하를 가속화하지 않는다는 것을 보여준다.[68] 마리화나를 적게 사용하면 담배 사용으로 인한 기관지 내성 효과보다는 기관지 내성 효과를 주지만 담배 흡연자에 의해 담배와 결합하거나 스스로 흡연하는 경우가 많다. 그러나 높은 사용량은 FEV1의 감소를 보여주었다.[69] 그것이 몇몇 호흡기 문제를 일으킨다는 증거가 있고, 조합으로 사용하는 것은 그것이 자발적인 기흉, 황소 폐기종, COPD, 폐암의 위험 인자로 암시하는 누적 독성 효과를 가질 수 있다.[68][70] 대마초 사용과 담배의 눈에 띄는 차이점은 흡연 중단으로 인한 지속적인 감소와 달리 호흡기 질환이 사용 중단으로 해결됐다는 점이다.[68] 마리화나를 사용한 것으로 보고된 호흡기 증상으로는 만성 기침, 가래 생산량 증가, 헉헉거림 등이 포함되었으나 호흡곤란은 없었다. 또한 이러한 증상은 일반적으로 흡연자들에게 영향을 미치기 10년 전에 보고되었다.[68] 또 다른 연구에서는 담배를 추가적으로 사용했음에도 만성 마리화나 흡연자들은 유사한 호흡기 질환이 생겼지만 기류 제한과 COPD는 발생하지 않는 것으로 나타났다.[71]
오염
조리나 난방에 사용되는 환기가 잘 안 되는 화재는 종종 석탄이나 나무나 건조한 똥 같은 바이오매스에 의해 연료가 공급되어 실내 공기 오염을 초래하고 개발도상국에서 COPD의 가장 흔한 원인 중 하나이다. 여성들은 노출이 클수록 더 많은 영향을 받는다.[12] 이러한 연료는 인도, 중국, 사하라 이남 아프리카의 80% 가정에서 주요 에너지원으로 사용된다.[73]
대도시에 사는 사람들은 시골에 사는 사람들에 비해 COPD 비율이 더 높다.[74] 도시 대기오염이 악화의 원인이 되는 요인이지만 COPD의 원인으로서의 전반적인 역할은 불분명하다. 그러나 도시 공기는 폐의 발달과 성숙에 상당한 영향을 미치고 COPD의 발달에 잠재적 위험요인에 기여한다.[12]
배기 가스를 포함한 실외 공기 질이 나쁜 지역은 일반적으로 COPD 비율이 더 높다.[73] 흡연과 관련된 전반적인 효과는 작다고 여겨진다.[12]
직업적 노출
작업장 먼지, 화학 물질 및 연기에 대한 강력하고 장기적인 노출은 흡연자, 비흡연자 및 금연자의 COPD 위험을 증가시킨다. 직업상 노출에 관여하고 영국에 등재된 물질은 카드뮴, 실리카, 곡물과 밀가루에서 나오는 먼지, 카드뮴에서 나오는 매연과 호흡기 증상을 촉진하는 용접 등이 있다.[14][12] 직장 노출은 10~20%의 경우 원인인 것으로 생각되며, 미국에서는 금연자 중 약 30%의 사례와 관련이 있다고 생각되며, 충분한 규제가 없는 국가에서는 아마도 더 큰 위험을 나타낼 것이다.[12][75] 먼지 노출과 담배 연기 노출의 부정적 영향이 누적된 것으로 보인다.[76]
유전학
유전학은 COPD의 발전에 역할을 한다. 관련 없는 흡연자들보다 담배를 피우는 COPD의 친척들 사이에서 더 흔하다.[12] 가장 잘 알려진 유전적 위험인자는 알파-1 항트립신 결핍증(AATD)이며, 이것이 유일한 유전자형(유전자적 하위형)으로 특정 치료법이 있다.[53] 이 위험은 특히 알파-1 안티프록신(AAT)이 부족한 사람도 담배를 피울 경우 높다.[77] 약 1~5%의 사건을[77][78] 담당하며 1만 명 중 3~4명 정도가 그 상태가 나타난다.[79]
COPDGene 연구는 COPD의 역학에 대한 지속적인 종방향 연구로서, 표현형을 식별하고 취약한 유전자와의 연관성을 찾는다. 국제 COPD유전학 컨소시엄과 공동으로 게놈을 광범위하게 분석한 결과 80개 이상의 COPD 관련 게놈 영역이 확인되었으며, 이들 지역에 대한 추가 연구가 요구되었다. 전체 게놈 염기서열화는 희귀 유전적 결정요인을 규명하기 위해 국립심장폐혈액연구소(NHLBI)와 진행 중인 협업(2019년)이다.[80]
병리학
COPD는 만성적이고 불완전하게 되돌릴 수 있는 나쁜 기류(공기류 제한)와 완전히 숨을 내쉬지 못하는(공기 트래핑)이 존재하는 진행성 폐질환이다.[81] 기류가 좋지 않은 것은 작은 기도의 질병과 폐기종(폐조직의 붕괴)의 결과물이다.[82] 이 두 요인의 상대적 기여도는 사람마다 다르다.[8] 공기 트래핑은 폐초인플레이션보다 선행한다.[83]
COPD는 흡입된 자극제에 대한 중요하고 만성적인 염증 반응으로 발전하며, 이는 결국 소항공기 질환으로 알려진 폐에서 기관지 및 치경 리모델링을 초래한다. 따라서 말초 기도 및 폐기종이 좁아지는 기도 리모델링은 폐 기능의 변화를 담당한다.[48] 점액성 간극은 특히 섬광과 점액 생산의 잘못된 규제로 인해 변형된다.[84] 때로는 만성 기관지염이라고 불리기도 하는 작은 기도 질환이 폐기종 발병의 전조인 것으로 보인다.[85] 관련된 염증 세포는 백혈구의 두 종류인 중성미자와 대식세포가 있다. 추가적으로 흡연을 하는 사람들은 세포독성 T세포에 관여하고 있고, COPD를 가진 몇몇 사람들은 천식에서의 그것과 비슷한 어시노필에 관여하고 있다. 이 세포 반응의 일부는 화학적 요인과 같은 염증 매개자에 의해 발생한다. 폐손상과 관련된 다른 과정으로는 담배연기에 고농도의 활성산소가 생성되어 염증세포에 의해 방출되는 산화스트레스와 프로테아제 억제제로 불충분하게 억제되는 프로테아제(특히 엘라스타아제)에 의한 폐의 결합조직의 파괴 등이 있다. 폐의 결합조직이 파괴되면 폐기종이 생기게 되고, 그 후 기류가 나빠지고, 마지막으로 호흡기 가스의 흡수·배출이 원활하지 않게 된다. COPD에서 자주 발생하는 일반적인 근육 낭비는 부분적으로 폐에 의해 혈액으로 방출되는 염증 매개체 때문일 수 있다.[12]
기도가 좁아지는 현상은 기도의 내부에 염증과 흉터가 생겨 발생한다. 이것은 숨을 충분히 내쉬지 못하는 원인이 된다. 이때 가슴의 압력이 기도를 압박하고 있기 때문에 호흡할 때 기류가 가장 많이 감소한다.[86] 이것은 다음 호흡이 시작될 때 폐 안에 남아 있는 이전의 호흡에서 더 많은 공기를 야기할 수 있고, 그 결과 어느 주어진 시간에 폐의 총 공기 부피가 증가하게 되는데, 이는 초인플레이션이 밀접하게 뒤따르는 공기 트래핑이라고 불리는 과정이다.[86][87][83] 운동으로 인한 초인플레이션은 이미 폐가 부분적으로 차 있을 때 호흡이 불편하기 때문에 COPD의 호흡곤란과 관련이 있다.[88] 초인플레이션 또한 악화되는 동안 악화될 수 있다.[89] 천식에서 발견되는 것과 유사한 자극제에 대한 기도 과민반응도 있을 수 있다.[79]
낮은 산소 수준, 그리고 결국 혈중 이산화탄소 수치가 높은 것은 기도폐쇄, 초인플레이션, 호흡 욕구 감소로 인한 가스 교환이 잘 되지 않아 발생할 수 있다.[12] 악화가 진행되는 동안 기도 염증도 증가해 초인플레이션 증가, 호기량 감소, 가스 전달 악화 등이 발생한다. 이것은 혈액 산소 농도를 낮출 수 있고, 만약 장기간 존재한다면, 폐의 동맥이 좁아지는 반면 폐기종은 폐의 모세혈관이 파괴되는 결과를 초래할 수 있다. 이 두 가지 질환 모두 폐심장질환을 유발할 수 있으며, 고전적으로 코르 풀모네일이라고도 한다.[41]
진단
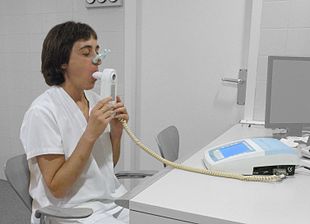
COPD의 진단은 호흡곤란, 만성 기침, 가래 생산, 잦은 겨울 감기와 질병의 위험요인에 노출된 이력이 있는 35~40세 이상 누구에게나 고려되어야 한다. 그런 다음 스피로메트리를 사용하여 진단을 확인한다.[4][90]
스피로메트리
스피로메트리(spirometry)는 존재하는 기류 장애물의 양을 측정하며 일반적으로 기도를 개방하기 위한 약인 기관지질제를 사용한 후에 실시된다.[91] 두 가지 주요 구성 요소를 측정하여 진단을 내리는데, 1초 만에 숨을 내쉴 수 있는 최대 공기량인 강제 호기량(FEV1)과 큰 호흡 한 번으로 숨을 내쉴 수 있는 최대 공기량인 강제 활력 용량(FVC)이다.[92] 일반적으로 첫[92] 번째 초에는 FVC의 75~80%가 나오고 COPD 증상이 있는 사람에서는 FEV1/FVC 비율이 70% 미만인 사람이 질병에 걸린 것으로 정의된다.[91] 이러한 측정을 바탕으로 스피로메트리는 노인들의 COPD 과다 진단으로 이어질 수 있다.[91] 국립보건의료원(National Institute for Health and Care Excellence) 기준은 추가로 FEV1이 예측치의 80% 미만이어야 한다.[93] COPD가 있는 사람들은 또한 폐포 표면적이 감소하여 일산화탄소에 대한 폐의 확산 능력이 감소하고 모세혈관 침대가 손상되는 것을 보여준다.[94] 천식 진단에서 일반적으로 사용되는 피크 호기량 흐름(만료의 최대 속도)을 테스트하는 것은 COPD 진단에 충분하지 않다.[93]
증상이 없는 사람에게 스피로메트리를 이용한 스크리닝은 불확실한 효과가 있어 일반적으로 권장되지는 않지만, 증상이 없지만 알려진 위험요소가 있는 사람에게는 권장된다.[39]
평가
| 등급 | 영향을 받는 활동 |
|---|---|
| 1 | 오직 격렬한 활동만 |
| 2 | 활기찬 걸음걸이 |
| 3 | 정상적인 걸음걸이로 |
| 4 | 몇 분 정도 걸은 후에 |
| 5 | 갈아입을 옷으로 |
| 심각도 | FEV1 % 예측 |
|---|---|
| 마일드(GOLD 1) | ≥80 |
| 중간(GOLD 2) | 50–79 |
| 심각(GOLD 3) | 30–49 |
| 매우 심각함(GOLD 4) | <30 |
COPD의 영향과 심각도를 평가하기 위해 다양한 방법을 사용할 수 있다.[90][39] MRC 숨쉬기 척도 또는 COPD 평가 시험(CAT)은 사용할 수 있는 간단한 질문지다.[95][90] GOLD는 MRC 척도를 수정하여 사용할 경우 단순히 호흡곤란을 테스트하는 것이므로 다른 테스트도 포함시킬 필요가 있다.[39][96] CAT 점수는 0~40점대, 점수가 높을수록 질병이 심각하다.[97] 스피로메트리는 기류 제한의 심각성을 결정하는 데 도움이 될 수 있다.[4] 이것은 일반적으로 개인의 나이, 성별, 키, 몸무게에 대해 예측된 "정상"의 백분율로 표현되는 FEV1에 기초한다.[4] 미국과 유럽의 지침은 모두 FEV1에 대한 치료 권고안을 부분적으로 기초할 것을 권고한다.[91] GOLD 가이드라인은 증상 평가, 기류 제한 정도, 악화의 이력에 근거하여 사람들을 4가지 범주로 분류한다.[96] 체중감량, 근육감소, 피로는 심하고 매우 심한 경우에 나타난다.[39]
기타 시험
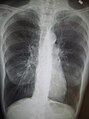
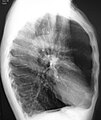
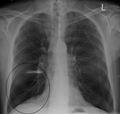
흉부 엑스레이는 COPD 진단에 유용하지는 않지만 다른 조건을 배제하거나 폐섬유화, 기관지확장증 등의 동반질환을 포함하는데 사용된다. X선에 COPD가 나타나는 특징적인 징후로는 초인플레이션(평탄한 횡경막과 복고공기 공간의 증가로 나타남)과 폐의 고농축이 있다.[5] COPD를 나타내는 세이버-시트 기관도 보일 수 있다.[98]
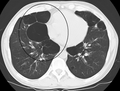
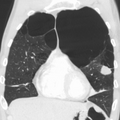
CT스캔은 기관지확장증의 배제를 제외하고는 일상적으로 사용되지 않는다.[5] 동맥혈의 분석은 산소 보충의 필요성을 판단하고 혈중 이산화탄소 수치가 높은지 평가하는 데 사용된다. 이는 예상된 FEV1 이하, 말초 산소 포화도가 92% 이하인 사람, 울혈성 심부전 증상이 있는 사람에게 권장된다.[99] 세계보건기구는 COPD 진단을 받은 모든 사람들에게 알파-1 항균 결핍 검사를 권고한다.[39]
차등진단
COPD는 울혈성 심부전, 천식, 기관지확장증, 결핵, 말기 기관지염, 확산 범브론치올염과 같은 다른 조건들과 차별화되어야 할 필요가 있을 수 있다.[5] 천식과 COPD의 구분은 증상, 흡연 이력, 기류 제한이 척추측만증에서 기관지 소도기로 되돌릴 수 있는지 여부에 기초하여 이루어진다.[100] 기류가 정상인 만성 기관지염은 COPD로 분류되지 않는다.[79]
예방
대부분의 COPD 사례는 담배연기와 기타 실내외 오염물질에 대한 노출을 줄임으로써 잠재적으로 예방할 수 있다.[17]
금연
정부, 보건 기관, 금연 단체의 정책은 사람들이 담배를 피우지 못하게 하고 흡연을 중단하도록 장려함으로써 흡연율을 낮출 수 있다.[101] 공공장소나 근무지에서의 흡연 금지는 간접흡연에 대한 노출을 줄이기 위한 중요한 조치로서, 많은 장소들이 금연법을 제정했지만, 더 많은 것을 추천한다.[73]
담배를 피우는 사람들에게 있어서, 흡연을 중단하는 것은 COPD의 악화를 늦추는 유일한 방책이다.[102][103] 질병의 늦은 단계에서도 폐 기능 악화의 속도를 낮추고 장해와 사망의 시작을 늦출 수 있다.[104] 종종 장기 금욕이 이루어지기 전에 몇 번의 시도가 필요하다.[101] 5년 이상의 시도는 거의 40%의 사람들에게 성공으로 이어진다.[105]
일부 흡연자들은 의지력만으로 장기간 금연할 수 있다. 그러나 흡연은 중독성이 강해 많은 흡연자들은 추가적인 지원이 필요하다.[106] 사회적 지원, 금연 프로그램 참여, 니코틴 대체 요법, 부프로피온, 바레니클라인 등의 약물 사용으로 금연 가능성이 향상된다.[101][103][105] 흡연치료제와 행동치료를 병행하면 행동치료만 하는 것에 비해 COPD가 있는 사람들이 담배를 끊는 데 효과적일 가능성이 2배 이상 높다.[107]
직업건강
석탄 채굴, 건설, 석재 제조업과 같은 위험에 처한 산업의 노동자들이 COPD를 개발할 가능성을 줄이기 위한 많은 조치가 취해졌다.[73] 이러한 조치의 예로는 공공 정책 수립,[73] 위험성에 대한 근로자 및 관리 교육, 금연 촉진, COPD 조기 징후 확인, 호흡기 사용, 분진 관리 등이 있다.[108][109] 효과적인 분진 조절은 환기 개선, 물 분무 사용 및 분진 발생을 최소화하는 채광 기법을 사용하여 달성할 수 있다.[110] 작업자가 COPD를 개발하면, 예를 들어 작업역할을 변경하여 진행 중인 먼지 노출을 피함으로써 추가적인 폐 손상을 줄일 수 있다.[111]
오염
실내외 공기질 모두 개선될 수 있어 COPD를 예방하거나 기존 질병의 악화를 늦출 수 있다.[73] 이것은 공공 정책 노력, 문화적 변화, 개인적 개입에 의해 달성될 수 있다.[112] 많은 선진국들이 규제를 통해 실외 공기질을 개선하는데 성공했고 이로 인해 인구의 폐 기능이 개선되었다.[73] 개인들도 실내외 오염에 대한 자극을 피하는 것이 좋다.[17]
개발도상국에서는 주택의 환기 개선과 난로와 굴뚝 개선을 통해 요리 및 난방 연료로 인한 연기에 대한 노출을 줄이는 것이 핵심 노력이다.[112] 적절한 난로는 실내 공기질을 85%까지 개선할 수 있다. 태양열 조리나 전기난방 등 대체에너지를 이용하는 것도 효과적이다. 등유나 석탄과 같은 연료를 사용하는 것이 나무나 똥과 같은 전통적인 바이오매스보다 더 나을 수 있다.[73]
관리
COPD는 치료할 수 없지만, 그 증상은 치료할 수 있고, 특히 흡연을 중단함으로써 그 진행을 지연시킬 수 있다.[1][6] 경영진의 주요 목표는 금연과 같은 비약물학적 치료를 제공하는 등 위험 요인에 대한 노출을 줄이는 것이다. 흡연을 중단하면 폐 기능 저하율을 낮출 수 있고, 폐암, 심혈관 질환 등 흡연 관련 질병으로 인한 사망률도 낮아진다.[1] 다른 권고사항으로는 매년 독감 예방접종과 악화의 위험을 줄이기 위한 폐렴구균 예방접종, 건강한 식습관에 대한 조언 제공, 신체 운동 장려 등이 있다. 호흡곤란, 스트레스 관리에 대한 지도도 조언한다.[6]
다른 질병들도 관리된다. 실행 계획이 작성되어 검토될 것이다.[113] 사람들에게 개인화된 행동 계획, 교육 세션, 그리고 악화가 발생했을 때 행동 계획의 사용에 대한 지원을 제공하는 것은 병원 방문 횟수를 줄이고 악화의 조기 치료를 장려한다.[114] 코르티코스테로이드 복용, 보조산소 사용 등 자기관리 개입이 행동계획과 결합되면 건강 관련 삶의 질이 평상시 대비 개선된다.[115] COPD가 영양실조인 경우 비타민C, 비타민E, 아연, 셀레늄으로 보충하면 체중, 호흡근육의 강도, 건강 관련 삶의 질을 향상시킬 수 있다.[18] 상당한 비타민D 결핍은 COPD에 걸린 사람들에게 흔하며, 악화되는 것을 증가시킬 수 있다. 부족할 때 보충하면 악화 횟수를 50% 줄일 수 있다.[28][116]
구강별 코르티코스테로이드는 회복 가능성을 높이고 전반적인 증상 지속시간을 감소시킨다.[117]
[112] 그들은 정맥 스테로이드와 똑같이 효과가 있지만 부작용이 적은 것으로 보인다.[118] 5일간 스테로이드제를 복용하면 10일이나 14일 정도 효과가 있다.[119] 심각한 악화를 겪는 사람들에게 항생제는 결과를 향상시킨다.[120] 아목시실린, 독시사이클린, 아지트로마이신 등 여러 가지 항생제가 사용될 수 있다. 한 항생제가 다른 항생제보다 나은지는 불분명하다.[121] 덜 심각한 환자를 위해 개선된 결과의 명확한 증거가 없다.[120] FDA는 심각한 부작용의 높은 위험으로 인해 다른 옵션을 사용할 수 있는 경우 플루오로 퀴놀론 사용을 금지할 것을 권고한다.[122] 급성 고압 호흡기 장애(급성 높은 수준의 이산화탄소)를 치료할 때 담즙 양기압(BPAP)은 사망률과 집중 치료의 필요성을 감소시킬 수 있다.[117] 악화 중 20% 미만이 병원 입원을 필요로 한다.[112] 호흡기 장애로 인한 산증이 없는 사람들의 경우, 가정 의료는 일부 입원치료를 피하는 데 도움이 될 수 있다.[112]
말기 질환자는 증상 완화에 집중한다.[123] 모르핀은 운동 내성을 향상시킬 수 있다.[18] 비침습적 인공호흡은 호흡을 지지하고 낮의 호흡곤란을 감소시키는 데 사용될 수 있다.[124][18]
기관지 도장기
흡입된 단작동 기관지염기는 필요한 경우 주로 사용하는 약이다. 정기적으로 사용하는 것은 권장하지 않는다.[6] 두 가지 주요 유형은 베타2-아드레날린 작용제 및 항이콜린 작용제(장작 또는 단작작용)이다. 베타2-아드레날린 작용제는 기관지에 있는 부드러운 근육 세포에서 수용기를 대상으로 하여 긴장을 풀고 공기 흐름을 개선시킨다. 그것들은 호흡의 부족을 줄이고, 동적 초인플레이션을 감소시키는 경향이 있으며, 운동 내성을 향상시킨다.[6][125] 단작작용 기관지염기는 4시간 동안 효과가 있으며, 유지요법에는 12시간 이상 효과가 있는 장기 작용 기관지염기를 사용한다. 증상이 더 심할 때는 짧은 연기제를 조합하여 사용할 수 있다.[6] 장기간 작용하는 베타-2 작용제와 함께 사용되는 흡입된 코르티코스테로이드는 둘 중 하나보다 효과적이다.[126]
티오트로피움과 같은 장작용제, 장작용제인 LABA(Long-acting Muscarinic antider)와 장작용제인 LABA(Long-acting 베타 작용제) 중 어떤 것이 더 나은지는 불분명하며, 각각 시도하고 가장 효과가 좋은 것으로 지속하는 것이 바람직할 수 있다.[127] 두 가지 유형의 작용제 모두 급성 악화의 위험을 15–25%[117] 감소시키는 것으로 보인다. LABA/LAMA의 조합은 장기 작용하는 기관지 소도기에 비해 COPD 악화를 줄이고 삶의 질을 개선할 수 있다.[128] 2018년 NICE 지침은 경제 모델링이 있는 이중 장기 작용 기관지 도장기를 사용할 것을 권고하고 있는데, 이는 하나의 장기 작용 기관지 도장기를 시작하고 나중에 다른 기관지를 추가하는 것보다 이 접근법이 더 바람직하다는 것을 시사한다.[129]
살부타몰(알부테롤)과 테르부탈린 등 몇 가지 단기 작용 β2 작용제를 구할 수 있다.[112] 그들은 4시간에서 6시간 동안 증상 완화를 제공한다.[112] 살미터올, 포모테롤, 인다카테롤과 같은 LABA는 종종 유지 치료제로 사용된다. 어떤 사람들은 편익의 증거가 제한적이라고 느끼는 반면,[130] 다른 사람들은 편익의 증거를 확립된 것으로 본다.[131][132][133] COPD에서[134] 장기 사용은 불안과 심장 떨림을 포함한 역효과를 동반하여 안전해 보인다.[117] 흡입 스테로이드제와 함께 사용하면 폐렴의 위험이 증가한다.[117] 스테로이드와 LABA가 함께 더 잘 작동할지 모르지만, 이 작은 이득이 증가된 위험보다 더 큰지는 확실하지 않다.[130][135] LABA와 항혈소독제인 장기작용 무스카린 길항작용제(LAMA)를 결합하면 LABA와 흡입한 코르티코스테리오드(ICS)와의 치료와 비교할 때 악화, 폐렴 감소, 강제퇴원량 개선(FEV1%) 및 삶의 질 향상 가능성이 있다는 증거가 있다.[136] 라바, 라마, ICS 세 가지를 합치면 모두 몇 가지 이득의 증거가 있다.[137] 인다카테롤은 하루 1회 흡입량을 필요로 하며, 안정적인 COPD를 가진 사람에게 하루 2회 투약해야 하는 다른 장기 작용 β2 작용제 약물과 마찬가지로 효과가 있다.[133]
COPD에서 사용되는 두 가지 주요 항고체제는 ipratropium과 tioropium이다. 이프라트로피움은 짧은 작용의 무스카린 길항제(SAMA)인 반면 티오트로피움은 오래 작용한다. 티오트로피움은 악화 감소와 삶의 질 향상과 관련이 있으며 [138]티오트로피움은 아이프라트로피움보다 더 나은 혜택을 제공한다.[139] 사망률이나 전체 입원률에는 영향을 미치지 않는 것으로 보인다.[138] 항이콜린제는 입안이 건조해지고 요로 증상이 나타날 수 있다.[117] 그들은 또한 심장병과 뇌졸중의 위험 증가와 관련이 있다.[140] 또 다른 장기 작용제인 아킬리디늄은 COPD와 관련된 입원을 줄이고 삶의 질을 향상시킨다.[141][142][143] RAMA 우메클리디늄 브로마이드는 또 다른 항고체성 대안이다.[144] 티오트로피움과 비교하면 라마의 아실리디늄, 글리코프로니움, 우메클리디늄은 효능이 비슷한 것으로 나타나는데, 4가지 모두 플라시보보다 효과적이다.[145] 아킬리디늄과 티오트로피움을 비교하는 추가 연구가 필요하다.[143]
코르티코스테로이드
흡입된 코르티코스테로이드(corticosteroid)는 COPD 사례에서 반복적으로 악화되는 1차 유지 치료제로 골드(GOLD)가 추천하는 항염화제다.[146][147] 그들의 규칙적인 사용은 특히 심각한 경우 폐렴의 위험을 증가시킨다.[28] 연구는 폐렴의 위험이 모든 종류의 코르티코스테로이드와 관련이 있다는 것을 보여주었고, 질병의 심각성과 관련이 있으며, 용량-반응 관계가 지적되었다.[146] 코르티코스테로이드의 사용은 (기관지 림프 조직에서) 림프성 엽의 수의 감소와 관련이 있다.[85] LABA/LAMA/ICS의 삼중 흡입 요법은 폐 기능을 개선하고 증상 및 악화를 감소시키며, 모노 또는 이중 치료보다 효과가 더 큰 것으로 보인다.[126]
2018 NICE 지침은 스테로이드 반응성을 나타내는 천식환자 또는 특징을 가진 사람들에게 ICS의 사용을 권고한다. 여기에는 천식이나 아토피에 대한 이전의 모든 진단, 더 높은 혈액 어시노필 카운트, 시간에 따른 FEV1의 상당한 변화(최소 400 mL), 피크 호기 흐름의 최소 20%의 주간 변동 등이 포함된다. 정확한 임계값이 무엇이어야 하는지, 언제 상승해야 하는지가 명확하지 않아 특정 값을 지정하지 않고 "Higher" eosinophil count를 선택했다.[148]
PDE4 억제제
인광체테라제-4 억제제(PDE4 억제제)는 폐 기능을 개선하고 중간에서 중증까지 질환의 악화를 줄여주는 항염화제다. 로플루밀라스트는 염증을 줄이기 위해 매일 한 번씩 구강으로 사용하는 PDE4 억제제로 직접적인 기관지염 효과가 없다. 전신 코르티코스테로이드와 함께 만성 기관지염을 앓고 있는 사람들을 치료하는 데 기본적으로 사용된다.[49] 보고된 로플루밀라스트 부작용은 치료 초기에 나타나며, 지속적인 치료로 인해 감소하며, 되돌릴 수 있다. 한 가지 효과는 체중 감소를 극적으로 하는 것이며, 체중 미달인 사람들에게는 그 사용을 피해야 한다. 우울증을 앓고 있는 사람들에게도 주의해서 사용하는 것이 좋다.[49]
기타의약
항생제의 장기적 예방적 사용, 특히 에리트로마이신과 같은 마크로라이드 등급의 항생제는 1년에 2번 이상 복용하는 사람들의 악화 빈도를 감소시킨다.[149][150] 이러한 관행은 세계의 일부 지역에서 비용 효과적일 수 있다.[151] 항생제 내성 및 청력 손실, 이명, 심장 박동 변화(긴 QT 증후군) 등 부작용 가능성이 우려된다.[150]
에오필린과 같은 메틸크산틴이 널리 사용된다. 그 엽록소는 안정적인 COPD에서 가벼운 기관지염 효과를 가지고 있는 것으로 보인다. 영감근육 기능이 개선된 것으로 보이지만 인과 효과는 불분명하다. 에오필린은 살미터톨의 첨가제로 사용되었을 때 호흡곤란을 개선시키는 것으로 보인다. 모든 개선 사례는 지속적인 릴리스 준비를 사용하여 보고되었다.[6] 메틸산틴은 역효과로 인한 악화에 사용하지 않는 것이 좋다.[28]
점액질은 만성 기관지염을 앓고 있는 일부 사람들의 악화를 줄이는데 도움을 줄 수 있다; 한 달 안에 입원 횟수와 장애 발생 일수를 줄임으로써 눈에 띈다.[152] 에르도스테인은 NICE가 추천하는 것으로 GOLD는 흡입한 코르티코스테로이드 사용시 주의하는 일부 점액체의 사용을 지원하고, 에르도스테인은 코르티코스테로이드 사용과 관계없이 좋은 효과를 가진 것으로 단식한다.[153] 에르도스테인 역시 항산화 성질을 가지고 있지만, 항산화제의 일반적인 사용을 뒷받침할 충분한 증거가 없다.[49] 에르도스테인은 악화될 위험을 크게 줄이고, 그 기간을 단축하며, 병원에 입원하는 것으로 나타났다.[154]
기침약은 권장하지 않는다.[155] 베타 차단제는 COPD에 걸린 사람에게는 억제되지 않으며, 동반성 심혈관 질환이 있는 경우에만 사용해야 한다.[49]
산소요법
호흡기 장애 시 산소 농도가 낮은 사람(50~55mmHg 미만의 부분압 또는 88%[18] 미만의 산소 포화도)에게는 보조 산소가 권장된다. Cor pulmonale과 폐고혈압을 포함한 합병증을 고려할 때, 관련된 수준은 56–59 mmHg이다.[156] 산소요법은 하루에 15~18시간 정도 사용하게 되어 있으며 심부전과 사망의 위험을 감소시킨다고 한다.[156] 산소 보충제(방출제)는 정상 또는 경미하게 산소 농도가 낮은 사람의 경우 운동 중 주었을 때 호흡곤란을 개선하지만, 정상적인 일상 활동 중 호흡곤란을 개선하거나 삶의 질에 영향을 미치지 않을 수 있다.[157] 급성 악화가 진행되는 동안 많은 사람들은 산소 치료를 필요로 한다; 사람의 산소 포화도를 고려하지 않고 고농도의 산소를 사용하면 이산화탄소의 수치가 증가하고 결과가 악화될 수 있다.[158][159] 높은 이산화탄소 수준의 위험성이 높은 사람의 경우 산소 포화도가 88~92%인 반면, 이러한 위험이 없는 사람의 경우 권장 수준은 94~98%[159]이다.
재활
폐재활은 운동, 질병관리, 상담 등의 프로그램으로 개인에게 이익을 주기 위해 조정된다.[160] 심각한 퇴원은 병원 입원, 높은 사망률, 일상 활동 수행 능력 저하를 초래한다. 병원 입원 후 폐 재활은 미래의 병원 입원, 사망률을 현저히 낮추고 삶의 질을 향상시키는 것으로 나타났다.[47]
최적의 운동 루틴, 운동 중 비침습적 인공호흡의 사용, COPD가 있는 사람들에게 제안된 운동 강도는 알려져 있지 않다.[161][162] 지구력 팔 운동을 하면 COPD가 있는 사람들의 팔 움직임이 좋아지고 호흡곤란이 약간 개선될 수 있다.[163] 팔 운동만 해도 삶의 질이 향상되는 것 같지는 않다.[163] 청순-립 호흡 운동이 유용할 수 있다.[24] 청결 립 호흡은 안정적인 COPD 환자의 포화, 호흡곤란, 피크 호기 유량(PEFR)을 개선한다.[164] 타이치 운동은 COPD에 걸린 사람들에게 연습하기에 안전한 것으로 보이며, 일반적인 치료 프로그램과 비교했을 때 폐 기능 및 폐 용량에 도움이 될 수 있다.[165] 타이치는 다른 운동 개입 프로그램보다 더 효과적이지 않은 것으로 밝혀졌다.[165] 흡기 및 호기근육훈련(IMT, EMT)은 일상생활의 활동 개선을 위한 효과적인 방법이다. 집에서 IMT와 걷기 운동을 병행하면 심한 COPD의 경우 호흡곤란을 억제하는 데 도움이 될 수 있다.[166] 또한 운동과 함께 저진폭 고속 관절 동원을 사용하면 폐 기능 및 운동 능력이 향상된다.[167] 척추 조작 치료의 목표는 호흡 중 폐에 대한 작업을 줄이기 위한 노력으로 흉부 이동성을 향상시키는 것이지만 COPD가 있는 사람들의 수동 치료를 뒷받침하는 증거는 매우 약하다.[167][168]
자세 배수, 타악/진동, 자동 발생 배수, 휴대용 양수압(PEP) 장치 및 기타 기계적 장치와 같은 기도 간격 기술(ACT)은 인공호흡 보조의 증가 필요성, 인공호흡 보조의 지속 기간 및 급성 COPD 환자에 대한 병원 체류 기간을 줄일 수 있다.[169] 안정적인 COPD를 가진 사람들의 경우, ACT는 건강 관련 삶의 질을 단기적으로 개선하고 호흡기 문제와 관련된 장기 입원 필요성을 감소시킬 수 있다.[169]
저체중이나 과체중은 COPD의 증상, 장애 정도, 예후에 영향을 미칠 수 있다. 저체중 COPD를 가진 사람들은 칼로리 섭취량을 증가시킴으로써 호흡근육력을 향상시킬 수 있다. 정기적인 운동이나 폐 재활 프로그램과 결합하면 COPD 증상의 개선으로 이어질 수 있다. 영양 보충은 영양실조에 걸린 사람들에게 유용할 수 있다.[18][170]
악화의 관리
COPD를 앓고 있는 사람들은 호흡기 감염에 의해 흔히 발생하는 악화(평형)를 경험할 수 있다. 악화되는 증상은 COPD와 차등 진단에 특정되지 않는 점을 고려할 필요가 있다.[28] 급성 악화는 일반적으로 단작용 흡입 베타 작용제와 단작작용 항균제의 조합을 포함하여 단작작동 기관지질제의 사용을 증가시킴으로써 치료된다.[28] 이러한 약물은 스페이서가 장착된 계량제 흡입기나 분무기를 통해 제공될 수 있으며, 두 약 모두 동일한 효과가 있는 것으로 보인다.[112][171] 분무화는 몸이 더 좋지 않은 사람들에게 더 쉬울 수 있다.[112] 산소 보충제는 유용할 수 있다. 그러나 과도한 산소는 CO2
수치를 증가시키고 의식 수준을 감소시킬 수 있다.[172] 코르티코스테로이드의 경구 투여는 폐 기능을 향상시키고 병원 체류를 단축시킬 수 있지만 5일에서 7일 정도만 사용하는 것이 좋다; 긴 코스가 폐렴과 사망의 위험을 증가시킨다.[28]
폐기종 절차
초인플레이션과 함께 심각한 폐기종의 경우 폐의 부피를 줄이는 여러 절차가 있다.
외과적
심각한 폐기종의 경우 다른 치료법 폐활량 감소 수술(LVRS)에 반응이 없는 것으로 판명된 폐기종이 선택사항이 될 수 있다.[173][174] LVRS는 손상된 조직을 제거하는데, 이것은 나머지 폐가 팽창할 수 있게 함으로써 폐 기능을 향상시킨다.[117][112] 폐기종이 상엽에 있을 때, 그리고 동반입증이 없을 때 고려된다.[175]
기관지경
폐 부피를 줄이기 위해 최소 침습성 기관지경 절차를 수행할 수 있다. 여기에는 밸브, 코일 또는 열절제가 포함된다.[18][176] 내측색 밸브는 발전된 폐기종에서 기인하는 심각한 초인플레이션에 사용될 수 있는 단방향 밸브로, 적절한 대상 로브와 이 절차에는 부차적 환기가 필요하지 않다. 1개 이상의 밸브를 로브에 배치하면 폐 기능, 운동 능력, 삶의 질을 향상시키는 잔류 부피 감소를 보장하는 로브의 부분 붕괴를 유도한다.[177]
밸브의 사용을 방해하는 부차적 환기가 있는 경우 밸브 대신 니티놀 코일을 배치하는 것이 좋다.[178] 니티놀은 생체 적합 합금이다.
이 두 기법은 모두 지속적인 공기 누출과 심혈관 합병증을 포함한 부작용과 관련이 있다. 열증기 절제술은 프로파일이 개선되었다. 가열된 수증기는 영구적인 섬유화 및 부피 감소로 이어지는 로브 부위를 대상으로 한다. 이 절차는 개별 로브 세그먼트를 대상으로 할 수 있으며, 부차적 인공호흡에 관계없이 수행될 수 있으며 폐기종의 자연적인 진행으로 반복될 수 있다.[179]
기타수술
매우 심각한 경우에는 폐 이식을 고려할 수 있다.[173] CT 스캔은 수술을 고려할 때 유용할 수 있다.[79] 환기/용접 섬광은 수술 중재의 사례를 평가하고 수술 후 반응을 평가하는 데 사용할 수 있는 또 다른 영상 방법이다.[180] 거대 불라가 혈관의 3분의 1 이상을 점유할 때 대퇴골절제술을 실시할 수 있다.[175]
예후
COPD는 진행적이고 조기 사망으로 이어질 수 있다. 전체 장애의 3%가 COPD와 관련이 있는 것으로 추정된다.[182] 전 세계적으로 COPD 장애 비율은 1990년부터 2010년까지 아시아를 중심으로 실내 공기 질이 개선되면서 감소하였다.[182] 그러나 COPD로 인한 장애 수명은 전반적으로 증가했다.[183]
COPD의 장기적 결과에 영향을 미치는 변수는 여러 가지가 있는데 GOLD는 단순히 스피로메트리 결과만이 아니라 체질량지수, 기도의 방해, 호흡곤란(호흡불감증), 운동 등의 주요 변수를 포함하는 복합시험(BOD)의 사용을 권장하고 있다.[184]
NICE는 안정적인 COPD에서 예후 평가에 BOD를 사용하는 것에 반대할 것을 권고한다. 악화 및 취약성과 같은 요인을 고려할 필요가 있다.[176] 나쁜 결과에 기여하는 다른 요인으로는 노령, 폐암, 심혈관 질환과 같은 합병증, 병원 입원이 필요한 악화의 수와 심각성이 있다.[28]
역학
유병률 추정치는 분석 및 측량 접근방식의 차이와 진단 기준의 선택으로 인해 상당한 변동이 있다.[185] 2010년에는 약 3억 8천 4백만 명의 사람들이 COPD를 앓았는데, 이는 전세계적으로 12%[8]의 유병률에 해당한다. 그 질병은 남녀 모두에게 영향을 미친다.[3] 1970년대와 2000년대 사이에 개발도상국의 증가는 이 지역의 흡연율 증가, 인구 증가, 전염병 등 다른 원인으로 인한 사망률 감소에 따른 고령화와 관련이 있는 것으로 생각된다.[117] 일부 선진국은 증가율이 증가했고, 일부는 안정세를 유지했으며, 일부는 COPD 유병률이 감소했다.[117]
매년 약 3백만 명의 사람들이 COPD로 죽는다.[8] 일부 국가에서는 남성이 감소했지만 여성은 증가했다.[186] 이것은 여성과 남성의 흡연율이 비슷해졌기 때문일 가능성이 높다.[79] COPD는 40세 이상에서 더 높은 비율이 발견되며, 이는 60세 이상에서 가장 높은 비율로 나이가 들면서 크게 증가한다.[8]
영국에서는 3백만 명의 사람들이 COPD의 영향을 받는 것으로 보고되고 있다 – 이 중 2백만 명은 진단되지 않은 것이다. 2007~2016년 평균 COPD 관련 사망자는 2만8600명이었다. 직업상 노출로 인한 추정 사망자는 약 15%로 약 4,000명으로 추정되었다.[185] 2018년 미국에서는 거의 1570만 명이 COPD 진단을 받았고, 수백만 명 이상이 진단을 받지 못한 것으로 추정된다.[187]
2011년, COPD를 위한 미국 내 입원 건수는 약 73만 건이었다.[188] 2019년 글로벌 COPD가 3번째 사망 원인이었다. 저소득 국가에서는 COPD가 10대 사망 원인에는 나타나지 않고, 다른 소득 집단에서는 5위 안에 든다.[189]
역사

만성폐쇄성폐질환이라는 명칭은 1965년에 처음 사용된 것으로 추정된다.[190] 이전에는 만성폐쇄성기관지폐질환, 만성기류장애, 만성폐쇄성폐질환, 비특정성폐질환, 확산폐색증후군 등 여러 다른 이름으로 알려져 왔다.[190]
폐기종과 만성기관지염이라는 용어는 1959년 CIBA 초청 심포지엄에서 COPD의 구성요소로, 1962년 미국 흉부사회 진단기준위원회 회의에서 공식적으로 정의되었다.[190]
폐기종에 대한 초기 설명은 1679년 T에 의해 시작되었다. 1769년 "특히 공기로부터 터지드"된 폐의 조반니 모가그니에 의해 "발광성 폐"의 상태에 대한 보넷.[190][191] 1721년 폐기종의 첫 그림은 루이시에 의해 만들어졌다.[191] 레네 레넥은 자신의 저서 『가슴의 질병에 관한 치료』(1837년)에서 폐세마라는 용어를 사용해 부검 중 가슴을 열어도 무너지지 않는 폐를 묘사했다. 그는 공기가 차고 기도가 점액으로 가득 차 있어 평소처럼 무너지지 않았다고 지적했다.[190] 1842년 존 허친슨은 스피미터를 발명하여 폐의 생명력을 측정할 수 있게 되었다. 그러나 그의 스피미터는 공기 흐름이 아니라 부피만 측정할 수 있었다. 1947년 티페노우와 피넬리는 기류 측정의 원리를 설명했다.[190]
20세기 초 영국에서 대기오염과 흡연 증가로 만성폐질환이 발생했지만 1952년 12월 런던 대 스모그까지 별 관심을 받지 못했다. 이것은 영국, 네덜란드 등지의 역학 연구에 박차를 가했다.[192] 1953년 미국의 알레르기 전문의인 조지 월드보트 박사는 1953년 미국 의학협회 저널에 흡연자의 호흡기 증후군이라는 새로운 질병에 대해 처음 기술했다. 이것이 흡연과 만성 호흡기 질환 사이의 첫 연관성이었다.[193]
현대적인 치료법은 20세기 후반기에 개발되었다. COPD에서의 스테로이드 사용을 지지하는 증거는 1950년대 말에 발표되었다. 기관지소독기는 1960년대에 이소판드레날린에 대한 유망한 실험에 따라 사용되기 시작했다. 단작작용 살부타몰과 같은 기관지확장기가 1970년대에 추가로 개발되었으며, 장기작용을 하는 기관지확장기의 사용은 1990년대 중반부터 시작되었다.[194]
사회와 문화
일반적으로 COPD는 널리 저진단을 받고 있으며, 많은 사람들이 치료를 받지 않고 있는 것으로 받아들여지고 있다. 미국에서 NIH는 11월을 COPD 인식의 달로 홍보하여 매년 그 상태에 대한 인식을 높이는 데 초점을 맞추고 있다.[195]
경제학
전 세계적으로 COPD는 2010년 기준으로 2조1000억 달러의 경제적 비용을 발생시킬 것으로 추정되며, 이 중 절반은 개발도상국에서 발생한다.[196] 이 중 약 1조9000억 달러가 의료 등 직접비용인 반면, 0조2000억 달러는 업무상 실직 등 간접비용이다.[197] 이것은 2030년까지 두 배 이상 증가할 것으로 예상된다.[196] 유럽에서 COPD는 의료 지출의 3%를 차지한다.[198] 미국에서는 이 질병의 비용이 500억 달러로 추산되는데, 대부분은 악화로 인한 것이다.[198] COPD는 2011년 미국 병원에서 가장 비싼 조건 중 하나였으며, 총 비용은 약 57억 달러였다.[188]
리서치
히알루론(Hyaluronan)은 세포의 보호막을 제공하는 세포외 매트릭스의 천연 설탕이다. 오염에 노출되면 폐의 히알루로난이 산산조각으로 분해되어 면역체계가 자극받고 활성화되는 것으로 나타났다. 다음 기도 수축과 염증이 뒤따른다. 이번 연구에서는 채집되지 않은 히알루론(Hyaluronan)을 흡입한 것이 산산조각 난 HA의 영향을 극복하고 염증을 감소시킨 것으로 나타났다. 흡입된 HA는 기관지 트리에서 국소적으로만 작용하며 약물에 간섭하지 않는다. 더 자유롭게 움직일 수 있게 해 점액 간극을 개선한다. 미국에서 최적의 용량 수준을 결정하기 위해 추가 연구가 수행될 것이다.[199]
액체 질소 계량형 극저온을 이용한 만성 기관지 아형을 겨냥한 새로운 극저온 치료가 시행되고 있으며, 2021년 9월 완료를 앞두고 있다.[200][201]
중피줄기세포를 이용한 줄기세포 치료는 폐 기능을 회복시켜 삶의 질을 높일 수 있는 잠재력을 갖고 있다. 2021년 6월 8건의 임상시험이 완료돼 17건이 진행 중이었다. 전반적으로, 줄기세포 치료는 안전하다는 것이 증명되었다. 실험에는 지방 조직, 골수, 탯줄혈액과 같은 다른 원천의 줄기세포를 사용하는 것이 포함된다.[202]
타겟팅된 폐관찰로 알려진 시술이 트라이얼되고 있으며 영국의 한 병원에서 임상시험(2021년)의 일부로 사용되고 있다. 이 새로운 최소 침습적 시술은 약 1시간이 소요되며, 전극을 설치하여 폐에 있는 질신경의 가지를 파괴한다. 부랑신경이 근육수축과 점액분비를 모두 담당하게 되어 기도가 좁아지게 된다. COPD가 있는 사람들에게 이러한 신경들은 대개 흡연 손상의 결과로서 지나치게 활동적이며, 지속적인 점액 분비물과 기도 수축은 기침, 호흡곤란, 쌕쌕거림, 가슴의 조임 등의 증상으로 이어진다.[203]
알파-1 항균제 결핍증을 가진 사람에 대한 알파-1 항균제 증강 치료의 효과는 명확하지 않다.[204] 이중 투여에 대한 후기 임상 실험은 엘라스틴의 분해를 늦추는 것과 폐기종의 진행에 대한 추가적인 연구가 요구되는 것에 약간의 개선을 보여주었다.[205]
COPD에서 질량분광학은 진단 도구로 연구되고 있다.[206]
호흡곤란 증상을 경험했을 때 COPD로 치료하기 위한 원격 건강 관리의 사용에 대한 연구는 계속되고 있다; 사람들을 원격으로 치료하는 것은 응급실 방문 횟수를 줄이고 그 사람의 삶의 질을 향상시킬 수 있다.[207]
COPD를 비롯한 폐질환에 대한 아스타잔틴의 효능에 대한 증거가 커지고 있다. 아스타잔틴은 항염증 성질을 가진 강력한 항산화 물질로, 그 사용에 더 많은 시련이 필요하다고 한다.[208]
다른동물
만성폐쇄성폐질환은 많은 다른 동물에서 발생할 수 있으며 담배연기에 노출되어 발생할 수 있다.[209] 그러나 이 병의 대부분은 비교적 온화하다.[210] 말에서 그것은 재발 기도폐쇄(RAO) 또는 중량으로 알려져 있다. RAO는 상당히 심각할 수 있으며, 대부분의 경우 일반적인 알레르기 유발 물질에 노출되는 것과 관련이 있다.[211] COPD는 늙은 개들에서도 흔히 발견된다.[212]
참고 항목
참조
- ^ a b c d e f g h i "Chronic obstructive pulmonary disease". NICE. Retrieved 5 July 2021.
- ^ a b c "Chronic obstructive pulmonary disease (COPD) - Complications BMJ Best Practice". bestpractice.bmj.com. Retrieved 11 July 2021.
- ^ a b c d e f g "Chronic obstructive pulmonary disease (COPD)". www.who.int. Retrieved 1 July 2021.
- ^ a b c d e f g h i j k l Gold Report 2021, 페이지 20–27, 2장: 진단 및 초기 평가.
- ^ a b c d Gold Report 2021, 페이지 33–35, 2장: 진단 및 초기 평가.
- ^ a b c d e f g h i j k Gold Report 2021, 페이지 40–46, 3장: 예방 및 유지관리 치료를 뒷받침하는 증거
- ^ a b GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ a b c d e f g h i j k l Gold Report 2021, 페이지 4–8, 1장: 정의 및 개요
- ^ a b c d e Myc LA, Shim YM, Laubach VE, Dimastromatteo J (April 2019). "Role of medical and molecular imaging in COPD". Clin Transl Med. 8 (1): 12. doi:10.1186/s40169-019-0231-z. PMC 6465368. PMID 30989390.
- ^ a b "ICD-11 - ICD-11 for Mortality and Morbidity Statistics". icd.who.int. Retrieved 30 June 2021.
- ^ Martini K, Frauenfelder T (November 2020). "Advances in imaging for lung emphysema". Ann Transl Med. 8 (21): 1467. doi:10.21037/atm.2020.04.44. PMC 7723580. PMID 33313212.
- ^ a b c d e f g h i j k l m n o p q r Gold Report 2021, 페이지 8–14, 1장: 정의 및 개요
- ^ a b De Rose V, Molloy K, Gohy S, Pilette C, Greene CM (2018). "Airway Epithelium Dysfunction in Cystic Fibrosis and COPD". Mediators Inflamm. 2018: 1309746. doi:10.1155/2018/1309746. PMC 5911336. PMID 29849481.
- ^ a b "COPD causes - occupations and substances". www.hse.gov.uk. Retrieved 3 July 2021.
- ^ Torres-Duque CA, García-Rodriguez MC, González-García M (August 2016). "Is Chronic Obstructive Pulmonary Disease Caused by Wood Smoke a Different Phenotype or a Different Entity?". Archivos de Bronconeumologia. 52 (8): 425–31. doi:10.1016/j.arbres.2016.04.004. PMID 27207325.
- ^ "Air pollution exposure in cities — European Environment Agency". www.eea.europa.eu. Retrieved 28 June 2021.
- ^ a b c Gold Report 2021, 페이지 80–83, 4장: 안정적인 COPD 관리
- ^ a b c d e f g Gold Report 2021, 페이지 60–65, 3장: 예방 및 유지관리 치료를 뒷받침하는 증거
- ^ Dobler CC, Morrow AS, Beuschel B, et al. (March 2020). "Pharmacologic Therapies in Patients With Exacerbation of Chronic Obstructive Pulmonary Disease: A Systematic Review With Meta-analysis". Annals of Internal Medicine. 172 (6): 413–422. doi:10.7326/M19-3007. PMID 32092762. S2CID 211476101.
- ^ GBD 2015 Mortality and Causes of Death Collaborators (October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ GBD 2013 Mortality and Causes of Death Collaborators (January 2015). "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013". Lancet. 385 (9963): 117–71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ "COPD Costs". www.cdc.gov. 5 July 2019.
- ^ "COPD commissioning toolkit" (PDF). www.assets.publishing.service.gov.uk. Retrieved 18 July 2021.
- ^ a b Mayer AF, Karloh M, Dos Santos K, de Araujo CL, Gulart AA (March 2018). "Effects of acute use of pursed-lips breathing during exercise in patients with COPD: a systematic review and meta-analysis". Physiotherapy. 104 (1): 9–17. doi:10.1016/j.physio.2017.08.007. PMID 28969859.
- ^ Gold Report 2021, 페이지 90–96, 4장: 안정적인 COPD 관리
- ^ O'Donnell DE, Milne KM, James MD, de Torres JP, Neder JA (January 2020). "Dyspnea in COPD: New Mechanistic Insights and Management Implications". Advances in Therapy. 37 (1): 41–60. doi:10.1007/s12325-019-01128-9. PMC 6979461. PMID 31673990.
- ^ a b Szalontai K, Gémes N, Furák J, et al. (June 2021). "Chronic Obstructive Pulmonary Disease: Epidemiology, Biomarkers, and Paving the Way to Lung Cancer". J Clin Med. 10 (13): 2889. doi:10.3390/jcm10132889. PMC 8268950. PMID 34209651.
- ^ a b c d e f g h i j Gold Report 2021, 페이지 104–109, 5장: 악화 관리.
- ^ "Common Colds". Centers for Disease Control and Prevention. 7 October 2020. Retrieved 20 August 2021.
- ^ Guo-Parke H, Linden D, Weldon S, Kidney JC, Taggart CC (2020). "Mechanisms of Virus-Induced Airway Immunity Dysfunction in the Pathogenesis of COPD Disease, Progression, and Exacerbation". Frontiers in Immunology. 11: 1205. doi:10.3389/fimmu.2020.01205. PMC 7325903. PMID 32655557.
- ^ Short B, Carson S, Devlin AC, et al. (March 2021). "Non-typeable Haemophilus influenzae chronic colonization in chronic obstructive pulmonary disease (COPD)". Critical Reviews in Microbiology. 47 (2): 192–205. doi:10.1080/1040841X.2020.1863330. PMID 33455514. S2CID 230608674.
- ^ US EPA, OAR (19 April 2016). "Particulate Matter (PM) Basics". www.epa.gov. Retrieved 21 July 2021.
- ^ a b Halpin DM, Criner GJ, Papi A, Singh D, Anzueto A, Martinez FJ, Agusti AA, Vogelmeier CF (January 2021). "Global Initiative for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease. The 2020 GOLD Science Committee Report on COVID-19 and Chronic Obstructive Pulmonary Disease". Am J Respir Crit Care Med. 203 (1): 24–36. doi:10.1164/rccm.202009-3533SO. PMC 7781116. PMID 33146552.
- ^ Iacobucci, Gareth (11 August 2020). "Covid lockdown: England sees fewer cases of colds, flu, and bronchitis". BMJ. 370: m3182. doi:10.1136/bmj.m3182. PMID 32784206. S2CID 221097739.
- ^ US EPA, OAR (13 August 2019). "Health Effects Attributed to Wildfire Smoke". www.epa.gov. Retrieved 21 July 2021.
- ^ "Forest Fires and Lung Health". the lung association. 25 August 2014. Retrieved 21 July 2021.
- ^ "Bushfire smoke". National Centre for Farmer Health. 19 March 2014. Retrieved 21 July 2021.
- ^ Aleva FE, Voets LW, Simons SO, et al. (March 2017). "Prevalence and Localization of Pulmonary Embolism in Unexplained Acute Exacerbations of COPD: A Systematic Review and Meta-analysis". Chest. 151 (3): 544–554. doi:10.1016/j.chest.2016.07.034. PMID 27522956. S2CID 7181799.
- ^ a b c d e f Gold Report 2021, 페이지 26–33, 2장: 진단 및 초기 평가.
- ^ Chan SH, Selemidis S, Bozinovski S, Vlahos R (June 2019). "Pathobiological mechanisms underlying metabolic syndrome (MetS) in chronic obstructive pulmonary disease (COPD): clinical significance and therapeutic strategies". Pharmacol Ther. 198: 160–188. doi:10.1016/j.pharmthera.2019.02.013. PMC 7112632. PMID 30822464.
- ^ a b Forfia PR, Vaidya A, Wiegers SE (January 2013). "Pulmonary heart disease: The heart-lung interaction and its impact on patient phenotypes". Pulm Circ. 3 (1): 5–19. doi:10.4103/2045-8932.109910. PMC 3641739. PMID 23662171.
- ^ Gold Report 2021, 페이지 121–126, 6장: COPD 및 합병증
- ^ a b Weinberger, Steven E. (2019). Principles of pulmonary medicine (Seventh ed.). Philadelphia, PA. p. 104. ISBN 9780323523714.
- ^ Delaunois, L. (1 October 1989). "Anatomy and physiology of collateral respiratory pathways". European Respiratory Journal. 2 (9): 893–904. PMID 2680588. Retrieved 30 August 2021.
- ^ Ramírez-Venegas A, Torres-Duque CA, Guzmán-Bouilloud NE, González-García M, Sansores RH (2019). "SMALLa AIRWAY DISEASE IN COPD ASSOCIATED TO BIOMASS EXPOSURE". Rev Invest Clin. 71 (1): 70–78. doi:10.24875/RIC.18002652. PMID 30810542.
- ^ Corlateanu A, Mendez Y, Wang Y, Garnica RJ, Botnaru V, Siafakas N (2020). "Chronic obstructive pulmonary disease and phenotypes: a state-of-the-art". Pulmonology. 26 (2): 95–100. doi:10.1016/j.pulmoe.2019.10.006. PMID 31740261.
- ^ a b Halpin DM, Miravitlles M, Metzdorf N, Celli B (2017). "Impact and prevention of severe exacerbations of COPD: a review of the evidence". Int J Chron Obstruct Pulmon Dis. 12: 2891–2908. doi:10.2147/COPD.S139470. PMC 5638577. PMID 29062228.
- ^ a b Brightling C, Greening N (August 2019). "Airway inflammation in COPD: progress to precision medicine" (PDF). Eur Respir J. 54 (2). doi:10.1183/13993003.00651-2019. PMID 31073084. S2CID 149444134.
- ^ a b c d e Gold Report 2021, 페이지 54–58, 3장: 예방 및 유지관리 치료를 뒷받침하는 증거
- ^ Bai S, Zhao L (2021). "Imbalance Between Injury and Defense in the COPD Emphysematous Phenotype". Frontiers in Medicine. 8: 653332. doi:10.3389/fmed.2021.653332. PMC 8131650. PMID 34026786.
- ^ Kumar A, Mahajan A, Salazar EA, et al. (June 2021). "Impact of human immunodeficiency virus on pulmonary vascular disease". Glob Cardiol Sci Pract. 2021 (2): e202112. doi:10.21542/gcsp.2021.12. PMC 8272407. PMID 34285903.
- ^ Osadnik CR, McDonald CF, Holland AE (2014). "Clinical issues of mucus accumulation in COPD". Int J Chron Obstruct Pulmon Dis. 9: 301–2. doi:10.2147/COPD.S61797. PMC 3970915. PMID 24741301.
- ^ a b Silverman EK (February 2020). "Genetics of COPD". Annu Rev Physiol. 82: 413–431. doi:10.1146/annurev-physiol-021317-121224. PMC 7193187. PMID 31730394.
- ^ Nikolić MZ, Sun D, Rawlins EL (August 2018). "Human lung development: recent progress and new challenges". Development. 145 (16). doi:10.1242/dev.163485. PMC 6124546. PMID 30111617.
- ^ Smith BM, Traboulsi H, Austin JM, et al. (January 2018). "Human airway branch variation and chronic obstructive pulmonary disease". Proc Natl Acad Sci U S A. 115 (5): E974–E981. doi:10.1073/pnas.1715564115. PMC 5798356. PMID 29339516.
- ^ a b Bailey KL, Samuelson DR, Wyatt TA (February 2021). "Alcohol use disorder: A pre-existing condition for COVID-19?". Alcohol. 90: 11–17. doi:10.1016/j.alcohol.2020.10.003. PMC 7568767. PMID 33080339.
- ^ a b Smith P, Jeffers LA, Koval M (November 2019). "Effects of different routes of endotoxin injury on barrier function in alcoholic lung syndrome". Alcohol. 80: 81–89. doi:10.1016/j.alcohol.2018.08.007. PMC 6613986. PMID 31278041.
- ^ Arvers P (December 2018). "[Alcohol consumption and lung damage: Dangerous relationships]". Rev Mal Respir (in French). 35 (10): 1039–1049. doi:10.1016/j.rmr.2018.02.009. PMID 29941207.
- ^ Slovinsky WS, Romero F, Sales D, Shaghaghi H, Summer R (November 2019). "The involvement of GM-CSF deficiencies in parallel pathways of pulmonary alveolar proteinosis and the alcoholic lung". Alcohol. 80: 73–79. doi:10.1016/j.alcohol.2018.07.006. PMC 6592783. PMID 31229291.
- ^ a b Ward H (2012). Oxford Handbook of Epidemiology for Clinicians. Oxford University Press. pp. 289–290. ISBN 978-0-19-165478-7.
- ^ Rennard S (2013). Clinical management of chronic obstructive pulmonary disease (2nd ed.). Informa Healthcare. p. 23. ISBN 978-0-8493-7588-0.
- ^ Sharma A, Barclay J (2010). COPD in primary care. Radcliffe Pub. p. 9. ISBN 978-1-84619-316-3.
- ^ Han MK, Martinez FJ (September 2020). "Host, Gender, and Early-Life Factors as Risks for Chronic Obstructive Pulmonary Disease". Clin Chest Med. 41 (3): 329–337. doi:10.1016/j.ccm.2020.06.009. PMC 7993923. PMID 32800188.
- ^ Amaral AF, Strachan DP, Burney PG, Jarvis DL (May 2017). "Female Smokers Are at Greater Risk of Airflow Obstruction Than Male Smokers. UK Biobank" (PDF). American Journal of Respiratory and Critical Care Medicine. 195 (9): 1226–1235. doi:10.1164/rccm.201608-1545OC. hdl:10044/1/45106. PMID 28075609. S2CID 9360093.
- ^ "Tobacco". www.who.int. Retrieved 12 July 2021.
- ^ Savran O, Ulrik CS (2018). "Early life insults as determinants of chronic obstructive pulmonary disease in adult life". Int J Chron Obstruct Pulmon Dis. 13: 683–693. doi:10.2147/COPD.S153555. PMC 5834168. PMID 29520136.
- ^ Patel, MP; Khangoora, VS; Marik, PE (October 2019). "A Review of the Pulmonary and Health Impacts of Hookah Use". Annals of the American Thoracic Society. 16 (10): 1215–1219. doi:10.1513/AnnalsATS.201902-129CME. PMID 31091965.
- ^ a b c d Chatkin JM, Zabert G, Zabert I, Chatkin G, Jiménez-Ruiz CA, de Granda-Orive JI, Buljubasich D, Solano Reina S, Figueiredo A, Ravara S, Riesco Miranda JA, Gratziou C (September 2017). "Lung Disease Associated With Marijuana Use". Arch Bronconeumol. 53 (9): 510–515. doi:10.1016/j.arbres.2017.03.019. PMID 28483343.
- ^ Underner M, Urban T, Perriot J, Peiffer G, Harika-Germaneau G, Jaafari N (December 2018). "[Spontaneous pneumothorax and lung emphysema in cannabis users]". Rev Pneumol Clin (in French). 74 (6): 400–415. doi:10.1016/j.pneumo.2018.06.003. PMID 30420278.
- ^ Martinasek MP, McGrogan JB, Maysonet A (November 2016). "A Systematic Review of the Respiratory Effects of Inhalational Marijuana". Respir Care. 61 (11): 1543–1551. doi:10.4187/respcare.04846. PMID 27507173.
- ^ Ribeiro LI, Ind PW (October 2016). "Effect of cannabis smoking on lung function and respiratory symptoms: a structured literature review". Npj Prim Care Respir Med. 26: 16071. doi:10.1038/npjpcrm.2016.71. PMC 5072387. PMID 27763599.
- ^ "Access to clean fuels and technologies for cooking". Our World in Data. Retrieved 15 February 2020.
- ^ a b c d e f g h Pirozzi C, Scholand MB (July 2012). "Smoking cessation and environmental hygiene". The Medical Clinics of North America. 96 (4): 849–67. doi:10.1016/j.mcna.2012.04.014. PMID 22793948.
- ^ Halbert RJ, Natoli JL, Gano A, et al. (September 2006). "Global burden of COPD: systematic review and meta-analysis". The European Respiratory Journal. 28 (3): 523–32. doi:10.1183/09031936.06.00124605. PMID 16611654.
- ^ Hopper T (2014). Mosby's Pharmacy Technician – E-Book: Principles and Practice. Elsevier Health Sciences. p. 610. ISBN 9780323292450.
- ^ Barnes PJ, Drazen JM, Rennard SI, Thomson NC, eds. (2009). "Relationship between cigarette smoking and occupational exposures". Asthma and COPD: Basic Mechanisms and Clinical Management. Academic. p. 464. ISBN 978-0-12-374001-4.
- ^ a b Foreman MG, Campos M, Celedón JC (July 2012). "Genes and chronic obstructive pulmonary disease". The Medical Clinics of North America. 96 (4): 699–711. doi:10.1016/j.mcna.2012.02.006. PMC 3399759. PMID 22793939.
- ^ Brode SK, Ling SC, Chapman KR (September 2012). "Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease". CMAJ. 184 (12): 1365–71. doi:10.1503/cmaj.111749. PMC 3447047. PMID 22761482.
- ^ a b c d e Reilly JJ, Silverman EK, Shapiro SD (2011). "Chronic Obstructive Pulmonary Disease". In Longo D, Fauci A, Kasper D, Hauser S, Jameson J, Loscalzo J (eds.). Harrison's Principles of Internal Medicine (18th ed.). McGraw Hill. pp. 2151–9. ISBN 978-0-07-174889-6.
- ^ Maselli DJ, Bhatt SP, Anzueto A, et al. (August 2019). "Clinical Epidemiology of COPD: Insights From 10 Years of the COPDGene Study". Chest. 156 (2): 228–238. doi:10.1016/j.chest.2019.04.135. PMC 7198872. PMID 31154041.
- ^ Capron T, Bourdin A, Perez T, Chanez P (June 2019). "COPD beyond proximal bronchial obstruction: phenotyping and related tools at the bedside" (PDF). Eur Respir Rev. 28 (152). doi:10.1183/16000617.0010-2019. PMID 31285287.
- ^ Kumar, Vinay; Abbas, Abul K.; Aster, Jon C. (2018). Robbins basic pathology (Tenth ed.). Philadelphia, Pennsylvania. pp. 498–502. ISBN 9780323353175.
- ^ a b D'Ascanio M, Viccaro F, Calabrò N, Guerrieri G, Salvucci C, Pizzirusso D, Mancini R, De Vitis C, Pezzuto A, Ricci A (2020). "Assessing Static Lung Hyperinflation by Whole-Body Plethysmography, Helium Dilution, and Impulse Oscillometry System (IOS) in Patients with COPD". Int J Chron Obstruct Pulmon Dis. 15: 2583–2589. doi:10.2147/COPD.S264261. PMC 7585810. PMID 33116475.
- ^ Lo Bello F, Ieni A, Hansbro PM, et al. (May 2020). "Role of the mucins in pathogenesis of COPD: implications for therapy". Expert Rev Respir Med. 14 (5): 465–483. doi:10.1080/17476348.2020.1739525. hdl:10453/139160. PMID 32133884. S2CID 212416323.
- ^ a b Higham A, Quinn AM, Cançado JE, Singh D (March 2019). "The pathology of small airways disease in COPD: historical aspects and future directions". Respir Res. 20 (1): 49. doi:10.1186/s12931-019-1017-y. PMC 6399904. PMID 30832670.
- ^ a b Calverley PM, Koulouris NG (January 2005). "Flow limitation and dynamic hyperinflation: key concepts in modern respiratory physiology". The European Respiratory Journal. 25 (1): 186–99. doi:10.1183/09031936.04.00113204. PMID 15640341.
- ^ Currie GP (2010). ABC of COPD (2nd ed.). Wiley-Blackwell, BMJ Books. p. 32. ISBN 978-1-4443-2948-3.
- ^ O'Donnell DE (April 2006). "Hyperinflation, dyspnea, and exercise intolerance in chronic obstructive pulmonary disease". Proceedings of the American Thoracic Society. 3 (2): 180–4. doi:10.1513/pats.200508-093DO. PMID 16565429. S2CID 20644418.
- ^ Cooper CB (October 2006). "The connection between chronic obstructive pulmonary disease symptoms and hyperinflation and its impact on exercise and function". The American Journal of Medicine. 119 (10 Suppl 1): 21–31. doi:10.1016/j.amjmed.2006.08.004. PMID 16996896.
- ^ a b c "Chronic obstructive pulmonary disease - NICE Pathways". pathways.nice.org.uk. Retrieved 29 June 2021.
- ^ a b c d Qaseem A, Wilt TJ, Weinberger SE, et al. (August 2011). "Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society". Ann Intern Med. 155 (3): 179–91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710. S2CID 18830625.
- ^ a b Young VB (2010). Blueprints medicine (5th ed.). Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 69. ISBN 978-0-7817-8870-0.
- ^ a b c 국립 보건 임상 우수 연구소. 임상 가이드라인 101: 만성폐쇄성폐질환. 2010년 6월 런던.
- ^ Bailey KL (July 2012). "The importance of the assessment of pulmonary function in COPD". The Medical Clinics of North America. 96 (4): 745–52. doi:10.1016/j.mcna.2012.04.011. PMC 3998207. PMID 22793942.
- ^ Williams N (August 2017). "The MRC breathlessness scale". Occup Med (Lond). 67 (6): 496–497. doi:10.1093/occmed/kqx086. PMID 28898975.
- ^ a b "Chronic obstructive pulmonary disease (COPD) - Criteria BMJ Best Practice". bestpractice.bmj.com. Retrieved 2 July 2021.
- ^ "COPD Assessment Test (CAT)". American Thoracic Society. Archived from the original on December 3, 2013. Retrieved November 29, 2013.
- ^ "saber sheath trachea Search Radiopaedia.org". Radiopaedia. Retrieved 13 August 2021.
- ^ Vestbo J, Hurd SS, Agustí AG, et al. (February 2013). "Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary". American Journal of Respiratory and Critical Care Medicine. 187 (4): 350–352. doi:10.1164/rccm.201204-0596PP. PMID 22878278.
- ^ BTS COPD Consortium (2005). "Spirometry in practice – a practical guide to using spirometry in primary care". pp. 8–9. Archived from the original on 26 August 2014. Retrieved 25 August 2014.
- ^ a b c Policy Recommendations for Smoking Cessation and Treatment of Tobacco Dependence. World Health Organization. 2003. pp. 15–40. ISBN 978-92-4-156240-9. Archived from the original on 2008-09-15.
- ^ Jiménez-Ruiz CA, Fagerström KO (March 2013). "Smoking cessation treatment for COPD smokers: the role of counselling". Monaldi Archives for Chest Disease. 79 (1): 33–7. doi:10.4081/monaldi.2013.107. PMID 23741944.
- ^ a b "Chronic obstructive pulmonary disease in over 16s: diagnosis and management Guidance and guidelines NICE". www.nice.org.uk. Retrieved 2018-06-05.
- ^ Kumar P, Clark M (2005). Clinical Medicine (6th ed.). Elsevier Saunders. pp. 900–1. ISBN 978-0-7020-2763-5.
- ^ a b Tønnesen P (March 2013). "Smoking cessation and COPD". European Respiratory Review. 22 (127): 37–43. doi:10.1183/09059180.00007212. PMID 23457163.
- ^ "Coping with cravings". nhs.uk. 27 April 2018. Retrieved 15 July 2021.
- ^ van Eerd EA, van der Meer RM, van Schayck OC, Kotz D (August 2016). "Smoking cessation for people with chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews (8): CD010744. doi:10.1002/14651858.CD010744.pub2. PMC 6400424. PMID 27545342.
- ^ Smith BK, Timby NE (2005). Essentials of nursing : care of adults and children. Lippincott Williams & Wilkins. p. 338. ISBN 978-0-7817-5098-1.
- ^ Rom WN, Markowitz SB, eds. (2007). Environmental and occupational medicine (4th ed.). Wolters Kluwer/Lippincott Williams & Wilkins. pp. 521–2. ISBN 978-0-7817-6299-1.
- ^ "Wet cutting". Health and Safety Executive. Archived from the original on December 3, 2013. Retrieved November 29, 2013.
- ^ George RB (2005). Chest medicine : essentials of pulmonary and critical care medicine (5th ed.). Lippincott Williams & Wilkins. p. 172. ISBN 978-0-7817-5273-2.
- ^ a b c d e f g h i j Vestbo J, Hurd SS, Agustí AG, et al. (February 2013). "Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary". American Journal of Respiratory and Critical Care Medicine. 187 (4): 347–65. doi:10.1164/rccm.201204-0596PP. PMID 22878278.
- ^ Gold Report 2021, 페이지 80–83, 4장: 안정적인 COPD 관리
- ^ Howcroft M, Walters EH, Wood-Baker R, Walters JA (December 2016). "Action plans with brief patient education for exacerbations in chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 12: CD005074. doi:10.1002/14651858.CD005074.pub4. PMC 6463844. PMID 27990628.
- ^ Lenferink A, Brusse-Keizer M, van der Valk PD, et al. (August 2017). "Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 2017 (8): CD011682. doi:10.1002/14651858.CD011682.pub2. PMC 6483374. PMID 28777450.
- ^ Jolliffe DA, Greenberg L, Hooper RL, et al. (April 2019). "Vitamin D to prevent exacerbations of COPD: systematic review and meta-analysis of individual participant data from randomised controlled trials". Thorax. 74 (4): 337–345. doi:10.1136/thoraxjnl-2018-212092. PMID 30630893.
- ^ a b c d e f g h i Decramer M, Janssens W, Miravitlles M (April 2012). "Chronic obstructive pulmonary disease". Lancet. 379 (9823): 1341–51. CiteSeerX 10.1.1.1000.1967. doi:10.1016/S0140-6736(11)60968-9. PMC 7172377. PMID 22314182.
- ^ Walters JA, Tan DJ, White CJ, Gibson PG, Wood-Baker R, Walters EH (September 2014). "Systemic corticosteroids for acute exacerbations of chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 9 (9): CD001288. doi:10.1002/14651858.CD001288.pub4. PMID 25178099.
- ^ Walters JA, Tan DJ, White CJ, Wood-Baker R (March 2018). "Different durations of corticosteroid therapy for exacerbations of chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 2018 (3): CD006897. doi:10.1002/14651858.CD006897.pub4. PMC 6494402. PMID 29553157.
- ^ a b Vollenweider DJ, Frei A, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA (October 2018). "Antibiotics for exacerbations of chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 2018 (10): CD010257. doi:10.1002/14651858.CD010257.pub2. PMC 6517133. PMID 30371937.
- ^ Mackay AJ, Hurst JR (July 2012). "COPD exacerbations: causes, prevention, and treatment". The Medical Clinics of North America. 96 (4): 789–809. doi:10.1016/j.mcna.2012.02.008. PMID 22793945.
- ^ "Fluoroquinolone Antibacterial Drugs: Drug Safety Communication – FDA Advises Restricting Use for Certain Uncomplicated Infections". FDA. 12 May 2016. Archived from the original on 16 May 2016. Retrieved 16 May 2016.
- ^ Oliveira EP, Medeiros Junior P (2020). "Palliative care in pulmonary medicine". J Bras Pneumol (in Portuguese). 46 (3): e20190280. doi:10.36416/1806-3756/e20190280. PMC 7572288. PMID 32638839.
- ^ Wilson ME, Dobler CC, Morrow AS, et al. (February 2020). "Association of Home Noninvasive Positive Pressure Ventilation With Clinical Outcomes in Chronic Obstructive Pulmonary Disease: A Systematic Review and Meta-analysis". JAMA. 323 (5): 455–465. doi:10.1001/jama.2019.22343. PMC 7042860. PMID 32016309.
- ^ Almadhoun, Khaled; Sharma, Sandeep (2021). "Bronchodilators". StatPearls. StatPearls Publishing. PMID 30085570. Retrieved 27 July 2021.
- ^ a b Gold Report 2021, 페이지 49, 3장: 예방 및 유지관리 치료를 뒷받침하는 증거
- ^ Farne HA, Cates CJ (October 2015). "Long-acting beta2-agonist in addition to tiotropium versus either tiotropium or long-acting beta2-agonist alone for chronic obstructive pulmonary disease" (PDF). The Cochrane Database of Systematic Reviews (10): CD008989. doi:10.1002/14651858.CD008989.pub3. PMC 4164463. PMID 26490945.
- ^ Oba Y, Keeney E, Ghatehorde N, Dias S, et al. (Cochrane Airways Group) (December 2018). "Dual combination therapy versus long-acting bronchodilators alone for chronic obstructive pulmonary disease (COPD): a systematic review and network meta-analysis". The Cochrane Database of Systematic Reviews. 2018 (12): CD012620. doi:10.1002/14651858.CD012620.pub2. PMC 6517098. PMID 30521694.
- ^ "Recommendations Chronic obstructive pulmonary disease in over 16s: diagnosis and management Guidance NICE". www.nice.org.uk. Retrieved 1 August 2021.
- ^ a b Cave AC, Hurst MM (May 2011). "The use of long acting β₂-agonists, alone or in combination with inhaled corticosteroids, in chronic obstructive pulmonary disease (COPD): a risk-benefit analysis". Pharmacology & Therapeutics. 130 (2): 114–43. doi:10.1016/j.pharmthera.2010.12.008. PMID 21276815.
- ^ Spencer S, Karner C, Cates CJ, Evans DJ (December 2011). Spencer S (ed.). "Inhaled corticosteroids versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease" (PDF). The Cochrane Database of Systematic Reviews (12): CD007033. doi:10.1002/14651858.CD007033.pub3. PMC 6494276. PMID 22161409.
- ^ Wang J, Nie B, Xiong W, Xu Y (April 2012). "Effect of long-acting beta-agonists on the frequency of COPD exacerbations: a meta-analysis". Journal of Clinical Pharmacy and Therapeutics. 37 (2): 204–11. doi:10.1111/j.1365-2710.2011.01285.x. PMID 21740451. S2CID 45383688.
- ^ a b Geake JB, Dabscheck EJ, Wood-Baker R, Cates CJ (January 2015). "Indacaterol, a once-daily beta2-agonist, versus twice-daily beta₂-agonists or placebo for chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 1: CD010139. doi:10.1002/14651858.CD010139.pub2. PMC 6464646. PMID 25575340.
- ^ Decramer ML, Hanania NA, Lötvall JO, Yawn BP (2013). "The safety of long-acting β2-agonists in the treatment of stable chronic obstructive pulmonary disease". International Journal of Chronic Obstructive Pulmonary Disease. 8: 53–64. doi:10.2147/COPD.S39018. PMC 3558319. PMID 23378756.
- ^ Nannini LJ, Lasserson TJ, Poole P (September 2012). Nannini LJ (ed.). "Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 9 (9): CD006829. doi:10.1002/14651858.CD006829.pub2. PMC 4170910. PMID 22972099.
- ^ Horita N, Goto A, Shibata Y, Ota E, Nakashima K, Nagai K, Kaneko T (February 2017). "Long-acting muscarinic antagonist (LAMA) plus long-acting beta-agonist (LABA) versus LABA plus inhaled corticosteroid (ICS) for stable chronic obstructive pulmonary disease (COPD)". The Cochrane Database of Systematic Reviews. 2: CD012066. doi:10.1002/14651858.CD012066.pub2. PMC 6464543. PMID 28185242.
- ^ Zheng Y, Zhu J, Liu Y, et al. (November 2018). "Triple therapy in the management of chronic obstructive pulmonary disease: systematic review and meta-analysis". BMJ. 363: k4388. doi:10.1136/bmj.k4388. PMC 6218838. PMID 30401700.
- ^ a b Karner C, Chong J, Poole P (July 2014). "Tiotropium versus placebo for chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews (7): CD009285. doi:10.1002/14651858.CD009285.pub3. PMID 25046211.
- ^ Cheyne L, Irvin-Sellers MJ, White J (September 2015). "Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews (9): CD009552. doi:10.1002/14651858.CD009552.pub3. PMID 26391969.
- ^ Singh S, Loke YK, Enright P, Furberg CD (January 2013). "Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications". Thorax. 68 (1): 114–6. doi:10.1136/thoraxjnl-2011-201275. PMID 22764216.
- ^ Jones P (April 2013). "Aclidinium bromide twice daily for the treatment of chronic obstructive pulmonary disease: a review". Advances in Therapy. 30 (4): 354–68. doi:10.1007/s12325-013-0019-2. PMID 23553509. S2CID 3530290.
- ^ Cazzola M, Page CP, Matera MG (June 2013). "Aclidinium bromide for the treatment of chronic obstructive pulmonary disease". Expert Opinion on Pharmacotherapy. 14 (9): 1205–14. doi:10.1517/14656566.2013.789021. PMID 23566013. S2CID 24973904.
- ^ a b Ni H, Soe Z, Moe S (September 2014). "Aclidinium bromide for stable chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 9 (9): CD010509. doi:10.1002/14651858.CD010509.pub2. PMID 25234126.
- ^ Ni H, Htet A, Moe S (June 2017). "Umeclidinium bromide versus placebo for people with chronic obstructive pulmonary disease (COPD)". The Cochrane Database of Systematic Reviews. 2017 (6): CD011897. doi:10.1002/14651858.CD011897.pub2. PMC 6481854. PMID 28631387.
- ^ Ismaila AS, Huisman EL, Punekar YS, Karabis A (2015). "Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis". International Journal of Chronic Obstructive Pulmonary Disease. 10: 2495–517. doi:10.2147/COPD.S92412. PMC 4655912. PMID 26604738.
- ^ a b Chen H, Sun J, Huang Q, Liu Y, Yuan M, Ma C, Yan H (2021). "Inhaled Corticosteroids and the Pneumonia Risk in Patients With Chronic Obstructive Pulmonary Disease: A Meta-analysis of Randomized Controlled Trials". Front Pharmacol. 12: 691621. doi:10.3389/fphar.2021.691621. PMC 8275837. PMID 34267661.
- ^ Chinet T, Dumoulin J, Honore I, Braun JM, Couderc LJ, Febvre M, Mangiapan G, Maurer C, Serrier P, Soyez F, Terrioux P, Jebrak G (December 2016). "[The place of inhaled corticosteroids in COPD]". Revue des Maladies Respiratoires. 33 (10): 877–891. doi:10.1016/j.rmr.2015.11.009. PMID 26831345.
- ^ "Recommendations Chronic obstructive pulmonary disease in over 16s: diagnosis and management Guidance NICE". www.nice.org.uk. Retrieved 2019-10-30.
- ^ Mammen MJ, Sethi S (2012). "Macrolide therapy for the prevention of acute exacerbations in chronic obstructive pulmonary disease". Polskie Archiwum Medycyny Wewnetrznej. 122 (1–2): 54–9. doi:10.20452/pamw.1134. PMID 22353707. S2CID 35183033.
- ^ a b Herath SC, Normansell R, Maisey S, Poole P (October 2018). "Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD)". The Cochrane Database of Systematic Reviews. 2018 (10): CD009764. doi:10.1002/14651858.CD009764.pub3. PMC 6517028. PMID 30376188.
- ^ Simoens S, Laekeman G, Decramer M (May 2013). "Preventing COPD exacerbations with macrolides: a review and budget impact analysis". Respiratory Medicine. 107 (5): 637–48. doi:10.1016/j.rmed.2012.12.019. PMID 23352223.
- ^ Poole P, Sathananthan K, Fortescue R (May 2019). "Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 5: CD001287. doi:10.1002/14651858.CD001287.pub6. PMC 6527426. PMID 31107966.
- ^ "Erdosteine". NICE. Retrieved 20 July 2021.
- ^ Meldrum OW, Chotirmall SH (June 2021). "Mucus, Microbiomes and Pulmonary Disease". Biomedicines. 9 (6): 675. doi:10.3390/biomedicines9060675. PMC 8232003. PMID 34199312.
- ^ "Bronchitis". nhs.uk. 17 October 2017.
- ^ a b Khor YH, Renzoni EA, Visca D, McDonald CF, Goh NS (July 2019). "Oxygen therapy in COPD and interstitial lung disease: navigating the knowns and unknowns". ERJ Open Res. 5 (3). doi:10.1183/23120541.00118-2019. PMC 6745413. PMID 31544111.
- ^ Ekström M, Ahmadi Z, Bornefalk-Hermansson A, Abernethy A, Currow D (November 2016). "Oxygen for breathlessness in patients with chronic obstructive pulmonary disease who do not qualify for home oxygen therapy". The Cochrane Database of Systematic Reviews. 11: CD006429. doi:10.1002/14651858.CD006429.pub3. PMC 6464154. PMID 27886372.
- ^ Jindal SK (2013). Chronic Obstructive Pulmonary Disease. Jaypee Brothers Medical. p. 139. ISBN 978-93-5090-353-7.
- ^ a b O'Driscoll BR, Howard LS, Davison AG (October 2008). "BTS guideline for emergency oxygen use in adult patients". Thorax. 63 Suppl 6 (6): vi1-68. doi:10.1136/thx.2008.102947. PMID 18838559.
- ^ "Pulmonary Rehabilitation". medlineplus.gov. Retrieved 9 September 2021.
- ^ McNamara RJ, McKeough ZJ, McKenzie DK, Alison JA (December 2013). "Water-based exercise training for chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews (12): CD008290. doi:10.1002/14651858.CD008290.pub2. PMID 24353107.
- ^ Menadue C, Piper AJ, van 't Hul AJ, Wong KK (May 2014). "Non-invasive ventilation during exercise training for people with chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews (5): CD007714. doi:10.1002/14651858.CD007714.pub2. PMID 24823712.
- ^ a b McKeough ZJ, Velloso M, Lima VP, Alison JA (November 2016). "Upper limb exercise training for COPD". The Cochrane Database of Systematic Reviews. 11: CD011434. doi:10.1002/14651858.CD011434.pub2. PMC 6464968. PMID 27846347.
- ^ Lalwani, Lajwanti; Mishra, Gyanshankar; Gaidhane, Abhay; Quazi, Zahiruddin (2020). "Short Term Effect of Pursed Lip Breathing Technique in Stable Patients of Chronic Obstructive Pulmonary Diseases (COPD)". European Journal of Molecular & Clinical Medicine. 7 (2): 1342-1347. Retrieved 4 November 2021.
- ^ a b Ngai SP, Jones AY, Tam WW (June 2016). "Tai Chi for chronic obstructive pulmonary disease (COPD)". The Cochrane Database of Systematic Reviews (6): CD009953. doi:10.1002/14651858.CD009953.pub2. PMID 27272131.
- ^ Thomas MJ, Simpson J, Riley R, Grant E (June 2010). "The impact of home-based physiotherapy interventions on breathlessness during activities of daily living in severe COPD: a systematic review". Physiotherapy. 96 (2): 108–19. doi:10.1016/j.physio.2009.09.006. PMID 20420957.
- ^ a b Wearing J, Beaumont S, Forbes D, Brown B, Engel R (February 2016). "The Use of Spinal Manipulative Therapy in the Management of Chronic Obstructive Pulmonary Disease: A Systematic Review". Journal of Alternative and Complementary Medicine. 22 (2): 108–14. doi:10.1089/acm.2015.0199. PMC 4761829. PMID 26700633.
- ^ Simonelli, C.; Vitacca, M.; Vignoni, M.; Ambrosino, N.; Paneroni, M. (2019). "Effectiveness of manual therapy in COPD: A systematic review of randomised controlled trials". Pulmonology. 25 (4): 236–247. doi:10.1016/j.pulmoe.2018.12.008. ISSN 2531-0437. PMID 30738792.
- ^ a b Osadnik CR, McDonald CF, Jones AP, Holland AE (March 2012). "Airway clearance techniques for chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 3 (3): CD008328. doi:10.1002/14651858.CD008328.pub2. PMID 22419331.
- ^ Ferreira IM, Brooks D, White J, Goldstein R (December 2012). Ferreira IM (ed.). "Nutritional supplementation for stable chronic obstructive pulmonary disease". The Cochrane Database of Systematic Reviews. 12: CD000998. doi:10.1002/14651858.CD000998.pub3. PMID 23235577.
- ^ Van Geffen WH, Douma WR, Slebos DJ, Kerstjens HA (29 August 2016). "Bronchodilators delivered by nebuliser versus inhalers for lung attacks of chronic obstructive pulmonary disease". Cochrane Database of Systematic Reviews. 29 (8): 011826. doi:10.1002/14651858.cd011826. hdl:11370/95fc3e6e-ebd0-440f-9721-489729f80add. Archived from the original on 13 September 2016.
- ^ Wise R. "Chronic Obstructive Pulmonary Disease (COPD) – Pulmonary Disorders – Merck Manuals Professional Edition". Merck Manuals Professional Edition. Archived from the original on 28 December 2016. Retrieved 16 December 2016.
- ^ a b Gold Report 2021, 페이지 92–96, 4장: 안정적인 COPD 관리
- ^ van Geffen, WH; Slebos, DJ; Herth, FJ; et al. (April 2019). "Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis". The Lancet. Respiratory Medicine. 7 (4): 313–324. doi:10.1016/S2213-2600(18)30431-4. PMID 30744937.
- ^ a b Duffy S, Marchetti N, Criner GJ (September 2020). "Surgical Therapies for Chronic Obstructive Pulmonary Disease". Clin Chest Med. 41 (3): 559–566. doi:10.1016/j.ccm.2020.06.011. PMID 32800206. S2CID 221145423.
- ^ a b "1 Recommendations Endobronchial valve insertion to reduce lung volume in emphysema Guidance NICE". www.nice.org.uk. Retrieved 7 July 2021.
- ^ Klooster K, Slebos DJ (May 2021). "Endobronchial Valves for the Treatment of Advanced Emphysema". Chest. 159 (5): 1833–1842. doi:10.1016/j.chest.2020.12.007. PMC 8129734. PMID 33345947.
- ^ Welling JB, Slebos DJ (August 2018). "Lung volume reduction with endobronchial coils for patients with emphysema". J Thorac Dis. 10 (Suppl 23): S2797–S2805. doi:10.21037/jtd.2017.12.95. PMC 6129816. PMID 30210833.
- ^ Valipour, Arschang (1 January 2017). "Bronchoscopic Thermal Vapour Ablation: Hot Stuff to Treat Emphysema Patients!". Archivos de Bronconeumología (English Edition). 53 (1): 1–2. doi:10.1016/j.arbr.2016.11.009. PMID 27916315. Retrieved 3 July 2021.
- ^ Mortensen, Jann; Berg, Ronan M.G. (1 January 2019). "Lung Scintigraphy in COPD". Seminars in Nuclear Medicine. 49 (1): 16–21. doi:10.1053/j.semnuclmed.2018.10.010. PMID 30545511. Retrieved 4 July 2021.
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. Archived from the original on 2009-11-11. Retrieved Nov 11, 2009.
- ^ a b Murray CJ, Vos T, Lozano R, et al. (December 2012). "Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2197–223. doi:10.1016/S0140-6736(12)61689-4. PMID 23245608. S2CID 205967479.
- ^ Vos T, Flaxman AD, Naghavi M, et al. (December 2012). "Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2163–96. doi:10.1016/S0140-6736(12)61729-2. PMC 6350784. PMID 23245607.
- ^ Gold Report 2021, 페이지 26–33, 2장: 진단 및 평가.
- ^ a b "COPD prevalence". NICE. Retrieved 18 July 2021.
- ^ Rycroft CE, Heyes A, Lanza L, Becker K (2012). "Epidemiology of chronic obstructive pulmonary disease: a literature review". International Journal of Chronic Obstructive Pulmonary Disease. 7: 457–94. doi:10.2147/COPD.S32330. PMC 3422122. PMID 22927753.
- ^ "CDC - Basics About COPD - Chronic Obstructive Pulmonary Disease (COPD)". www.cdc.gov. 9 June 2021. Retrieved 18 July 2021.
- ^ a b Torio CM, Andrews RM (2006). "National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2011: Statistical Brief #160". Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. PMID 24199255. Archived from the original on 2017-03-14.
- ^ "The top 10 causes of death". www.who.int.
- ^ a b c d e f Petty TL (2006). "The history of COPD". International Journal of Chronic Obstructive Pulmonary Disease. 1 (1): 3–14. doi:10.2147/copd.2006.1.1.3. PMC 2706597. PMID 18046898.
- ^ a b Wright JL, Churg A (2008). "Pathologic Features of Chronic Obstructive Pulmonary Disease: Diagnostic Criteria and Differential Diagnosis" (PDF). In Fishman A, Elias J, Fishman J, Grippi M, Senior R, Pack A (eds.). Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. pp. 693–705. ISBN 978-0-07-164109-8.
- ^ Woolcock A (1984). "The Search for Words to Describe the Bad Blowers". Chest. 85 (6): 73S–74S. doi:10.1378/chest.85.6_Supplement.73S.
- ^ Waldbott GL (1965). A struggle with Titans. Carlton Press. p. 6.
- ^ Fishman AP (May 2005). "One hundred years of chronic obstructive pulmonary disease". American Journal of Respiratory and Critical Care Medicine. 171 (9): 941–8. doi:10.1164/rccm.200412-1685OE. PMID 15849329.
- ^ "November is National COPD Awareness Month NHLBI, NIH". www.nhlbi.nih.gov. Retrieved 21 July 2021.
- ^ a b Lomborg B (2013). Global problems, local solutions : costs and benefits. Cambridge University Press. p. 143. ISBN 978-1-107-03959-9.
- ^ Bloom D (2011). The Global Economic Burden of Noncommunicable Diseases (PDF). World Economic Forum. p. 24. Archived (PDF) from the original on 2015-02-04.
- ^ a b Vestbo J, Hurd SS, Agustí AG, et al. (February 2013). "Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary". American Journal of Respiratory and Critical Care Medicine. 187 (4). doi:10.1164/rccm.201204-0596PP. PMID 22878278.
- ^ "NIH study shows hyaluronan is effective in treating chronic lung disease". National Institutes of Health (NIH). 1 February 2021. Retrieved 7 August 2021.
- ^ Poggi C, Mantovani S, Pecoraro Y, Carillo C, Bassi M, D'Andrilli A, Anile M, Rendina EA, Venuta F, Diso D (November 2018). "Bronchoscopic treatment of emphysema: an update". J Thorac Dis. 10 (11): 6274–6284. doi:10.21037/jtd.2018.10.43. PMC 6297441. PMID 30622803.
- ^ "A Prospective Safety and Feasibility Study of the RejuvenAir™ System Metered Cryospray Therapy for Chronic Bronchitis Patients". clinicaltrials.gov. 25 January 2021. Retrieved 16 August 2021.
- ^ Chen YT, Miao K, Zhou L, Xiong WN (June 2021). "Stem cell therapy for chronic obstructive pulmonary disease". Chin Med J (Engl). 134 (13): 1535–1545. doi:10.1097/CM9.0000000000001596. PMC 8280064. PMID 34250959.
- ^ "First UK patients get pioneering new treatment for serious lung disease Royal Brompton & Harefield hospitals". www.rbht.nhs.uk. Retrieved 4 August 2021.
- ^ Gøtzsche PC, Johansen HK (September 2016). "Intravenous alpha-1 antitrypsin augmentation therapy for treating patients with alpha-1 antitrypsin deficiency and lung disease". The Cochrane Database of Systematic Reviews. 9: CD007851. doi:10.1002/14651858.CD007851.pub3. PMC 6457738. PMID 27644166.
- ^ Campos MA, Geraghty P, Holt G, et al. (August 2019). "The Biological Effects of Double-Dose Alpha-1 Antitrypsin Augmentation Therapy. A Pilot Clinical Trial". Am J Respir Crit Care Med. 200 (3): 318–326. doi:10.1164/rccm.201901-0010OC. PMC 6680306. PMID 30965011.
- ^ Nambiar S, Bong How S, Gummer J, Trengove R, Moodley Y (February 2020). "Metabolomics in chronic lung diseases". Respirology. 25 (2): 139–148. doi:10.1111/resp.13530. PMID 30907495.
- ^ McLean S, Nurmatov U, Liu JL, Pagliari C, Car J, Sheikh A (July 2011). "Telehealthcare for chronic obstructive pulmonary disease" (PDF). The Cochrane Database of Systematic Reviews (7): CD007718. doi:10.1002/14651858.CD007718.pub2. PMID 21735417.
- ^ Cheng J, Eroglu A (June 2021). "The Promising Effects of Astaxanthin on Lung Diseases". Adv Nutr. 12 (3): 850–864. doi:10.1093/advances/nmaa143. PMC 8166543. PMID 33179051.
- ^ Akers RM, Denbow DM (2008). Anatomy and Physiology of Domestic Animals. Wiley. p. 852. ISBN 978-1-118-70115-7.
- ^ Churg A, Wright JL (2007). "Animal models of cigarette smoke-induced chronic obstructive lung disease". Models of Exacerbations in Asthma and COPD. Contributions to Microbiology. 14. pp. 113–25. doi:10.1159/000107058. ISBN 978-3-8055-8332-9. PMID 17684336.
- ^ "Recurrent Airway Obstruction in Horses - Respiratory System". Veterinary Manual. Retrieved 7 July 2021.
- ^ Miller MS, Tilley LP, Smith FW (January 1989). "Cardiopulmonary disease in the geriatric dog and cat". The Veterinary Clinics of North America. Small Animal Practice. 19 (1): 87–102. doi:10.1016/S0195-5616(89)50007-X. PMID 2646821.
인용된 작품
- Global Strategy for Prevention, Diagnosis and Management of COPD: 2021 Report (PDF). Global Initiative for Chronic Obstructive Lung Disease. 25 November 2020. Retrieved 28 June 2021.
외부 링크
| 위키미디어 커먼즈에는 만성폐쇄성폐질환과 관련된 미디어가 있다. |
| 분류 | |
|---|---|
| 외부 자원 |