멜라놉신
Melanopsin| OPN4 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||||||||||||||||||
| 별칭 | OPN4, MOP, opsin 4 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 606665 MGI: 1353425 호몰로진: 69152 GeneCard: OPN4 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 10: 86.65 – 86.67Mb | Chr 14: 34.59 – 34.6Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
멜라놉신(Melanopsin)은 opsin이라고 불리는 빛에 민감한 망막 단백질의 더 큰 계열에 속하는 광전자 증배제의 일종으로, 유전자 Opn4에 의해 암호화된다.[5] 포유류 망막에는 두 가지 추가 범주의 opsin이 있는데, 둘 다 각각 로드와 콘 광수용체 세포에서 로도신(rohodopsin)과 포토신(type I, II, III)의 시각적 이미지 형성에 관여한다.
인간에게 멜라노신은 본질적으로 감광성 망막강변세포(ipRGC)에서 발견된다.[6] 그것은 또한 쥐와 영장류의 홍채에서도 발견된다.[7] 멜라놉신은 쥐, 암피옥수스, 그리고 다른 화음에서도 발견된다.[8] ipRGC는 단파장(파란색) 가시광선의 흡수에 특히 민감한 광수용체 세포로 포유류에서 중추 "신체시계"로도 알려진 초파장핵(SCN)이라고 불리는 뇌의 영역으로 직접 정보를 전달한다.[9] 멜라놉신은 다른 기능뿐만 아니라 순환 리듬의 설정에도 중요한 비영상 형성 역할을 한다. Opn4 유전자의 돌연변이는 계절적 영향장애(SAD)와 같은 임상장애로 이어질 수 있다.[10] 한 연구에 따르면 멜라노핀은 인간의 뇌(망막하이포탈라믹관 바깥쪽)의 18개 부위에서 세포내, 세밀한 패턴으로 대뇌피질, 소뇌피질, 그리고 주로 핵이 아닌 뉴런 소마에서 발견되었다고 한다.[11] 멜라놉신은 인간의 원추로도 표현된다. 그러나 인간 원추의 0.11%~0.55%만이 멜라노핀을 발현하고 있으며 망막의 말초부위에서만 발견된다.[12] 인간 말초 망막은 4가지 다른 광전자 등급에 의해 가장 잘 설명되는 높은 강도에서 빛을 감지한다.[13]
디스커버리
멜라놉신은 1998년 이그나시오 프로벤치오에 의해 아프리카 발톱 개구리의 멜라노포레스 즉, 빛에 민감한 피부 세포에서 새로운 오핀으로 처음 발견되었다.[14] 1년 후, 연구원들은 이미지 형성에 관여하는 세포인 막대나 원뿔이 없는 쥐들이 여전히 밝은 어두운 순환에 빠져있다는 것을 발견했다.[15] 이러한 관찰로 인해 외측 망막에 위치한 로드나 콘(cones)이 순환 인큐베이터에 필요하지 않으며, 포유류 눈에 제3종류의 광수용체가 존재한다는 결론에 도달했다.[5] 프로벤치오와 동료들은 2000년에 멜라노핀이 생쥐 망막, 특히 갱리온 세포에도 존재하며 비시각적 광자 지각 업무를 매개한다는 것을 발견했다.[16] 멜라노핀은 Opn4에 의해 다양한 유기체에서 직교로 암호화되어 있는 것으로 밝혀졌다.[5]
이들 망막강변세포는 고립된 상태에서도 빛에 반응해 선천적으로 감광성이 강한 것으로 밝혀져 본질적으로 감광성이 강한 망막강변세포(ipRGC)라는 이름이 붙었다.[17] 그것들은 이미 알려진 막대들과 원추들 외에 포유류 망막의 제3종류의 광수용체 세포들을 구성하며, 순환 광전자 증강에 빛을 투입하는 주요 통로인 것으로 나타났다.[16] 사실, 멜라노신 색소는 맹인 쥐가 빛에 반응하는 데 필요했기 때문에 포유류에서 빛 주기에 멜라노신 색소가 관여할 수 있다는 것이 나중에 사치다난다 팬더와 동료들에 의해 증명되었다.[18]
종 분포
포유류에는 Opn4과의 한 가지에서 파생된 Opn4m라는 직교 멜라노핀 유전자가 있으며, 약 50~55% 보존되어 있다.[19] 그러나 닭과 제브라피쉬를 포함한 비매란 척추동물들은 약 3억 6천만년 전에 Opn4m에서 갈라진 뚜렷한 혈통을 가진 것으로 보이는 멜라놉신 유전자인 Opn4x의 또 다른 버전을 가지고 있다.[20] 포유류는 진화 초기에 Opn4x라는 유전자를 비교적 일찍 잃어버려 광감소 능력이 전반적으로 저하되었다. 이 사건은 야행성 포유류가 진화하던 시기에 발생했다는 사실로 설명할 수 있다고 생각된다.[19]
구조
인간 멜라노신 유전자 opn4는 samer hattar와 동료들이 연구한 바와 같이 내유전자 망막 내 RGC의 1~2%만을 구성하는 ipRGCs로 표현된다.[9] 이 유전자는 약 11.8 kb에 걸쳐 있으며 10번 염색체의 긴 팔 부분에 매핑되어 있다. 이 유전자는 9개의 인트론과 10개의 엑손들을 포함하고 있는데, 보통 다른 인간의 수술에서 발견되는 4개에서 7개의 엑손과 비교된다.[16] 비인종 척추동물에서 멜라노신(Melanopsin)은 망막 세포의 더 넓은 부분 집합체뿐만 아니라 눈의 홍채 근육, 깊은 뇌 부위, 소나무샘, 피부 등 망막 밖의 감광성 구조에서도 발견된다.[19] Opn4의 파라로그에는 OPN1LW, OPN1MW, RHO, OPN3가 포함되며 게놈 프로젝트에 의해 발견되었다.[21]
멜라놉신은 다른 모든 동물 opsin(예: 로도신)과 마찬가지로 G-단백질 결합수용체(GPCR) 계열의 일원이다. 멜라노신 단백질은 혈장막에 7개의 알파 나선형, N-단자영역, C-단자영역에 통합되어 있다.[22] 특히 아미노산 염기서열과 하류 신호 캐스케이드 등에서 척추동물 포토피그먼트보다 무척추동물의 opsin과 훨씬 닮았다.[17] 무척추동물 opsins와 마찬가지로 gq 계열의 G단백질을 통해 내적인 광이소머레이즈[23] 활동과 신호를 갖는 포토피그먼트인 것으로 보인다.
함수
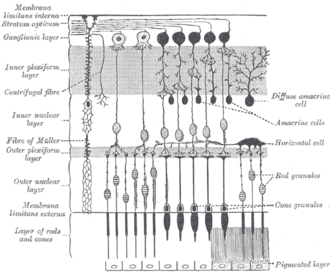
막대나 원뿔과 [24]같은 멜라노신 성분이 함유된 갱도세포는 빛과 어둠의 적응력을 모두 보여주며, 최근 빛 노출의 역사에 따라 민감도를 조절한다.[25] 그러나 로드와 콘은 이미지, 패턴, 움직임, 색의 수신을 담당하지만 멜라노신 함유 ipRGC는 빛의 존재에 대한 뇌와 신체의 다양한 반사 반응에 기여한다.[17]
멜라노핀의 생리학적 빛 검출에 대한 증거가 생쥐에서 실험되었다. 일반적으로 감광성이 없는 마우스 세포선 Neuro-2a는 인간의 멜라노핀을 첨가하여 빛에 민감하게 된다. 광자폰스는 단파장 광선(피크 흡수 ~479nm)에 선택적으로 민감하며,[26][27] 색상으로 긴 파장으로 이동하는 내성 광이소머레이즈 재생 기능이 있다.[28]
멜라노신 광수용체는 다양한 파장에 민감하며 480나노미터 전후의 푸른 빛 파장에서 최고 빛 흡수에 도달한다.[29] 다른 빛의 파장은 최적의 480 nm에서 멀어질수록 효율이 저하되는 멜라노신 신호 시스템을 작동시킨다. 예를 들어 445nm(가시적 스펙트럼에서 더 클로스~보랏빛) 정도의 짧은 파장은 480nm의 빛보다 멜라노신 광수용체 자극에 절반 정도 효과적이다.[29]
주로 야행성인 일부 홍채의 홍채에 있는 멜라노신(Melanopsin)은 홍채가 빛에 노출되면 홍채를 닫는다. 이 국소 동공 빛 반사작용(PLR)은 홍채가 멜라노핀을 발현함에도 불구하고 영장류에는 없다.[7]
메커니즘
적절한 주파수를 가진 빛이 눈에 들어오면 본질적으로 감광성 망막세포(ipRGC)에 포함된 멜라노핀을 활성화시켜 작용 전위를 촉발한다. 이러한 뉴런 전기 신호는 뉴런 축을 통해 중뇌의 올리버 전구핵(OPN)이라 불리는 번데기 조절의 중심과 같은 특정 뇌 표적으로 이동한다. 결과적으로 ipRGCs에서 멜라토닌의 자극은 동공 수축과 소나무샘에서 멜라토닌 방출 억제와 같은 빛에 대한 행동 및 생리학적 반응을 매개한다.[30][31] 포유류 망막의 ipRGC는 시상하부의 초경련핵(SCN)에 투영되는 망막의 한 종단이다. 초거대성 핵은 때때로 뇌의 "마스터 시계"[32]로 묘사되는데, 이는 그것이 순환 리듬을 유지시키기 때문이다. 그리고 ipRGCs에서 SCN에 이르는 신경 신호는 내부 순환 리듬에서 태양의 상승과 설정에 이르는 것이다.[9] SCN은 또한 레티노하이포탈라믹 트랙을 통해 로드와 콘의 입력을 받기 때문에 포유류 망막에 있는 세 가지 감광성 세포 유형(rods, cones, ipRGC)의 정보는 모두 SCN(SCN) SCN으로 전송된다.[33]
멜라노신 함유 갱리온 세포는 신경전달물질 글루탐산염과 뇌하수체 아데닐라아제 활성 폴리펩타이드(PACAP)를 액손 단자에서 방출함으로써 이러한 표적들에 영향을 미치는 것으로 생각된다.[34] 멜라노신 함유 갱리온 세포는 또한 이러한 경로에 입력을 더할 수 있는 봉과 원추로부터 입력을 받는다.
순환 리듬에 미치는 영향
멜라놉신은 포유류에서 순환기 리듬의 광전자 증진에 중요한 역할을 한다. 광학적으로 연결된 유기체는 지구의 태양 주기인 대략 24시간 주기로 그 활동을 조정했다.[35] 포유류에서 축소를 발현하는 멜라노신(Melanopsin)은 레티노히포탈라믹관(RHT)을 통해 초거대성핵(SCN)을 목표로 한다.[9]
포유류에서 눈은 빛 신호를 뇌로 전달하는 주된 감광성 기관이다. 그러나, 시각장애인들은 빛에 대한 의식적인 인식이 없음에도 불구하고 여전히 환경적인 빛-어두운 주기에 빠져들 수 있다. 한 연구는 피실험자를 밝은 빛에 장기간 노출시키고 멜라토닌 농도를 측정했다. 멜라토닌은 시각장애가 없는 인간뿐만 아니라 시각장애 참여자에서도 억제되어, 시각장애에도 불구하고 서클라디아계가 사용하는 광통로가 기능적으로 온전하다는 것을 시사했다.[36] 따라서, 의사들은 눈이 순환기 심장박동기의 광증강화에 중요한 역할을 하기 때문에 더 이상 맹인 환자의 자궁내막술이나 태어날 때 눈을 제거하는 것을 연습하지 않는다.
로드만, 콘만, 또는 로드와 콘이 모두 부족한 돌연변이 종의 생쥐에서, 모든 종의 생쥐는 여전히 환경에서 변화하는 가벼운 자극에 빠져있지만, 제한된 응답으로, 로드와 콘은 순환 광전자 증강에 필요하지 않으며 포유류의 눈은 r에 필요한 또 다른 광전자 증분을 가지고 있어야 한다는 것을 암시한다.일주 시계의 자기 [15]계발
멜라노신 녹아웃 생쥐는 광증강도를 감소시킨다. 멜라노신(Melanopsin)을 정상적으로 발현한 야생형 생쥐와 비교했을 때, 멜라노신-null 생쥐(Opn4 -/-)[18]에서 광유발상변동(light-induced phase shift in motion activity)의 결손이 눈에 띄었다. 이 멜라노신 결핍 쥐들은 비록 정상보다 더 느리지만 여전히 변화하는 환경 자극에 이끌릴 수 있었기 때문에, 그들의 순환 리듬을 완전히 잃지 않았다.[37] 이는 멜라노핀이 인텐테인먼트에는 충분하지만 정상적인 광증강 활동을 위해서는 다른 광광물질과 함께 작용해야 함을 시사했다. 로드리스, 콘리스, 멜라노신리스였던 트리플 뮤턴트 생쥐는 서커디안 리듬에서 완전한 손실을 나타내므로 광증강에는 로도신, 포토신, 멜라노신 등 이 광수용체에 있는 세 가지 광광다이렉트 모두 필요하다.[38] 따라서 포유류의 광증강 경로에 있는 세 광전자 사이에는 기능적 중복성이 있다. 단 한 개의 광전자만 삭제한다고 해서 환경광암 주기에 관여하는 유기체의 능력이 제거되는 것은 아니지만, 반응의 강도가 감소하는 것은 아니다.
규정
멜라놉신(Melanopsin)은 기능을 비활성화하는 방법으로 세포내 카복시 꼬리에 인산화를 겪는다. 멜라노핀은 다른 오핀에 비해 유난히 긴 카복시 꼬리를 갖고 있어 인산화 가능성이 있는 세린과 트레오닌 아미노산 부위가 37개 들어 있다.[39] 그러나 7개의 아미노산으로 이루어진 군집은 제브라피쉬 멜라노핀을 비활성화하기에 충분하다. 이러한 부위는 멜라노핀이 빛에 노출되면 인산성이 저하되며, 로도핀을 규제하는 부위와 독특하다.[40] 그것들은 ipRGC에서 칼슘 이온에 대한 적절한 대응을 위해 중요하다; 특히 세린-381과 세린-398에서 기능 인산화 부위의 부족은 전압에 의한 칼슘 이온 채널이 열렸을 때 빛에 의한 칼슘 이온 유입에 대한 세포의 반응을 감소시킨다.[41]
유전자 Opn4로 볼 때 도파민(DA)은 ipRGC에서 멜라노신 mRNA를 조절하는 요인이다.[42]
임상적 유의성
비이미지 형성 시력에서 멜라노신 역할을 발견한 것이 광유전학의 성장으로 이어졌다. 이 분야는 망막염 색소증, 당뇨병 등 인간의 눈병 치료 등 임상 응용 분야에서 가능성을 보여 왔다.[43] Opn4, P10L의 오감 돌연변이는 계절적 영향장애(SAD) 환자의 5%에 관련되어 있다.[10] 이는 겨울에 이용 가능한 빛의 감소로 인해 우울한 생각을 경험하는 조건이다. 게다가 멜라노신 기반의 수용체는 편두통 통증과 연관되어 있다.[44]
시력 회복
퇴행성 안질환 망막염 색소증(RP) 환자에 대한 광유전자 치료에서 멜라노핀의 역할에 대한 연구가 최근 진행 중인데 망막변화가 있는 생쥐의 눈에 기능성 멜라노핀을 재도입하면 번데기 광 반사작용(PLR)이 회복된다.[45] 이 같은 쥐들은 또한 빛 자극과 어두운 자극을 구별할 수 있었고 실내 빛에 대한 민감도를 증가시켰다. 이 쥐들에 의해 입증된 높은 민감도는 인간과 인간의 눈 질환에 적용될 수 있는 시력 회복의 가능성을 보여준다.[43][46]
수면/웨이크 패턴 제어
멜라놉신은 수면 주기와 잠에서 깨는 것을 조절하는데 도움을 줄 수 있다. 츠네마츠와 동료들은 저혈당 오레신 뉴런에서 멜라노핀을 발현하는 유전자이전 생쥐를 만들었다. 푸른 빛의 짧은 4초 맥박(광섬유로 유도)으로, 유전자 변형 생쥐는 흔히 "깊은 수면"으로 알려진 느린파 수면(SWS)에서 오래 지속되는 깨어 있는 상태로 성공적으로 전환될 수 있었다. 파란 불빛을 끈 후, 하이포탈라믹 오렉신 뉴런은 수십 초 동안 활동을 보였다.[43][47] 로드와 콘은 빛에 의한 수면 개시에는 아무런 역할을 하지 않는 것으로 나타나 ipRGC와 멜라노핀을 구별한다. 이는 특히 고주파등(예: 푸른 빛)과 함께 인간의 ipRGC와 경계성 사이에 연관성이 있다는 강력한 증거를 제공한다. 따라서 멜라노신(Melanopsin)은 수면 주기 조절을 위한 치료 대상으로 사용할 수 있다.[48]
혈당 수치의 조절
2011년 예씨와 동료들이 발표한 논문에서 멜라노핀을 활용해 치료 환경에서 테스트한 광유전성 합성전사기를 만들어 제2형 당뇨병에 걸린 포유류의 혈당 수치를 조절하는 데 도움을 주는 융합 단백질인 Fc-글루카곤 유사펩타이드 1(Fc-GLP-1)을 생산했다. 연구진은 생쥐에게 멜라노신 유전자와 NFAT(활성 T세포의 핵인자) 촉진제 하에서 각각 관심 유전자를 포함한 2개의 벡터로 감염시킨 미세캡슐화된 유전자(transgenic hEK) 293세포를 피하 이식했다. 그들이 이중 열성 당뇨병 생쥐에서 Fc-GLP-1의 발현을 성공적으로 제어하고 이러한 생쥐에서 고혈당, 즉 고혈당 수치를 감소시켰다. 이는 제2형 당뇨병을 치료하기 위한 광유전적 도구로서 멜라노핀을 사용할 가능성을 보여준다.[43][49]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000122375 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000021799 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c Hankins MW, Peirson SN, Foster RG (January 2008). "Melanopsin: an exciting photopigment" (PDF). Trends in Neurosciences. 31 (1): 27–36. doi:10.1016/j.tins.2007.11.002. PMID 18054803. S2CID 1645433.
- ^ Provencio I, Warthen DM (2012). "Melanopsin, the photopigment of intrinsically photosensitive retinal ganglion cells". Wiley Interdisciplinary Reviews: Membrane Transport and Signaling. 1 (2): 228–237. doi:10.1002/wmts.29.
- ^ a b Xue T, Do MT, Riccio A, Jiang Z, Hsieh J, Wang HC, et al. (November 2011). "Melanopsin signalling in mammalian iris and retina". Nature. 479 (7371): 67–73. Bibcode:2011Natur.479...67X. doi:10.1038/nature10567. PMC 3270891. PMID 22051675.
- ^ Angueyra JM, Pulido C, Malagón G, Nasi E, Gomez MD (2012). "Melanopsin-expressing amphioxus photoreceptors transduce light via a phospholipase C signaling cascade". PLOS ONE. 7 (1): e29813. Bibcode:2012PLoSO...729813A. doi:10.1371/journal.pone.0029813. PMC 3250494. PMID 22235344.
- ^ a b c d Hattar S, Liao HW, Takao M, Berson DM, Yau KW (February 2002). "Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity". Science. 295 (5557): 1065–70. Bibcode:2002Sci...295.1065H. doi:10.1126/science.1069609. PMC 2885915. PMID 11834834.
- ^ a b Roecklein KA, Rohan KJ, Duncan WC, Rollag MD, Rosenthal NE, Lipsky RH, Provencio I (April 2009). "A missense variant (P10L) of the melanopsin (OPN4) gene in seasonal affective disorder". Journal of Affective Disorders. 114 (1–3): 279–85. doi:10.1016/j.jad.2008.08.005. PMC 2647333. PMID 18804284.
- ^ Nissilä J, Mänttäri S, Tuominen H, Särkioja T, Takala T, Saarela S, Timonen M (2012). "P-780 – The abundance and distribution of melanopsin (OPN4) protein in human brain". European Psychiatry. 27: 1–8. doi:10.1016/S0924-9338(12)74947-7. S2CID 82045589.
- ^ Dkhissi-Benyahya O, Rieux C, Hut RA, Cooper HM (April 2006). "Immunohistochemical evidence of a melanopsin cone in human retina". Investigative Ophthalmology & Visual Science. 47 (4): 1636–41. doi:10.1167/iovs.05-1459. PMID 16565403.
- ^ Horiguchi H, Winawer J, Dougherty RF, Wandell BA (January 2013). "Human trichromacy revisited". Proceedings of the National Academy of Sciences of the United States of America. 110 (3): E260-9. Bibcode:2013PNAS..110E.260H. doi:10.1073/pnas.1214240110. PMC 3549098. PMID 23256158.
- ^ Provencio I, Jiang G, De Grip WJ, Hayes WP, Rollag MD (January 1998). "Melanopsin: An opsin in melanophores, brain, and eye". Proceedings of the National Academy of Sciences of the United States of America. 95 (1): 340–5. Bibcode:1998PNAS...95..340P. doi:10.1073/pnas.95.1.340. PMC 18217. PMID 9419377.
- ^ a b Freedman MS, Lucas RJ, Soni B, von Schantz M, Muñoz M, David-Gray Z, Foster R (April 1999). "Regulation of mammalian circadian behavior by non-rod, non-cone, ocular photoreceptors". Science. 284 (5413): 502–4. Bibcode:1999Sci...284..502F. doi:10.1126/science.284.5413.502. PMID 10205061.
- ^ a b c Provencio I, Rodriguez IR, Jiang G, Hayes WP, Moreira EF, Rollag MD (January 2000). "A novel human opsin in the inner retina". The Journal of Neuroscience. 20 (2): 600–5. doi:10.1523/JNEUROSCI.20-02-00600.2000. PMC 6772411. PMID 10632589.
- ^ a b c Berson DM, Dunn FA, Takao M (February 2002). "Phototransduction by retinal ganglion cells that set the circadian clock". Science. 295 (5557): 1070–3. Bibcode:2002Sci...295.1070B. doi:10.1126/science.1067262. PMID 11834835. S2CID 30745140.
- ^ a b Panda S, Sato TK, Castrucci AM, Rollag MD, DeGrip WJ, Hogenesch JB, et al. (December 2002). "Melanopsin (Opn4) requirement for normal light-induced circadian phase shifting" (PDF). Science. 298 (5601): 2213–6. Bibcode:2002Sci...298.2213P. doi:10.1126/science.1076848. PMID 12481141. S2CID 20602808.
- ^ a b c Bellingham J, Chaurasia SS, Melyan Z, Liu C, Cameron MA, Tarttelin EE, et al. (July 2006). "Evolution of melanopsin photoreceptors: discovery and characterization of a new melanopsin in nonmammalian vertebrates". PLOS Biology. 4 (8): e254. doi:10.1371/journal.pbio.0040254. PMC 1514791. PMID 16856781.

- ^ Benton MJ (May 1990). "Phylogeny of the major tetrapod groups: morphological data and divergence dates". Journal of Molecular Evolution. 30 (5): 409–24. Bibcode:1990JMolE..30..409B. doi:10.1007/BF02101113. PMID 2111854. S2CID 35082873.
- ^ Baraas RC, Hagen LA, Dees EW, Neitz M (November 2012). "Substitution of isoleucine for threonine at position 190 of S-opsin causes S-cone-function abnormalities". Vision Research. 73: 1–9. doi:10.1016/j.visres.2012.09.007. PMC 3516400. PMID 23022137.
- ^ Tobin AB (March 2008). "G-protein-coupled receptor phosphorylation: where, when and by whom". British Journal of Pharmacology. 153 Suppl 1: S167-76. doi:10.1038/sj.bjp.0707662. PMC 2268057. PMID 18193069.
- ^ Panda S, Nayak SK, Campo B, Walker JR, Hogenesch JB, Jegla T (January 2005). "Illumination of the melanopsin signaling pathway". Science. 307 (5709): 600–4. Bibcode:2005Sci...307..600P. doi:10.1126/science.1105121. PMID 15681390. S2CID 22713904.
- ^ Feigl B, Zele AJ (August 2014). "Melanopsin-expressing intrinsically photosensitive retinal ganglion cells in retinal disease" (PDF). Optometry and Vision Science. 91 (8): 894–903. doi:10.1097/OPX.0000000000000284. PMID 24879087. S2CID 34057255.
- ^ Wong KY, Dunn FA, Berson DM (December 2005). "Photoreceptor adaptation in intrinsically photosensitive retinal ganglion cells". Neuron. 48 (6): 1001–10. doi:10.1016/j.neuron.2005.11.016. PMID 16364903.
- ^ Bailes HJ, Lucas RJ (May 2013). "Human melanopsin forms a pigment maximally sensitive to blue light (λmax ≈ 479 nm) supporting activation of G(q/11) and G(i/o) signalling cascades". Proceedings. Biological Sciences. 280 (1759): 20122987. doi:10.1098/rspb.2012.2987. PMC 3619500. PMID 23554393.
- ^ Berson DM (August 2007). "Phototransduction in ganglion-cell photoreceptors". Pflügers Archiv. 454 (5): 849–55. doi:10.1007/s00424-007-0242-2. PMID 17351786.
- ^ Melyan Z, Tarttelin EE, Bellingham J, Lucas RJ, Hankins MW (February 2005). "Addition of human melanopsin renders mammalian cells photoresponsive". Nature. 433 (7027): 741–5. Bibcode:2005Natur.433..741M. doi:10.1038/nature03344. PMID 15674244. S2CID 4426682.
- ^ a b Enezi J, Revell V, Brown T, Wynne J, Schlangen L, Lucas R (August 2011). "A "melanopic" spectral efficiency function predicts the sensitivity of melanopsin photoreceptors to polychromatic lights". Journal of Biological Rhythms. 26 (4): 314–23. doi:10.1177/0748730411409719. PMID 21775290. S2CID 22369861.
- ^ Markwell EL, Feigl B, Zele AJ (May 2010). "Intrinsically photosensitive melanopsin retinal ganglion cell contributions to the pupillary light reflex and circadian rhythm" (PDF). Clinical & Experimental Optometry. 93 (3): 137–49. doi:10.1111/j.1444-0938.2010.00479.x. PMID 20557555. S2CID 21778407.
- ^ Zaidi FH, Hull JT, Peirson SN, Wulff K, Aeschbach D, Gooley JJ, et al. (December 2007). "Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina". Current Biology. 17 (24): 2122–8. doi:10.1016/j.cub.2007.11.034. PMC 2151130. PMID 18082405.
- ^ Evans JA (July 2016). "Collective timekeeping among cells of the master circadian clock". The Journal of Endocrinology. 230 (1): R27-49. doi:10.1530/JOE-16-0054. PMC 4938744. PMID 27154335.
- ^ Reppert SM, Weaver DR (August 2002). "Coordination of circadian timing in mammals". Nature. 418 (6901): 935–41. Bibcode:2002Natur.418..935R. doi:10.1038/nature00965. PMID 12198538. S2CID 4430366.
- ^ Hannibal J, Fahrenkrug J (April 2004). "Target areas innervated by PACAP-immunoreactive retinal ganglion cells". Cell and Tissue Research. 316 (1): 99–113. doi:10.1007/s00441-004-0858-x. PMID 14991397. S2CID 24148323.
- ^ Allada R, Emery P, Takahashi JS, Rosbash M (2001). "Stopping time: the genetics of fly and mouse circadian clocks". Annual Review of Neuroscience. 24 (1): 1091–119. doi:10.1146/annurev.neuro.24.1.1091. PMID 11520929.
- ^ Czeisler CA, Shanahan TL, Klerman EB, Martens H, Brotman DJ, Emens JS, et al. (January 1995). "Suppression of melatonin secretion in some blind patients by exposure to bright light". The New England Journal of Medicine. 332 (1): 6–11. doi:10.1056/NEJM199501053320102. PMID 7990870.
- ^ Rollag MD, Berson DM, Provencio I (June 2003). "Melanopsin, ganglion-cell photoreceptors, and mammalian photoentrainment". Journal of Biological Rhythms. 18 (3): 227–34. doi:10.1177/0748730403018003005. PMID 12828280. S2CID 9034442.
- ^ Panda S, Provencio I, Tu DC, Pires SS, Rollag MD, Castrucci AM, et al. (July 2003). "Melanopsin is required for non-image-forming photic responses in blind mice". Science. 301 (5632): 525–7. Bibcode:2003Sci...301..525P. doi:10.1126/science.1086179. PMID 12829787. S2CID 37600812.
- ^ Blasic JR, Lane Brown R, Robinson PR (May 2012). "Light-dependent phosphorylation of the carboxy tail of mouse melanopsin". Cellular and Molecular Life Sciences. 69 (9): 1551–62. doi:10.1007/s00018-011-0891-3. PMC 4045631. PMID 22159583.
- ^ Blasic JR, Matos-Cruz V, Ujla D, Cameron EG, Hattar S, Halpern ME, Robinson PR (April 2014). "Identification of critical phosphorylation sites on the carboxy tail of melanopsin". Biochemistry. 53 (16): 2644–9. doi:10.1021/bi401724r. PMC 4010260. PMID 24678795.
- ^ Fahrenkrug J, Falktoft B, Georg B, Hannibal J, Kristiansen SB, Klausen TK (December 2014). "Phosphorylation of rat melanopsin at Ser-381 and Ser-398 by light/dark and its importance for intrinsically photosensitive ganglion cells (ipRGCs) cellular Ca2+ signaling". The Journal of Biological Chemistry. 289 (51): 35482–93. doi:10.1074/jbc.M114.586529. PMC 4271233. PMID 25378407.
- ^ Sakamoto K, Liu C, Kasamatsu M, Pozdeyev NV, Iuvone PM, Tosini G (December 2005). "Dopamine regulates melanopsin mRNA expression in intrinsically photosensitive retinal ganglion cells". The European Journal of Neuroscience. 22 (12): 3129–36. doi:10.1111/j.1460-9568.2005.04512.x. PMID 16367779. S2CID 21517576.
- ^ a b c d Koizumi A, Tanaka KF, Yamanaka A (January 2013). "The manipulation of neural and cellular activities by ectopic expression of melanopsin". Neuroscience Research. 75 (1): 3–5. doi:10.1016/j.neures.2012.07.010. PMID 22982474. S2CID 21771987.
- ^ Jennifer Couzin-Frankel (2010). "Why Light Makes Migraines Worse – ScienceNOW". Archived from the original on 31 July 2016. Retrieved 3 April 2011.
- ^ Busskamp V, Picaud S, Sahel JA, Roska B (February 2012). "Optogenetic therapy for retinitis pigmentosa". Gene Therapy. 19 (2): 169–75. doi:10.1038/gt.2011.155. PMID 21993174.
- ^ Lin B, Koizumi A, Tanaka N, Panda S, Masland RH (October 2008). "Restoration of visual function in retinal degeneration mice by ectopic expression of melanopsin". Proceedings of the National Academy of Sciences of the United States of America. 105 (41): 16009–14. Bibcode:2008PNAS..10516009L. doi:10.1073/pnas.0806114105. PMC 2572922. PMID 18836071.
- ^ Tsunematsu T, Tanaka KF, Yamanaka A, Koizumi A (January 2013). "Ectopic expression of melanopsin in orexin/hypocretin neurons enables control of wakefulness of mice in vivo by blue light". Neuroscience Research. 75 (1): 23–8. doi:10.1016/j.neures.2012.07.005. PMID 22868039. S2CID 207152803.
- ^ Lupi D, Oster H, Thompson S, Foster RG (September 2008). "The acute light-induction of sleep is mediated by OPN4-based photoreception" (PDF). Nature Neuroscience. 11 (9): 1068–73. doi:10.1038/nn.2179. hdl:11858/00-001M-0000-0012-DD96-A. PMID 19160505. S2CID 15941500.
- ^ Ye H, Daoud-El Baba M, Peng RW, Fussenegger M (June 2011). "A synthetic optogenetic transcription device enhances blood-glucose homeostasis in mice". Science. 332 (6037): 1565–8. Bibcode:2011Sci...332.1565Y. doi:10.1126/science.1203535. PMID 21700876. S2CID 6166189.
추가 읽기
- Rovere G, Nadal-Nicolás FM, Wang J, Bernal-Garro JM, García-Carrillo N, Villegas-Pérez MP, et al. (December 2016). "Melanopsin-Containing or Non-Melanopsin-Containing Retinal Ganglion Cells Response to Acute Ocular Hypertension With or Without Brain-Derived Neurotrophic Factor Neuroprotection". Investigative Ophthalmology & Visual Science. 57 (15): 6652–6661. doi:10.1167/iovs.16-20146. PMID 27930778.







