크로마토포레
Chromatophore
색소포체는 색을 내는 세포로, 그 중 많은 종류는 색소를 함유한 세포, 즉 세포군이며 양서류, 어류, 파충류, 갑각류, 두족류 등을 포함한 광범위한 동물에서 발견된다.대조적으로 포유류와 새들은 색소를 얻기 위해 멜라노사이트라고 불리는 종류의 세포를 가지고 있다.
색소포체는 발열성 동물에서 피부와 눈 색깔을 발생시키는 데 크게 기여하며 배아 발달 중 신경 파고에서 생성된다.성숙한 색소포체는 백색광 아래 색(더 적절하게 "후")을 기준으로 하위 분류로 분류된다: 크산토포레스(노란색), 홍색포자(빨간색), 이리도포자(반사/빨간색), 침색포자(흰색), 흑색포자(검은색/갈색), 시아노포자(파란색).대부분의 색소포체는 빛의 특정 파장을 흡수하는 색소를 함유하고 있지만, 침소포체와 이리도포체의 색상은 각각의 산란과 광학적 간섭 특성에 의해 생성된다.
어떤 종들은 색소를 변환시키고 색소포레 내에서 반사판의 방향을 바꾸는 메커니즘을 통해 빠르게 색을 바꿀 수 있다.흔히 위장술의 한 종류로 쓰이는 이 과정을 생리적 색 변화 또는 메타크로스라고 한다.[1]문어와 같은 두팔로포드는 이를 이루기 위해 근육에 의해 조절되는 복잡한 색소포레 기관을 가지고 있는 반면, 카멜레온과 같은 척추동물은 세포 신호 전달에 의해 비슷한 효과를 낸다.그러한 신호는 호르몬이나 신경전달물질일 수 있으며 기분, 온도, 스트레스 또는 지역 환경의 가시적 변화에 의해 시작될 수 있다.[citation needed]색소포체는 인간의 질병을 이해하기 위해 그리고 약물 발견의 도구로서 과학자들에 의해 연구된다.
인간발견
아리스토텔레스는 그의 역사 동물원에서 위장술과 신호전달 모두를 위해 색깔을 바꾸는 문어의 능력을 언급했다([2]BC 400년 전).
문어...그 먹이의 색깔을 그 먹이에 인접한 돌의 색깔처럼 보이게 함으로써 먹이를 찾는다. 그것은 또한 경고할 때에도 그렇게 한다.
1819년 이탈리아 과학 저널에서 무척추동물이 색소를 함유하고 있는 세포를 크로모포로로 묘사한 것은 지오제 산기오반니가 처음이다.[3]
찰스 다윈은 비글의 항해(1860년)에서 오징어의 색깔을 바꾸는 능력을 묘사했다.[4]
이 동물들은 또한 그들의 색깔을 바꾸는 아주 특별한 카멜레온 같은 힘에 의해 발견되는 것을 피한다.그들은 그들이 지나다니는 땅의 성질에 따라 그들의 색조를 변화시키는 것처럼 보인다: 깊은 물에 있을 때, 그들의 일반적인 색조는 갈색을 띤 자주색이었지만, 땅 위에 놓이거나 얕은 물에 있을 때, 이 어두운 색조는 노란색을 띤 녹색의 하나로 바뀌었다.좀더 주의 깊게 살펴본 그 색은 프랑스 회색이었는데, 밝은 노란색 점들이 무수히 많았으며, 이들 중 전자는 강도가 다양했다; 후자는 완전히 사라지고 돌아가면서 다시 나타났다.이러한 변화들은 히아신스 적색과 밤갈색 사이의 틴트에 따라 달라지는 구름이 계속해서 몸 위를 지나갈 정도로 영향을 미쳤다.어느 부분이든 약간의 갈바니즘의 충격을 받아 거의 검게 변했는데, 비슷한 효과가 있었지만, 그보다 적은 정도는 바늘로 피부를 긁어내면서 생성되었다.이 구름들, 혹은 불릴 수 있는 대로 붉게 물드는 여러 가지 색깔의 액체를 함유한 미세한 음낭의 대체적인 팽창과 수축에 의해 생성된다고 한다.
크로마토포레 분류
색소포레라는 용어는 냉혈 척추동물과 두족류 동물의 신경마루에서 유래한 색소내성 세포의 명칭으로 (상기오반니의 크로모포로에 따라) 채택되었다.단어 자체는 '색깔'을 뜻하는 그리스어 chroma(χρμμα)와 '거세'를 뜻하는 poros(φόρρςς)에서 유래했다.이와는 대조적으로, 새와 포유류에서 발견되는 색을 담당하는 세포에는 크로마토세(kytos, "cell"을 의미하는 kytos (κττος))라는 단어가 채택되었다.이러한 동물들에서는 오직 한 종류의 세포인 멜라노사이트만이 확인되었다.
색소포체는 외관에 따라 분류할 수 있을 만큼 충분히 이해된 것은 1960년대였다.이 분류 체계는 색소의 생화학이 세포가 어떻게 기능하는지에 대한 과학적 이해에 더 유용할 수 있음에도 불구하고 오늘날까지 지속되고 있다.[5]
색소를 생성하는 분자는 두 가지 뚜렷한 등급으로 분류된다: 바이오크롬과 구조 색상 또는 "체크롬"[6]이다.바이오크롬은 카로티노이드와 프테리딘과 같은 진정한 색소를 포함한다.이러한 색소는 백색광을 구성하는 가시광선 스펙트럼의 일부를 선택적으로 흡수하는 동시에 다른 파장을 관찰자의 눈에 도달하게 한다.구조 색상은 빛의 파장의 4분의 1을 중심으로 한 눈금을 가진 구조물에서 빛의 회절, 반사 또는 산란 등의 다양한 조합에 의해 생성된다.그러한 많은 구조물은 단순히 그 규모 때문에 빛의 파장(색)을 방해하고 다른 것을 전송하기 때문에 다른 방향에서 볼 때 다른 색을 만들어 발광하는 경우가 많다.[citation needed]
모든 색소 세포가 색소나 반사 구조를 포함하는 반면에(알비니즘에서와 같이 돌연변이가 발생한 경우는 제외), 색소 함유 세포가 모두 색소 세포인 것은 아니다.예를 들어, Hamm은 피의 붉은 외관을 담당하는 바이오크롬이다.주로 발생학적 발달 과정에서 형성되기보다는 유기체의 일생 동안 골수에서 생성되는 적혈구(에리스로시테스)에서 발견된다.따라서 적혈구는 색소세포로 분류되지 않는다.[citation needed]
크산토포레와 홍반포레
노란색 프테리딘 색소를 다량 함유한 크로마토포레스는 크산토포레라고 불리며, 주로 붉은색/오렌지색 카로티노이드 성분이 함유된 색소는 에리트로포레스로 불린다.[5]그러나 프테리딘과 카로티노이드 성분이 함유된 베시클레스는 같은 세포에서 발견되기도 하는데, 이 경우 전체 색상은 붉은 색소와 노란 색소의 비율에 따라 달라진다.[7]따라서 이러한 색소포레 유형의 구별이 항상 명확한 것은 아니다.
대부분의 크로마토포레스는 구아노신 3인산염으로부터 프테리딘을 생성할 수 있지만 크산토포레스는 노란 색소를 축적할 수 있는 보충 생화학적 경로를 가지고 있는 것으로 보인다.이와는 대조적으로 카로티노이드들은 대사되어 적혈구로 운반된다.이것은 카로틴이 제한되는 귀뚜라미의 식단에서 보통 녹색 개구리를 사육함으로써 처음 증명되었다.개구리의 식단에 카로틴이 없다는 것은 적색/오렌지 카로티노이드 색의 '필터'가 적색세포에 존재하지 않는다는 것을 의미했다.이것은 개구리를 초록색 대신 파랗게 보이게 만들었다.[8]
이리도포레와 여우원숭이
이리도포레(Iridophores)는 구아닌으로 만든 결정 화학 색소판을 이용해 빛을 반사하는 색소포레라고도 한다.[9]조명이 켜지면 빛의 건설적인 간섭 때문에 무지개빛 색상이 생성된다.어류 이리도포레스는 일반적으로 세포질 층으로 분리된 구아닌 판을 쌓아 현미경의 1차원 브라그 거울을 형성한다.방향과 광학 두께 모두 관찰된 색상의 성질을 결정한다.[10]이리도포레스는 바이오크롬을 컬러 필터로 사용함으로써 틴달(Tyndall) 또는 레일리(Rayleigh) 산란(Rayleigh)으로 알려진 광학적 효과를 생성해 밝은 청색이나 -녹색 색상을 만들어 낸다.[11]
이와 관련된 종류의 크로마토포레, 레우코포레는 일부 물고기, 특히 타페툼에서 발견된다.이리도포레스처럼 빛을 반사하기 위해 결정성 청진(흔히 구아닌)을 이용한다.이리도포레와 달리, 여우원숭이는 회절을 감소시키는 더 조직적인 결정체를 가지고 있다.백색 광원을 제공하면 백색 광채가 난다.크산토포레스나 홍반포레와 마찬가지로 어류에서도 이리도포레와 여우코르스의 구별이 항상 분명한 것은 아니지만, 일반적으로 이리도포레스는 무지개빛이나 금속색을 발생시키는 것으로 간주되는 반면, 이리도포레는 반사적인 흰색을 생성한다.[11]
멜라노포스
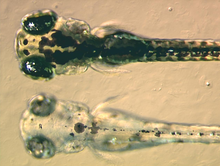
멜라노포레에는 멜라닌의 일종인 유멜라닌이 함유되어 있는데, 이 유멜라닌은 빛을 흡수하는 특성 때문에 흑갈색으로 보인다.멜라노솜이라 불리는 베실체에 포장되어 세포 전체에 분포한다.유멜라닌은 일련의 촉매 화학 반응에서 티로신에서 생성된다.일부 피롤링과 함께 디하이드록신돌과 디하이드록신돌-2-카복실산 단위를 함유한 복합화학물질이다.[12]멜라닌 합성의 핵심 효소는 티로시나아제다.이 단백질이 결함이 있을 때는 멜라닌이 생성되지 않아 특정 유형의 알비니즘이 발생할 수 없다.몇몇 양서류 종에는 유멜라닌과 함께 포장된 다른 색소들이 있다.예를 들어, 필로메두신 개구리의 멜라노포레스에서 소설 깊은 (와인) 적색 색소가 확인되었다.[13]아놀리스 그라하미와 같은 아놀리스 도마뱀의 일부 종은 특정 신호와 호르몬 변화에 반응하여 멜라노사이트를 사용하며, 밝은 청색, 갈색, 검은색에 이르는 색이 될 수 있다.이는 이후 유멜라닌 코어 주변에 축적되는 프테리딘 다이머인 프테로호딘으로 확인되었으며, 호주와 파푸아뉴기니의 다양한 나무개구리 종에도 존재한다.다른 덜 연구된 종들은 복잡한 멜라노포레 색소를 가지고 있을 가능성이 높지만, 그럼에도 불구하고 현재까지 연구된 대부분의 멜라노포레에는 유멜라닌이 독점적으로 포함되어 있는 것이 사실이다.[14]
인간은 피부, 머리카락, 눈 색깔을 생성하기 위해 멜라노포체와 동등한 포유류인 색소 세포의 한 종류만 가지고 있다.이러한 이유로, 그리고 세포의 많은 숫자와 대조적인 색상으로 인해 대개 그들을 시각화하기가 매우 쉽기 때문에, 멜라노포어는 단연코 가장 널리 연구된 색소포레이다.그러나 멜라노포레스의 생물학과 멜라노사이트의 생물학 사이에는 차이가 있다.멜라노사이트는 유멜라닌 외에도 파에오멜라닌이라는 노란색/빨간색소를 생성할 수 있다.[citation needed]
시아노포스
동물과 식물의 거의 모든 활기찬 블루스는 색소보다는 구조적인 색소에 의해 만들어진다.그러나, 신치로푸스 브란티누스의 어떤 종류는 시아노포레스라는 세포에 알려지지 않은 화학 구조의 시안 바이오크롬을 가지고 있다.[11]제한된 분류학 범위에서 특이하게 보이지만, 다른 어류와 양서류에는 시아노포어(더 이상 특이한 색소포어 종류도 있을 수 있다)가 있을 수 있다.예를 들어, 색소가 정의되지 않은 밝은 색깔의 색소포체는 독성 다트 개구리와 유리 개구리 모두에서 발견되며,[15] 에리트로-이리도포라 불리는 비정형 이분색 색소포체는 Phychromis diadema에 설명되어 왔다.[16]
색소 변환
많은 종들이 색소포체 내부의 색소를 번역할 수 있고, 이는 신체 색상의 명백한 변화를 초래한다.생리학적 색의 변화라고 알려진 이 과정은 멜라닌이 가장 어둡고 눈에 잘 띄는 색소이기 때문에 멜라노포레스에서 가장 널리 연구되고 있다.상대적으로 진피가 얇은 대부분의 종에서, 피부 멜라노포체는 평평한 경향이 있고 넓은 표면적을 덮는다.그러나 성인 파충류처럼 피부층이 두꺼운 동물에서는 피부 멜라노포체가 다른 색소포체와 3차원 단위를 형성하는 경우가 많다.이러한 피부 색소포레 단위(DCU)는 가장 위쪽의 크산토포레 또는 적색포도레 층, 그 다음에는 이리도포레 층, 마지막으로 이리도포레를 덮는 공정이 있는 바구니 모양의 멜라노포레 층으로 구성된다.[17]
두 종류의 멜라노포레 모두 생리학적 색채 변화에 중요하다.평평한 피부 멜라노포체는 종종 다른 색소포체 위에 덧씌워지기 때문에 색소가 세포 전체에 분산되면 피부는 어두워 보인다.색소가 세포의 중앙을 향해 집적되면 다른 색소체의 색소는 빛에 노출되고 피부는 색소를 띠게 된다.마찬가지로 DCUs에서 멜라닌이 집적된 후에는 이리도포레 층에서 산란된 빛의 크산토포레(노란색) 필터링을 통해 피부가 녹색으로 나타난다.멜라닌의 분산에는 빛이 더 이상 흩어지지 않고 피부가 검게 보인다.다른 생체 색소도 색소 변환이 가능하기 때문에 여러 가지 색소 유형을 가진 동물들은 분절 효과를 잘 활용함으로써 화려한 피부색을 연출할 수 있다.[18][19]
빠른 색소 변환의 제어와 역학은 많은 다른 종들, 특히 양서류와 텔레ost 어류에서 잘 연구되어 왔다.[11][20]이 과정은 호르몬이나 뉴런 통제 하에 있을 수 있다는 것이 증명되었고 많은 종류의 뼈 어류의 경우 색소포체는 가시광선, 자외선 복사, 온도, pH, 화학 물질 등과 같은 환경 자극에 직접적으로 반응할 수 있다.[21]색소를 변환시키는 것으로 알려진 신경화학물질은 멜라노포레스 표면에 있는 그것의 수용체를 통해 노르아드레날린을 포함한다.[22]번역을 조절하는 데 관여하는 주요 호르몬은 각각 뇌하수체, 소나무선, 시상하부에서 주로 생성되는 멜라노코틴, 멜라토닌, 멜라닌 농축 호르몬(MCH)으로 보인다.이 호르몬들은 또한 피부의 세포들에 의해 파라시린 방식으로 생성될 수도 있다.멜라노포레 표면에서 호르몬은 특정 G단백질 결합 수용체를 활성화시켜 신호를 세포로 변환시키는 것으로 나타났다.멜라노코르틴은 색소의 분산을 초래하는 반면 멜라토닌과 MCH는 집산을 초래한다.[23]
물고기와[24] 개구리에서는 멜라노코틴, MCH, 멜라토닌 수용체가 다수 확인되었으며,[25][26] 여기에는 인간의 피부와 머리카락 색깔을 조절하는 것으로 알려진 멜라노코틴 수용체 MC1R의 호몰로뉴가 포함된다.[27]멜라닌 분산을 위해 제브라피쉬에서 MC1R이 필요하다는 것이 입증되었다.[28]세포 내부에서는 주기적인 아데노신 단인산염(cAMP)이 색소 변환의 중요한 두 번째 전달자로 나타났다.cAMP는 아직 완전히 이해되지 않은 메커니즘을 통해 단백질 키나아제 A와 같은 다른 단백질에 영향을 주어 미세관 및 미세필름을 따라 음소체가 포함된 색소를 운반하는 분자 모터를 구동시킨다.[29][30][31]
배경 적응
대부분의 물고기, 파충류, 양서류는 환경의 변화에 대응하여 제한된 생리학적 색 변화를 겪는다.배경 적응이라고 알려진 이러한 종류의 위장술은 거의 즉각적인 환경의 색조를 모방하기 위해 피부 톤을 약간 어둡게 하거나 밝게 하는 것으로 가장 흔하게 나타난다.배경 적응과정이 시력에 의존하고 있다는 것이 증명되었다(동물이 그것에 적응하기 위해서는 환경을 볼 수 있어야 할 필요가 있어 보인다).[32] 그리고 멜라노포레스에서의 멜라닌 번역이 색변화의 주요 요소라는 것이 증명되었다.[23]카멜레온과 아놀레온과 같은 몇몇 동물들은 매우 빠르게 많은 다른 색들을 발생시킬 수 있는 고도로 발달된 배경 적응 반응을 가지고 있다.그들은 단순히 그들의 환경을 모방하기 보다는 온도, 기분, 스트레스 수준, 사회적 단서에 반응하여 색깔을 바꾸는 능력을 적응시켰다.
개발
척추동물의 배아 발달 동안, 색소포체는 신경 관의 여백에서 발생하는 세포의 쌍극인 신경 파고에서 생성되는 여러 종류의 세포 중 하나이다.이 세포들은 먼 거리를 이동하는 능력을 가지고 있어 색소포체가 피부, 눈, 귀, 뇌를 포함한 신체의 많은 장기를 채울 수 있게 한다.어류 멜라노포레스와 이리도포레스는 부드러운 근육 조절 단백질[칼포닌]과 칼데스몬을 함유하고 있는 것으로 밝혀졌다.[33]신경의 볏을 파도에 남겨둔 채, 색소포체는 진피를 통해 등측방향 경로를 취하여 기저 라미나의 작은 구멍을 통해 외측방향 경로로 들어가거나, 솜과 신경관 사이의 복강경로를 취한다.이것의 예외는 눈의 망막색소침착 상피의 흑색상피다.이것들은 신경의 파고에서 나온 것이 아니다.대신 신경관을 밖으로 내밀면 시신경이 생성되고, 그 결과 망막이 형성된다.[citation needed]
다발성 크로마토포레 전구세포(크롬토바스라고 함)가 언제 어떻게 딸 아형으로 발전하는지는 연구가 진행 중인 분야다.예를 들어 제브라피쉬 배아에서는 수정 후 3일이 지나도록 성인 물고기에서 발견되는 각각의 세포 등급인 멜라노포레스, 크산토포레스, 이리도포레스 등이 이미 존재한다고 알려져 있다.돌연변이 생선을 이용한 연구는 키트, 삭스10, mitf와 같은 전사 인자가 색소포레 분화를 제어하는 데 중요하다는 것을 입증했다.[34]만약 이 단백질들이 결함이 있다면, 색소포체는 지역적으로 혹은 완전히 존재하지 않을 수 있으며, 이로 인해 유교적 장애가 발생할 수 있다.
실용적 응용
색소포체는 응용 연구에 쓰이기도 한다.예를 들어, 제브라피쉬 애벌레는 크롬포레스가 어떻게 조직화하고 의사소통하는지를 연구하기 위해 이용된다. 성인 물고기에서 볼 수 있는 규칙적인 수평 줄무늬 패턴을 정확하게 생성하기 위해서 말이다.[35]이것은 진화적 발달 생물학 분야에서 패터닝을 이해하는 데 유용한 모델 시스템으로 보여진다.크로마토포레 생물학은 흑색종과 알비니즘을 포함한 인간의 상태나 질병을 모형화하는 데도 이용되어 왔다.최근 멜라노포레 특유의 황금 제브라피쉬 변종인 Slc24a5를 담당한 유전자가 피부색과 강한 상관관계가 있는 인간과 동등한 유전자를 가진 것으로 나타났다.[36]
특정한 시각적 결함을 가진 동물들이 빛 환경에 적응하지 못하기 때문에 색소포체는 냉혈종에서 실명의 생물학적 지표로도 사용된다.[32]멜라노포레스에서 색소 변환을 매개하는 수용체의 인간 호몰로게이션은 식욕 억제, 태닝 등의 과정에 관여하는 것으로 생각되어 약물의 매력적인 표적이 된다.[26]따라서 제약회사들은 아프리카 발톱 개구리의 멜라노포체를 이용한 잠재적 생체 활성 화합물을 신속하게 식별하기 위한 생물학적 분석법을 개발했다.[37]다른 과학자들은 멜라노포스를 바이오센서로 사용하는 기술과 [38]빠른 질병 감지를 위한 기술을 개발했다(백일해독소가 물고기 멜라노포체의 색소 집적을 막는다는 발견에 기초함).[39]주로 갑오징어처럼 물체를 거의 보이지 않게 만들 수 있는 활동적인 위장술의 한 종류로서, 색소포레 매개 색상 변경의 잠재적인 군사 적용이 제안되었다.[40][41]
두팔로포드 크로마토포레스

콜로이드 세팔로포드(문어, 오징어, 오징어, 오징어 포함)는 다양한 밝은 색상과 무늬를 생성하면서 색깔을 빠르게 변화시키기 위해 사용하는 복잡한 다세포 기관을 가지고 있다.각각의 염색체 단위는 단일 염색체 세포와 수많은 근육, 신경, 활, 피복 세포로 구성되어 있다.[42]색소 세포 안에서는 색소 과립이 시토탄성 천식이라고 불리는 탄성낭에 둘러싸여 있다.색깔을 바꾸기 위해 동물은 근육 수축에 의해 천골의 형태나 크기를 왜곡하고, 그 투명성, 반사성 또는 불투명성을 변화시킨다.이는 세포 내의 색소성 빈실을 번역하는 것이 아니라, 천골의 모양이 바뀐다는 점에서 어류, 양서류, 파충류에서 사용되는 메커니즘과 다르다.그러나 비슷한 효과를 얻는다.
문어와 대부분의 오징어는[43] 색소체를 복잡하고 굴절된 색소 표시장치에서 작동시킬 수 있으며, 이로 인해 다양한 색소 도식이 빠르게 변화한다.색소포체를 조작하는 신경은 뇌에 각각 조절하는 색소포체와 이형화된 패턴으로 위치하는 것으로 생각된다.이는 색상 변화 패턴이 기능적으로 뉴런 활성화 패턴과 일치한다는 것을 의미한다.이것은 뉴런들이 반복 신호 캐스케이드에서 활성화되면서, 색깔의 변화를 관찰할 수 있는 이유를 설명할 수 있을 것이다.[44]카멜레온처럼, 두족류 동물들도 사회적 상호작용을 위해 생리학적 색의 변화를 이용한다.그들은 또한 뛰어난 정확도로 지역 환경의 색 분포와 질감을 모두 맞출 수 있는 능력을 가지고 있어 위장술에 가장 능숙하다.
참고 항목
메모들
- ^ Scott M. Boback & Lynn M. Siefferman (2010). "Variation in Color and Color Change in Island and Mainland Boas (Boa constrictor)". Journal of Herpetology. 44 (4): 506–515. doi:10.1670/09-026.1. S2CID 53634890.
- ^ 아리스토텔레스역사 동물원.IX, 622a: 2-10기원전 약 400년.루치아나 보렐리, 프란체스카 게라르디, 그라치아노 피오리토에서 인용.세팔로포다에서 패터링하는 몸의 카탈로그.피렌체 대학 출판부, 2006.추상 구글 책들
- ^ Sangiovanni, G (1819). "Descrizione di un particolare sistema di organi cromoforo espansivo-dermoideo e dei fenomeni che esso produce, scoperto nei molluschi cefaloso". G. Enciclopedico Napoli. 9: 1–13.
- ^ Darwin, Charles (1860). "Chapter 1. Habits of a Sea-slug and Cuttle-fish". Journal Of Researches Into The Natural History And Geology Of The Countries Visited During The Voyage Round The World Of H.M.S. 'Beagle' Under The Command Of Captain Fitz Roy, R.N. John Murray, London. p. 7.
- ^ a b Bagnara, JT (1966). Cytology and cytophysiology of non-melanophore pigment cells. International Review of Cytology. Vol. 20. pp. 173–205. doi:10.1016/S0074-7696(08)60801-3. ISBN 978-0-12-364320-9. PMID 5337298.
- ^ Fox, DL. Animal Biochromes 및 구조 색상: 동물의 세계에서 색체의 물리적, 화학적, 분포적, 생리학적 특성1976년 버클리 캘리포니아 대학교 출판부ISBN 0-520-02347-1
- ^ Matsumoto, J (1965). "Studies on fine structure and cytochemical properties of erythrophores in swordtail, Xiphophorus helleri, with special reference to their pigment granules (pterinosomes)". J Cell Biol. 27 (3): 493–504. doi:10.1083/jcb.27.3.493. PMC 2106771. PMID 5885426.
- ^ Bagnara JT.비마말리아 조직에서 색소세포의 해부학적 구조와 생리학적 비교인: 색소 시스템: 1998년 옥스포드 대학 출판부의 생리학과 병리학.ISBN 0-19-509861-7
- ^ Taylor, JD. (1969). "The effects of intermedin on the ultrastructure of amphibian iridophores". Gen Comp Endocrinol. 12 (3): 405–16. doi:10.1016/0016-6480(69)90157-9. PMID 5769930.
- ^ Morrison, RL. (1995). "A transmission electron microscopic (TEM) method for determining structural colors reflected by lizard iridophores". Pigment Cell Res. 8 (1): 28–36. doi:10.1111/j.1600-0749.1995.tb00771.x. PMID 7792252.
- ^ a b c d Fujii, R. (2000). "The regulation of motile activity in fish chromatophores". Pigment Cell Res. 13 (5): 300–19. doi:10.1034/j.1600-0749.2000.130502.x. PMID 11041206.
- ^ Ito, S; Wakamatsu, K. (2003). "Quantitative analysis of eumelanin and pheomelanin in humans, mice, and other animals: a comparative review". Pigment Cell Res. 16 (5): 523–31. doi:10.1034/j.1600-0749.2003.00072.x. PMID 12950732.
- ^ Bagnara, J.T.; Taylor, JD; Prota, G (1973). "Color changes, unusual melanosomes, and a new pigment from leaf frogs". Science. 182 (4116): 1034–5. Bibcode:1973Sci...182.1034B. doi:10.1126/science.182.4116.1034. PMID 4748673. S2CID 33900017.
- ^ Bagnara, J.T. (2003). "Enigmas of Pterorhodin, a Red Melanosomal Pigment of Tree Frogs". Pigment Cell Research. 16 (5): 510–516. doi:10.1034/j.1600-0749.2003.00075.x. PMID 12950730.
- ^ Schwalm, PA; Starrett, PH; McDiarmid, RW (1977). "Infrared reflectance in leaf-sitting neotropical frogs". Science. 196 (4295): 1225–7. Bibcode:1977Sci...196.1225S. doi:10.1126/science.860137. PMID 860137. S2CID 45014819.
- ^ Goda M, Ohata M, Ikoma H, Fujiyoshi Y, Sugimoto M, Fujii R (2011). "Integumental reddish-violet coloration owing to novel dichromatic chromatophores in the teleost fish, Pseudochromis diadema". Pigment Cell Melanoma Res. 24 (4): 614–7. doi:10.1111/j.1755-148X.2011.00861.x. PMID 21501419. S2CID 3299089.
- ^ Bagnara, JT; Taylor, JD; Hadley, ME (1968). "The dermal chromatophore unit". J Cell Biol. 38 (1): 67–79. doi:10.1083/jcb.38.1.67. PMC 2107474. PMID 5691979.
- ^ Palazzo, RE; Lynch, TJ; Lo, SJ; Taylor, JD; Tchen, TT (1989). "Rearrangements of pterinosomes and cytoskeleton accompanying pigment dispersion in goldfish xanthophores". Cell Motil Cytoskeleton. 13 (1): 9–20. doi:10.1002/cm.970130103. PMID 2543509.
- ^ Porras, MG; De Loof, A; Breuer, M; Aréchiga, H (2003). "Procambarus clarkii". Peptides. 24 (10): 1581–9. doi:10.1016/j.peptides.2003.08.016. PMID 14706537. S2CID 2593619.
- ^ Deacon, SW; Serpinskaya, AS; Vaughan, PS; Lopez Fanarraga, M; Vernos, I; Vaughan, KT; Gelfand, VI (2003). "Dynactin is required for bidirectional organelle transport". The Journal of Cell Biology. 160 (3): 297–301. doi:10.1083/jcb.200210066. PMC 2172679. PMID 12551954.
- ^ Meyer-Rochow, VB (2001). "Fish chromatophores as sensors of environmental stimuli". In Kapoor BG & Hara TJ (ed.). Sensory Biology of Jawed Fishes. Science Publishers Enfield (NH), USA. pp. 317–334.
- ^ Aspengren, S; Sköld, HN; Quiroga, G; Mårtensson, L; Wallin, M (2003). "Noradrenaline- and melatonin-mediated regulation of pigment aggregation in fish melanophores". Pigment Cell Res. 16 (1): 59–64. doi:10.1034/j.1600-0749.2003.00003.x. PMID 12519126.
- ^ a b Logan, D. W.; Burn, SF; Jackson, IJ (2006). "Regulation of pigmentation in zebrafish melanophores". Pigment Cell Research. 19 (3): 206–213. doi:10.1111/j.1600-0749.2006.00307.x. PMID 16704454.
- ^ Logan, DW; Bryson-Richardson, RJ; Taylor, MS; Currie, P; Jackson, IJ (2003). "Sequence characterization of teleost fish melanocortin receptors". Ann N Y Acad Sci. 994 (1): 319–30. Bibcode:2003NYASA.994..319L. doi:10.1111/j.1749-6632.2003.tb03196.x. PMID 12851332. S2CID 37853710.
- ^ Sugden, D; Davidson, K; Hough, KA; Teh, MT (2004). "Melatonin, melatonin receptors and melanophores: a moving story". Pigment Cell Res. 17 (5): 454–60. doi:10.1111/j.1600-0749.2004.00185.x. PMID 15357831.
- ^ a b Logan, DW; Bryson-Richardson, RJ; Pagán, KE; Taylor, MS; Currie, PD; Jackson, IJ (2003). "The structure and evolution of the melanocortin and MCH receptors in fish and mammals". Genomics. 81 (2): 184–91. doi:10.1016/S0888-7543(02)00037-X. PMID 12620396.
- ^ Valverde, P; Healy, E; Jackson, I; Rees, JL; Thody, AJ (1995). "Variants of the melanocyte-stimulating hormone receptor gene are associated with red hair and fair skin in humans". Nat Genet. 11 (3): 328–30. doi:10.1038/ng1195-328. PMID 7581459. S2CID 7980311.
- ^ Richardson, J; Lundegaard, PR; Reynolds, NL; Dorin, JR; Porteous, DJ; Jackson, IJ; Patton, EE (2008). "mc1r Pathway regulation of zebrafish melanosome dispersion". Zebrafish. 5 (4): 289–95. doi:10.1089/zeb.2008.0541. PMID 19133827.
- ^ Snider, J; Lin, F; Zahedi, N; Rodionov, V; Yu, CC; Gross, SP (2004). "Intracellular actin-based transport: How far you go depends on how often you switch". Proceedings of the National Academy of Sciences of the United States of America. 101 (36): 13204–9. Bibcode:2004PNAS..10113204S. doi:10.1073/pnas.0403092101. PMC 516548. PMID 15331778.
- ^ Rodionov, VI; Hope, AJ; Svitkina, TM; Borisy, GG (1998). "Functional coordination of microtubule-based and actin-based motility in melanophores". Current Biology. 8 (3): 165–8. doi:10.1016/S0960-9822(98)70064-8. PMID 9443917.
- ^ Kashina, AS; Semenova, IV; Ivanov, PA; Potekhina, ES; Zaliapin, I; Rodionov, VI (2004). "Protein kinase A, which regulates intracellular transport, forms complexes with molecular motors on organelles". Current Biology. 14 (20): 1877–81. doi:10.1016/j.cub.2004.10.003. PMID 15498498.
- ^ a b Neuhauss, SC. (2003). "Behavioral genetic approaches to visual system development and function in zebrafish" (PDF). J Neurobiol. 54 (1): 148–60. doi:10.1002/neu.10165. PMID 12486702.[데드링크]
- ^ Meyer-Rochow, VB; Royuela, M (2002). "Calponin, caldesmon, and chromatophores: the smooth muscle connection". Microsc. Res. Tech. 58 (6): 504–513. doi:10.1002/jemt.10169. PMID 12242708. S2CID 30194336.
- ^ Kelsh, RN; Schmid, B; Eisen, JS (2000). "Genetic analysis of melanophore development in zebrafish embryos". Dev Biol. 225 (2): 277–93. doi:10.1006/dbio.2000.9840. PMID 10985850.
- ^ Kelsh, RN (2004). "Genetics and evolution of pigment patterns in fish". Pigment Cell Research. 17 (4): 326–36. doi:10.1111/j.1600-0749.2004.00174.x. PMID 15250934. S2CID 15112204.
- ^ Lamason, RL; Mohideen, MA; Mest, JR; Wong, AC; Norton, HL; Aros, MC; Jurynec, MJ; Mao, X; et al. (2005). "SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans". Science. 310 (5755): 1782–6. Bibcode:2005Sci...310.1782L. doi:10.1126/science.1116238. PMID 16357253. S2CID 2245002.
- ^ Jayawickreme, CK; Sauls, H; Bolio, N; Ruan, J; Moyer, M; Burkhart, W; Marron, B; Rimele, T; Shaffer, J (1999). "Use of a cell-based, lawn format assay to rapidly screen a 442,368 bead-based peptide library". J Pharmacol Toxicol Methods. 42 (4): 189–97. doi:10.1016/S1056-8719(00)00083-6. PMID 11033434.
- ^ Andersson, TP; Filippini, D; Suska, A; Johansson, TL; Svensson, SP; Lundström, I (2005). "Frog melanophores cultured on fluorescent microbeads: biomimic-based biosensing". Biosens Bioelectron. 21 (1): 111–20. doi:10.1016/j.bios.2004.08.043. PMID 15967358.
- ^ Karlsson, JO; Andersson, RG; Askelöf, P; Elwing, H; Granström, M; Grundström, N; Lundström, I; Ohman, L (1991). "The melanophore aggregating response of isolated fish scales: a very rapid and sensitive diagnosis of whooping cough". FEMS Microbiol Lett. 66 (2): 169–75. doi:10.1111/j.1574-6968.1991.tb04860.x. PMID 1936946.
- ^ Hansford, Dave (August 6, 2008). "Cuttlefish Change Color, Shape-Shift to Elude Predators". National Geographic News. Wellington, New Zealand.
[...] cuttlefish have instead relied on invisibility, a talent that may have applications for human technology. Norman said the military has shown interest in cuttlefish camouflage with a view to one day incorporating similar mechanisms in soldiers' uniforms.
- ^ Lee I. 나노튜브 잡음 신호 처리 박사 논문2005; Southern California 대학교.
- ^ Cloney, RA; Florey, E (1968). "Ultrastructure of cephalopod chromatophore organs". Zeitschrift für Zellforschung und Mikroskopische Anatomie. 89 (2): 250–80. doi:10.1007/BF00347297. PMID 5700268. S2CID 26566732.
- ^ Laan, A; Guthnick, T; Kuba, MJ; Laurent, G (2014). "Behavioral analysis of cuttlefish traveling waves and its implications for neural control". Current Biology. 24 (15): 1737–1742. doi:10.1016/j.cub.2014.06.027. PMID 25042589.
- ^ Demski, LS (1992). "Chromatophore systems in teleosts and cephalopods: a levels oriented analysis of convergent systems". Brain, Behavior and Evolution. 40 (2–3): 141–56. doi:10.1159/000113909. PMID 1422807.
외부 링크
| 위키미디어 커먼즈에는 크로마토포레스와 관련된 미디어가 있다. |