알코올(화학)
Alcohol (chemistry)화학에서 알코올은 포화 탄소 [2]원자에 결합된 적어도 하나의 수산기(-OH)를 운반하는 유기 화합물의 한 종류입니다.알코올이라는 용어는 원래 약물로 사용되며 알코올 음료에 존재하는 주요 알코올인 1차 알코올 에탄올(에틸 알코올)을 가리킵니다.메탄올과 에탄올이 가장 단순한 예인 알코올의 중요한 종류에는 일반식n2n+1 CHOH에 부합하는 모든 화합물이 포함됩니다. 이 기사의 주제는 1차(RCHOH2), 2차(RCHOH2) 및 3차3(RCOH) 알코올입니다.
접미사 -ol은 히드록실기가 가장 우선순위가 높은 관능기인 모든 물질의 IUPAC 화학명에 나타난다.priority가 높은 그룹이 컴파운드에 존재할 경우 프리픽스hydroxy-가 IUPAC 이름에 사용됩니다.비 IUPAC 이름의 접미사 -ol(예: 파라세타몰 또는 콜레스테롤)도 일반적으로 해당 물질이 알코올임을 나타냅니다.단, 히드록실 관능기를 포함하는 일부 화합물은 접미사 -ol 또는 접두사 hydroxy-를 포함하지 않는 간단한 이름을 가지고 있다(예: 당 포도당 및 수크로스).
역사
포도주의 내뱉는 불타는 성질은 아리스토텔레스 (기원전 384–322), 테오프라스토스 (c.기원전 371–287), 그리고 대 플리니우스 (기원전 23/24–79)[3]와 같은 고대 자연 철학자들에게 이미 알려져 있었다.하지만, 2세기와 3세기 로마 [4]이집트에서 더욱 발전된 증류 기술이 개발되었음에도 불구하고, 이것이 알코올의 분리로 곧바로 이어지지는 않았다.자비르 이븐 에이얀(9세기 CE)의 글 중 하나에서 처음 발견된 중요한 인식은 끓는 와인에 소금을 첨가함으로써 와인의 상대적인 휘발성을 증가시킴으로써 결과 증기의 가연성을 높일 [5]수 있다는 것이다.와인의 증류는 알-킨드(c.c.801–873 CE)와 알-파라브(872–950)에 기인하는 아랍어 작품과 알-자흐라위(라틴어: Abulcasis, 936–1013)의 제28권(라틴어: Abulcasis, 936–1013) 키타프(라틴어: Latinfr ()에서 증명된다.12세기에는 포도주를 소금으로 증류하여 아쿠아 아렌스("불타는 물")를 만드는 레시피가 라틴어 작품에 등장하기 시작했고, 13세기 말에는 서유럽 [7]화학자들 사이에서 널리 알려진 물질이 되었다.
타데오 알데로티(123–1296)의 연구는 수냉식 스틸을 통해 알코올을 농축하는 방법을 설명하고 있으며, 이를 통해 알코올 순도가 90%가 될 [8]수 있습니다.에탄올의 약효는 빌라노바의 아르날드(1240–c.1311 CE)와 루페시사의 존(1310–1366)에 의해 연구되었으며, 후자는 에탄올을 모든 질병을 예방할 수 있는 생명을 유지하는 물질로 간주했다.[9]
명명법
어원학
"알코올"이라는 단어는 [10]아이라이너로 사용되는 파우더인 아랍어 콜(아랍어: لحل roman roman, 로마어: al-ku),l)에서 왔다.Al-는 영어의 에 해당하는 아랍어 한정사이다.원래 알코올은 천연 미네랄 스티브나이트의 승화로 생성되는 매우 미세한 분말에서 사용되어 안티몬 트리술피드23 SbS를 형성했습니다.그것은 이 광물의 정수 또는 "정신"으로 여겨졌다.그것은 방부제, 아이라이너, 화장품으로 사용되었다.알코올의 의미는 증류된 물질로 확장되었다가 에탄올로 좁혀졌다. 이때 "술"은 독한 [11]술의 동의어였다.
바르톨로뮤 트라헤론은 1543년 비고의 존을 번역하면서 이 단어를 "잔인한" 작가들이 사용하는 "고운 가루"라는 용어로 소개하고 있다.비고는 "야만한 악사들은 알코올, 또는 (내가 그것을 경험했을 때) 알코폴을 훌륭한 푸드레로 [12]사용한다"고 썼다.
윌리엄 존슨이 쓴 1657년판 렉시콘 치미쿰은 "안티모늄 시브 스티비움"[13]이라는 단어를 광택을 낸다.확장적으로, 그 단어는 증류된 와인의 증류된 정수인 "포도주의 알코올"을 포함하여 증류를 통해 얻은 모든 액체를 가리키게 되었다.알키미아(1594)의 리바비우스는 "비니 알코올 벨 비넘 알칼리사툼"을 가리킨다.존슨(1657)은 알코올 비니를 "칸도 옴니스 슈퍼플루이트 비니 a vini a vino superfluitas vini a vino separatur, ita ut accensum ardeat donec totum compuatuer, nihilque fécum aut paudeatis in fundo remanatis"라고 표현한다.[clarification needed]이 단어의 의미는 18세기에 와인의 정신(오늘날 에탄올로 알려진 화학 물질)으로 제한되었고 [12]1850년 이후 현대 화학에서 "알코올"로 불리는 물질 등급으로 확장되었다.
에탄올이라는 용어는 1892년에 발명되었는데, "에탄"과 "알코올"의 "올"을 혼합하여 libfix로 [14]일반화되었습니다.
계통명
IUPAC 명명법은 과학 출판물과 물질의 정확한 식별이 중요한 경우에 사용된다.단순 알코올을 명명할 때 알칸 사슬의 이름은 말단 e를 잃고 예를 들어 알칸 사슬 이름 "에탄올"[15]에서와 같이 접미사 -ol을 추가합니다.필요에 따라 알칸명과 -ol:CHCHOH의322 프로판-1-ol, CHCH(OH)CH의33 프로판-2-ol 사이에 히드록실기의 위치를 나타낸다.고우선도 그룹(알데히드, 케톤, 카르본산 등)이 존재하는 경우, 예를 들어 1-히드록시-2-프로파논(CHC3(O)CHOH2)[16]과 같이 프리픽스 히드록시-가 사용된다.[15]하나 이상의 히드록시기를 가진 화합물을 폴리올이라고 한다.CHH(OH)CHOH2(프로필렌 글리콜)의3 프로판-1,2-diol과 같이 수산기의 위치 번호 목록을 따라 접미사 -diol, -triol 등을 사용하여 명명한다.
| 구조식 | 골격식 | 우선 IUPAC 이름 | 기타 계통명 | 통용명 | 도 |
|---|---|---|---|---|---|
| CH-CH-OH322 | 프로판-1-올 | 1-프로판올 n-프로필 알코올 | 프로판올 | 기본적인 | |
 |  | 프로판-2-올 | 2-프로판올 | 이소프로필 알코올 이소프로판올 | 이차적인 |
 |  | 시클로헥산올 | 이차적인 | ||
 | 2-메틸프로판-1-ol | 2-메틸-1-프로판올 | 이소부틸 알코올 이소부탄올 | 기본적인 | |
 | 테르트아밀알코올 | 2-메틸부탄-2-ol 2-메틸-2-부탄올 | TAA | 제3의 |
히드록시기가 방향족 고리상의 SP카본에2 결합되어 있는 경우, 해당 분자는 페놀로 별도로 분류되어 [17]페놀을 명명하기 위한 IUPAC 규칙을 사용하여 명명된다.페놀은 뚜렷한 성질을 가지고 있으며 알코올로 분류되지 않습니다.
통용명
다른 덜 격식적인 맥락에서 알코올은 종종 해당하는 알킬기 이름 뒤에 "알코올"이라는 단어가 붙는다(예: 메틸알코올, 에틸알코올).프로필 알코올은 히드록실기가 직선 프로판 사슬의 말단 또는 중간 탄소에 결합되어 있는지에 따라 n-프로필 알코올 또는 이소프로필 알코올일 수 있다.계통적 명칭으로 기술된 바와 같이, 분자의 다른 그룹이 우선권을 갖는 경우 알코올 부분은 종종 "히드록시-"[18] 접두사를 사용하여 표시됩니다.
고대 명명법에서 알코올은 "카르비놀"을 어미지로 사용하여 메탄올 유도체로 명명될 수 있습니다.예를 들어 (CH3)3COH는 트리메틸카르비놀로 명명할 수 있다.
프라이머리, 세컨더리 및 세컨더리
알코올은 수산기 관능기를 가진 탄소 원자에 연결된 탄소 원자의 수에 따라 1차, 2차(sec-, s-), 3차(tert-, t-)로 분류된다.(각각의 숫자 속기 1°, 2° 및 3°가 비공식 설정에서 사용되는 경우가 있습니다.)[19]1차 알코올은 일반식2 RCHOH를 가지고 있습니다.가장 단순한 1차 알코올은 메탄올(CHOH3)로, R=H이고 다음으로 에탄올이며, 에탄올은 R=CH로3 메틸기입니다.2차 알코올은 RR'CHOH 형태의 알코올이며, 가장 단순한 알코올은 2-프로판올(R=R'=CH3)입니다.3차 알코올의 경우 일반적인 형태는 RR'R"COH입니다.가장 간단한 예는 tert-butanol(2-methylpropan-2-ol)이며, R', R'은 각각 CH이다3.이들 약어에서 R, R' 및 R'은 치환기, 알킬기 또는 기타 부착된 일반적으로 유기기를 나타낸다.
예
| 유형 | 공식 | IUPAC 이름 | 통칭 |
|---|---|---|---|
| 단수력 알코올 | 쵸우3 | 메탄올 | 목재 알코올 |
| 쵸우25 | 에탄올 | 알코올 | |
| 쵸우37 | 프로판-2-ol | 이소프로필 알코올, 알코올을 문지르다 | |
| 쵸우49 | 부탄-1-올 | 부탄올 부틸알코올 | |
| 쵸우511 | 펜탄-1-올 | 펜탄올 아밀알코올 | |
| 쵸우1633 | 헥사데칸-1-ol | 세틸알코올 | |
| 다수체 알코올 | C2H4(OH)2 | 에탄-1,2-디올 | 에틸렌 글리콜 |
| C3H6(OH)2 | 프로판-1,2-디올 | 프로필렌 글리콜 | |
| C3H5(OH)3 | 프로판-1,2,3-트리올 | 글리세롤 | |
| C4H6(OH)4 | 부탄-1, 2, 3, 4-테트라올 | 에리스리톨 스레이톨 | |
| C5H7(OH)5 | 펜탄-1, 2, 3, 4, 5-펜톨 | 자일리톨 | |
| C6H8(OH)6 | 헥산-1, 2, 3, 4, 5, 6-글리콜 | 만니톨 소르비톨 | |
| C7H9(OH)7 | 헵탄-1, 2, 3, 4, 5, 6, 7-헵톨 | 볼레미톨 | |
| 불포화 지방족 알코올 | 쵸우35 | 프로펠러-2-ene-1-ol | 알릴알코올 |
| 쵸우1017 | 3,7-디메틸록타-2,6-디엔-1-ol | 게라니올 | |
| 쵸우33 | 프로펠러-2-yn-1-ol | 프로파길 알코올 | |
| 지방식 알코올 | C6H6(OH)6 | 시클로헥산-1, 2, 3, 4, 5, 6-헥솔 | 이노시톨 |
| 쵸우1019 | 5-메틸-2-(프로판-2-일)시클로헥산-1-ol | 멘톨 |
적용들
알코올은 오랜 역사를 가지고 있습니다.이 기사에서 중점적으로 다루는 단순 모노 알코올의 경우, 다음은 가장 중요한 공업용 [21]알코올입니다.
- 메탄올, 주로 포름알데히드 생산 및 연료첨가물로서의
- 에탄올, 주로 알코올 음료, 연료 첨가물, 용제
- 용매 및 용제의 전구체로 사용되는 1-프로판올, 1-부탄올 및 이소부틸 알코올
- 가소제에 사용되는 C6–C11 알코올(예: 폴리염화비닐)
- 지방 알코올(C12–C18), 세제의 전구체
메탄올은 1980년에 약 1,200만 톤/y가 생산되는 가장 일반적인 공업용 알코올입니다.다른 알코올의 결합 용량은 거의 동일하며, 대략적으로 [21]균등하게 분배됩니다.
독성
급성 독성과 관련하여 단순 알코올은 급성 독성이 낮습니다.몇 밀리리터의 복용량은 허용된다.펜타놀, 헥사놀, 옥타놀 및 긴 알코올의 경우 LD50의 범위는 2-5g/kg(쥐, 경구)입니다.에탄올은 덜 독하다[22].모든 알코올은 순한 피부 자극제입니다.[21]
메탄올(및 에틸렌 글리콜)의 대사는 간 알코올 탈수소효소에 대한 친화력이 높은 에탄올의 존재에 의해 영향을 받습니다.이런 방식으로 메탄올은 그대로 [23][24][25]소변으로 배출된다.
물리 속성
일반적으로 히드록실기는 알코올을 극성으로 만든다.그 그룹들은 서로 그리고 대부분의 다른 화합물들과 수소 결합을 형성할 수 있다.극성 OH가 존재하기 때문에 알코올은 단순 탄화수소보다 수용성이 더 높습니다.메탄올, 에탄올, 프로판올은 물에 섞일 수 있다.4개의 탄소 사슬을 가진 부탄올은 적당히 용해된다.
수소 결합으로 인해 알코올은 유사한 탄화수소 및 에테르보다 끓는점이 더 높은 경향이 있습니다.알코올 에탄올의 비등점은 78.29°C인데 비해 탄화수소 헥산은 69°C, 디에틸 에테르는 34.6°C입니다.
자연발생
단순한 알코올은 자연에서 널리 발견된다.에탄올은 주요 에너지 생산 경로인 발효의 산물이기 때문에 가장 두드러진다.다른 단순 알코올, 주로 동체 알코올은 미량으로만 형성됩니다.그러나 설탕, 일부 아미노산, 지방산에서 나타나는 것처럼 더 복잡한 알코올이 만연해 있습니다.
생산.
지글러 및 옥소 프로세스
지글러 공정에서는 에틸렌과 트리에틸알루미늄에서 선형 알코올을 제조한 후 산화 및 가수분해한다.[21]1-옥탄올의 이상적인 합성은 다음과 같습니다.
- Al(CH25)3 + 9CH24 → Al(CH817)3
- Al(C8H17)3+3O+3H2O3HOC8H17+Al(OH)3 →.
그 과정은 증류로 나누어진 알코올의 범위를 생성합니다.
많은 더 높은 알코올 알켄 수소 첨가 순 히드로포로 이루어진다.매우 평범하다 언제는 터미널 alkene에 적용하는, 하나는 일반적으로 선형 술:[21]인정을 받고 있다.
- RCH=CH2+H2+CO→ RCH2CH2CHO
- RCH2CH2CHO+3H2→ RCH2CH2CH2오호
이러한 프로세스는 세제에게 유용한 기름진 술 준다.
수화 반응
산업 중요성의 일부 저 분자량. 술도 물의 알켄에 의해 주로 발생된다.에탄올은, isopropanol, 2-butanol, tert-butanol 이 일반 메서드에 의해 생산됩니다.두 구현과 간접적인 방법을 채택한다.직접적 방법은, 일반적으로 산성 촉매제를 사용하여 안정적인 인터 미디 에이츠의 형성을 막을 수 있다.간접 방법에서, alkene는 그 후에 가수 분해물은 황산 에스테르,로 변환됩니다.직접 수화 증류수의 원유가 분수의 분배에서 에틸렌(에틸렌 수화)[26]또는 다른 알켄을 사용하여.
또한 산업적으로는 에틸렌옥사이드로부터 디올에틸렌글리콜을 생산하기 위해 수화작용이 사용된다.
생물 경로
에탄올은 에탄올을 생성하기 위해 효모와 37°C 미만의 온도에서 전분의 가수분해로부터 생성된 당을 사용하여 발효함으로써 얻어진다.예를 들어, 이러한 과정은 인버타아제 효소에 의한 수크로스의 포도당 및 과당으로의 전환과 복합체 치마아제에 의한 포도당의 에탄올 및 이산화탄소로의 전환에 의해 진행될 수 있다.
장내 양성 박테리아 중 몇몇 종은 혐기성 대사의 한 형태로 발효를 사용한다.이 대사 반응은 폐기물로 에탄올을 생성한다.따라서 인체에는 이러한 박테리아에 의해 내생적으로 생성된 알코올이 일정량 포함되어 있습니다.드문 경우이긴 하지만, 이는 음주량이 생성되는 "[27][28][29]자동 양조 증후군"을 일으키기에 충분할 수 있습니다.
에탄올과 마찬가지로 부탄올도 발효 과정을 통해 생산될 수 있다.사카로미세스 효모는 75°F(24°C) 이상의 온도에서 이러한 높은 알코올을 생성하는 것으로 알려져 있습니다.클로스트리디움 아세트뷰틸리쿰 박테리아는 산업 규모로 [30]부탄올을 생산하기 위해 셀룰로오스를 먹고 살 수 있다.
대체
1차 할로겐화 알킬은 주로 친핵성 지방족 치환에서 1차 알코올과 NaOH 또는 KOH와 반응한다.(2차, 특히 3차 할로겐화 알킬은 대신 제거(알켄) 생성물을 제공합니다.)그리냐드 시약은 2차 및 3차 알코올에 카르보닐기와 반응합니다.관련 반응으로는 바르비에 반응과 노자키히야마 반응이 있다.
축소
알데히드 또는 케톤은 수소화붕소나트륨 또는 수소화리튬으로 환원됩니다(산성 작업 후).알루미늄 이소프로필레이트에 의한 또 다른 감소는 Meerwein-Ponndorf-Verley 감소입니다.노요리 비대칭 수소화는 β-케토에스테르의 비대칭 환원이다.
가수 분해
알케인은 보통 2차 또는 3차 알코올을 제공하는 촉매로 농축 황산을 사용하여 산성 촉매 수화 반응을 일으킵니다.알케인의 수소화-산화 및 옥시 수은 감소는 유기 합성에 있어 보다 신뢰할 수 있다.알케인은 할로히드린 생성 반응에서 NBS 및 물과 반응한다.아민은 디아조늄 소금으로 전환될 수 있으며, 디아조늄 소금들은 가수분해된다.
환원 및 수화를 통한 2차 알코올의 형성은 다음과 같습니다.
반응
디프로토네이션
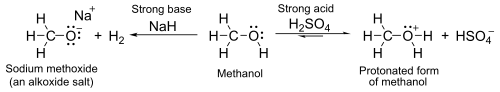
약 16-19의a 수성 pK 값을 가진 이들은 일반적으로 물보다 약간 약한 산이다.수소화 나트륨이나 나트륨과 같은 강한 염기와 함께 알콕시드라고 불리는 염기를 형성하며[31], 일반식은− RO+ M입니다.
- 2 R-OH + 2 NaH → 2 R-ONA−+ + 2 H2
- 2 R-OH + 2 Na → 2 R-ONA−+ + H2
알코올의 산도는 용매화의 영향을 강하게 받습니다.가스 단계에서는 알코올이 [32]물보다 더 산성입니다.DMSO에서 알코올(및 물)의 pK는a 약 29–32입니다.그 결과 알콕사이드(및 수산화물)는 이 용제의 강력한 염기 및 친핵체(예를 들어 윌리엄슨 에테르 합성용)이다.특히, DMSO의 RO 또는– HO는– 알킨의 탈양성자를 통해 아세틸리드 이온의 유의한 평형 농도를 생성하는 데 사용될 수 있다(Favorskii [33][34]반응 참조).
친핵성 치환
OH기는 친핵성 치환 반응에서 좋은 이탈기가 아니므로 중성 알코올은 이러한 반응에서 반응하지 않습니다.그러나 먼저 산소를 양성자화하여 ROH+2를 생성하면− 이탈기(물)가 훨씬 안정되어 친핵 치환이 일어날 수 있다.예를 들어 3차 알코올은 염산과 반응하여 3차 할로겐화 알킬기를 생성하며, 여기서 수산기는 단분자 친핵 치환에 의해 염소 원자에 의해 치환된다.1차 알코올 또는 2차 알코올을 염산과 반응시키려면 염화 아연과 같은 활성제가 필요합니다.다른 방법으로는 [1]염화티오닐을 사용하여 직접 변환해도 된다.
알코올도 마찬가지로 브롬화수소산 또는 삼브롬화 인을 사용하여 알킬 브롬화물로 변환할 수 있습니다. 예를 들어 다음과 같습니다.
- 3 R-OH + PBr3 → 3 RBr + HPO33
바톤-맥콤비 탈산소화에서 알코올을 염기 치환 반응으로 트리부틸틴 하이드라이드 또는 트리메틸보란-수 복합체에 의해 알칸으로 탈산소화한다.
탈수
한편 산소 원자는 황산과 같은 강한 산의 존재 하에서 약한 염기성을 띠게 하는 단독의 비결합 전자를 가지고 있다.예를 들어 메탄올의 경우:
강한 산으로 처리하면 알코올은 E1 제거 반응을 일으켜 알케인을 생성합니다.일반적으로 이 반응은 가장 안정적인(일반적으로 가장 치환된) 알켄이 형성된다는 자이체프의 법칙에 따릅니다.3차 알코올은 상온 바로 위에서는 쉽게 제거되지만 1차 알코올은 더 높은 온도가 필요합니다.
다음은 에틸렌을 생성하기 위해 에탄올의 산 촉매 탈수를 나타내는 다이어그램입니다.
보다 제어된 제거 반응은 크산토 에스테르 형성을 필요로 한다.
양성자 분해
3차 알코올은 강한 산과 반응하여 탄수화물을 생성합니다.이 반응은 예를 들어 tert-부틸 알코올로부터 이소부틸렌과 같은 탈수와 관련이 있습니다.특별한 종류의 탈수반응은 트리페닐메탄올, 특히 그 아민치환유도체를 포함한다.이러한 알코올은 산 처리 시 안정적인 카보코네이션(시판 염료)[35]을 제공하기 위해 수분을 손실합니다.
에스테르화
알코올과 카르본산은 소위 피셔 에스테르화라고 불리는 형태로 반응합니다.반응에는 보통 농축 황산과 같은 촉매가 필요합니다.
- R−OH + R'−COH2 → R'-COR2 + HO2
다른 유형의 에스테르도 유사한 방식으로 제조됩니다. 예를 들어 토실(토실레이트) 에스터는 피리딘에서 알코올과 p-톨루엔술포닐 염화물의 반응에 의해 만들어집니다.
산화
1차 알코올(R-CHOH2)은 알데하이드(R-CHO) 또는 카르본산(R-COH2)으로 산화될 수 있다.2차 알코올(RRCH-OH12)의 산화는 일반적으로 케톤(RRC12=O) 단계에서 종료됩니다.3차 알코올(RRRC-OH123)은 내산화성이 있습니다.
1차 알코올이 카르본산으로 직접 산화되는 것은 일반적으로 해당 알데히드를 통해 진행되며, 알데히드 하이드레이트(R-CH(OH)2는 물과의 반응에 의해 카르본산으로 더 산화되기 전에 변환됩니다.

1차 알코올을 알데히드로 변환하는 데 유용한 시약은 일반적으로 2차 알코올을 케톤으로 산화시키는 데도 적합합니다.여기에는 콜린스 시약과 데스마틴 페리미난이 포함된다.1차 알코올을 카르본산으로 직접 산화하려면 과망간산칼륨 또는 존스 시약을 사용합니다.
「 」를 참조해 주세요.
인용문
- ^ "alcohols". IUPAC Gold Book. Retrieved 16 December 2013.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "알코올" . doi : 10.1351 / goldbook . A00204
- ^ Berthelot, Marcellin; Houdas, Octave V. (1893). La Chimie au Moyen Âge. Vol. I–III. Paris: Imprimerie nationale. 제1권, 137쪽
- ^ Berthelot & Houdas 1893, vol.I, 페이지 138-139.
- ^ al-Hassan, Ahmad Y. (2009). "Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century". Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry. Hildesheim: Georg Olms Verlag. pp. 283–298. (저작자 웹사이트에서도 같은 내용을 볼 수 있습니다).
- ^ al-Hassan 2009 (저자 웹사이트에서도 같은 내용을 이용할 수 있습니다); cf.Berthelot & Houdas 1893, vol.I, 페이지 141, 143때때로, 유황도 와인에 첨가되었다(Berthelot & Houdas 1893, vol. 참조).I, 페이지 143).
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. ISBN 9782881245947. 페이지 204-1986.
- ^ Holmyard, Eric John (1957). Alchemy. Harmondsworth: Penguin Books. ISBN 978-0-486-26298-7. 페이지 51~52.
- ^ Principe, Lawrence M. (2013). The Secrets of Alchemy. Chicago: The University of Chicago Press. ISBN 978-0226103792. 페이지 69-71.
- ^ Harper, Douglas. "Alcohol". Etymonline. MaoningTech. Retrieved 17 May 2018.
- ^ Lohninger, H. (21 December 2004). "Etymology of the Word "Alcohol"". VIAS Encyclopedia. Retrieved 17 May 2018.
- ^ a b "alcohol, n.". OED Online. Oxford University Press. 15 November 2016.
- ^ Johnson, William (1652). Lexicon Chymicum.
- ^ Armstrong, Henry E. (8 July 1892). "Contributions to an international system of nomenclature. The nomenclature of cycloids". Proc. Chem. Soc. 8 (114): 128. doi:10.1039/PL8920800127.
As ol is indicative of an OH derivative, there seems no reason why the simple word acid should not connote carboxyl, and why al should not connote COH; the names ethanol ethanal and ethanoic acid or simply ethane acid would then stand for the OH, COH and COOH derivatives of ethane.
- ^ a b William Reusch. "Alcohols". VirtualText of Organic Chemistry. Archived from the original on 19 September 2007. Retrieved 14 September 2007.
- ^ 유기화학 IUPAC 명명법.알코올 규칙 C-201.
- ^ 유기화학명칭법 C-203: 페놀
- ^ "How to name organic compounds using the IUPAC rules". www.chem.uiuc.edu. THE DEPARTMENT OF CHEMISTRY AT THE UNIVERSITY OF ILLINOIS. Retrieved 14 November 2016.
- ^ Reusch, William (2 October 2013). "Nomenclature of Alcohols". chemwiki.ucdavis.edu/. Retrieved 17 March 2015.
- ^ "Global Status Report on Alcohol 2004" (PDF). Retrieved 28 November 2010.
- ^ a b c d e 를 클릭합니다Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter. "Alcohols, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_279..
- ^ 에탄올 독성
- ^ Schep LJ, Slaughter RJ, Vale JA, Beasley DM (30 September 2009). "A seaman with blindness and confusion". BMJ. 339: b3929. doi:10.1136/bmj.b3929. PMID 19793790. S2CID 6367081.
- ^ Zimmerman HE, Burkhart KK, Donovan JW (1999). "Ethylene glycol and methanol poisoning: diagnosis and treatment". Journal of Emergency Nursing. 25 (2): 116–20. doi:10.1016/S0099-1767(99)70156-X. PMID 10097201.
- ^ Lobert S (2000). "Ethanol, isopropanol, methanol, and ethylene glycol poisoning". Critical Care Nurse. 20 (6): 41–7. doi:10.4037/ccn2000.20.6.41. PMID 11878258.
- ^ Lodgsdon J.E. (1994). "Ethanol". In Kroschwitz J.I. (ed.). Encyclopedia of Chemical Technology. Vol. 9 (4th ed.). New York: John Wiley & Sons. p. 820. ISBN 978-0-471-52677-3.
- ^ P. Geertinger MD; J. Bodenhoff; K. Helweg-Larsen; A. Lund (1 September 1982). "Endogenous alcohol production by intestinal fermentation in sudden infant death". Zeitschrift für Rechtsmedizin. Springer-Verlag. 89 (3): 167–172. doi:10.1007/BF01873798. PMID 6760604. S2CID 29917601.
- ^ Logan BK, Jones AW (July 2000). "Endogenous ethanol 'auto-brewery syndrome' as a drunk-driving defence challenge". Medicine, Science, and the Law. 40 (3): 206–15. doi:10.1177/002580240004000304. PMID 10976182. S2CID 6926029.
- ^ Cecil Adams (20 October 2006). "Designated drunk: Can you get intoxicated without actually drinking alcohol?". The Straight Dope. Retrieved 27 February 2013.
- ^ Zverlov, W; Berezina, O; Velikodvorskaya, GA; Schwarz, WH (August 2006). "Bacterial acetone and butanol production by industrial fermentation in the Soviet Union: use of hydrolyzed agricultural waste for biorefinery". Applied Microbiology and Biotechnology. 71 (5): 587–97. doi:10.1007/s00253-006-0445-z. PMID 16685494. S2CID 24074264.
- ^ 알칼리 금속 알콕시드는 일반적으로 소금이라고 표현되지만 실제로는 올리고머 클러스터 또는 고분자 사슬이라고 구조적으로 더 잘 설명됩니다.예를 들어 tert-butoxide 칼륨은 큐반 형태의 테트라머 [t-BuOK]4로 구성되며 THF와 같은 극성 용제에도 잔류한다.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Ahmed, Jasimuddin; Swain, Asim Kumar; Das, Arpan; Govindarajan, R.; Bhunia, Mrinal; Mandal, Swadhin K. (14 November 2019). "A K-arylacetylide complex for catalytic terminal alkyne functionalization using KOtBu as a precatalyst". Chemical Communications. 55 (92): 13860–13863. doi:10.1039/C9CC07833A. ISSN 1364-548X. PMID 31670328. S2CID 204974842.
- ^ WO1994012457A1, Babler, James H., "제3의 알키놀을 준비하는 프로세스", 1994-06-09 발행
- ^ Gessner, Thomas; Mayer, Udo (2000). "Triarylmethane and Diarylmethane Dyes". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a27_179.
일반 참고 자료
- Metcalf, Allan A. (1999). The World in So Many Words. Houghton Mifflin. ISBN 0-395-95920-9.