베타 카르볼린
beta-Carboline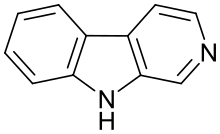 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 9H피리도[3,4-b]도 | |
기타 이름
| |
| 식별자 | |
3D 모델(JSmol) | |
| 128414 | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.005.418 |
| EC 번호 |
|
| 케그 | |
| 메슈 | 노하르만 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C11H8N2 | |
| 어금질량 | 168.20 g/168 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
β-카르볼린 (9H-피리도[3,4-b]indole)은 100개 이상의 알칼로이드와 합성 화합물에 대한 기본적인 화학 구조를 나타낸다.이러한 물질의 효과는 각각의 대체물에 따라 달라진다.천연 β-카볼린은 주로 뇌 기능에 영향을 미치지만 항산화[1] 효과도 나타낼 수 있다.합성적으로 설계된 β-카볼린 유도체는 최근 신경보호성,[2] 인지강화성, 항암성질을 가진 것으로 나타났다.[3]
약리학
특정 β-카볼린의 약리학적 효과는 대체물에 따라 달라진다.예를 들어 천연 β-카볼린 하르민에는 위치 7과 1에 대체물이 있다.따라서 신경 발달에 필요한 분자인 DYRK1A 단백질 키나아제의 선택적 억제제 역할을 한다.[4][5]또한 세로토닌 수용체 2A와 상호작용하여 쥐에게 다양한 항우울제 효과를 나타낸다.[6][7]게다가, 그것은 쥐 해마에서 뇌에서 유래된 신경영양인자(BDNF)의 수준을 증가시킨다.[7][8]BDNF의 감소는 인간의 심각한 우울증과 관련이 있다.하르민의 항우울제 효과는 세로토닌과 노르아드레날린의 분해를 줄임으로써 MAO-A 억제제로서의 기능에도 기인할 수 있다.[8][9]
합성 파생상품인 9-메틸-β-카볼린은 신경영양성 인자의 발현 증가와 호흡사슬 활성 강화 등 신경보호 효과를 보여 왔다.[10][11]또한 이 파생상품은 인지기능을 [12]향상시키고 도파민성 뉴런 수를 증가시키며 시냅스와 덴드리트성 증식을 촉진하는 것으로 나타났다.[13][14]그것은 또한 파킨슨병과 다른 신경퇴행 과정에 대한 동물 모델에서도 치료 효과를 보여주었다.[11]
그러나 위치 3에 대체물이 있는 β-카볼린은 GABA-A 수용체에 대한 벤조디아제핀의 영향을 감소시키고 따라서 경련성, 항시 유발성, 기억력 향상 효과를 가질 수 있다.[15]또한 3-히드록시메틸-베타-카볼린은 설치류에서 플루라제팜의 수면 촉진 효과를 차단하며, 그 자체로 용량 의존적인 방식으로 수면을 감소시킬 수 있다.[16]또 다른 파생물질인 메틸-β-카르보린-3-카르복실산염은 낮은 용량에서는 학습과 기억력을 자극하지만 높은 용량에서는 불안과 경련을 유발할 수 있다.[15]위치 9의 수정과 함께, 불안이나 경련을 조장하지 않고 학습과 기억력에 대해 유사한 긍정적인 효과가 관찰되었다.[12]
또한 β-카볼린 유도체는 "스트렙토미스"종이 거주하는 토양에서 항생제 레베토마이신 A의 생성을 강화한다.[17][18]구체적으로는 β-카볼린을 룩스R 계열의 대형 ATP 결합 조절기에 결합함으로써 생체합성 유전자의 발현이 촉진된다.
또한 유산균 spp.는 β-카볼린(1-acetel-β-카볼린)을 분비하여 병원성 곰팡이 칸디다 알비칸이 보다 치명적인 성장 형태(yeast-to-filament 전환)로 변화하지 못하게 한다.따라서 β-카볼린은 질 칸디다스에서 곰팡이 패혈증에 이르는 병리학을 유발하는 마이크로바이옴 성분의 불균형을 역전시킨다.[19]
β-카볼린은 DNA, 효소(GPX4, 키나제 등), 단백질(ABCG2/BRCP1 등) 등 다양한 암 관련 분자와도 상호작용하기 때문에 잠재적 항암제로도 논의된다.[3]
β-카볼린의 의학적 사용을 위한 탐색적 인간 연구
liana Banisteriopsis caapi의 추출물은 아마존 부족들이 엔테오겐으로 사용되어 19세기 중반에 환각제로 묘사되었다.[20]20세기 초, 유럽의 약사들은 하르민을 활성 물질로 식별했다.[21]이 발견은 의약품으로서의 잠재력을 더욱 조사하려는 관심을 자극했다.예를 들어, 저명한 약리학자 루이 르윈은 후두뇌증 파킨슨병 환자에게 B. caapi를 투여한 후 신경학적 핸디캡에서 극적인 효과를 보였다.[20]1930년경에는 일반적으로 하르미네로 치료함으로써 저포키닌증, 침 흘림, 기분, 때로는 경직성이 개선된다는 것이 합의되었다.파킨슨병과 후두뇌성 파킨슨병을 앓고 있는 환자들을 대상으로 20, 30대에 모두 25개의 연구가 발표되었다.하르민의 약리학적 효과는 주로 중심 모노아민 산화효소(MAO) 억제 특성에 기인한다.생체내 연구와 설치류 연구는 바니스테리오시스 카피 추출물과 페가눔 하르말라 추출물이 선조체 도파민 방출을 유발한다는 것을 보여주었다.[22][23][24]게다가, 해민은 MPTP 치료 생쥐에서 도파민성 뉴런의 생존을 지원한다.[25]하민 역시 N-메틸-아스파테이트(NMDA) 수용체를 적대시하기 때문에 일부 연구자들은 파킨슨병 환자의 빠른 개선을 이러한 항글루타마테라믹 효과 때문이라고 추측했다.[26][20]그러나 당시 합성 항고체제의 출현으로 하르민은 완전히 포기하게 되었다.[20]
구조
β-카볼린은 인도레 알칼로이드 그룹에 속하며 인도레 골격과 융합된 피리딘 링으로 구성된다.[27]β-카볼린의 구조는 트립타민 구조와 유사하며, 에틸아민 체인은 여분의 탄소 원자를 통해 인도레 링에 다시 연결되어 3링 구조를 생성한다.β-카볼린의 생합성은 유사한 트립타민으로부터 이 경로를 따르는 것으로 생각된다.[28]선택적으로 빨간색과 파란색으로 이중 결합을 색칠하여 구조 공식에 표시된 세 번째 링에서 다양한 수준의 포화도가 가능하다.
β-카볼린의 예
보다 중요한 일부 β-카볼린은 아래 구조별로 표로 작성된다.이들의 구조물은 앞에서 언급한 적색 또는 청색으로 표시된 결합을 포함할 수 있다.
| 단축 이름 | R1 | R6 | R7 | R9 | 구조 |
|---|---|---|---|---|---|
| β-카르볼린 | H | H | H | H |  |
| 피놀린 | H | OCH3 | H | H |  |
| 하르메 | CH3 | H | H | H |  |
| 하르민 | CH3 | H | OCH3 | H | 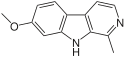 |
| 하르말린 | CH3 | H | OCH3 | H |  |
| 하르말롤 | CH3 | H | 오호 | H |  |
| 테트라하이드로아민 | CH3 | H | OCH3 | H |  |
| 9-메틸-β-카볼린 | H | H | H | CH3 | 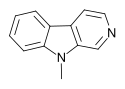 |
| 3-카르복시-테트라하이드론하르만 | H / CH3 / COOH | H | H | H |  |
자연발생
β-카르볼린 알칼로이드는 원핵생물, 식물, 동물에 널리 퍼져 있다.일부 β-카볼린, 특히 테트라하이드로-카볼린들은 트립토판, 세로토닌 및 트립타민을 전구체로 하여 식물과 인체에서 자연적으로 형성될 수 있다.
- 총 8개의 식물군은 64종의 β-카볼린 알칼로이드를 표현하는 것으로 알려져 있다.예를 들어 β-카볼린들은 하르민, 하르말린, 테트라하이드로아민은 리아나 바니스테리오시스 카피의 성분으로 토착 사이키델릭 약제 아야후아스카의 약리학에 중추적인 역할을 한다.더욱이 페가눔 하르말라(시리아 루)의 씨앗은 0.16%~[29]5.9% [30]β-카볼린 알칼로이드(건조량 기준)를 함유하고 있다.
- β-카르볼린 유도체 특정 그룹인 '에우디스토민'은 리트렐라 시길리노이드,[31] 리소클리눔 깨지기 쉬운 또는 유사디스토마 아우레움과 같은 아스키디안(Ascidiacea 계열의 해양곡)에서 추출되었다.[33]
- 노스토카르볼린은 민물 시아노박테리움으로부터 격리되었다.[34]
- 완전 방향족인 β-카볼린도 많은 식품에서 발생하지만 낮은 농도에서 발생한다.양조된 커피, 건포도, 잘 다진 생선과 육류에서 가장 많은 양이 검출되었다.[35]흡연은 1인당 최대 수천 µg의 수준을 가진 완전 방향족 β-카볼린의 또 다른 중요한 공급원이다.[36]
- β-카볼린도 전갈의 큐티클에서 발견되어 특정 파장(예: 블랙라이트)에서 자외선에 노출되면 피부가 형광색으로 변한다.[37]
참고 항목
참조
- ^ Francik R, Kazek G, Cegła M, Stepniewski M (March 2011). "Antioxidant activity of beta-carboline derivatives". Acta Poloniae Pharmaceutica. 68 (2): 185–189. PMID 21485291.
- ^ Gulyaeva N, Aniol V (June 2012). "Good guys from a shady family". Journal of Neurochemistry. 121 (6): 841–842. doi:10.1111/j.1471-4159.2012.07708.x. PMID 22372749.
- ^ a b Aaghaz S, Sharma K, Jain R, Kamal A (April 2021). "β-Carbolines as potential anticancer agents". European Journal of Medicinal Chemistry. 216: 113321. doi:10.1016/j.ejmech.2021.113321. PMID 33684825.
- ^ Mennenga SE, Gerson JE, Dunckley T, Bimonte-Nelson HA (January 2015). "Harmine treatment enhances short-term memory in old rats: Dissociation of cognition and the ability to perform the procedural requirements of maze testing". Physiology & Behavior. 138: 260–265. doi:10.1016/j.physbeh.2014.09.001. PMC 4406242. PMID 25250831.
- ^ Becker W, Sippl W (January 2011). "Activation, regulation, and inhibition of DYRK1A". The FEBS Journal. 278 (2): 246–256. doi:10.1111/j.1742-4658.2010.07956.x. PMID 21126318.
- ^ Glennon RA, Dukat M, Grella B, Hong S, Costantino L, Teitler M, et al. (August 2000). "Binding of beta-carbolines and related agents at serotonin (5-HT(2) and 5-HT(1A)), dopamine (D(2)) and benzodiazepine receptors". Drug and Alcohol Dependence. 60 (2): 121–132. doi:10.1016/s0376-8716(99)00148-9. PMID 10940539.
- ^ a b Fortunato JJ, Réus GZ, Kirsch TR, Stringari RB, Stertz L, Kapczinski F, et al. (November 2009). "Acute harmine administration induces antidepressive-like effects and increases BDNF levels in the rat hippocampus". Progress in Neuro-Psychopharmacology & Biological Psychiatry. Bed nucleus of the stria terminalis: anatomy, physiology, functions. 33 (8): 1425–1430. doi:10.1016/j.pnpbp.2009.07.021. PMID 19632287.
- ^ a b Fortunato JJ, Réus GZ, Kirsch TR, Stringari RB, Fries GR, Kapczinski F, et al. (October 2010). "Chronic administration of harmine elicits antidepressant-like effects and increases BDNF levels in rat hippocampus". Journal of Neural Transmission. 117 (10): 1131–1137. doi:10.1007/s00702-010-0451-2. PMID 20686906.
- ^ López-Muñoz F, Alamo C (2009-05-01). "Monoaminergic neurotransmission: the history of the discovery of antidepressants from 1950s until today". Current Pharmaceutical Design. 15 (14): 1563–1586. doi:10.2174/138161209788168001. PMID 19442174.
- ^ Antkiewicz-Michaluk L, Rommelspacher H, eds. (2012). "Isoquinolines And Beta-Carbolines As Neurotoxins And Neuroprotectants". doi:10.1007/978-1-4614-1542-8.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ a b Wernicke C, Hellmann J, Zieba B, Kuter K, Ossowska K, Frenzel M, et al. (January 2010). "9-Methyl-beta-carboline has restorative effects in an animal model of Parkinson's disease". Pharmacological Reports. 62 (1): 35–53. doi:10.1016/s1734-1140(10)70241-3. PMID 20360614.
- ^ a b Gruss M, Appenroth D, Flubacher A, Enzensperger C, Bock J, Fleck C, et al. (June 2012). "9-Methyl-β-carboline-induced cognitive enhancement is associated with elevated hippocampal dopamine levels and dendritic and synaptic proliferation". Journal of Neurochemistry. 121 (6): 924–931. doi:10.1111/j.1471-4159.2012.07713.x. PMID 22380576.
- ^ Hamann J, Wernicke C, Lehmann J, Reichmann H, Rommelspacher H, Gille G (March 2008). "9-Methyl-beta-carboline up-regulates the appearance of differentiated dopaminergic neurones in primary mesencephalic culture". Neurochemistry International. 52 (4–5): 688–700. doi:10.1016/j.neuint.2007.08.018. PMID 17913302.
- ^ Polanski W, Reichmann H, Gille G (June 2011). "Stimulation, protection and regeneration of dopaminergic neurons by 9-methyl-β-carboline: a new anti-Parkinson drug?". Expert Review of Neurotherapeutics. 11 (6): 845–860. doi:10.1586/ern.11.1. PMID 21651332.
- ^ a b Venault P, Chapouthier G (February 2007). "From the behavioral pharmacology of beta-carbolines to seizures, anxiety, and memory". TheScientificWorldJournal. 7: 204–223. doi:10.1100/tsw.2007.48. PMC 5901106. PMID 17334612.
- ^ Mendelson WB, Cain M, Cook JM, Paul SM, Skolnick P (January 1983). "A benzodiazepine receptor antagonist decreases sleep and reverses the hypnotic actions of flurazepam". Science. 219 (4583): 414–416. Bibcode:1983Sci...219..414M. doi:10.1126/science.6294835. PMID 6294835. S2CID 43038332.
- ^ Panthee S, Takahashi S, Hayashi T, Shimizu T, Osada H (April 2019). "β-carboline biomediators induce reveromycin production in Streptomyces sp. SN-593". Scientific Reports. 9 (1): 5802. Bibcode:2019NatSR...9.5802P. doi:10.1038/s41598-019-42268-w. PMC 6456619. PMID 30967594.
- ^ Panthee S, Kito N, Hayashi T, Shimizu T, Ishikawa J, Hamamoto H, et al. (June 2020). "β-carboline chemical signals induce reveromycin production through a LuxR family regulator in Streptomyces sp. SN-593". Scientific Reports. 10 (1): 10230. Bibcode:2020NatSR..1010230P. doi:10.1038/s41598-020-66974-y. PMC 7311520. PMID 32576869.
- ^ MacAlpine J, Daniel-Ivad M, Liu Z, Yano J, Revie NM, Todd RT, et al. (October 2021). "A small molecule produced by Lactobacillus species blocks Candida albicans filamentation by inhibiting a DYRK1-family kinase". Nature Communications. 12 (1): 6151. doi:10.1038/s41467-021-26390-w. PMID 34686660.
- ^ a b c d Djamshidian A, Bernschneider-Reif S, Poewe W, Lees AJ (2016). "Banisteriopsis caapi, a Forgotten Potential Therapy for Parkinson's Disease?". Movement Disorders Clinical Practice. 3 (1): 19–26. doi:10.1002/mdc3.12242. PMC 6353393. PMID 30713897.
- ^ Foley P (2003). "Beans, roots and leaves: a brief history of the pharmacological therapy of parkinsonism". Wurzburger Medizinhistorische Mitteilungen. 22: 215–234. PMID 15641199.
- ^ Schwarz MJ, Houghton PJ, Rose S, Jenner P, Lees AD (June 2003). "Activities of extract and constituents of Banisteriopsis caapi relevant to parkinsonism". Pharmacology, Biochemistry, and Behavior. 75 (3): 627–633. doi:10.1016/s0091-3057(03)00129-1. PMID 12895680.
- ^ Brierley DI, Davidson C (January 2013). "Harmine augments electrically evoked dopamine efflux in the nucleus accumbens shell". Journal of Psychopharmacology. 27 (1): 98–108. doi:10.1177/0269881112463125. PMID 23076833.
- ^ Samoylenko V, Rahman MM, Tekwani BL, Tripathi LM, Wang YH, Khan SI, et al. (February 2010). "Banisteriopsis caapi, a unique combination of MAO inhibitory and antioxidative constituents for the activities relevant to neurodegenerative disorders and Parkinson's disease". Journal of Ethnopharmacology. 127 (2): 357–367. doi:10.1016/j.jep.2009.10.030. PMC 2828149. PMID 19879939.
- ^ Barallobre MJ, Perier C, Bové J, Laguna A, Delabar JM, Vila M, Arbonés ML (June 2014). "DYRK1A promotes dopaminergic neuron survival in the developing brain and in a mouse model of Parkinson's disease". Cell Death & Disease. 5 (6): e1289. doi:10.1038/cddis.2014.253. PMC 4611726. PMID 24922073.
- ^ Du W, Aloyo VJ, Harvey JA (October 1997). "Harmaline competitively inhibits [3H]MK-801 binding to the NMDA receptor in rabbit brain". Brain Research. 770 (1–2): 26–29. doi:10.1016/s0006-8993(97)00606-9. PMID 9372198.
- ^ 정신 활동 식물 백과사전: 민족학 및 그 응용.라치, 크리스찬파크 스트리트 프레스 c. 2005
- ^ Baiget J, Llona-Minguez S, Lang S, Mackay SP, Suckling CJ, Sutcliffe OB (2011). "Manganese dioxide mediated one-pot synthesis of methyl 9H-pyrido[3,4-b]indole-1-carboxylate: Concise synthesis of alangiobussinine". Beilstein Journal of Organic Chemistry. 7: 1407–1411. doi:10.3762/bjoc.7.164. PMC 3201054. PMID 22043251.
- ^ Hemmateenejad B, Abbaspour A, Maghami H, Miri R, Panjehshahin MR (August 2006). "Partial least squares-based multivariate spectral calibration method for simultaneous determination of beta-carboline derivatives in Peganum harmala seed extracts". Analytica Chimica Acta. 575 (2): 290–299. doi:10.1016/j.aca.2006.05.093. PMID 17723604.
- ^ Herraiz T, González D, Ancín-Azpilicueta C, Arán VJ, Guillén H (March 2010). "beta-Carboline alkaloids in Peganum harmala and inhibition of human monoamine oxidase (MAO)". Food and Chemical Toxicology. 48 (3): 839–845. doi:10.1016/j.fct.2009.12.019. hdl:10261/77694. PMID 20036304.
- ^ Lake RJ, Blunt JW, Munro MH (1989). "Eudistomins from the New Zealand ascidian Ritterella sigillinoides". Aust. J. Chem. 42 (7): 1201–1206. doi:10.1071/CH9891201.
- ^ Badre A, Boulanger A, Abou-Mansour E, Banaigs B, Combaut G, Francisco C (April 1994). "Eudistomin U and isoeudistomin U, new alkaloids from the Caribbean ascidian Lissoclinum fragile". Journal of Natural Products. 57 (4): 528–533. doi:10.1021/np50106a016. PMID 8021654.
- ^ Davis RA, Carroll AR, Quinn RJ (July 1998). "Eudistomin V, a new beta-carboline from the Australian ascidian Pseudodistoma aureum". Journal of Natural Products. 61 (7): 959–960. doi:10.1021/np9800452. PMID 9677285.
- ^ Becher PG, Beuchat J, Gademann K, Jüttner F (December 2005). "Nostocarboline: isolation and synthesis of a new cholinesterase inhibitor from Nostoc 78-12A". Journal of Natural Products. 68 (12): 1793–1795. doi:10.1021/np050312l. PMID 16378379.
- ^ Herraiz, Tomás (2011-11-10), "β-Carbolines as Neurotoxins", Isoquinolines And Beta-Carbolines As Neurotoxins And Neuroprotectants, Boston, MA: Springer US, pp. 77–103, retrieved 2021-11-16
- ^ Herraiz, T.; González, D.; Ancín-Azpilicueta, C.; Arán, V.J.; Guillén, H. (March 2010). "β-Carboline alkaloids in Peganum harmala and inhibition of human monoamine oxidase (MAO)". Food and Chemical Toxicology. 48 (3): 839–845. doi:10.1016/j.fct.2009.12.019. ISSN 0278-6915.
- ^ Stachel SJ, Stockwell SA, Van Vranken DL (August 1999). "The fluorescence of scorpions and cataractogenesis". Chemistry & Biology. 6 (8): 531–539. doi:10.1016/S1074-5521(99)80085-4. PMID 10421760.
외부 링크
- 미국 국립 의학 도서관의 베타 카볼린(MeSH)
- TiHKAL #44번
- 일반적으로 TiHKAL
- 커피 속 베타 카볼린
- Farzin D, Mansouri N (July 2006). "Antidepressant-like effect of harmane and other beta-carbolines in the mouse forced swim test". European Neuropsychopharmacology. 16 (5): 324–328. doi:10.1016/j.euroneuro.2005.08.005. PMID 16183262. S2CID 54410407.




