혈소판
Platelet| 혈소판 | |
|---|---|
 | |
| 세부 사항 | |
| 전구체 | 거대핵세포 |
| 기능. | 혈전 형성, 출혈 방지 |
| 식별자 | |
| 라틴어 | 혈소판 |
| MeSH | D001792 |
| FMA | 62851 |
| 미세해부학적 용어 | |
혈소판 또는 혈전 세포(그리스어 κμβγ, "cloth" 및 "cell"에서 유래)는 혈액의 구성 요소로, 응고 인자와 함께, 뭉쳐 혈관 손상으로 인한 출혈에 반응하여 [1]혈전을 시작하는 기능을 합니다.혈소판은 세포핵을 가지고 있지 않습니다; 그것들은 [3]골수나 폐의[2] 거대핵 세포에서 유래된 세포질의 조각들이고, 그리고 나서 순환으로 들어갑니다.혈소판은 포유류에서만 발견되는 반면 다른 척추동물(조류, 양서류)에서는 혈소판이 온전한 [4]: 3 단핵세포로 순환합니다.
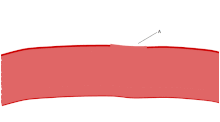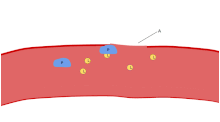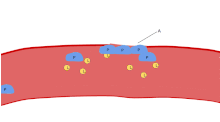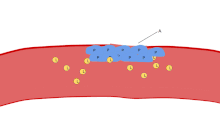
혈소판의 주요 기능 중 하나는 지혈에 기여하는 것입니다. 즉, 중단된 내피 부위에서 출혈이 멈추는 과정입니다.그들은 현장에 모여 물리적으로 방해가 너무 크지 않는 한 구멍을 막습니다.첫째, 혈소판은 중단된 내피 외부의 물질에 부착됩니다: 접착.둘째로, 그들은 모양을 바꾸고, 수용기를 켜고, 화학적 메신저를 분비합니다: 활성화.셋째, 수용체 브리지(receptor bridge)를 통해 서로 연결됩니다: 응집([5]aggregation).이 혈소판 플러그의 형성(1차 지혈)은 결과적인 피브린 침착 및 연결(2차 지혈)과 함께 응고 캐스케이드의 활성화와 관련이 있습니다.이러한 과정은 중복될 수 있습니다: 스펙트럼은 주로 혈소판 플러그, "흰색 응고"에서 주로 피브린, "붉은 응고" 또는 더 전형적인 혼합물로 구성됩니다.어떤 사람들은 공정의[6] 완료에 4단계와 5단계로 뒤이은 수축과 혈소판 억제를 추가하고, 또 다른 사람들은 6단계인 상처 치료를 추가합니다.혈소판은 선천적 및 적응적[8] 혈관내 면역반응에도[7] 참여합니다.
구조.
구조.
혈소판은 구조적으로 주변 영역에서 가장 [citation needed]안쪽 영역까지 4개 영역으로 나눌 수 있습니다.
- 주변 영역 – 혈소판 부착, 활성화 및 응집에 필요한 당단백질이 풍부합니다.예를 들어, GPIb/IX/V; GPIVI; GPIb/IIIa.
- 솔-겔 존 – 미세한 튜브와 미세한 필라멘트가 풍부하여 혈소판이 원반 모양을 유지할 수 있습니다.
- 오가넬 구역 – 혈소판 과립이 풍부합니다.알파 과립은 인자 V, 인자 VIII, 피브리노겐, 피브로넥틴, 혈소판 유래 성장인자 및 화학작용제와 같은 응고 매개물질을 포함합니다.델타 과립, 즉 촘촘한 몸에는 혈소판을 활성화하는 매개물질인 ADP, 칼슘, 세로토닌이 포함되어 있습니다.
- 막 영역 – 거대핵 세포의 매끄러운 소포체로부터 유도된 막이 트롬복산 A2 합성을 담당하는 밀집된 관형 시스템으로 조직되어 있습니다.이 치밀한 튜브 시스템은 트롬복산 A2 방출을 돕기 위해 표면 혈소판 막에 연결됩니다.
모양.
순환하는 비활성 혈소판은 최대 [10]직경 2~3 μm의 쌍곡선 디스코이드([9][4]: 117–118 렌즈 모양) 구조입니다.활성화된 혈소판은 표면을 덮고 있는 세포막 돌출부를 가지고 있습니다.
첫 번째 근사치에서 혈소판 형태는 편평한 스페로이드와 유사한 것으로 간주될 수 있으며, 반축비는 2 대 [11]8입니다.이 근사치는 혈소판 모집단의 유체역학적 특성과 광학적 특성을 모델링하고 유세포분석을 [12]통해 개별 측정된 혈소판의 기하학적 매개변수를 복원하는 데 종종 사용됩니다.첫 번째 원리로부터 모양을 모델링하는 혈소판 표면 형태학의 더 정확한 생물물리학 모델은 침착하고 활성화된 [13]상태에서 더 현실적인 혈소판 기하학을 얻는 것을 가능하게 합니다.
발전

- 거대핵세포와 혈소판의 생성은 신장과 간에서 생성되는 호르몬인 트롬보포이에틴에 의해 조절됩니다.
- 각각의 거대핵세포는 일생 동안 1,000개에서 3,000개의 혈소판을 생산합니다.
- 건강한 성인에게서 하루 평균 10개의11 혈소판이 생산됩니다.
- 예비 혈소판은 비장에 저장되며 교감 신경계에 의해 유발된 비장 수축에 의해 필요할 때 방출됩니다.

- 순환 혈소판의 평균 수명은 8-9일입니다.[14]개별 혈소판의 수명은 Bcl-xL [15]타이머가 있는 내부 세포질 조절 경로에 의해 조절됩니다.
- 오래된 혈소판은 비장과 간에서 식세포증에 의해 파괴됩니다.
지혈

혈소판의 기본적인 기능은 뭉쳐서 급성 출혈을 막는 것입니다.193개 이상의 단백질과 301개의 상호작용이 혈소판 [5]역학에 관여하는 것으로 알려져 있기 때문에 이 과정은 복잡합니다.겹치는 부분이 많지만 혈소판 기능은 세 단계로 모델링할 수 있습니다.
접착력
온전한 내피의 혈전 형성은 산화 [16]질소, 프로스타사이클린 [17]및 CD39에 의해 방지됩니다.[18]
내피 세포는 폰 윌레브란트 인자(VWF)에 의해 내피하 콜라겐에 부착되며, 이 세포들은 이 콜라겐을 생성합니다.VWF는 또한 내피 세포의 Weibel-Palade 체내에 저장되어 혈액 내로 구성적으로 분비됩니다.혈소판은 vWF를 알파 과립에 저장합니다.
내피층이 파괴되면 콜라겐과 VWF는 혈소판을 내피하에 고정시킵니다.혈소판 GP1b-IX-V 수용체는 VWF와 결합하고; GPVI 수용체 및 인테그린 α2β1은 [19]콜라겐과 결합함.
활성화

억제
온전한 내피 라이닝은 산화질소, 내피-ADPase 및 PGI2(prostacyclin)를 생성하여 혈소판 활성화를 억제합니다.내피-ADP효소는 혈소판 활성화제 [citation needed]ADP를 분해합니다.
휴지 혈소판은 순환 AMP 활성화 칼슘 펌프를 통해 활성 칼슘 배출을 유지합니다.혈소판 형상 변화와 탈과립화를 촉진하는 두 번째 메신저이기 때문에 세포 내 칼슘 농도는 혈소판 활성화 상태를 결정합니다(아래 참조).내피 프로스타사이클린은 휴지 혈소판의 표면에 있는 프로스타노이드 수용체에 결합합니다.이 이벤트는 결합된 Gs 단백질을 자극하여 아데닐레이트 사이클라아제 활성을 증가시키고 cAMP의 생성을 증가시켜 칼슘의 유출을 더욱 촉진시키고 혈소판 [citation needed]활성화를 위한 세포 내 칼슘 가용성을 감소시킵니다.
반면 ADP는 혈소판 표면의 퓨린성 수용체에 결합합니다.혈소판 퓨린성 수용체 P2Y12는 Gi 단백질과 결합되어 있기 때문에 ADP는 혈소판 아데닐레이트 사이클라아제 활성과 cAMP 생성을 감소시켜 cAMP 칼슘 유출 펌프를 비활성화함으로써 혈소판 내부의 칼슘 축적을 유도합니다.다른 ADP-수용체 P2Y1은 포스포리파아제 C-베타2(PLCB2)를 활성화하는 Gq에 결합하여 이노시톨 1,4,5-트리스포스페이트(IP3) 생성 및 세포 내 더 많은 칼슘 방출을 초래합니다.이는 함께 혈소판 활성화를 유도합니다.내피성 ADPase는 ADP를 저하시키고 이러한 현상을 방지합니다.클로피도그렐과 관련된 항혈소판제는 퓨린저성 수용체 P2Y12 [citation needed]길항제로서도 작용합니다.데이터에 따르면 ADP는 첫 번째 응집 파동 동안 PI3K/Akt 경로를 활성화하여 트롬빈 생성 및 두 번째 [20]응집 파동을 유발하는 PARγ1 활성화로 이어집니다.
트리거(유도)
혈소판 활성화는 부착이 발생한 후 몇 초 안에 시작됩니다.피하피의 콜라겐이 혈소판의 수용체(GPVI 수용체 및 인테그린 α2β1)와 결합할 때 유발됩니다.GPVI는 Fc 수용체 감마 사슬과 관련이 있으며, 티로신 키나아제 캐스케이드의 활성화를 통해 최종적으로 PLC-감마2(PLCG2)의 활성화 [citation needed]및 더 많은 칼슘 방출로 이어집니다.
조직 인자는 또한 혈액의 인자 VII에 결합하며, 이는 트롬빈 생성을 증가시키기 위해 외인성 응고 캐스케이드를 시작합니다.트롬빈은 Gq와 G12를 통해 작용하는 강력한 혈소판 활성화제입니다.이것들은 G 단백질로 결합된 수용체이며, 그들은 기본적인 칼슘 유출을 극복하면서 혈소판 내에서 칼슘 매개 신호 경로를 켭니다.3개의 G 단백질(Gq, Gi, G12) 패밀리는 완전한 활성화를 위해 함께 작동합니다.트롬빈은 또한 혈소판 플러그의 2차 피브린 강화를 촉진합니다.혈소판 활성화는 인자 V와 피브리노겐을 분해하고 방출하여 응고 캐스케이드를 잠재시킵니다.따라서, 실제로는 혈소판의 플러그와 응고 과정이 순차적이라기보다는 동시에 일어나고 있으며, 각각은 다른 사람을 유도하여 최종적인 피브린-가교 혈전을 [citation needed]형성하도록 유도하고 있습니다.
구성요소(결과)
GPIB/IIIa 활성화
콜라겐 매개 GPVI 신호전달은 트롬복산 A2(TXA2)의 혈소판 생성을 증가시키고 프로스타사이클린의 생성을 감소시킵니다.이것은 효소 포스포리파아제 A2, 사이클로-산소효소 1 및 트롬복산-A 합성효소를 포함하는 혈소판의 에이코사노이드 합성 경로의 대사 흐름을 변화시킴으로써 발생합니다.혈소판은 혈소판 표면에 있는 혈소판 자체의 트롬복산 수용체(따라서 소위 "아웃 인" 메커니즘)에 작용하는 트롬복산 A2와 다른 혈소판의 그것들을 분비합니다.이러한 수용체는 GPIB/IIIa 수용체를 활성 형태로 전환하여 [5]응집을 시작하는 혈소판 내 신호전달을 유발합니다.
과립 분비

혈소판은 밀도가 높은 과립, 람다 과립 및 알파 과립을 포함합니다.활성화된 혈소판은 이 과립들의 내용물을 그들의 운하 시스템을 통해 외부로 분비합니다.간단하게, 결합되고 활성화된 혈소판이 탈과립되어 혈소판 화학작용제를 방출하여 내피 손상 부위로 더 많은 혈소판을 끌어들입니다.과립 특성:
- α 과립(알파 과립) – P-셀렉틴, 혈소판 인자 4, 형질전환성장인자-β1, 혈소판 유래성장인자, 피브로넥틴, B-트롬보글로불린, vWF, 피브리노겐 및 응고인자 V, XIII 함유
- ◦ 과립(델타 또는 밀도가 높은 과립) – ADP 또는 ATP, 칼슘 및 세로토닌 포함
- ◦ 과립(과립) – 리소좀과 유사하며 여러 가수분해효소를 포함함
- ∙ 과립(lambdaλ) – 선박 수리 후기의 재흡수에 관여하는 내용물
형태변화
유세포분석과 전자현미경에서 볼 수 있듯이, ADP를 사용하여 혈소판에 노출될 때 가장 민감한 활성화 신호는 형태학적 [21]변화입니다.미토콘드리아 과분극화는 형태학의 [22]변화를 시작하는 데 중요한 사건입니다.혈소판 내 칼슘 농도가 증가하여 미세관/액틴 필라멘트 복합체 사이의 상호작용을 자극합니다.활성화되지 않은 혈소판에서 완전히 활성화된 혈소판으로의 연속적인 형태 변화는 주사 전자 현미경에서 가장 잘 보입니다.이 길을 따라 세 단계를 조기 수지상, 조기 확산, 확산이라고 명명합니다.활성화되지 않은 혈소판의 표면은 뇌의 표면과 매우 비슷하게 생겼으며, 표면적을 넓히기 위해 여러 번의 얕은 접힌 주름에서 나온 주름진 모습; 초기 수지상, 다수의 팔과 다리를 가진 문어; 초기 확산, 팬에 익히지 않은 계란 후라이, "노른자"가 중심체이고, 확산,중심부가 더 조밀한 익힌
이러한 변화는 혈소판 세포막과 미세소관/액틴 복합체의 상호작용과 그 막의 확장 및 침지인 개방관계(OCS)에 의해 모두 유도됩니다.이 복합체는 이 막들 바로 아래에 위치하며 말 그대로 염증이 있는 OCS를 혈소판 내부에서 끌어내는 화학 모터입니다. 바지 주머니를 뒤집어 수지상 조직을 만드는 것과 같이 말입니다.이 과정은 근육세포의 [23]수축기전과 비슷합니다.따라서 OCS 전체가 "계란 튀김"을 형성하기 때문에 초기 혈소판 막과 구별할 수 없게 됩니다.표면적의 이러한 극적인 증가는 혈소판 [24]막에 인지질을 추가하거나 늘리지 않으면서 발생합니다.
혈소판-응고 인자 상호작용: 응고 촉진
혈소판 활성화로 인해 막 표면이 음전하를 띄게 됩니다.신호 전달 경로 중 하나는 음전하를 띤 인지질을 안쪽의 혈소판 막 표면에서 바깥쪽의 혈소판 막 표면으로 이동시키는 스크램블레이스를 켭니다.그리고 나서 이러한 인지질은 혈소판과 응고 캐스케이드 사이의 상호작용 장소 중 두 곳인 테나아제와 프로트롬비나아제 복합체를 결합시킵니다.칼슘 이온은 이러한 응고 인자의 결합에 필수적입니다.
혈소판은 vWF 및 피브린과의 상호작용 외에도 트롬빈, 인자 X, Va, VIIa, XI, IX 및 프로트롬빈과 상호작용하여 응고 [25][26]캐스케이드를 통해 형성을 완료합니다.6개의 연구는 혈소판이 조직 인자를 발현한다고 제안했습니다. 최종 연구는 [25]혈소판이 그렇지 않다는 것을 보여줍니다.쥐의 혈소판은 결론적으로 조직 인자 단백질을 발현하는 것으로 나타났으며 또한 쥐의 혈소판은 조직 인자 pre-mRNA와 성숙 mRNA를 [27]모두 운반한다는 것이 증명되었습니다.
집계

혈소판의 응집은 활성화 후 몇 분 후에 시작되며, GPIIb/IIIa 수용체를 켜는 결과로 발생하여 이러한 수용체가 vWF 또는 [5]fibrinogen과 결합할 수 있습니다.혈소판 [28]당 약 6만개의 이러한 수용체가 있습니다.활성화 중에 적어도 9개의 다른 혈소판 표면 수용체 중 하나 이상이 켜지면, 혈소판 내 신호 경로는 기존 GpIIb/IIIa 수용체가 모양을 바꾸어 곧게 말려 [5]결합할 수 있게 합니다.
피브리노겐은 GPIB/IIIa를 결합시킬 수 있는 양쪽 끝에 결절이 있는 막대형 단백질이기 때문에, GPIB/IIIa가 노출된 활성화된 혈소판은 피브리노겐을 응집체로 결합시킬 수 있습니다.또한 GPIB/IIIa는 추가적인 구조적 안정화를 위해 혈소판을 피하 vWF에 추가로 고정시킬 수 있습니다.
고전적으로 이것이 응집에 관련된 유일한 메커니즘이라고 생각되었지만 혈류 속도(즉, 전단 범위)[29]에 따라 응집을 시작할 수 있는 세 가지 새로운 메커니즘이 확인되었습니다.
면역기능
혈소판은 선천적 면역에 중심적인 역할을 하며, 다양한 염증 과정에 참여하고 병원체를 직접적으로 결합시키고 심지어는 파괴합니다.이것은 심각한 세균이나 바이러스 감염을 가진 많은 사람들이 혈소판 감소증을 가지고 있어서 염증에 대한 기여를 감소시킨다는 임상 데이터를 뒷받침합니다.패혈증이나 염증성 장질환에서는 혈소판-백혈구 응집체(PLA)가 대표적인데, 혈소판과 면역세포의 [30]연관성을 보여줍니다.
혈소판 세포막에는 콜라겐에 대한 수용체가 있습니다.혈관 벽이 파열된 후 혈소판이 노출되고 주변 결합 조직의 콜라겐에 부착됩니다.
면역혈전증
지혈은 포유류에서 혈소판의 기본적인 기능이기 때문에, 감염을 제한하는 [7]데에도 그 용도가 있습니다.부상의 경우 혈소판은 응고 캐스케이드와 함께 혈전을 형성함으로써 첫 번째 방어선을 형성합니다.따라서 지혈과 숙주 방어가 진화 과정에서 얽혀 있었습니다.예를 들어 대서양 투구 게(4억년 이상 된 것으로 추정되는 살아있는 화석)에서 유일한 혈구형인 아메보사이트는 지혈 기능과 세균성 방어 분자를 포함하는 세포 내 과립의 외세포화를 통해 병원균의 캡슐화 및 식세포화를 촉진합니다.혈액 응고는 병원성 박테리아를 [31]안에 가둠으로써 면역 기능을 지원합니다.
비록 혈전증, 즉 온전한 혈관의 혈액 응고는 보통 병리학적 면역 반응으로 보여지는데, 혈관 내강의 둔각과 그에 따른 저산소 조직 손상으로 이어지는데, 어떤 경우에는 면역 혈전증이라고 불리는 지시 혈전증이 국소적으로 감염의 확산을 조절할 수 있습니다.혈전증은 혈소판, 호중구, 단핵구의 일치성으로 진행됩니다.이 과정은 면역 세포가 그들의 패턴 인식 수용체(PRR)를 활성화함으로써 또는 혈소판-박테리아 결합에 의해 시작됩니다.혈소판은 혈소판 PRR과[30] 박테리아 표면 단백질을 통해 직접적으로 박테리아와 결합하거나 혈소판과 [32]박테리아 모두에 결합하는 혈장 단백질을 통해 박테리아와 결합할 수 있습니다.단세포는 응고의 외인성 경로를 활성화함으로써 박테리아 병원체 관련 분자 패턴(PAMP) 또는 손상 관련 분자 패턴(DAMP)에 반응합니다.호중구는 NETosis에 의한 혈액 응고를 촉진합니다.차례로, 혈소판은 호중구의 네토시스를 촉진합니다.NET는 조직 인자를 결합시켜 응고 중심을 감염 위치에 결합시킵니다.그들은 또한 XII 인자에 음전하를 띤 표면을 제공함으로써 내재 응고 경로를 활성화시킵니다.응고 억제제를 분해하는 단백질 분해 효소와 같은 다른 호중구 분비물 또한 [7]과정을 강화합니다.
면역혈전을 조절하는 동안 불균형이 발생할 경우, 이 과정은 빠르게 이상해질 수 있습니다.면역혈전증의 조절결함은 파종성 혈관내 응고(DIC)나 심부정맥혈전증과 같이 여러 형태로 병리적 혈전증을 일으키는 주요 요인으로 의심됩니다.패혈증의 DIC는 조절되지 않은 응고 과정뿐만 아니라 과도한 전신 염증 반응의 대표적인 예로, 피브린, 혈소판, 호중구 [7]및 NET과 같은 생리학적 면역 혈전증과 유사한 구성의 다수의 미세혈청을 초래합니다.
염증
혈소판은 부상이나 감염 부위에 빠르게 배치되며 백혈구와 상호작용하고 사이토카인, 케모카인 및 기타 염증 [33][34][35][36][37]매개물질을 분비함으로써 잠재적으로 염증 과정을 조절합니다.혈소판은 또한 혈소판 유래 성장인자(PDGF)를 분비합니다.
혈소판은 혈소판-백혈구 응집체(PLA)를 형성함으로써 호중구를 조절합니다.이러한 형성은 호중구에서 αmβ2 (Mac-1) 인테그린의 상향조절 생성을 유도합니다.PLA와의 상호작용은 호중구의 탈과립화와 증가된 식세포증을 유도하기도 합니다.혈소판은 또한 반응성 산소종(ROS)의 생성과 호중구에서 E-셀렉틴, ICAM-1 및 VCAM-1과 같은 부착 분자의 과조절 발현을 유도하고 대식세포를 활성화하며 T [30]및 B 림프구에서 세포독성 반응을 활성화하는 가용성 CD40L의 가장 큰 공급원입니다.
최근에는 핵이 없는 포유류의 혈소판이 자율적인 운동을 할 수 없다는 믿음이 [38]반증되었습니다.사실, 혈소판은 혈관 벽을 확장시키고 혈전을 재구성하는 활동적인 청소기입니다.그들은 박테리아를 포함한 많은 표면을 인식하고 부착하여 개방된 운하 체계(OCP)에 완전히 덮을 수 있으며, OCS가 단지 외부 혈장 막의 침투이기 때문에, 식세포증이 아닌 "커버시토시스"라는 프로세스 이름이 제안되게 합니다.이 혈소판-세균 다발은 이후 NETosis와 식세포증을 이용하여 박테리아를 파괴하는 호중구를 위한 상호작용 플랫폼으로 사용됩니다.
혈소판은 활막염이나 류마티스 [39]관절염과 같은 만성 염증성 질환에도 참여합니다.혈소판은 콜라겐 수용체 당단백질 IV(GPVI)에 의해 활성화됩니다.염증성 혈소판 마이크로베시클은 이웃한 섬유아세포와 유사한 활모세포, 특히 Il-6 및 Il-8로부터 일정한 사이토카인 분비를 유발합니다.주변 세포외기질의 염증성 손상은 지속적으로 더 많은 콜라겐을 노출시켜 미세 소포의 생성을 유지합니다.
적응면역
활성화된 혈소판은 항체와 상호작용하면서 적응 면역에 참여할 수 있습니다.그들은 IgG의 일정한 단편(Fc)에 대한 수용체인 FcγRIIA를 통해 IgG에 특이적으로 결합할 수 있습니다.활성화되고 IgG 색소화된 박테리아에 결합되면 혈소판은 활성산소종(ROS), 항균 펩타이드, 디펜신, 키노키딘 및 프로테아제를 방출하여 박테리아를 직접 [40]죽입니다.혈소판은 또한 선천적 및 적응적 면역 [40][41]반응을 연결하는 무기 폴리포스페이트 또는 혈소판 인자 4 (PF4)와 같은 염증 및 응집 촉진 매개물질을 분비합니다.
장애의 징후 및 증상
혈소판 장애로 인해 자발적이고 과다한 출혈이 발생할 수 있습니다.이 출혈은 혈소판이 부족하거나, 기능하지 않는 혈소판이 부족하거나, 혈소판이 매우 과도하게 많아(100만/마이크로리터 이상) 발생할 수 있습니다.(과잉된 수치는 격리로 인한 상대적인 폰 윌레브란트 요인 결핍을 발생시킵니다.)[42][43]
출혈의 [4]: 815, Table 39-4 특성과 위치로 출혈이 혈소판 장애 때문인지 응고 인자 장애 때문인지에 대한 단서를 얻을 수 있습니다.다음의 모든 것은 응고 출혈이 아닌 혈소판 출혈을 시사합니다. 면도기에 베인 상처로 인한 출혈은 신속하고 과도하지만 압력에 의해 조절될 수 있습니다. 피부에 자발적인 출혈이 발생하여 크기에 따라 이름 지어진 보랏빛 얼룩을 유발합니다: 페테키아, 자반, 회충, 점막에 출혈이 발생합니다.잇몸, 코 출혈, 위장 출혈, 폐경기, 그리고 망막내 및 두개내 출혈.
혈소판 및/또는 정상 혈소판이 비정상적인 혈관 벽에 반응할 경우 정맥 혈전증 및 동맥 혈전증이 발생할 수 있습니다.증상은 혈전증 부위에 따라 다릅니다.
측정 및 테스트
측정.
혈액 내 혈소판 농도(즉, 혈소판 수)는 혈구계를 사용하여 수동으로 측정하거나, 콜터 계수기 또는 광학 방법과 [44]같은 입자 계수를 사용하여 혈액을 자동 혈소판 분석기에 배치하여 측정합니다.가장 일반적인 혈액 검사 방법은 측정에 혈소판 수를 포함하며, 일반적으로 (PLT)[45]로 보고됩니다.
혈소판 농도는 개인마다, 시간이 지남에 따라 달라지는데, 인구 평균은3 mm 당 250,000에서 260,000 세포 사이(마이크로리터당)이지만, 일반적인 실험실에서 허용하는 정상 범위는3 mm 당 150,000에서 400,000 세포 사이 또는 리터 [45][44]당 150,4009,10 사이입니다.

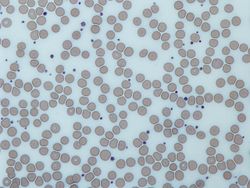
혈소판은 염색된 혈액 얼룩에서 적혈구 지름의 약 20%인 짙은 보라색 반점으로 나타납니다.비말은 혈소판의 크기, 모양, 질적인 수 및 뭉침 여부를 검사하는 데 사용됩니다.건강한 성인은 전형적으로 혈소판보다 10배에서 20배 많은 적혈구를 가지고 있습니다.
출혈시간
블리딩 타임은 1910년 [46]듀크에 의해 혈소판 기능의 시험으로 처음 개발되었습니다.듀크의 테스트는 30초마다 블랏된 귀엽의 표준화된 상처에서 출혈이 멈추는 데 걸리는 시간을 측정했습니다.출혈이 멈추는 정상 시간은 [47]3분이 채 되지 않았습니다.지금은 좀 더 현대적인 기술들이 사용되고 있습니다.정상적인 출혈 시간은 충분한 혈소판 수치와 기능, 그리고 정상적인 미세혈관을 반영합니다.
다중 전극 집성계
다중 전극 응집 측정에서 항응고된 전혈은 두 쌍의 전극이 있는 1회용 큐벳에 식염수 및 혈소판 작용제와 혼합됩니다.혈소판이 전극 위에 응집되면서 전극 사이의 임피던스가 증가하는 것을 측정하고 [48][49]곡선으로 시각화합니다.
| ADP | 에피네프린 | 콜라겐 | 리스토세틴 | |
|---|---|---|---|---|
| P2Y 수용체[50] 결함(클로피도그렐 포함) | 감소됨 | 보통의 | 보통의 | 보통의 |
| 아드레날린수용체결함[50] | 보통의 | 감소됨 | 보통의 | 보통의 |
| 콜라겐수용체결함[50] | 보통의 | 보통의 | 감소 또는 부재 | 보통의 |
| 보통의 | 보통의 | 보통의 | 감소 또는 부재 | |
| 감소됨 | 감소됨 | 감소됨 | 정상 또는 감소 | |
| 저장소풀부족[51] | 2차 파동 없음 | 부분적 | ||
| 아스피린 또는 아스피린 유사 장애 | 2차 파동 없음 | 불참 | 보통의 | |
광투과골재계측
광투과 응집법(LTA)에서 혈소판이 풍부한 플라즈마는 광원과 광전지 사이에 배치됩니다.응집되지 않은 플라즈마는 비교적 적은 빛을 통과시킵니다.아고니스트를 첨가한 후 혈소판이 응집하여 광투과율이 높아지며 [52]광전지에 의해 감지됩니다.
PFA-100
PFA-100(혈소판 기능 검사 – 100)은 콜라겐과 에피네프린 또는 콜라겐과 ADP로 코팅된 막 내의 개구부를 포함하는 일회용 카트리지를 통해 시트화된 전혈을 흡인하는 혈소판 기능 분석 시스템입니다.이러한 작용제는 혈소판의 부착, 활성화 및 응집을 유도하여 개구의 급속한 폐색과 폐쇄 시간(CT)이라 불리는 혈류의 중단을 초래합니다.EPI와 콜라겐이 있는 CT가 높아지면 폰 빌레브란트병, 요독증 또는 순환 혈소판 억제제와 같은 내재적 결함을 나타낼 수 있습니다.콜라겐과 ADP를 포함한 추적 검사는 콜라겐과 EPI를 가진 비정상적인 CT가 아세틸술살리실산(아스피린) 또는 억제제를 [53]포함한 약물의 효과에 의해 발생했는지 여부를 나타내는 데 사용됩니다.
장애
각색:[4]: vii
혈소판 농도가 낮은 것은 혈소판감소증이라고 하며, 생산이 감소하거나 파괴가 증가하기 때문입니다.혈소판의 농도가 상승하면 혈소판 증가증이라고 불리며 선천적이거나 (사이토카인에 대해) 반응하거나, 조절되지 않은 생산으로 인해 발생합니다: 골수증식성 신생물 또는 특정한 다른 골수증식 신생물 중 하나입니다.혈소판 기능 장애는 혈소판병증 또는 혈소판 기능 장애라고 불립니다.
정상 혈소판은 출혈보다는 혈관 벽의 이상에 반응하여 부적절한 혈소판 부착/활성화 및 혈전증을 초래할 수 있습니다: 온전한 혈관 내에 혈전이 형성됩니다.이런 종류의 혈전은 정상적인 혈전과는 다른 메커니즘에 의해 발생합니다. 즉, 정맥 혈전증의 피브린을 확장하는 것, 불안정하거나 파열된 동맥 플라크를 확장하는 것, 동맥 혈전증을 야기하는 것, 그리고 미세 순환 혈전증.동맥 혈전은 혈류를 부분적으로 차단하여 하류의 허혈을 유발하거나, 완전히 차단하여 하류 조직을 사망에 이르게 할 수 있습니다.
혈소판 장애의 세 가지 광범위한 범주는 "충분하지 않다", "기능적이지 않다", 그리고 "[4]: vii 너무 많다"입니다.
혈소판감소증
- 면역혈소판감소증(ITP) – 이전에는 면역혈소판감소증 및 특발성혈소판감소증 퍼푸라로 알려져 있었습니다.
- 비장비대
- 가족혈소판감소증[54][55]
- 화학요법
- 바베시오시스
- 뎅기열
- 오날라이
- 혈전성 혈소판감소성 자반증
- 헬프 증후군
- 용혈성요독증후군
- 약물 유발 혈소판감소증 (5가지 알려진 약물 - 가장 문제가 되는 것은 헤파린 유발 혈소판감소증 (HIT)
- 임신 관련
- 신생아 동종 면역 관련
- 재생불량성빈혈
- 수혈 관련
- 가성혈소판감소증
- 백신유도면역혈소판감소증(VITT)
변화된 혈소판 기능(혈소판감소증)
- 선천적
- 유착장애
- 활성화 장애
- 과립의 양이나 분비 장애
- 헤르만스키-푸들라크 증후군
- 회색 혈소판증후군
- ADP 수용체 결함
- 사이클로옥시게나제 활성 저하
- 혈소판 저장 풀 부족
- 응집장애
- 응고제 활성 장애
- 획득한
혈소판증가증 및 혈소판감소증
- 반응성
- 만성감염
- 만성염증
- 악성도
- 저스플렌증(스플렌술 후 절제술
- 철결핍
- 급성출혈
- 골수증식성 신생물 – 혈소판은 상승되어 있고 활성화되어 있습니다.
- 다른 골수성 신생물과 연관성이 있음
- 선천적
약리학
소염제
염증 치료에 사용되는 몇몇 약물들은 정상적인 혈소판 기능을 억제하는 원치 않는 부작용을 가지고 있습니다.비스테로이드성 소염제(NSAIDS)입니다.아스피린은 사이클로옥시게나제-1(COx1)을 억제함으로써 혈소판 기능을 비가역적으로 방해하고, 따라서 정상적인 지혈을 합니다.결과적인 혈소판은 DNA가 없기 때문에 새로운 사이클로옥시제나아제를 생산할 수 없습니다.정상적인 혈소판 기능은 아스피린 사용이 중단되고 영향을 받은 혈소판이 일주일 이상 걸릴 수 있는 새 혈소판으로 교체될 때까지 돌아오지 않습니다.또 다른 NSAID인 이부프로펜은 보통 [60]24시간 이내에 혈소판 기능이 돌아오며 아스피린이 [61]아스피린의 비가역적인 효과를 예방하기 전에 이부프로펜을 복용하는 등 오랜 기간 동안의 효과가 없습니다.
혈소판 기능을 억제하는 약물
이 약들은 혈전 형성을 막기 위해 사용됩니다.
경구제
혈소판 생성을 촉진하는 약물
정맥주사제
치료법
수혈
적응증
혈소판 수혈은 비정상적으로 낮은 혈소판 수를 교정하는 데 가장 자주 사용되며, 자발적인 출혈(일반적으로 10x109/L 미만의 수에서)을 방지하거나 일부 출혈을 수반할 것으로 예상되는 의료 절차를 위해 사용됩니다.예를 들어, 수술을 받는 환자의 경우 50×109/L 미만의 수치는 비정상적인 수술 출혈과 관련이 있으며, 80×109/[62]L 미만의 수치에 대해서는 경막외와 같은 국소 마취 시술을 피할 수 있습니다.혈소판 수는 정상이지만 개인이 아스피린이나 클로피도그렐을 [63]복용하는 경우와 같이 혈소판이 제 기능을 하지 못하는 경우에도 혈소판이 수혈될 수 있습니다.마지막으로, 혈소판은 대규모 수혈 프로토콜의 일부로서 수혈될 수 있는데, 이는 심각한 출혈을 해결하기 위해 세 가지 주요 혈액 성분(적혈구, 혈장, 혈소판)을 수혈하는 것입니다.혈소판 수혈은 응고병증을 유발하기 때문에 혈전성 혈소판감소증(TTP)에서 금지됩니다.
수집

혈소판은 전혈의 수집된 단위에서 분리되어 치료 용량을 만들기 위해 풀링되거나 혈소판 무력증에 의해 수집됩니다. 혈액은 기증자로부터 채취되어 혈소판을 제거하는 장치를 통과하고 나머지는 폐루프로 기증자에게 반환됩니다.업계 표준은 혈소판이 수혈 전 세균 검사를 받아 패혈증 반응을 피할 수 있도록 하는 것으로 치명적일 수 있습니다.최근 혈액 은행 및 수혈 서비스를 위한 AABB 산업 표준(5.1.5.1)은 [64]혈소판에서 박테리아 선별의 대안으로 병원체 감소 기술의 사용을 허용했습니다.
때때로 "무작위" 혈소판이라고 불리는 풀링된 전혈소판은 두 가지 [65]방법 중 하나로 분리됩니다.미국에서는 전혈 단위를 큰 원심분리기에 넣어 "소프트 스핀"이라고 합니다.이 설정에서 혈소판은 플라즈마에서 부유한 상태로 유지됩니다.혈소판이 풍부한 플라즈마(PRP)는 붉은 세포에서 제거된 다음 더 빠른 설정에서 원심분리하여 플라즈마로부터 혈소판을 수확합니다.세계의 다른 지역에서는 혈소판과 백혈구를 포함하는 "버피 코트" 층에서 혈소판이 매달리게 하는 환경을 사용하여 전혈의 단위를 원심 분리합니다."버피 코트"는 멸균 주머니에 격리되어 소량의 적혈구와 혈장에 매달린 후 다시 원심분리하여 적혈구와 백혈구로부터 혈소판과 혈장을 분리합니다.초기의 제조 방법에 관계없이, 멸균 연결 장치를 사용하여 복수의 기증품을 하나의 용기에 결합하여 원하는 치료 용량의 단일 제품을 제조할 수 있습니다.
공여자로부터 혈액을 채취하고 채취된 혈액을 원심분리하여 혈소판과 채취할 성분을 분리하는 기계장치를 이용하여 구심성 혈소판을 채취합니다.남은 혈액은 기증자에게 돌아옵니다.이 방법의 장점은 전혈소판에 대한 다수의 기부와는 달리, 한 번의 기부가 적어도 한 번의 치료 용량을 제공한다는 것입니다.이것은 받는 사람이 그만큼 많은 다른 기증자들에게 노출되지 않고 수혈로 전염되는 질병과 다른 합병증의 위험이 적음을 의미합니다.때로는 암 환자와 같이 정기적으로 혈소판을 수혈해야 하는 사람은 위험을 더욱 최소화하기 위해 특정 기증자로부터 반복적인 기부를 받을 수 있습니다.예를 들어, 리보플라빈 및 UV 광 치료제를 사용한 혈소판의 병원체 감소는 기증된 혈액제제에 포함된 병원체의 감염 부하를 감소시키기 위해 수행될 수 있으며, 이에 따라 수혈-전염병의 [66][67]전염 위험을 감소시킬 수 있습니다.수혈을 [68]목적으로 하는 혈액 성분을 오염시킬 수 있는 바이러스, 세균, 기생충 및 백혈구의 비활성화를 위해 아모탈렌 및 UVA 광을 이용한 또 다른 광화학적 치료 방법이 개발되었습니다.또한 구심성 혈소판은 원하는 혈액 성분을 분리하는 데 수집 방법이 "소프트 스핀" 원심 분리보다 더 효율적이기 때문에 오염된 적혈구를 더 적게 포함하는 경향이 있습니다.
보관소
두 가지 방법 중 하나로 수집된 혈소판은 유통기한이 보통 5일로 매우 짧습니다.이로 인해 기부금을 테스트하는 데 종종 꼬박 하루가 필요하기 때문에 공급 부족 문제가 자주 발생합니다.혈소판에 효과적인 방부제가 없기 때문에, 그것들은 효력을 빨리 잃고 신선할 때 가장 좋습니다.
혈소판은 20~24°C(68~75.2°F)에서 일정한 교반하에 보관됩니다.유닛을 냉장 보관할 수 없습니다. 이로 인해 혈소판이 모양을 바꾸고 기능을 상실하게 됩니다.실온 보관은 채혈 과정에서 혈액 성분에 유입된 세균이 증식하여 환자에게 균혈증을 일으킬 수 있는 환경을 제공합니다.미국에서는 수혈 [69]전에 세균 오염 여부를 검사하도록 하는 규정이 있습니다.

수취인에게 전달
혈소판은 상당한 양의 적혈구(RBC)를 포함하지 않는 한, 공여자와 공여자 사이의 면역 적합성을 보장하기 위해 공여자와 공여자 사이에 같은 A-B-O 혈액 그룹에 속하거나 교차 일치될 필요가 없습니다.RBC의 존재는 제품에 붉은 오렌지 색을 부여하며 일반적으로 전혈소판과 관련이 있습니다.유형별 혈소판을 발행하기 위해 노력하는 경우도 있지만, RBC의 경우와 마찬가지로 중요한 것은 아닙니다.
수혈 관련 이식편과 숙주 질환을 예방하기 위해 혈소판을 제공하기 전에 방사선을 조사하거나 표시된 경우 혈장을 제거하기 위해 세척할 수 있습니다.
수혈 후에 받는 사람의 혈소판 수의 변화를 "증가"라고 하며 수혈 후 혈소판 수에서 수혈 전 혈소판 수를 빼서 계산합니다.받는 사람의 신체 크기, 수혈받은 혈소판의 수, 수혈받은 혈소판의 조기 파괴를 야기할 수 있는 임상적 특징 등 많은 요인들이 증가에 영향을 미칩니다.환자가 적절한 수혈 후 증가를 입증하지 못한 경우, 이를 혈소판 수혈 불응성이라고 합니다.
혈소판은 구심성 또는 무작위 기증자를 통해 처리될 수 있습니다.이 과정에서 혈소판은 원심분리기에서 회전하고 과량의 혈장은 제거하여 혈소판 농축액 10~100mL를 남깁니다.이렇게 부피가 줄어든 혈소판은 보통 신생아와 소아 환자에게만 수혈되는데, 혈장의 부피가 크면 아이의 작은 순환계에 과부하가 걸릴 수 있습니다.혈장의 부피가 더 작으면 [70]혈장 단백질에 대한 역수액 반응의 가능성도 줄어듭니다.부피가 줄어든 혈소판의 유통기한은 4시간에 [71]불과합니다.
상처수리
혈전은 출혈을 멈추기 위한 일시적인 해결책일 뿐이며, 조직의 복구가 필요합니다.내피의 작은 중단은 생리학적 메커니즘에 의해 처리되고 외상외과 [72]의사에 의해 큰 중단이 발생합니다.섬유소는 섬유소 용해 효소인 플라스민에 의해 천천히 용해되고 혈소판은 식세포증에 [73]의해 제거됩니다.
혈소판은 강력한 화학작용제인 혈소판유래성장인자(PDGF); 및 세포외기질의 침착을 촉진하는 TGF 베타; 섬유아세포성장인자, 인슐린유사성장인자1, 혈소판유래표피성장인자 및 혈관내피성장인자를 방출하는 것을 특징으로 하는 세포외기질 형성방법.혈소판이 풍부한 혈장(PRP)을 통해 증가된 농도에서 이들 인자의 국소 적용은 상처 [74]치유에 부가적으로 사용됩니다.
기타동물
혈소판 대신에, 포유류가 아닌 척추동물들은 형태학적으로 B 림프구를 닮은 핵혈소판을 가지고 있습니다.그들은 트롬빈에 반응하지만 혈소판처럼 ADP, 세로토닌,[75][76] 아드레날린에는 반응하지 않습니다.
역사
- 조지 걸리버는 1841년에 조지프 잭슨 [78]리스터에 의해 1830년에 발명된 쌍둥이 렌즈 현미경을 사용하여 혈소판의[77] 그림을 그렸습니다.이 현미경은 혈소판을 처음 볼 수 있을 정도로 해상도가 향상되었습니다.
- 윌리엄 애디슨은 1842년에 혈소판 피브린 [79]응고물을 그렸습니다.
- Lionel Beale은 1864년에 [80]혈소판을 보여주는 그림을 처음으로 출판했습니다.
- 1865년 막스 슐체는 그가 "구형"이라고 부르는 것을 묘사했는데, 그는 이것이 적혈구보다 훨씬 작고, 때때로 뭉쳐 있으며, 때때로 피브린 [81]물질의 컬렉션에서 발견된다고 언급했습니다.
- 1882년 줄리오 비조제로는 생체 내에서 양서류의 혈액을 현미경으로 연구했습니다.그는 슐츠의 구 모양을 작은 접시라고 이름 지었습니다.[82][83]Scientific American의 한 기사는 Bizzozero가 Blutplatchen이라는 [84]이름을 제안했다고 말합니다.
- 윌리엄 오슬러는 1886년에 출판된 강의에서 혈소판을 관찰하고, 혈소판을 제3의 소립자와 혈소판이라고 불렀으며, 이를 "무채색 원형질 디스크"[85]라고 묘사했습니다.
- 제임스 라이트는 자신의 이름을 딴 얼룩을 이용하여 피 얼룩을 조사했고, 1906년[86] 출판에서 접시라는 용어를 사용했지만 1910년[87] 출판에서 혈소판으로 바뀌었고, 이것은 보편적으로 받아들여지는 용어가 되었습니다.
혈소판(cloth cell)이라는 용어는 1900년대 초에 사용되기 시작했고 때때로 혈소판의 동의어로 사용됩니다; 그러나 혈소판과 관련된 다른 용어들(예를 들어,[4]: v3 저혈소판을 의미하는 혈소판 감소증)에 대한 뿌리 단어로서를 제외하고는 일반적으로 과학 문헌에서 사용되지 않습니다.혈소판이라는 용어는 포유동물이 아닌 척추동물의 혈액에서 발견되는 단핵세포에 적절합니다: 혈소판의 기능적인 등가이지만 골수 거대핵세포의 [4]: 3 세포질 조각이 아닌 온전한 세포로 순환합니다.
어떤 맥락에서는 혈전이라는 단어가 혈전이라는 단어의 구성에 관계없이 혈전이라는 단어와 혼용되어 사용되기도 합니다. 흰색, 빨간색 또는 혼합).다른 맥락에서 그것은 정상과 비정상적인 응고를 대조하기 위해 사용됩니다: 혈전은 생리적인 지혈에서 발생하고 혈전은 병리학적인 그리고 과도한 양의 [88]응고에서 발생합니다.세 번째 맥락에서는 혈전이 결과이고 혈전이 결과입니다.
참고 항목
참고문헌
- ^ Laki K (December 1972). "Our ancient heritage in blood clotting and some of its consequences". Annals of the New York Academy of Sciences. 202 (1): 297–307. Bibcode:1972NYASA.202..297L. doi:10.1111/j.1749-6632.1972.tb16342.x. PMID 4508929. S2CID 45051688.
- ^ Machlus KR, Thon JN, Italiano JE (April 2014). "Interpreting the developmental dance of the megakaryocyte: a review of the cellular and molecular processes mediating platelet formation". British Journal of Haematology. 165 (2): 227–236. doi:10.1111/bjh.12758. PMID 24499183. S2CID 42595581.
- ^ Lefrançais, Emma; Ortiz-Muñoz, Guadalupe; Caudrillier, Axelle; Mallavia, Beñat; Liu, Fengchun; Sayah, David M.; Thornton, Emily E.; Headley, Mark B.; David, Tovo; Coughlin, Shaun R.; Krummel, Matthew F. (April 2017). "The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors". Nature. 544 (7648): 105–109. Bibcode:2017Natur.544..105L. doi:10.1038/nature21706. ISSN 1476-4687. PMC 5663284. PMID 28329764.
- ^ a b c d e f g Michelson, Alan D. (2013). Platelets (3rd ed.). Academic. ISBN 978-0123878373.
- ^ a b c d e Yip J, Shen Y, Berndt MC, Andrews RK (February 2005). "Primary platelet adhesion receptors". IUBMB Life. 57 (2): 103–108. doi:10.1080/15216540500078962. PMID 16036569. S2CID 12054259.
- ^ Berridge, Michael J. (1 October 2014). "Module 11: Cell Stress, Inflammatory Responses and Cell Death" (PDF). Cell Signalling Biology. Vol. 6. Portland Press. pp. 11-1–11-30. doi:10.1042/csb0001011.

- ^ a b c d Gaertner F, Massberg S (December 2016). "Blood coagulation in immunothrombosis-At the frontline of intravascular immunity". Seminars in Immunology. 28 (6): 561–569. doi:10.1016/j.smim.2016.10.010. PMID 27866916.
- ^ Hampton T (April 2018). "Platelets' Role in Adaptive Immunity May Contribute to Sepsis and Shock". JAMA. 319 (13): 1311–1312. doi:10.1001/jama.2017.12859. PMID 29614158.
- ^ Jain NC (June 1975). "A scanning electron microscopic study of platelets of certain animal species". Thrombosis et Diathesis Haemorrhagica. 33 (3): 501–507. PMID 1154309.
- ^ Paulus JM (September 1975). "Platelet size in man". Blood. 46 (3): 321–336. doi:10.1182/blood.V46.3.321.321. PMID 1097000.
- ^ Frojmovic MM (1976). "Geometry of normal mammalian platelets by quantitative microscopic studies". Biophysical Journal. 16 (9): 1071–1089. Bibcode:1976BpJ....16.1071F. doi:10.1016/s0006-3495(76)85756-6. PMC 1334946. PMID 786400.
- ^ Moskalensky AE, Yurkin MA, Konokhova AI, Strokotov DI, Nekrasov VM, Chernyshev AV, Tsvetovskaya GA, Chikova ED, Maltsev VP (2013). "Accurate measurement of volume and shape of resting and activated blood platelets from light scattering". Journal of Biomedical Optics. 18 (1): 017001. Bibcode:2013JBO....18a7001M. doi:10.1117/1.JBO.18.1.017001. PMID 23288415. S2CID 44626047.
- ^ Moskalensky AE, Yurkin MA, Muliukov AR, Litvinenko AL, Nekrasov VM, Chernyshev AV, Maltsev VP (2018). "Method for the simulation of blood platelet shape and its evolution during activation". PLOS Computational Biology. 14 (3): e1005899. Bibcode:2018PLSCB..14E5899M. doi:10.1371/journal.pcbi.1005899. PMC 5860797. PMID 29518073.
- ^ Harker LA, Roskos LK, Marzec UM, Carter RA, Cherry JK, Sundell B, Cheung EN, Terry D, Sheridan W (April 2000). "Effects of megakaryocyte growth and development factor on platelet production, platelet life span, and platelet function in healthy human volunteers". Blood. 95 (8): 2514–2522. doi:10.1182/blood.V95.8.2514. PMID 10753829.
- ^ Mason KD, Carpinelli MR, Fletcher JI, Collinge JE, Hilton AA, Ellis S, Kelly PN, Ekert PG, Metcalf D, Roberts AW, Huang DC, Kile BT (March 2007). "Programmed anuclear cell death delimits platelet life span". Cell. 128 (6): 1173–1186. doi:10.1016/j.cell.2007.01.037. PMID 17382885. S2CID 7492885.
- ^ Palmer RM, Ferrige AG, Moncada S (1987). "Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor". Nature. 327 (6122): 524–526. Bibcode:1987Natur.327..524P. doi:10.1038/327524a0. PMID 3495737. S2CID 4305207.
- ^ Jones CI, Barrett NE, Moraes LA, Gibbins JM, Jackson DE (2012). "Endogenous inhibitory mechanisms and the regulation of platelet function". Platelets and Megakaryocytes. Methods in Molecular Biology. Vol. 788. pp. 341–366. doi:10.1007/978-1-61779-307-3_23. ISBN 978-1-61779-306-6. PMID 22130718.
- ^ Marcus AJ, Broekman MJ, Drosopoulos JH, Olson KE, Islam N, Pinsky DJ, Levi R (April 2005). "Role of CD39 (NTPDase-1) in thromboregulation, cerebroprotection, and cardioprotection". Seminars in Thrombosis and Hemostasis. 31 (2): 234–246. doi:10.1055/s-2005-869528. PMID 15852226.
- ^ Dubois C, Panicot-Dubois L, Merrill-Skoloff G, Furie B, Furie BC (May 2006). "Glycoprotein VI-dependent and -independent pathways of thrombus formation in vivo". Blood. 107 (10): 3902–3906. doi:10.1182/blood-2005-09-3687. PMC 1895285. PMID 16455953.
- ^ Jiang, L.; Xu, C.; Yu, S.; Liu, P.; Luo, D.; Zhou, Q.; Gao, C.; Hu, H. (2013). "A critical role of thrombin/PAR-1 in ADP-induced platelet secretion and the second wave of aggregation". Journal of Thrombosis and Haemostasis. 11 (5): 930–940. doi:10.1111/jth.12168. ISSN 1538-7933. PMID 23406164.
- ^ Litvinov RI, Weisel JW, Andrianova IA, Peshkova AD, Minh GL (2018). "Differential Sensitivity of Various Markers of Platelet Activation with Adenosine Diphosphate". BioNanoScience. 9 (1): 53–58. doi:10.1007/s12668-018-0586-4. PMC 6750022. PMID 31534882.
- ^ Matarrese P, Straface E, Palumbo G, Anselmi M, Gambardella L, Ascione B, Del Principe D, Malorni W (February 2009). "Mitochondria regulate platelet metamorphosis induced by opsonized zymosan A – activation and long-term commitment to cell death". The FEBS Journal. 276 (3): 845–856. doi:10.1111/j.1742-4658.2008.06829.x. PMID 19143843.
- ^ White JG (December 1987). "An overview of platelet structural physiology". Scanning Microsc. 1 (4): 1677–1700. PMID 3324323.
- ^ Behnke O (1970). "The morphology of blood platelet membrane systems". Series Haematologica. 3 (4): 3–16. PMID 4107203.
- ^ a b Bouchard BA, Mann KG, Butenas S (August 2010). "No evidence for tissue factor on platelets". Blood. 116 (5): 854–855. doi:10.1182/blood-2010-05-285627. PMC 2918337. PMID 20688968.
- ^ Ahmad SS, Rawala-Sheikh R, Walsh PN (1992). "Components and assembly of the factor X activating complex". Seminars in Thrombosis and Hemostasis. 18 (3): 311–323. doi:10.1055/s-2007-1002570. PMID 1455249.
- ^ Tyagi T, Ahmad S, Gupta N, Sahu A, Ahmad Y, Nair V, Chatterjee T, Bajaj N, Sengupta S, Ganju L, Singh SB, Ashraf MZ (February 2014). "Altered expression of platelet proteins and calpain activity mediate hypoxia-induced prothrombotic phenotype". Blood. 123 (8): 1250–1260. doi:10.1182/blood-2013-05-501924. PMID 24297866.
- ^ O'Halloran AM, Curtin R, O'Connor F, Dooley M, Fitzgerald A, O'Brien JK, Fitzgerald DJ, Shields DC (February 2006). "The impact of genetic variation in the region of the GPIIIa gene, on Pl expression bias and GPIIb/IIIa receptor density in platelets". British Journal of Haematology. 132 (4): 494–502. doi:10.1111/j.1365-2141.2005.05897.x. PMID 16412022. S2CID 41983626.
- ^ Coller BS, Cheresh DA, Asch E, Seligsohn U (January 1991). "Platelet vitronectin receptor expression differentiates Iraqi-Jewish from Arab patients with Glanzmann thrombasthenia in Israel". Blood. 77 (1): 75–83. doi:10.1182/blood.V77.1.75.75. PMID 1702031.
- ^ a b c Jenne CN, Urrutia R, Kubes P (June 2013). "Platelets: bridging hemostasis, inflammation, and immunity". International Journal of Laboratory Hematology. 35 (3): 254–261. doi:10.1111/ijlh.12084. PMID 23590652.
- ^ Levin J (2007), "The Evolution of Mammalian Platelets", Platelets, Elsevier/50763-1, pp. 3–22, doi:10.1016/b978-012369367-9, ISBN 978-0123693679
- ^ Cox D, Kerrigan SW, Watson SP (June 2011). "Platelets and the innate immune system: mechanisms of bacterial-induced platelet activation". Journal of Thrombosis and Haemostasis. 9 (6): 1097–1107. doi:10.1111/j.1538-7836.2011.04264.x. PMID 21435167.
- ^ Weyrich AS, Zimmerman GA (September 2004). "Platelets: signaling cells in the immune continuum". Trends in Immunology. 25 (9): 489–495. doi:10.1016/j.it.2004.07.003. PMID 15324742.
- ^ Wagner DD, Burger PC (December 2003). "Platelets in inflammation and thrombosis". Arteriosclerosis, Thrombosis, and Vascular Biology. 23 (12): 2131–2137. doi:10.1161/01.ATV.0000095974.95122.EC. PMID 14500287.
- ^ Diacovo TG, Puri KD, Warnock RA, Springer TA, von Andrian UH (July 1996). "Platelet-mediated lymphocyte delivery to high endothelial venules". Science. 273 (5272): 252–255. Bibcode:1996Sci...273..252D. doi:10.1126/science.273.5272.252. PMID 8662511. S2CID 21334521.
- ^ Iannacone M, Sitia G, Isogawa M, Marchese P, Castro MG, Lowenstein PR, Chisari FV, Ruggeri ZM, Guidotti LG (November 2005). "Platelets mediate cytotoxic T lymphocyte-induced liver damage". Nature Medicine. 11 (11): 1167–1169. doi:10.1038/nm1317. PMC 2908083. PMID 16258538.
- ^ Oehlers, Stefan H.; Tobin, David M.; Britton, Warwick J.; Shavit, Jordan A.; Nguyen, Tuong; Johansen, Matt D.; Johnson, Khelsey E.; Hortle, Elinor (2019). "Thrombocyte inhibition restores protective immunity to mycobacterial infection in zebrafish". The Journal of Infectious Diseases. 220 (3): 524–534. doi:10.1093/infdis/jiz110. PMC 6603966. PMID 30877311.
- ^ Gaertner F, Ahmad Z, Rosenberger G, Fan S, Nicolai L, Busch B, Yavuz G, Luckner M, Ishikawa-Ankerhold H, Hennel R, Benechet A, Lorenz M, Chandraratne S, Schubert I, Helmer S, Striednig B, Stark K, Janko M, Böttcher RT, Verschoor A, Leon C, Gachet C, Gudermann T, Mederos Y, Schnitzler M, Pincus Z, Iannacone M, Haas R, Wanner G, Lauber K, Sixt M, Massberg S (November 2017). "Migrating Platelets Are Mechano-scavengers that Collect and Bundle Bacteria". Cell. 171 (6): 1368–1382.e23. doi:10.1016/j.cell.2017.11.001. PMID 29195076.
- ^ Boilard E, Nigrovic PA, Larabee K, Watts GF, Coblyn JS, Weinblatt ME, Massarotti EM, Remold-O'Donnell E, Farndale RW, Ware J, Lee DM (January 2010). "Platelets amplify inflammation in arthritis via collagen-dependent microparticle production". Science. 327 (5965): 580–583. Bibcode:2010Sci...327..580B. doi:10.1126/science.1181928. PMC 2927861. PMID 20110505.
- ^ a b Palankar R, Kohler TP, Krauel K, Wesche J, Hammerschmidt S, Greinacher A (June 2018). "Platelets kill bacteria by bridging innate and adaptive immunity via platelet factor 4 and FcγRIIA". Journal of Thrombosis and Haemostasis. 16 (6): 1187–1197. doi:10.1111/jth.13955. PMID 29350833.
- ^ McMorran BJ, Wieczorski L, Drysdale KE, Chan JA, Huang HM, Smith C, Mitiku C, Beeson JG, Burgio G, Foote SJ (December 2012). "Platelet factor 4 and Duffy antigen required for platelet killing of Plasmodium falciparum". Science. 338 (6112): 1348–1351. Bibcode:2012Sci...338.1348M. doi:10.1126/science.1228892. PMID 23224555. S2CID 206544569.
- ^ Murakawa M, Okamura T, Tsutsumi K, Tanoguchi S, Kamura T, Shibuya T, Harada M, Niho Y (1992). "Acquired von Willebrand's disease in association with essential thrombocythemia: regression following treatment". Acta Haematologica. 87 (1–2): 83–87. doi:10.1159/000204725. PMID 1585777.
- ^ van Genderen PJ, Leenknegt H, Michiels JJ, Budde U (September 1996). "Acquired von Willebrand disease in myeloproliferative disorders". Leukemia & Lymphoma. 22 Suppl 1: 79–82. doi:10.3109/10428199609074364. PMID 8951776.
- ^ a b Stiff, Patrick J. (1990). Walker, H. Kenneth; Hall, W. Dallas; Hurst, J. Willis (eds.). Clinical Methods: The History, Physical, and Laboratory Examinations (3rd ed.). Boston: Butterworths. ISBN 978-0-409-90077-4. PMID 21250105.
- ^ a b "Platelet Disorders: Thrombocytopenia". National Heart, Lung, and Blood Institute (NHLBI). 24 March 2022. Retrieved 2022-11-18.
- ^ Lind, Stuart E.; Kurkjian, Carla D. (2011). "The bleeding time". In Michelson, Alan D. (ed.). Platelets (2nd ed.). Elsevier. p. 485. ISBN 978-0080465869.
- ^ Duke WW (1910). "The relation of blood platelets to hemorrhagic disease". JAMA. 55 (14): 1185–1192. doi:10.1001/jama.1910.04330140029009.
- ^ Ranucci, Marco; Simioni, Paolo (2016). Point-of-Care Tests for Severe Hemorrhage: A Manual for Diagnosis and Treatment. Springer. pp. 40–42. ISBN 978-3-319-24795-3.
- ^ Marcucci, Carlo; Schoettker, Patrick (2014). Perioperative Hemostasis: Coagulation for Anesthesiologists. Springer. pp. 54–56. ISBN 978-3-642-55004-1.
- ^ a b c d e Borhany, Munira; Pahore, Zaen; ul Qadr, Zeeshan; Rehan, Muhammad; Naz, Arshi; Khan, Asif; Ansari, Saqib; Farzana, Tasneem; Nadeem, Muhammad; Raza, Syed Amir; Shamsi, Tahir (2010). "Bleeding disorders in the tribe: result of consanguineous in breeding". Orphanet Journal of Rare Diseases. 5 (1). doi:10.1186/1750-1172-5-23. ISSN 1750-1172.
- ^ a b "Why Perform Platelet Aggregation?". Helena Biosciences. 2015
- ^ Cuker, Adam (2014). "Light Transmission Aggregometry". The Hematologist. 11 (2). doi:10.1182/hem.V11.2.2555. ISSN 1551-8779.
- ^ "Platelet Function Assay FAQ" (PDF). Department of Pathology. Virginia Commonwealth University. Retrieved 2017-03-27.
- ^ Warren, JT; Di Paola, J (2 June 2022). "Genetics of inherited thrombocytopenias". Blood. 139 (22): 3264–3277. doi:10.1182/blood.2020009300. PMC 9164741. PMID 35167650.
- ^ Pecci, A; Balduini, CL (July 2021). "Inherited thrombocytopenias: an updated guide for clinicians". Blood Reviews. 48: 100784. doi:10.1016/j.blre.2020.100784. PMID 33317862. S2CID 229178137.
- ^ Kornerup KN, Page CP (August 2007). "The role of platelets in the pathophysiology of asthma". Platelets. 18 (5): 319–328. doi:10.1080/09537100701230436. PMID 17654302. S2CID 7923694.
- ^ Laidlaw TM, Kidder MS, Bhattacharyya N, Xing W, Shen S, Milne GL, Castells MC, Chhay H, Boyce JA (April 2012). "Cysteinyl leukotriene overproduction in aspirin-exacerbated respiratory disease is driven by platelet-adherent leukocytes". Blood. 119 (16): 3790–3798. doi:10.1182/blood-2011-10-384826. PMC 3335383. PMID 22262771.
- ^ Erpenbeck L, Schön MP (April 2010). "Deadly allies: the fatal interplay between platelets and metastasizing cancer cells". Blood. 115 (17): 3427–3436. doi:10.1182/blood-2009-10-247296. PMC 2867258. PMID 20194899.
- ^ Pleass RJ (July 2009). "Platelet power: sticky problems for sticky parasites?". Trends in Parasitology. 25 (7): 296–299. doi:10.1016/j.pt.2009.04.002. PMC 3116138. PMID 19539528.
- ^ "Summaries for patients. Platelet function after taking Ibuprofen for 1 week". Annals of Internal Medicine. 142 (7): I–54. April 2005. doi:10.7326/0003-4819-142-7-200504050-00004. PMID 15809457.
- ^ Rao GH, Johnson GG, Reddy KR, White JG (1983). "Ibuprofen protects platelet cyclooxygenase from irreversible inhibition by aspirin". Arteriosclerosis. 3 (4): 383–388. doi:10.1161/01.ATV.3.4.383. PMID 6411052. S2CID 3229482.
- ^ van Veen JJ, Nokes TJ, Makris M (January 2010). "The risk of spinal haematoma following neuraxial anaesthesia or lumbar puncture in thrombocytopenic individuals". British Journal of Haematology. 148 (1): 15–25. doi:10.1111/j.1365-2141.2009.07899.x. PMID 19775301.
- ^ Roback J, Grossman B, Harris T, Hillyer C, eds. (2011). Technical Manual (17th ed.). Bethesda MD: AABB. p. 580. ISBN 978-1-56395-315-6.
- ^ American Association of Blood Banks (2003). "5.1.5.1". Standards for Blood Banks and Transfusion Services (22nd ed.). Bethesda MD: AABB.
- ^ Högman CF (January 1992). "New trends in the preparation and storage of platelets". Transfusion. 32 (1): 3–6. doi:10.1046/j.1537-2995.1992.32192116428.x. PMID 1731433.
- ^ Ruane PH, Edrich R, Gampp D, Keil SD, Leonard RL, Goodrich RP (June 2004). "Photochemical inactivation of selected viruses and bacteria in platelet concentrates using riboflavin and light". Transfusion. 44 (6): 877–885. doi:10.1111/j.1537-2995.2004.03355.x. PMID 15157255. S2CID 24109912.
- ^ Perez-Pujol S, Tonda R, Lozano M, Fuste B, Lopez-Vilchez I, Galan AM, Li J, Goodrich R, Escolar G (June 2005). "Effects of a new pathogen-reduction technology (Mirasol PRT) on functional aspects of platelet concentrates". Transfusion. 45 (6): 911–919. doi:10.1111/j.1537-2995.2005.04350.x. PMID 15934989. S2CID 23169569.
- ^ Prowse CV (April 2013). "Component pathogen inactivation: a critical review". Vox Sanguinis. 104 (3): 183–199. doi:10.1111/j.1423-0410.2012.01662.x. PMID 23134556. S2CID 38392712.
- ^ AABB (2009). Standards for Blood Banks and Transfusion Services (26th ed.). Bethesda MD: AABB.
- ^ Schoenfeld H, Spies C, Jakob C (March 2006). "Volume-reduced platelet concentrates". Current Hematology Reports. 5 (1): 82–88. PMID 16537051.
- ^ CBBS: 세척 및 부피 감소된 혈소판 감소 장치 Wayback Machine에서 2014-04-14 보관.Cbbsweb.org (2001-10-25).2011-11-14에 검색되었습니다.
- ^ 응우옌, D.T., 오르길 D.P., 머피 G.F. (2009).제4장 상처치유와 피부재생의 병태생리학적 근거피부 손실 치료를 위한 생체 재료.Woodhead Publishing (영국/유럽) & CRC Press (미국), Cambridge/Boca Raton, pp. 25-57. (ISBN 978-1-4200-9989-8 ISBN 978-1-84569-363-3)
- ^ Movat HZ, Weiser WJ, Glynn MF, Mustard JF (December 1965). "Platelet phagocytosis and aggregation". The Journal of Cell Biology. 27 (3): 531–543. doi:10.1083/jcb.27.3.531. PMC 2106759. PMID 4957257.
- ^ Gawaz M, Vogel S (October 2013). "Platelets in tissue repair: control of apoptosis and interactions with regenerative cells". Blood. 122 (15): 2550–2554. doi:10.1182/blood-2013-05-468694. PMID 23963043.
- ^ Schmaier AA, Stalker TJ, Runge JJ, Lee D, Nagaswami C, Mericko P, Chen M, Cliché S, Gariépy C, Brass LF, Hammer DA, Weisel JW, Rosenthal K, Kahn ML (September 2011). "Occlusive thrombi arise in mammals but not birds in response to arterial injury: evolutionary insight into human cardiovascular disease". Blood. 118 (13): 3661–3669. doi:10.1182/blood-2011-02-338244. PMC 3186337. PMID 21816834.
- ^ Belamarich FA, Shepro D, Kien M (November 1968). "ADP is not involved in thrombin-induced aggregation of thrombocytes of a non-mammalian vertebrate". Nature. 220 (5166): 509–510. Bibcode:1968Natur.220..509B. doi:10.1038/220509a0. PMID 5686175. S2CID 4269208.
- ^ Lancet, 1882, ii. 916; Gulliver의 해부학, 생리학, 병리학, 식물학 연구의 노트, 1880; Carpenter's Physiology, ed.파워, 9번째, '걸리버' 아래 색인 참조.
- ^ Godlee, Sir Rickman (1917). Lord Lister. London: Macmillan & Co.
- ^ Robb-Smith AH (July 1967). "Why the platelets were discovered". British Journal of Haematology. 13 (4): 618–637. doi:10.1111/j.1365-2141.1967.tb00769.x. PMID 6029960. S2CID 5742616.
- ^ Beale LS (1864). "On the Germinal Matter of the Blood, with Remarks upon the Formation of Fibrin". Transactions of the Microscopical Society & Journal. 12: 47–63. doi:10.1111/j.1365-2818.1864.tb01625.x.
- ^ Schultze M (1865). "Ein heizbarer Objecttisch und seine Verwendung bei Untersuchungen des Blutes". Arch Mikrosk Anat. 1 (1): 1–42. doi:10.1007/BF02961404. S2CID 84919090.
- ^ Bizzozero, J. (1882). "Über einen neuen Forrnbestandteil des Blutes und dessen Rolle bei der Thrombose und Blutgerinnung". Arch Pathol Anat Phys Klin Med. 90 (2): 261–332. doi:10.1007/BF01931360. S2CID 37267098.
- ^ Brewer DB (May 2006). "Max Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet". British Journal of Haematology. 133 (3): 251–258. doi:10.1111/j.1365-2141.2006.06036.x. PMID 16643426.
- ^ Scientific American. Munn & Company. 1882. p. 105.
- ^ Osler W (1886). "On certain problems in the physiology of the blood corpuscles". The Medical News. 48: 421–425.
- ^ Wright JH (1906). "The Origin and Nature of the Blood Plates". The Boston Medical and Surgical Journal. 154 (23): 643–645. doi:10.1056/NEJM190606071542301.
- ^ Wright JH (1910). "The histogenesis of blood platelets". Journal of Morphology. 21 (2): 263–278. doi:10.1002/jmor.1050210204. hdl:2027/hvd.32044107223588. S2CID 84877594.
- ^ Furie B, Furie BC (August 2008). "Mechanisms of thrombus formation". The New England Journal of Medicine. 359 (9): 938–949. doi:10.1056/NEJMra0801082. PMID 18753650.


