쿠퍼 세포
Kupffer cell| 쿠퍼 세포 | |
|---|---|
 | |
 기본 간 구조 | |
| 세부 사항 | |
| 위치 | 간 |
| 기능. | 대식세포 |
| 식별자 | |
| 라틴어 | 대식세포모양체 |
| 메쉬 | D007728 |
| TH | H3.04.05.0.00016 |
| FMA | 14656 |
| 미세해부술의 해부학적 용어 | |
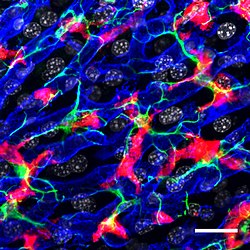
성상 대식세포 및 쿠퍼-브라우츠 세포로도 알려진 쿠퍼 세포는 간동체의 내강 내에 국소화된 특수 세포이며 혈관 벽을 구성하는 내피 세포에 접착제이다.쿠퍼 세포는 체내에서 조직 상주 대식세포의 가장 큰 집단을 구성한다.간문맥을 통해 위장관에서 간으로 운반되는 내장 박테리아, 박테리아 내독소, 미생물 잔해는 먼저 간의 첫 번째 면역 세포인 쿠퍼 세포와 접촉할 것이다.따라서 쿠퍼 세포 기능의 변화는 알코올성 간질환, 바이러스성 간염, 간내 담즙성 간염, 지방간염, 간이식 중 간의 활성화 또는 거부반응, 간섬유화 [2][3]등 다양한 간질환과 연관될 수 있다.그들은 단핵 식세포 시스템의 일부를 형성한다.
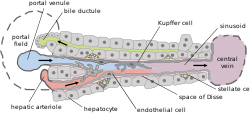
위치 및 구조
쿠퍼 세포는 간엽의 중심엽과 주피질 영역 모두에서 정현파 내피세포에 부착되어 있는 것을 발견할 수 있다.쿠퍼세포의 기능과 구조는 위치에 따라 특화된다.중심엽 쿠퍼 세포는 더 큰 경향이 있고 리소좀 효소와 식세포 활성을 가지는 반면, 중심엽 쿠퍼 세포는 더 많은 초산화기를 생성한다.
쿠퍼 세포는 특성이 아메보이드이며, 모든 방향으로 돌출하는 미세빌리, 의사돌기 및 편모충을 포함한 표면 특징을 가지고 있습니다.미립자와 가성구균은 입자의 내구증상에 역할을 한다.
핵은 움푹 패이고 난형이며, 소엽될 수 있다.
주목할 만한 세포질 요소는 리보솜, 골지 복합체, 중심극, 미세관 및 미세 필라멘트를 포함한다.쿠퍼 세포는 또한 거친 소포체, 핵 외피 및 환상 층을 포함하며, 이들 모두는 페르옥시다아제 활성을 나타낸다.
중요한 것은 쿠퍼 세포가 SR-AI/II 스캐빈저 수용체를 발현한다는 것이다.이 수용체는 리포다당류(LPS) 및 리포테이코산의 지질 A 도메인을 인식하고 결합하는 데 관여합니다.(리포다당류(LPS)는 세포벽 그램 음성균에 존재하는 세균성 엔도톡신이며, 리포테이코산은 그램 양성균에 존재한다.)이 검출 시스템 때문에 쿠퍼 세포는 간의 [4]세균 감염에 대한 면역 반응을 시작하고 매개하는 데 중요한 역할을 한다.
발전
쿠퍼 세포의 초기 집단의 발달은 전구 세포가 태아 대식세포로 분화하는 배아 노른자 주머니에서 시작된다.일단 그들이 혈류로 들어가면, 그들은 그들이 머무는 태아의 간으로 이동한다.거기서 그들은 쿠퍼 세포로 분화를 완료한다.정상적인 조건에서는 이러한 쿠퍼 세포군은 수명이 길고 스스로 [5]재생됩니다.
그러나 상주하는 쿠퍼 세포군이 고갈되면 골수 내 조혈줄기세포에서 유래해 혈액순환을 통해 간으로 운반되는 단구도 진정한 쿠퍼 세포로 완전히 분화할 수 있다.단구 순환에 의해 지속적으로 갱신되어야 하는 다른 조직 대식세포와 달리, 이러한 단구 유래의 쿠퍼 세포는 일단 모집단이 [6]형성되면 자가 갱신할 수 있다.
성숙한 쿠퍼 세포의 발달은 대식세포 콜로니 자극인자(CSF1)가 중요한 역할을 하는 수많은 성장인자에 의해 조절된다.IL-4와 같은 제2형 염증에 관여하는 사이토카인은 쿠퍼 세포 증식을 자극할 수도 있다.쿠퍼 세포군의 완전한 보충을 위한 14일에서 21일의 기간은 동물 연구에서 입증되었다.높은 단구 유입과 성숙률에도 불구하고, 간 쿠퍼 세포군은 엄격하게 유지된다.쿠퍼 세포의 평균 수명은 3.8일로 추정될 정도로 높은 회전율이 존재합니다.그러나 체내 쿠퍼 세포의 궁극적인 운명은 아직 완전히 [4][7][3]파악되지 않았다.
기능.
쿠퍼 세포의 주요 기능은 간을 통과할 때 간문 시스템에서 나온 이물질과 입자를 제거하는 것입니다.쿱퍼 세포는 식세포증에서는 큰 입자를, 음세포증에서는 [4]작은 입자를 흡수할 수 있다.쿠퍼 세포는 면역체계의 선천적인 반응에 필수적이다.그것들은 숙주 방어에 중요하며 지질, 단백질 복합체 및 작은 입자를 포함한 많은 다른 화합물의 신진대사에 역할을 합니다.그들은 또한 순환에서 [2][3]아포토시스 세포를 제거하는데 유용하다.
간에서 쿠퍼 세포의 양은 일정하게 유지됩니다.쿠퍼 세포는 세포군이 스스로 보충할 수 있는 증식 능력을 가지고 있다: 이것은 증식 잠재력이 없는 단구 유래 대식세포와는 완전히 대조적이다.오래되거나 결함이 있는 세포는 아포토시스와 인접한 쿠퍼 세포에 의한 식세포화를 통해 제거된다.
쿠퍼 세포는 간엽에서의 위치에 따라 기능이 이질적이다.피질 주변부의 세포는 혈류에 직접 노출되어 들어오는 이물질을 보다 효율적으로 처리하기 위해 더 큰 리소좀 활성을 발현한다.반면 중심엽의 세포는 관류를 덜 경험하고, 깊은 관통성 부상과 감염에 대항하기 위해 더 많은 저장소의 슈퍼옥시드를 갖추고 있다.
감염이나 자극에 반응하여, 쿠퍼 세포는 염증성 사이토카인, TNF-α, 산소 라디칼, 단백질 분해 효소를 생성할 수 있습니다.이러한 중재자의 과도한 생산은 간 [4]손상의 발병과 관련이 있다.
쿠퍼 세포는 박테리아를 제거하는 것 외에도 식세포 작용을 통해 노화 적혈구를 파괴함으로써 헤모글로빈을 재활용하는 역할도 한다.글로빈 사슬은 재사용되고 철분 함유 부분인 헴은 다시 철분 분해되어 재사용되고 빌리루빈은 간세포 내에서 글루쿠론산과 결합되어 담즙으로 분비된다.
Helmy 등은 면역글로불린 패밀리(CRIG)의 보체 수용체인 쿠퍼 세포에 존재하는 수용체를 확인했다.CRIg가 없는 쥐는 시스템 코팅 병원균을 제거할 수 없었다.CRIg는 생쥐와 사람에게 보존되며 선천적인 면역체계의 [8]중요한 구성요소이다.
임상적 의의
쿠퍼 세포는 특정 활성화 상태를 분극시킬 수 있는 능력을 가진 믿을 수 없을 정도로 플라스틱 세포이며 다양한 미세 환경에서 다른 기능을 수행할 수 있습니다.M1(클래식 활성화)과 M2(대체 활성화)는 대식세포 분극의 양 극단을 나타낸다.M1 편광 쿠퍼 세포는 TNF-alpha와 같은 다량의 염증성 사이토카인을 생성한다.한편, M2 편광 쿠퍼 세포는, 예를 들면 [9][4]IL-10과 같은 대량의 항염증 매개체를 생성한다.
쿠퍼 세포는 패혈증에 대한 반응으로 손상된 간의 병원 형성에 역할을 한다.간의 대식세포는 IL-1과 TNF-alpha를 활성화하고 방출한다.이는 백혈구와 정현파 내피세포를 활성화시켜 ICAM-1을 발현시킨다.그 결과 단백질분해효소, 산소라디칼, 프로스타노이드 및 백혈구의 다른 물질로 인해 내피조직이 손상된다.
쿠퍼 세포 활성화는 만성 알코올 중독자에게서 흔히 볼 수 있는 에탄올 유도 간 손상에 대한 반응으로 만성 및 급성 알코올 간 질환의 병원 형성에 기여한다.만성 알코올 중독과 간 손상은 두 번의 타격 시스템을 다룬다.첫 번째 타격은 에탄올의 직접적인 독성과 그 대사 부산물에 의해 매개되는 반면, 두 번째 타격은 간접적이며, 장에서 리포다당류(엔도톡신)의 섭취 증가에 의해 매개된다.
에탄올은 장상피의 투과성을 증가시켜 장내강에서 간문정맥을 통해 장내 세균에 의해 생성된 내독소가 간으로 누출된다.엔도톡신의 존재는 쿠퍼 세포의 강한 M1 분극을 유발한다.활성화된 쿠퍼 세포에 의해 대량의 활성산소종, 소염성 사이토카인 및 케모카인이 생성되어 간 손상을 일으킨다.
캐스케이드는 엔도톡신을 내장하는 쿠퍼 세포상의 수용체인 톨 유사 수용체 4(TLR4)와 CD14의 엔도톡신 매개 활성화로 시작된다.이것은 차례로 슈퍼옥시드의 동시 생산과 함께 소염성 사이토카인과 종양 괴사인자 알파(TNFα)의 전사를 활성화한다.
사이토카인과 초산화물은 각각 염증과 산화 손상을 일으키는 반면, TNFα는 간의 성세포를 자극하여 콜라겐 합성을 시작합니다.이러한 과정들은 간의 섬유화, 즉 흉터를 초래한다.섬유증은 결국 광범위한 [10]흉터로 인한 간 기능 상실인 간경화를 일으킬 것이다.
역사
그 세포들은 1876년 [11]Karl Wilhelm von Kupfer에 의해 처음 관찰되었다.과학자들은 그것들을 "Sternzellen"이라고 불렀지만, 부정확하게, 그것들이 간 혈관의 내피에서 필수적인 부분이고 그것으로부터 유래되었다고 생각했다.1898년, 몇 년간의 연구 끝에, Tadeusz Browicz는 그것들을 [12][13][14][15]대식세포로 정확하게 식별했다.
레퍼런스
- ^ Bonnardel J, T'Jonck W, Gaublomme D, Browaeys R, Scott CL, Martens L, et al. (October 2019). "Stellate Cells, Hepatocytes, and Endothelial Cells Imprint the Kupffer Cell Identity on Monocytes Colonizing the Liver Macrophage Niche". Immunity. 51 (4): 638–654.e9. doi:10.1016/j.immuni.2019.08.017. PMC 6876284. PMID 31561945.
- ^ a b Nguyen-Lefebvre, Anh Thu; Horuzsko, Anatolij (2015). "Kupffer Cell Metabolism and Function". Journal of Enzymology and Metabolism. 1 (1). PMC 4771376. PMID 26937490.
- ^ a b c Dixon, Laura J.; Barnes, Mark; Tang, Hui; Pritchard, Michele T.; Nagy, Laura E. (April 2013). "Kupffer Cells in the Liver". Comprehensive Physiology. 3 (2): 785–797. doi:10.1002/cphy.c120026. ISSN 2040-4603. PMC 4748178. PMID 23720329.
- ^ a b c d e Basit, Hajira; Tan, Michael L.; Webster, Daniel R. (2020), "Histology, Kupffer Cell", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 29630278, retrieved 2020-08-25
- ^ Naito M, Hasegawa G, Takahashi K (November 1997). "Development, differentiation, and maturation of Kupffer cells". Microscopy Research and Technique. 39 (4): 350–64. doi:10.1002/(SICI)1097-0029(19971115)39:4<350::AID-JEMT5>3.0.CO;2-L. PMID 9407545.
- ^ Scott C, Zheng F, De Baetselier P, et al. (27 January 2016). "Bone marrow-derived monocytes give rise to self-renewing and fully differentiated Kupffer cells". Nature Communications. 7, 10321 (2016). doi:10.1038/ncomms10321.
- ^ "Kupffer Cells in Non-alcoholic Fatty Liver Disease: Friend or Foe?". www.ijbs.com. Retrieved 2020-08-31.
- ^ Helmy KY, Katschke KJ, Gorgani NN, Kljavin NM, Elliott JM, Diehl L, et al. (March 2006). "CRIg: a macrophage complement receptor required for phagocytosis of circulating pathogens". Cell. 124 (5): 915–27. doi:10.1016/j.cell.2005.12.039. PMID 16530040. S2CID 15525209.
- ^ Zeng, Tao; Zhang, Cui-Li; Xiao, Mo; Yang, Rui; Xie, Ke-Qin (2016). "Critical Roles of Kupffer Cells in the Pathogenesis of Alcoholic Liver Disease: From Basic Science to Clinical Trials". Frontiers in Immunology. 7: 538. doi:10.3389/fimmu.2016.00538. ISSN 1664-3224. PMC 5126119. PMID 27965666.
- ^ Wheeler MD (2003). "Endotoxin and Kupffer cell activation in alcoholic liver disease". Alcohol Research & Health. 27 (4): 300–6. PMC 6668869. PMID 15540801.
- ^ Haubrich WS (July 2004). "Kupffer of Kupffer cells". Gastroenterology. 127 (1): 16. doi:10.1053/j.gastro.2004.05.041. PMID 15236167.
- ^ Szymańska R, Schmidt-Pospuła M (1979). "[Studies of liver's reticuloendothelial cells by Tadeusz Browicz and Karl Kupffer. A historical outline]". Archiwum Historii Medycyny. 42 (3): 331–6. PMID 386989.
- ^ Stachura J, Gałązka K (December 2003). "History and current status of Polish gastroenterological pathology". Journal of Physiology and Pharmacology. 54 Suppl 3: 183–92. PMID 15075472.
- ^ Śródka A, Gryglewski RW, Szczepański W (2006). "Browicz or Kupffer cells?". Polish Journal of Pathology. 57 (4): 183–5. PMID 17285760.
- ^ Wake K (2009). "[Browicz's phagocytic cells and Kupffer's 'so-called stellate cells']". Kaibogaku Zasshi. 84 (1): 17–21. PMID 19413196.
외부 링크
- 해부사진 : 소화기/유모/간5/간4 - 데이비스 캘리포니아 대학 비교기관 - "유모, 간(EM, Low)"
- 조직 이미지: 15508loa – 보스턴 대학의 조직학 학습 시스템
- 쿠퍼 세포 재단 - 쿠퍼 세포 재단의 임무는 건강하고 질병이 있는 간에서 쿠퍼 세포와 사인파 장벽의 역할에 대한 지식을 향상시키기 위한 연구와 교육을 자극하고 지원하는 것입니다.
