크랩트리 촉매
Crabtree's catalyst | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 (SP-4)-(η, η-시클로옥타-1,5-디엔)(피리딘)(트리시클로헥실포스판)이리듐(1+)헥사플루오로인산염(1-) | |
| 식별자 | |
3D 모델(Jsmol) | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.164.161 |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C31H50F6IrNP2 | |
| 어금니 질량 | 804.9026 g/mol |
| 외모 | 황색 미세결정 |
| 융점 | 150 °C(302 °F, 423 K)(분해)[1] |
달리 명시된 경우를 제외하고는 표준 상태(25°C [77°F], 100kPa)에 있는 재료에 대한 데이터가 제공됩니다. | |
크랩트리의 촉매는 화학식이 [CHIrP812(CH611)]3인 유기아연 화합물입니다.C5H5N]PF6. 로버트 크랩트리(Robert H. Crabtree)가 개발한 수소화 및 수소-전달 반응을 위한 균질 촉매입니다. 이 공기 안정적인 주황색 고체는 상업적으로 이용 가능하며 방향성 수소화로 인해 방향성 그룹별로 트랜스 스테레오 선택성을 부여하는 것으로 알려져 있습니다.[2][3]
구조와 합성
복합체는 d8 복합체에 대해 예상되는 바와 같이 정사각형 평면 분자 기하학을 갖습니다. 시클로옥타디엔 이리듐 클로라이드 이량체로 제조됩니다.[4]
반응성
크랩트리의 촉매는 모노-, 디-, 트라이- 및 테트라-치환된 기질의 수소화에 효과적입니다. Wilkinson의 촉매와 Schrock-Osborn 촉매는 테트라치환된 올레핀의 수소화를 촉매하지 않지만, Crabtree의 촉매는 높은 회전수에서 수소화를 촉매합니다(표).[2][5]
이직빈도 기판 윌킨슨 촉매 슈록-오스본 촉매 크랩트리 촉매 Hex-1-ene 650 4000 6400 사이클로헥센 700 10 4500 1-메틸사이클로헥센 13 — 3800 2,3-Dimethyl-but-2-ene — — 4000
촉매는 실온에서 반응성이 있습니다.[1] 용매 건조나 수소의 세심한 탈산소화 없이 반응이 강력합니다. 촉매는 에스테르와 같은 약염기성 작용기에는 내성이 있지만 알코올(아래 참조)이나 아민에는 내성이 없습니다.[2] 촉매는 양성자를 함유한 불순물에 민감합니다.[6]
촉매는 실온에서 약 10분 후에 비가역적으로 비활성화되며, 노란색으로 표시됩니다. 한 가지 비활성화 과정은 수소화물 가교 이량체의 형성을 포함합니다.[7] 따라서 보통 크랩트리의 촉매는 매우 낮은 촉매 부하에서 사용됩니다.

기타 촉매 기능: 동위원소 교환 및 이성질화
수소화 외에도 촉매는 알켄의 이성질화 및 수소화 반응을 촉매합니다.[1]

크랩트리의 촉매는 동위원소 교환 반응에 사용됩니다. 보다 구체적으로, 중간체를 사용하지 않고 수소 원자와 중수소 및 삼중수소 동위원소의 직접적인 교환을 촉매합니다.[8] 크랩트리의 촉매와 동위원소 교환은 매우 국소 선택적인 것으로 나타났습니다.[9][10]
직능군 연출의 영향력
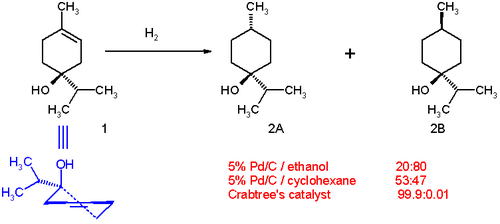
테르펜-4-올의 수소화는 지시기(-OH 그룹)를 갖는 화합물이 디아스테레오 선택적 수소화를 겪는 능력을 보여줍니다. 에탄올의 탄소에 팔라듐을 사용하면 생성물 분포는 20:80으로 시스 이성질체를 선호합니다(스킴 1의 2B). 극성은 (하이드록시기와) 용매와 상호작용합니다. 이는 이종 촉매의 표면에 작용기가 결합하여 반응을 지휘하는 효과인 약간의 합포성 때문입니다.[11][12] 용매인 시클로헥산에서는 합친성이 더 이상 존재하지 않기 때문에 53:47로 분포가 바뀝니다(시클로헥산에는 방향기가 없습니다). 크랩트리의 촉매를 디클로로메탄에 사용하면 트랜스 이성질체 2A에 유리하게 분포가 완전히 바뀝니다. 이 선택성은 예측 가능하고 실용적으로 유용합니다.[13] 카르보닐기는 또한 크랩트리 촉매에 의한 수소화를 고도로 국소 선택적으로 유도하는 것으로 알려져 있습니다.[14][15][16]
크랩트리의 촉매로 테르펜-4-ol의 수소화 입체 선택성을 유발하는 연출 효과는 다음과 같습니다.

역사
크랩트리와 대학원생 조지 모리스는 1970년대 파리 근교 기프쉬르이베트에 있는 치미에데스 물질 네이처렐 연구소에서 윌킨슨의 로듐 기반 촉매의 이리듐 유사체를 연구하던 중 이 촉매를 발견했습니다.
이전의 수소화 촉매에는 윌킨슨 촉매와 오스본과 슈록이 개발한 두 개의 포스핀기를 가진 양이온성 로듐(I) 복합체가 포함되었습니다.[17] 이 촉매들은 변위를 통해 수소화를 이루어냈는데, 금속을 가로질러 수소를 첨가한 후 로듐 금속으로부터 용매 또는 포스핀기가 분리되어 수소화될 올레핀이 활성 부위에 접근할 수 있었습니다.[2] 이 변위는 로듐 복합체의 경우 빠르게 발생하지만 이리듐 복합체의 경우에는 거의 발생하지 않습니다.[18] 이 때문에 당시 연구는 이리듐과 같은 3열 전이금속을 포함하는 화합물 대신 로듐 화합물에 초점을 맞췄습니다. 윌킨슨, 오스본, 슈록도 배위용제만을 사용했습니다.[19]
크랩트리는 리간드 해리 단계가 이질적인 촉매 작용에서 발생하지 않는다는 점에 주목했으며, 이 단계가 균질한 시스템에서 제한적이라는 점을 가정했습니다.[2] 그들은 "비배위 용매에서 비가역적으로 생성된 활성 부위"를 가진 촉매를 찾았습니다. 이는 크랩트리 촉매의 개발과 용매 CHCl의22 사용으로 이어졌습니다.
참고문헌
- ^ a b c Crabtree, R. H. (2001). "(1,5-Cyclooctadiene)(tricyclohexylphosphine)(pyridine)iridium(I) Hexafluorophosphate". e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc290m.pub4 (inactive 1 August 2023).
{{cite encyclopedia}}: CS1 maint: 2023년 8월 기준 DOI 비활성화 (링크) - ^ a b c d e Robert H. Crabtree (1979). "Iridium compounds in catalysis". Acc. Chem. Res. 12 (9): 331–337. doi:10.1021/ar50141a005.
- ^ Brown, J. M. (1987). "Directed Homogeneous Hydrogenation". Angew. Chem. Int. Ed. 26 (3): 190–203. doi:10.1002/anie.198701901.
- ^ Crabtree, R. H.; Morris, G. E. (1977). "Some diolefin complexes of Iridium(I) and a trans-Influence Series for the Complexes [IrCl(cod)L]". J. Organomet. Chem. 135 (3): 395–403. doi:10.1016/S0022-328X(00)88091-2.
- ^ White, M. (2002-10-15). "Hydrogenation" (PDF). Retrieved 2014-12-01.
- ^ Xu, Yingjian; Mingos, D. Michael P.; Brown, John M. (2008). "Crabtree's catalyst revisited; Ligand effects on stability and durability". Chem. Comm. 2008 (2): 199–201. doi:10.1039/b711979h. PMID 18092086.
- ^ Crabtree, R.; Felkin, H.; Morris, G. (1977). "Cationic iridium diolefin complexes as alkene hydrogenation catalysts and the isolation of some related hydrido complexes". Journal of Organometallic Chemistry. 141 (2): 205–215. doi:10.1016/S0022-328X(00)92273-3.
- ^ Schou, S. (2009). "The effect of adding Crabtree's catalyst to rhodium black in direct hydrogen isotope exchange reactions". Journal of Labelled Compounds and Radiopharmaceuticals. 52 (9): 376–381. doi:10.1002/jlcr.1612.
- ^ Valsborg, J.; Sorensen, L.; Foged, C. (2001). "Organoiridium catalysed hydrogen isotope exchange of benzamide derivatives". Journal of Labelled Compounds and Radiopharmaceuticals. 44 (3): 209–214. doi:10.1002/jlcr.446.
- ^ Hesk, D.; Das, P.; Evans, B. (1995). "Deuteration of acetanilides and other substituted aromatics using [Ir(COD)(Cy3P)(Py)]PF6 as catalyst". Journal of Labelled Compounds and Radiopharmaceuticals. 36 (5): 497–502. doi:10.1002/jlcr.2580360514.
- ^ Thompson, H.; Naipawer, R. (1973). "Stereochemical control of reductions. III. Approach to group haptophilicities". Journal of the American Chemical Society. 95 (19): 6379–6386. doi:10.1021/ja00800a036.
- ^ Rowlands, G. (2002-01-01). "Hydrogenation" (PDF). Retrieved 2014-12-01.
- ^ Brown, J. (1987). "Directed Homogeneous Hydrogenation [New Synthetic Methods (65)]". Angew. Chem. Int. Ed. Engl. 26 (3): 190–203. doi:10.1002/anie.198701901.
- ^ Schultz, A.; McCloskey, P. (1985). "Carboxamide and carbalkoxy group directed stereoselective iridium-catalyzed homogeneous olefin hydrogenations". Journal of Organic Chemistry. 50 (26): 5905–5907. doi:10.1021/jo00350a105.
- ^ Crabtree, R. H.; Davis, M. W. (1986). "Directing effects in homogeneous hydrogenation with [Ir(cod)(PCy3)(py)]PF6". J. Org. Chem. 51 (14): 2655–2661. doi:10.1021/jo00364a007.
- ^ Crabtree, R.; Davis, M. (1983). "Occurrence and origin of a pronounced directing effect of a hydroxyl group in hydrogenation with [Ir(cod)P(C6H11)3(py)]PF6". Organometallics. 2 (5): 681–682. doi:10.1021/om00077a019.
- ^ Schrock, R.; Osborn, J. A. (1976). "Catalytic hydrogenation using cationic rhodium complexes. I. Evolution of the catalytic system and the hydrogenation of olefins". Journal of the American Chemical Society. 98 (8): 2134–2143. doi:10.1021/ja00424a020.
- ^ Osborn, J.; Shapley, J. (1970). "Rapid intramolecular rearrangements in pentacoordinate transition metal compounds. Rearrangement mechanism of some fluxional iridium(I) complexes". Journal of the American Chemical Society. 92 (23): 6976–6978. doi:10.1021/ja00726a047.
- ^ Young, J.; Wilkinson, G. (1966). "The preparation and properties of tris(triphenylphosphine)halogenorhodium(I) and some reactions thereof including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives". J. Chem. Soc. A. 1966: 1711. doi:10.1039/J19660001711.