아린
Aryne아리아인[1] 또는 벤지인은[2] 두 개의 대체물을 제거함으로써 방향족 고리에서 파생된 매우 반응성이 높은 종이다.가장 흔한 아린은 정형외과이지만 메타아린과 파라아린도 알려져 있다.[3][4][5] o아린스는 긴장된 알키네스의 예들이다.
o-arynes 내 본딩
벤진의 알키네 표현은 가장 널리 접하게 된다. o-아리아인 즉, 1,2-다이데하이드로아렌은 보통 긴장된 삼중 결합을 가진 것으로 묘사된다.[6]
정형외과-벤진에서 삼중결합에 대한 기하학적 제약은 평면 내 p-오르비탈의 중첩을 감소시키고, 따라서 삼중결합이 약해진다.[7]벤지네에서 3중 결합의 진동 주파수는 Radziszewski가 1846 cm로−1 할당했는데, 이는 [8]약 2150 cm의−1 진동 주파수를 가진 비스트레이티드 알키네에서보다 약한 3중 결합을 나타낸다.그럼에도 불구하고, 정형외과-벤지네는 큰 싱글렛-트리플릿 간격과 알키네와 같은 반응성에서 볼 수 있듯이, 바이라디컬이라기보다는 긴장된 알키네에 가깝다.[3]
아린의 LUMO는 구속되지 않은 알키네스의 LUMO보다 훨씬 낮게 놓여 있어 핵생물의 HOMO에 더 좋은 에너지 매치가 된다.따라서 벤진은 전기영역적 성격을 가지고 있으며 핵소포체와 반응을 일으킨다.[9]벤진의 상세한 MO 분석은 1968년에 발표되었다.[10]
오아린즈 발생
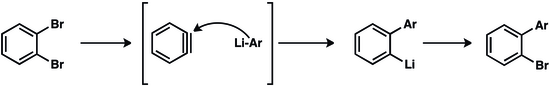
극도의 반응성으로 인해 아린이 현장에서 생성되어야 한다.다른 반응성 매개체의 전형적으로 벤진은 반드시 갇히고 그렇지 않으면 비페닐렌으로 희석된다.
벤진으로의 초기 경로에는 아릴 할로겐화물의 탈수소화가 수반되었다.
그러한 반응은 강한 기저와 높은 온도를 필요로 한다.정형외과 방산 아레네는 온화한 조건에서 벤지에게 전구체 역할을 한다.벤진은 마그네슘에 의한 2-브로모플루오로벤젠의 탈할로겐화에 의해 생성된다.[11]안트라닐산은 디아조트화 및 중화화하여 2-다이아조니오벤젠-1-카복시화(diazoniobenzene-1-carboxylate)로 변환할 수 있다.비록 폭발적이긴 하지만,[12] 이 zwitterionic 종은 벤진의 편리하고 값싼 전구체다.[13]
또 다른 방법은 트리메틸릴라릴 트리플플레이트를 기반으로 한다.[14]트리메틸실릴 그룹의 불소 변위는 삼불산 제거 및 벤진 방출 유발:
헥사이드하이드로 디엘-알데르 반응(HDDA)에는 사이클로어드 1,3-다이앤과 알킨이 포함된다.[15]
히드록시아민-O-술폰산과 1H-벤조트리아졸을 혼합하면 중간이 생성되며, 납(IV) 아세테이트로 거의 정량적인 수율에서 벤젠으로 산화될 수 있다.[16]
오아린의 반응
심지어 낮은 온도에서도 아린은 극도로 반응한다.이들의 반응성은 (1)핵세포 첨가, (2) 순환 반응, (3) 결합 삽입의 세 가지 주요 등급으로 분류할 수 있다.
아린에 핵포화 첨가물
아릴은 기본 핵소포체로 치료하면 탈염 알파에 대해 탈염화시켜 탈수화(detrodrohalogen을 유발한다.동위원소 교환 연구는 아릴 플루오르화물과 아릴 염소화물의 경우, 제거 사건은 두 단계로 진행되며, 그 다음에 핵소독체가 방출된다.따라서 이 과정은 공식적으로 알리프 화합물의 E1cb 메커니즘과 유사하다.반면에 아릴 브로마이드와 요오드화물은 일반적으로 결합된 싱코플라나 E2 메커니즘에 의해 제거되는 것으로 보인다.[17][18]그 결과로 생긴 벤지네는 보통 핵포화물과 양성자에 의해 첨가된 제품을 형성한다.벤진 중간자 생성은 반응의 느린 단계다.[19]
"아린 커플링" 반응으로 제약 산업, 농업 및 많은 금속으로 만들어진 변형에서 리간드로 가치가 있는 비페닐 화합물이 생성될 수 있다.[20]
금속-아렌 제품은 또 다른 아린을 첨가할 수 있어 연쇄 성장 중합으로 이어질 수 있다.구리(I) 청산가리를 이니시에이터로 사용하여 최대 100개의 아렌 단위를 포함하는 최초의 아린 산출 폴리머에 추가.[21]
그룹 탈퇴(LG)와 대체(Y)가 상호 직교 또는 파라인 경우 벤진 중간은 1개만 가능하다.다만 LG가 Y로 메타화하면 Regi화학 결과(A, B)가 가능하다.만약 Y가 전자에서 철수하는 것이라면 H는B H보다A 산성이 높아 레지오이소머 B가 생성된다.유사하게 Y가 전자 기증을 할 경우 레지오이소머 A가 생성되는데, 지금은A H가 더 산성화된 양성자이기 때문이다.
대체 물질(Y)을 가진 벤지네에는 두 개의 레지오이소머가 있다. 트리플 본드는 C2와 C3 사이 또는 C3과 C4 사이에 위치할 수 있다.이탈 그룹에 대한 대체물은 C2와 C3의 삼중 결합으로 이어진다.Para Y와 LG는 C3와 C4의 3중 결합을 가진 레지오이소머로 이어진다.메타 대체물은 위에서 설명한 것처럼 두 레지오이소머를 모두 감당할 수 있다.C2와 C3 사이에 위치한 삼중 결합의 경우, 전자 인출(EWG) 대체물(예: CF3)은 EWG에 가능한 한 가까운 곳에 카르바니온을 배치하는 데 핵물질을 첨가하도록 지시한다.그러나, 전자 기부 (EDG) 대체품들, 예를 들어 CH3는 제품들 사이의 선택성을 거의 제공하지 않을 것이다.C3와 C4 사이에 삼중 결합이 위치한 레지오이소머에서는 핵 첨가물에 대한 대체물의 효과가 감소하고, 파라와 메타 제품의 혼합물을 얻는 경우가 많다.[19]
아린의 순환반응
벤진은 비페닐렌을 형성하기 위해 급속한 조광화를 겪는다.벤지네로 가는 일부 루트는 특히 이 후속 반응의 빠르고 높은 수율을 이끌어 낸다.[13][16]트리머라이징은 트리페닐렌을 준다.[22]
벤지네는 사이클링 반응[4+2]을 겪을 수 있다.무연탄에서 생성되었을 때, trypticene 결과.[11]이 방법에서 벤지네와 푸란 사이의 디엘-알데르 반응의 일치된 메커니즘은 다음과 같다.다른 벤지네[4+2] 사이클로어드는 단계적 메커니즘을 통해 진행되는 것으로 생각된다.
대표적인 예가 1,2,3,4-테트라페닐나프탈렌의 합성이다.[23]테트라브로모벤젠은 부틸리튬과 푸란과 반응하여 테트라하이드로안트라센을[24] 형성할 수 있다.
[4+2] 아린스의 사이클로아데이션은 천연물 총합성에 일반적으로 적용되었다.그러나 그러한 접근법의 주요 제한사항은 푸란과 사이클로펜타디엔과 같은 제한된 디엔을 사용할 필요성이다.[14]2009년에 Buszek와 동료들은 Aryne[4+2]-cycloadition을 사용하여 허브딘돌 A를 합성했다.[25] 6,7-indolyne은 복잡한 4회성 반복 제품을 공급하기 위해 사이클로펜타디엔과 [4+2] 사이클로adien을 투여한다.
벤지네는 광범위한 알케인과 함께 [2+2] 사이클로어드를 겪는다.벤진의 전기영역학적 특성 때문에 전자 기부 대체물을 함유한 알켄이 이 반응에 가장 효과적이다.[26]
유의미한 부산물 형성으로 인해 아린[2+2] 화학은 천연물 총합성에 거의 활용되지 않는다.[14]그럼에도 불구하고, 몇 가지 예가 존재한다.1982년 스티븐스와 동료들은 아린과 케틴 아세트 사이에 [2+2] 사이클로어딕션을 이용한 택시오네 합성을 보고했다.[27]
모리와 동료들은 그들의 대만인 C의 총합성에서 팔라듐 분석 [2+2+2]-아린과 디아인의 코시클라이징을 수행했다.[28]
아린의 결합-삽입 반응
아린 σ-본드 삽입반응의 첫 번째 예는 1973년 멜레인의 합성이다.[29]
기타탈수벤젠류
벤지네가 1,2-디데하이드로벤젠이라면 1,3-디데하이드로벤젠과 1,4-디데하이드로벤젠 등 2개의 이소머가 추가로 가능하다.[3]실리코에서의 에너지는 각각 106, 122 및 138 kcal/mol(444, 510, 577 kJ/mol)이다.[30]1,2,1,3 이소머는 싱글릿 접지 상태가 있는 반면, 1,4-벤진에서는 간격이 더 작다.
1,2-, 1,3-, 1,4-didehydrobenzenes의 상호 변환이 연구되었다.[30][31]페닐 대체 아린 전구체의[30] 열분해(900 °C)에서 다음과 같이 1,2 ~ 1,3-디데히드로벤젠 변환이 발생하도록 가정하였다.벤지네 인터콘버전에는 극도로 높은 온도가 필요하다.
1,4-다이데하이드로아레나목
기존의 1,4-디데하이드로벤젠 실험에서 300 °C로 가열하면 [1,6-D2]-A는 [3,2-D2]-B와 쉽게 평준화되지만 C 또는 D와 평준화되지는 않는다.중수소 원자가 B를 형성하기 위해 동시에 이동하는 것과 C나 D 중 어느 것도 형성되지 않는다는 사실은 순환적이고 대칭적인 중간-1,4-다이데하이드로벤젠의 존재만으로 설명할 수 있다.[32]
1,4-didehydrobenzene에는 singlet과 triplet라는 두 개의 주가 제안되었고, singlet 상태는 에너지가 더 낮다.[33][34]트리플트 상태는 두 개의 비접촉적 급진적 중심을 나타내며, 따라서 페닐 라디칼과 같은 비율로 수력학을 추상화해야 한다.그러나 싱글렛 상태는 트리플렛보다 안정성이 높기 때문에 수소 분열의 전환 상태를 형성하기 위해 안정화 에너지의 일부가 손실되어 수소 추상화가 느려진다.첸은 에네딘 약물 후보자들의 선택성을 높이기 위해 싱글릿-트리플릿 에너지 격차가 큰 1,4-다이데하이드로벤젠 아날로그 사용을 제안했다.[35]
역사
아레네스에 대한 최초의 증거는 스토어머와 칼러트의 작품에서 나왔다.1902년, 그들은 에탄올 2-에톡시벤조푸란의 베이스가 있는 3-브로모벤조푸란을 처리하면 형성되는 것을 관찰했다.이 관찰에 기초하여 그들은 아리네 중간자를 가정했다.[36]
위티그 외 연구진은 비페닐을 주기 위해 플루오벤젠과 페닐리튬의 반응으로 zwitterionic 중량을 호출했다.[37][38][39]이 가설은 나중에 확인되었다.[40][41][42][43][44]
1953년 C 라벨링 실험은 벤진의 중간을 강력하게 지지했다.[40]존 D. 로버츠 외 연구진은 클로로벤젠-1-C와14 아미드 칼륨의 반응이 C-1과 C-2에서 C 통합과 동일한 양의 아일린을 투여했다는 것을 보여주었다.
위티그와 포머는 벤지네가 [4+2] 사이클로어드 추가 반응에 참여한다는 것을 발견했다.[45]
벤진의 존재에 대한 추가적인 증거는 분광학 연구에서 나왔다.[3]벤진은 "분자 용기"에서 관찰되었다.[46]
2015년에는 STM에 의해 단일 아린 분자가 이미징되었다.[47]
m-벤진(m-Benzyne)은64 과산화 에스테르2 1,3-CH3(OC(O)CH)와 같은 1,3 분해 벤젠 유도체에서 생성되었을 때 1990년대에 처음 입증되었다.2[3]
p-벤지네스에 대한 돌파구는 1960년대에 나타났고, 그 뒤를 버그만 사이클링에 관한 연구들이 뒤따랐다.[32]이 테마는 1,4-다이데하이드로벤젠을 생성하는 칼리케사미닌과 같은 에네디인 "사이토스타믹스"가 발견되면서 화제가 되었다.[48]
총합성에서의 벤젠의 예
아린을 매개체로 삼아 다양한 천연물이 준비됐다.[14]아리아인에 대한 핵동위원소 첨가물은 천연물 총합성에 널리 사용되어 왔다.실제로, 아린의 핵포화물은 아린 화학의 가장 오래된 것으로 알려진 적용의 일부다.[14]크립토오솔린(1)과 크립토롤린(2)의 합성을 시도했을 때 아린에 핵포필릭을 첨가한 것이 사용됐다.[49]
테트라사이클릭 메로테르페노이드(+--lipphagal)의 합성에는 아린 중간자(aryne 중간자)가 포함되어 있었다.[50]그들의 접근법은 천연물의 최종 고리를 닫기 위해 아린 사이클링을 채택했다.[14]
아린들의 다면체 반응은 1,2분해된 영역의 신속한 형성을 가능하게 하는 강력한 변형이다.그것의 잠재적 효용성에도 불구하고, 천연물 합성에 있어서 다세포성자 아린 반응의 예는 드물다.[14]탈수소 테뉴엔 B의 합성에는 네 가지 성분의 아린 결합 반응이 사용되었다.[51]
참고 항목
- 아린 화학의 더 많은 예: 트리시클로부타벤젠, 인메틸사이클로판, 트랜지션 메탈벤지네 복합체
- 피리딘 등가 피리딘
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "아닌". doi:10.1351/골드북.A00465
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "벤지네스". doi:10.1351/골드북.B00634
- ^ a b c d e Hans Henning Wenk, Michael Winkler, Wolfram Sander (2003). "One Century of Aryne Chemistry". Angew. Chem. Int. Ed. 42 (5): 502–528. doi:10.1002/anie.200390151. PMID 12569480.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "Dehydroaenes". doi:10.1351/골드북.D01574
- ^ IUPAC 골드 북 엔트리는 "m-벤진"과 "p-벤진"을 1,3, 1,4-디데하이드로벤젠의 잘못된 용어로 식별한다.
- ^ 앤슬린, E. V.; 더거티, D.A.: 현대 물리 유기 화학, 대학 과학 서적, 2006, p612.
- ^ Gampe, C. M.; Carreira, E. M. (2012). "Arynes and Cyclohexyne in Natural Product Synthesis". Angew. Chem. Int. Ed. Engl. 51 (16): 3766–78. doi:10.1002/anie.201107485. PMID 22422638.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Radziszewski, J. G.; Hess, Jr. B. A.; Zahradnik, R. (1992). "Infrared Spectrum of o-Benzyne: Experiment and Theory". J. Am. Chem. Soc. 114: 52. doi:10.1021/ja00027a007.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ 길크리스트, T. L. 보충제 C: 삼중 결합 기능 그룹의 화학, 1부. 파타이, S.; 라파포트, Z.Eds, John Wiley & Sons, New York, 1983년
- ^ Hoffmann, R.; Imamura, A.; Hehre, W. J. (1968). "Benzynes, dehydroconjugated molecules, and the interaction of orbitals separated by a number of intervening sigma bonds". J. Am. Chem. Soc. 90 (6): 1499. doi:10.1021/ja01008a018.
- ^ a b Wittig, Georg (1959). "Triptycene". Org. Synth. 39: 75. doi:10.15227/orgsyn.039.0075.
- ^ Sullivan, John M. (1971-06-01). "Explosion during preparation of benzenediazonium-2-carboxylate hydrochloride". Journal of Chemical Education. 48 (6): 419. Bibcode:1971JChEd..48..419S. doi:10.1021/ed048p419.3. ISSN 0021-9584.
- ^ a b Logullo, Francis M.; Seitz, Arnold M.; Friedman, Lester (1968). "Benzenediazonium-2-Carboxylate and Biphenylene (Benzenediazonium, o-carboxy-, hydroxide, inner salt)". Org. Synth. 48: 12. doi:10.15227/orgsyn.048.0012.
- ^ a b c d e f g Tadross, P. M.; Stoltz, B. M. (2012). "A Comprehensive History of Arynes in Natural Product Total Synthesis". Chem. Rev. 112 (6): 3550–3577. doi:10.1021/cr200478h. PMID 22443517.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Hoye, T. R.; Baire, B.; Niu, D.; Willoughby, P. H.; Woods, B. P. (2012). "The hexadehydro-Diels–Alder reaction". Nature. 490 (7419): 208–212. Bibcode:2012Natur.490..208H. doi:10.1038/nature11518. PMC 3538845. PMID 23060191.
- ^ a b Campbell, C.D.; C.W. Rees (1969). "Reactive intermediates. Part I. Synthesis and oxidation of 1- and 2-aminobenzotriazole". J. Chem. Soc. C. 1969 (5): 742–747. doi:10.1039/J39690000742.
- ^ Panar, Manuel (1961). The Elimination-Addition Mechanism of Nucleophilic Aromatic Substitution. Pasadena, CA: California Institute of Technology (Ph.D. Thesis). pp. 4–5.
- ^ H., Lowry, Thomas (1987). Mechanism and theory in organic chemistry. Richardson, Kathleen Schueller (3rd ed.). New York: Harper & Row. pp. 643. ISBN 0060440848. OCLC 14214254.
- ^ a b 앤슬린, E. V.; 더거티, D. A. 현대 물리 유기 화학.대학교 과학 도서, 2006
- ^ 디머, V.; 베고트, M.; 레루, F. R.; 콜로베르트, F. 유로 J. Org. 2011년 화학, 341년
- ^ Mizukoshi, Yoshihide; Mikami, Koichiro; Uchiyama, Masanobu (2015). "Aryne Polymerization Enabling Straightforward Synthesis of Elusive Poly(ortho-arylene)s". J. Am. Chem. Soc. 137 (1): 74–77. doi:10.1021/ja5112207. PMID 25459083.
- ^ Heaney, H.; Millar, I. T. (1960). "Triphenylene". Organic Syntheses. 40: 105.; Collective Volume, vol. 5, 1973, p. 1120
- ^ "1,2,3,4-Tetraphenylnaphthalene". Organic Syntheses. 46: 107. 1966. doi:10.15227/orgsyn.046.0107.
- ^ "Use of 1,2,4,5-Tetrabromobenzene as a 1,4-Nenzadiyne Equivalent: Anti- and Syn-1,4,5,8-tetrahydroanthracene 1,4:5,8-diepoxides". Organic Syntheses. 75: 201. 1998. doi:10.15227/orgsyn.075.0201.
- ^ Buszek, K. R.; Brown, N.; Kuo, D. (2009). "Concise Total Synthesis of (±)-cis-Trikentrin A and (±)-Herbindole A via Intermolecular Indole Aryne Cycloaddition". Org. Lett. 11 (1): 201–204. doi:10.1021/ol802425m. PMC 2723800. PMID 19055375.
- ^ 펠리시에, H.; 산텔리, M.4면체, 2003; 59, 701
- ^ Stevens, R. V.; Bisacchi, G. S. J. Org, Chem. 1982; 47, 2396
- ^ 사토, Y.; 타무라, T.;모리, M. 안젤로 화학. 인트. 2004년 12월 43일, 2436일
- ^ Guyot, M.; Molho, D.4면체 1973; 14, 3433
- ^ a b c Blake, M. E.; Bartlett, K. L.; Jones, M. Jr (2003). "A m-Benzyne to o-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group". J. Am. Chem. Soc. 125 (21): 6485–90. doi:10.1021/ja0213672. PMID 12785789.
- ^ Polishchuk, A. L.; Bartlett, K. L.; Friedman, L. A.; Jones, M. Jr (2004). "A p-Benzyne to m-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Completion of the Benzyne Cascade". J. Phys. Org. Chem. 17 (9): 798–806. doi:10.1002/poc.797.
- ^ a b Richard R. Jones; Robert G. Bergman (1972). "p-Benzyne. Generation as an intermediate in a thermal isomerization reaction and trapping evidence for the 1,4-benzenediyl structure". J. Am. Chem. Soc. 94 (2): 660–661. doi:10.1021/ja00757a071.
- ^ Clauberg, H.; Minsek, D. W.; Chen, P. (1992). "Mass and photoelectron spectroscopy of C3H2. .DELTA.Hf of singlet carbenes deviate from additivity by their singlet-triplet gaps". J. Am. Chem. Soc. 114: 99. doi:10.1021/ja00027a014.
- ^ Blush, J. A.; Clauberg, H.; Kohn, D. W.; Minsek, D. W.; Zhang, X.; Chen, P. (1992). "Photoionization mass and photoelectron spectroscopy of radicals, carbenes, and biradicals". Acc. Chem. Res. 25 (9): 385. doi:10.1021/ar00021a001.
- ^ Chen, P (1996). "Design of Diradical-based Hydrogen Abstraction Agents". Angew. Chem. Int. Ed. Engl. 35 (1314): 1478. doi:10.1002/anie.199614781.
- ^ Stoermer, R.; Kahlert, B. (1902). "Ueber das 1- und 2-Brom-cumaron". Berichte der Deutschen Chemischen Gesellschaft. 35 (2): 1633–1640. doi:10.1002/cber.19020350286.
- ^ Wittig, G.; Pieper, G.; Fuhrmann, G. (1940). "Über die Bildung von Diphenyl aus Fluorbenzol und Phenyl-lithium (IV. Mitteil. über Austauschreaktionen mit Phenyl-lithium)". Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 73 (11): 1193–1197. doi:10.1002/cber.19400731113.
- ^ Wittig, Georg (1942). "Phenyl-lithium, der Schlüssel zu einer neuen Chemie metallorganischer Verbindungen". Die Naturwissenschaften. 30 (46–47): 696–703. Bibcode:1942NW.....30..696W. doi:10.1007/BF01489519. S2CID 37148502.
- ^ Wittig, G (1954). "Fortschritte auf dem Gebiet der organischen Aniono-Chemie". Angewandte Chemie. 66 (1): 10–17. Bibcode:1954AngCh..66...10W. doi:10.1002/ange.19540660103.
- ^ a b Roberts, John D. (1953). "Rearrangement in the Reaction of Chlorobenzene-1-C14With Potassium Amide1". Journal of the American Chemical Society. 75 (13): 3290–3291. doi:10.1021/ja01109a523.
- ^ Roberts, John D. (1956). "The Mechanism of Aminations of Halobenzenes 1". Journal of the American Chemical Society. 78 (3): 601–611. doi:10.1021/ja01584a024.
- ^ Roberts, John D. (1956). "Orientation in Aminations of Substituted Halobenzenes 1". Journal of the American Chemical Society. 78 (3): 611–614. doi:10.1021/ja01584a025.
- ^ 현대 아릴레이션 방법.Lutz Ackermann 2009 WALIY-VCH Verlag GmbH & Co. KGA, Weinheim ISBN 978-3-527-31937-4 편집
- ^ Heaney, H. (1962). "The Benzyne and Related Intermediates". Chemical Reviews. 62 (2): 81–97. doi:10.1021/cr60216a001.
- ^ 위틱, 지퍼; 포머, 엘앤지우. 1955년 화학; 67년(13년), 348년
- ^ Warmuth, R.; Yoon (2001). "Recent highlights in hemicarcerand chemistry". Acc. Chem. Res. 34 (2): 96. doi:10.1021/ar980082k. PMID 11263868.
- ^ On-surface; Pérez, E.Guitián; Peña, L.Gross (2015). "On-surface generation and imaging of arynes by atomic force microscopy". Nature Chemistry. 7 (8): 623–8. Bibcode:2015NatCh...7..623P. doi:10.1038/nchem.2300. PMID 26201737.
- ^ Galm, U; Hager, MH; Van Lanen, SG; Ju, J; Thorson, JS; Shen, B (Feb 2005). "Antitumor antibiotics: bleomycin, enediynes, and mitomycin". Chemical Reviews. 105 (2): 739–58. doi:10.1021/cr030117g. PMID 15700963.
- ^ 카메타니, T.; 오가사와라, K. J. 화학. Soc, C 1967, 2208
- ^ Day, J. J.; McFadden, R. M.; Virgil, S. C.; Kolding, H.; Alleva, J. L.; Stoltz, B. M. (2011). "The catalytic enantioselective total synthesis of (+)-liphagal". Angew. Chem. Int. Ed. 50 (30): 6814–8. doi:10.1002/anie.201101842. PMC 3361906. PMID 21671325.
- ^ Soorukram, D.; Qu, T.; Barrett, A. G. M. (2008). "Four-Component Benzyne Coupling Reactions: A Concise Total Synthesis of Dehydroaltenuene B". Org. Lett. 10 (17): 3833–3835. doi:10.1021/ol8015435. PMID 18672878.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크)
외부 링크
 위키미디어 커먼스의 아리네스 관련 매체
위키미디어 커먼스의 아리네스 관련 매체