리스덱삼페타민
Lisdexamfetamine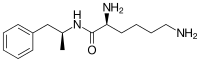 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 비반스, 티벤스, 엘반스, 기타 |
| 기타 이름 | (2S)-2,6-다이아미노-N-[(2S)-1-페닐프로판-2-yl]헥사나미드 N-[(2S)-1-페닐-2-프로파닐]-L-리시나미드 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a607047 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 의존성 책임감 있는 | 중간[1][2] |
| 중독 책임감 있는 | 중간[3][4] |
| 경로: 행정 | 입으로(캡슐) |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 96.4%[6] |
| 신진대사 | 처음에는 적혈구의 효소에 의한 가수분해. 후속 신진대사는 암페타민#파마코키네틱스를 따른다. |
| 행동 개시 | 2시간[7][8] |
| 제거 반감기 | ≤1 h(프러제 분자) 9–11시간(덱스트루암페타민) |
| 작용기간 | 10-12시간[9][7][8] |
| 배설 | 리날: ~2% |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| 화학 및 물리적 데이터 | |
| 공식 | C15H25N3O |
| 어금질량 | 263.385 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| | |
그중에서도 비반스라는 상표명으로 판매되는 리스트샴페타민은 5세 이상 사람들의 주의력결핍과잉행동장애(ADHD)는 물론 성인들 사이에서는 보통에서 심각한 폭식장애를 치료하는데 주로 쓰이는 흥분제 약이다.[10] Lisdexamfetahine은 입으로 복용한다. 그것의 효과는 일반적으로 2시간 이내에 시작하고 최대 14시간까지 지속된다.[10][11] 영국에서는 보통 메틸페니다이트보다 덜 선호된다.[12]
리스덱삼페타민의 일반적인 부작용으로는 식욕 저하, 불안, 설사, 수면장애, 자극성, 메스꺼움 등이 있다.[10] 드물지만 심각한 부작용으로는 조증, 심장에 문제가 있는 사람의 갑작스러운 심장사, 정신질환 등이 있다.[10] DEA당 약물 남용 가능성이 높다.[10][11] 세로토닌 증후군은 특정한 다른 약물과 함께 사용하면 발생할 수 있다.[10] 임신 중 이 제품을 사용하면 아기에게 해를 끼칠 수 있으며, 모유 수유 중에는 제조업체에서 권장하지 않는다.[12][10][11]
리스덱삼페타민은 인체에 의해 중추신경계(CNS) 자극제인 덱스트로암페타민으로 전환된 후 작용하는 비활동성 프로드약이다.[10][13] 화학적으로 리스덱삼페타민은 덱스트로암페타민에 부착된 아미노산 L-리신(L-리신)으로 구성된다.[14]
Lisdexamfetahine은 2007년 미국에서 의료용으로 승인되었다.[10] 2019년에는 미국에서 9백만 개 이상의 처방전을 받아 가장 흔하게 처방된 79번째 약이었다.[15][16] 그것은 영국의 B급 통제 물질이고 미국의 2급 통제 물질이다.[12][17]
사용하다
메디컬
Lisdexamfetamine은 주로 주의력 결핍 과잉행동 장애(ADHD)와 폭식장애의 치료제로 사용된다;[18] 그것은 다른 제약 암페타민과 유사한 오프라벨 용도를 가지고 있다.[9] 65세 이상의 개인은 ADHD를 위한 리스트덱삼페타민 임상실험에서 일반적으로 테스트되지 않았다.[18] 일부 동물종에서 충분히 높은 용량으로 장기간 암페타민에 노출되면 도파민 계통이 비정상적으로 발달하거나 신경 손상을 일으키는 것으로 알려져 있지만 ADHD를 앓고 있는 인간에서는 치료용량에서 약물암페타민이 뇌 발달과 신경 성장을 개선하는 것으로 보인다.[19][20][21][22][23] 자기공명영상(MRI) 연구 검토 결과, 암페타민으로 장기간 치료하면 ADHD 피험자에서 발견되는 뇌 구조와 기능의 이상이 감소하고 기저 갱년기의 오른쪽 입자핵 등 뇌의 여러 부분에서 기능이 개선되는 것으로 나타났다.[21][22][23]
임상 각성제 연구의 리뷰는 ADHD 치료를 위한 장기 연속 암페타민 사용의 안전성과 효과를 확립했다.[24][25][26] 2년간 지속되는 ADHD 치료를 위한 연속 자극제 치료의 무작위 제어 실험은 치료 효과와 안전성을 입증했다.[24][25] Two reviews have indicated that long-term continuous stimulant therapy for ADHD is effective for reducing the core symptoms of ADHD (i.e., hyperactivity, inattention, and impulsivity), enhancing quality of life and academic achievement, and producing improvements in a large number of functional outcomes[note 1] across 9 categories of outcomes related to a지적, 반사회적인 행동, 운전, 비흡연 약물 사용, 비만, 직업, 자존감, 서비스 사용(즉, 학업, 직업, 건강, 재정, 법률 서비스) 및 사회 기능.[24][26] 한 리뷰는 평균 4.5 IQ 포인트 증가, 지속적인 주의력 증가, 파괴적 행동과 과잉 행동의 지속적 감소를 발견한 어린이들의 ADHD 암페타민 치료제에 대한 9개월간의 무작위 통제 실험을 강조했다.[25] 또 다른 리뷰는 현재까지 시행된 가장 오랜 추적 연구를 바탕으로 유년기에 시작되는 평생 자극제 치료법이 ADHD 증상을 억제하는 데 지속적으로 효과적이며 성인으로서 물질 사용 장애의 발생 위험을 감소시킨다고 지적했다.[24]
ADHD의 현재 모델들은 그것은 어떤 뇌의neurotransmitter 시스템의 기능 장애와 관련된;[27]이 기능 장애는 청반은 prefr까지noradrenergic 전망에서 그mesocorticolimbic 프로젝션에 손상된 도파민 제품 신경 전달과 노르 에피네프린 제품 신경 전달을 포함하는 것을 제안합니다.onta이피질[27] 메틸페니데이트나 암페타민 같은 정신안정제는 ADHD 치료에 효과적이다. 왜냐하면 ADHD는 이러한 시스템에서 신경전달물질 활동을 증가시키기 때문이다.[28][27][29] 이러한 자극제를 사용하는 사람들의 약 80%는 ADHD 증상의 개선을 본다.[30] ADHD를 앓고 있는 아이들은 흥분제 약을 사용하는 다른 아이들과 가족 구성원들과 더 좋은 관계를 가지며, 학교에서 더 나은 성적을 내고, 덜 산만하고 충동적이며, 주의력이 더 길다.[31][32] 약암페타민을 가진 아동, 청소년, 성인의 ADHD 치료에 대한 코크란 리뷰는[note 2] 단기 연구 결과 이러한 약물이 증상의 심각성을 감소시키는 것으로 나타났지만 부작용 때문에 비침습성 의약품에 비해 중단률이 높다고 밝혔다.[34][35] 투렛 증후군과 같은 틱장애를 가진 어린이들의 ADHD 치료에 대한 코크란 리뷰는 자극제가 일반적으로 틱을 악화시키지는 않지만, 덱스트로암페타민을 많이 복용하면 일부 개인에서 틱을 악화시킬 수 있다고 밝혔다.[36]
성능 향상
인지성능
2015년에 체계적 검토와 좋은 품질의 임상 메타 분석할 때 낮은(치료)의 복용량에 사용하면, 암페타민 인지 능력을 작업 기억 장기적인 일화 기억, 억제 그리고 관심의 정상적인 건강한 성인들 사이에서 몇몇면들을 포함한 겸손한 아직 모호하지 않은 개선,;[37][38]이 cogn을 생산하는 것을 발견했다.ition-en암페타민의 한싱 효과는 전두엽 피질에서 도파민1 수용체 D와 아드레노셉터 α의2 간접 활성화를 통해 부분적으로 매개되는 것으로 알려져 있다.[28][37] 2014년부터 체계적으로 검토한 결과, 암페타민 저선량도 기억력 통합을 향상시켜 정보 회수율 향상으로 이어졌다.[39] 암페타민 치료용량은 또한 피질 네트워크 효율을 강화하는데, 이것은 모든 개인의 작업 기억력 향상을 매개하는 효과다.[28][40] 암페타민과 다른 ADHD 자극제는 또한 작업 편의성(과제 수행에 대한 동기 부여)을 향상시키고 활력(깨끗함)을 증가시켜 목표 지향적인 행동을 촉진한다.[28][41][42] 암페타민과 같은 자극제는 어렵고 지루한 과제에서 성능을 향상시킬 수 있으며 일부 학생들은 공부와 시험 보조 도구로 사용된다.[28][42][43] 불법 흥분제 사용에 대한 자체 보고된 연구를 바탕으로 대학생의 5~35%가 오락성 약물이 아닌 학업성취도 향상에 주로 쓰이는 전용 ADHD 흥분제를 사용하고 있다.[44][45][46] 그러나 치료 범위를 초과하는 고암페타민 선량은 기억력 및 인지 조절의 다른 측면을 방해할 수 있다.[28][42]
물리적 성능
암페타민은 일부 운동선수들에 의해 지구력 향상과 경계력 향상과 같은 심리적, 운동적 경기력 향상 효과로 사용되지만,[47][48] 대학, 국내, 국제 도핑방지기관에서 규제하는 스포츠 경기에서는 비의료용 암페타민 사용이 금지된다.[49][50] 경구 치료용량에서 건강한 사람에게 암페타민은 근육의 근력, 가속도, 혐기성 조건에서의 운동성능, 지구력(즉, 피로발작을 지연시키는 것)을 증가시키는 동시에 반응시간을 향상시키는 것으로 나타났다.[47][51][52] 암페타민은 주로 중추신경계 내 도파민의 재흡수 억제와 분비를 통해 지구력과 반응시간을 향상시킨다.[51][52][53] 암페타민 및 기타 도파민성 약품도 "안전 스위치"를 오버라이드하여 고정된 수준의 인지된 힘 발휘 시 출력량을 증가시켜 노심 온도 한도를 증가시켜 정상적으로 제한되지 않는 예비 용량에 접근할 수 있도록 한다.[52][54][55] 치료용량에서 암페타민의 부작용은 운동능력에 지장을 주지 않지만,[47][51] 훨씬 더 높은 용량에서 암페타민은 빠른 근육파괴나 체온상승과 같은 경기능력에 심각한 손상을 주는 효과를 유발할 수 있다.[56][51]
콘트라인커뮤니케이션
제약 리스트덱삼페타민 디메실레이트는 암페타민 제품에 과민성을 가진 환자나 제제의 비활성 성분 중 어느 하나에서든 억제된다.[18] 또한 최근 14일 이내에 모노아민 산화효소 억제제(MAOI)를 사용한 환자에게도 억제된다.[18][57] 암페타민 제품은 미국 식품의약국(USFDA)이 약물 남용, 심장병, 심한 동요나 불안 등의 이력이 있는 사람이나 현재 동맥경화증, 녹내장, 갑상선기능항진증, 심한 고혈압 등을 겪고 있는 사람에게서 제약을 받는다.[58] 미국 식품의약국은 조울증, 우울증, 혈압 상승, 간 또는 신장 질환, 조증, 정신 질환, 레이노 현상, 발작, 갑상선 질환, 틱스, 투렛 증후군이 있는 사람은 암페타민을 복용하면서 증상을 관찰할 것을 권고하고 있다.[58] 암페타민은 미국 임신 범주 C에 분류된다.[58] 이는 동물 연구에서 태아에게 해로운 점이 관찰되었고 적절한 인간 연구가 수행되지 않았다는 것을 의미한다. 암페타민은 잠재적 이득이 위험보다 클 경우 임산부에게 여전히 처방될 수 있다.[59] 암페타민도 모유에 들어가는 것으로 나타났기 때문에, 미국 식품의약국은 산모들에게 모유를 사용할 때 모유를 먹이는 것을 피하라고 권고하고 있다.[58] 성장이 저해될 수 있기 때문에, 미국 식품의약국은 암페타민을 처방한 어린이와 청소년의 키와 몸무게를 감시할 것을 권고한다.[58] 호주 치료용품 관리국에 의해 승인된 정보를 처방하는 것은 거식증을 더욱 억제한다.[60]
역효과
리스덱삼페타민을 함유한 제품은 암페타민이 함유된 제품과 유사한 약물 안전성 프로파일을 갖고 있다.[14]
상호작용
- 산성화제: 아스코르브산 등 소변을 산성화하는 약물은 덱스트로암페타민의 소변 배설을 증가시켜 체내 덱스트로암페타민의 반감기를 감소시킨다.[18][61]
- 알칼리화제: 중탄산나트륨과 같이 소변을 알칼리화시키는 약물은 덱스트로암페타민의 소변 배설을 감소시켜 체내 덱스트로암페타민의 반감기를 증가시킨다.[18][61]
- 모노아민 산화효소 억제제: MAOIs와 lisdexamfeteamin과 같은 중추신경계 자극제를 함께 사용하면 고혈압 위기를 초래할 수 있다.[18]
약리학
작용기전
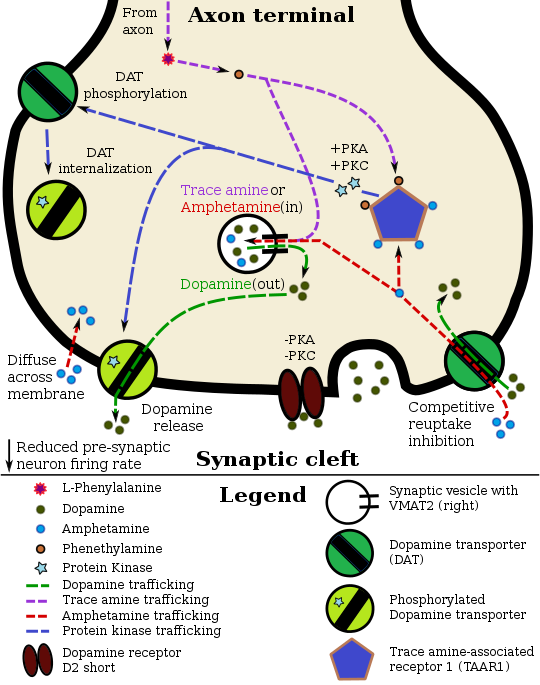
도파민 뉴런의 암페타민 약리역학 |
리스덱삼페타민은 체내에서 약물의 활동을 담당하는 약리학적 활성 화합물인 덱스트로암페타민으로 전환되는 비활성 프로드루약이다.[69] 경구 섭취 후 리스덱삼페타민은 적혈구 내 효소에 의해 분해되어 자연적으로 발생하는 필수 아미노산인 L-리신과 덱스트로암페타민을 형성한다.[18] 리스덱삼페타민에서 덱스트로암페타민으로의 전환은 위장 pH의 영향을 받지 않으며 정상적인 위장전달시간 변경의 영향을 받지 않을 가능성이 높다.[18][70]
amphetamine, 즉, 덱스트로 암페타민과 levoamphetamine의 광학 이성질체이다 TAAR1 촉진제와 모노아민 신경 세포에 입학할 수 있어 폐포 모노아민 트랜스포터 2억제제,[62][63]이 그들( 다른 사람들 사이에서 도파민, 노르 에피네프린 세로토닌 같은 것들,)이 시냅스전 neu에 저장 사이트에서 모노아민 신경 전달 물질을 방출하게 한다.ron, 시냅스 구획에서 이 신경전달물질의 재흡수를 [62][63]막아야지
리스덱삼페타민은 하루 종일 지속되는 긴 효과 지속시간을 제공하고, 남용 가능성을 줄인다는 목표로 개발되었다. 아미노산 리신을 부착하면 혈류에서 사용할 수 있는 덱스트로암페타민의 상대적인 양이 느려진다. 리스덱삼페타민 캡슐에는 무료 덱스트로암페타민이 없기 때문에 덱스트로암페타민은 압착이나 단순 추출 등 기계적 조작을 통해 사용할 수 없게 된다. 리스트덱삼페타민에서 덱스트로암페타민을 생산하기 위해서는 비교적 정교한 생화학적 과정이 필요하다.[70] 인종암페타민과 덱스트로암페타민염의 대략 같은 부분을 함유하고 있는 애드럴과는 반대로, 리스트삼페타민은 단일 에노머 덱스트로암페타민 공식이다.[69][71] 수행된 연구에 따르면, 리스트삼페타민 다메실레이트는 덱스트로암페타민보다 남용 잠재력이 적을 수 있고 ADHD 치료를 위해 FDA 승인을 받은 복용량의 디에틸프로피온과 유사한 남용 프로파일을 가질 수 있지만, 이 투여량이 100% [70]이상 초과되었을 때 여전히 높은 남용 잠재력을 가지고 있다.
약동학
암페타민의 경구 생체이용률은 위장 pH에 따라 다양하며,[56] 내장에서 잘 흡수되며, 덱스트로암페타민의 생체이용률은 일반적으로 75%가 넘는다.[72] 암페타민은 pK가a 9.9인 약한 염기로,[73] 결과적으로 pH가 기본일 때는 지질 용해성 프리 베이스 형태에 더 많은 약물이 들어가며, 더 많은 약물이 장 상피의 지질 풍부한 세포막을 통해 흡수된다.[73][56] 반대로 산성 pH는 약물이 대부분 수용성 계양(소금) 형태로 되어 있고, 적게 흡수된다는 것을 의미한다.[73] 혈류에서 순환하는 암페타민의 약 20%는 혈장 단백질과 결합되어 있다.[74] 흡수에 이어 암페타민은 체내 대부분의 조직으로 쉽게 분배되며, 뇌척수액과 뇌 조직에서 고농도가 발생한다.[75]
암페타민 에나토머의 반감기는 소변 pH에 따라 다르며 다르다.[73] 정상 소변 pH에서 덱스트로암페타민과 레보암페타민의 반감기는 각각 9~11시간, 11~14시간이다.[73] 산성이 높은 소변은 엔노머 반감기를 7시간으로 감소시키고,[75] 알칼리성이 높은 소변은 반감기를 34시간까지 증가시킨다.[75] 즉시 방출되는 염과 확장 방출된 염은 각각 투여 후 3시간과 7시간 후 혈장 농도에 도달한다.[73] 암페타민은 신장을 통해 제거되며, 약물의 30~40%가 정상적인 비뇨기 pH에서 변하지 않고 배설된다.[73] 비뇨기 pH가 기본일 때 암페타민은 자유 염기 형태여서 배설량이 적다.[73] 소변 pH가 비정상일 때 암페타민의 비뇨기 회복은 소변이 너무 기본인지 산성인지에 따라 각각 1%에서 75%까지 범위가 될 수 있다.[73] 경구 투여 후 3시간 이내에 소변에서 암페타민이 나타난다.[75] 섭취한 암페타민의 약 90%는 마지막 경구 투여 후 3일 후에 제거된다.[75]
프로드마약 리스트삼페타민은 위장관에 흡수될 때 암페타민만큼 pH에 민감하지 않으며,[18] 혈류로 흡수된 후 적혈구 관련 효소에 의해 가수분해를 통해 덱스트로암페타민으로 전환된다.[18] 리스덱삼페타민의 제거 반감기는 일반적으로 1시간 미만이다.[18]
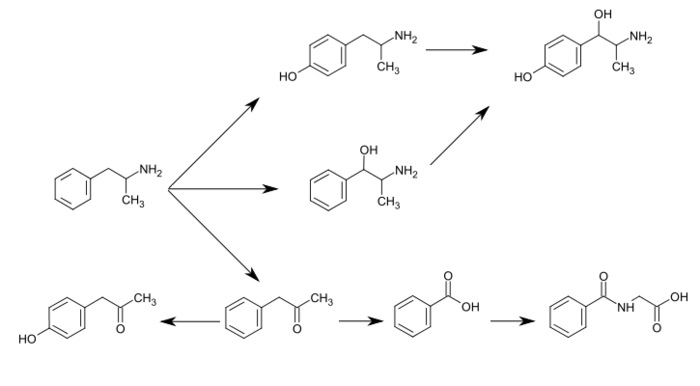
CYP2D6, 도파민 β-히드록실라아제(DBH), 플라빈 함유 모노옥시제 3(FMO3), 부티레이트-CoA 리게아제(XM-ligase), 글리신 N-아킬전달효소(GLYAT)는 암페타민 또는 그 대사물을 사람 내 대사시키는 효소다.[sources 1] 암페타민은 4-히드록시암페타민, 4-히드록시노레페드린, 4-히드록시페닐아세톤, 벤조산, 히프산, 노레페드린, 페닐라세톤 등 다양한 배설물 대사 제품을 갖고 있다.[73][76] 이들 대사물 중 활성 동조체는 4히드록시암페타민,[77] 4히드록시노레페드린,[78] 노레페드린이다.[79] 주요 대사경로는 방향성 파라-수소화, 알리프 알파 및 베타-수소화, N-산소화, N-데알킬화, 탈염 등이 있다.[73][80] 인간 내 알려진 대사 경로, 검출 가능한 대사물 및 대사 효소에는 다음이 포함된다.
화학
이 구간은 확장이 필요하다. 덧셈으로 도움도 된다. (2015년 9월) |
Lisdexamfetamine은 필수 아미노산 L-리신의 카르복실산 그룹과 덱스트로암페타민이 응결되어 형성된 아미드 연동을 가진 대체암페타민이다.[14] 스테레오케미칼의 보유와 함께 반응이 일어나므로 리스덱삼페타민 제품은 하나의 스테레오이머로서 존재한다. There are many possible names for lisdexamfetamine based on IUPAC nomenclature, but it is usually named as N-[(2S)-1-phenyl-2-propanyl]-L-lysinamide or (2S)-2,6-diamino-N-[(1S)-1-methyl-2-phenylethyl]hexanamide.[90] 응축 반응은 수분 손실과 함께 발생한다.
- (S)-PHCH
2(CH
3)NH
2 + (S
2)-HUCH(NH
2)ECHCHCHCH
2
2
2
2
2 → (S
3, S)-PHCHHCH
2(O)CHCHCHCHCH
2
2
2
2
2 + HO
2
아민 기능성 그룹은 공기 중의 산화 작용에 취약하기 때문에, 아민 기능성 그룹이 함유된 의약품은 보통 이 모이가 양성된 곳에서 소금으로 제조된다. 이것은 안정성과 수용성을 증가시키고, 분자 화합물을 이온 화합물로 변환시킴으로써 용해점을 증가시켜 고체 제품을 보장한다.[91] 리스덱삼페타민의 경우 메탄설폰산의 등가물 2개와 반응해 백색에서 오프화이트(Off-white) 색상의 수용성(792mg mL−1) 분말인 다메실산염(dimesylate sale)을 생산해 이를 달성한다.[18]
- PCH
2(CH
3)NHC(O
2)CHC(O
2
2
2
2
2)CHCHCH+2 CHSOH
3
3 → [PhCH
2(CH
3+
3)NHCHCHCH(O)CHCHCHCHNH][
2ChSO
2
2
2
2+
3
3−
3]
다른 공식과 비교
Lisdexamfetamine dimesylate는 덱스트로암페타민을 전달하는 시판된 제제물이다. 다음 표는 이 약을 다른 암페타민 약물과 비교한 것이다.
| 약물을 복용하다 | 공식 | 분자질량 [주4] | 암페타민 베이스 [주5] | 암페타민 베이스 같은 양으로 | 와의 복용량. 동일본위 내용물 [주6] | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| (g/message) | (%) | (30mg 용량) | ||||||||
| 총계 | 밑의 | 총계 | 덱스트로- | 레보- | 덱스트로- | 레보- | ||||
| 황산페타민 덱스트로암페타민[93][94] | (C9H13N)2•H2SO4 | 368.49 | 270.41 | 73.38% | 73.38% | — | 22.0mg | — | 30.0mg | |
| 황산암페타민 암페타민[95] | (C9H13N)2•H2SO4 | 368.49 | 270.41 | 73.38% | 36.69% | 36.69% | 11.0mg | 11.0mg | 30.0mg | |
| 애더럴 | 62.57% | 47.49% | 15.08% | 14.2mg | 4.5mg | 35.2mg | ||||
| 25% | 황산페타민[93][94] 덱스트로암페타민 | (C9H13N)2•H2SO4 | 368.49 | 270.41 | 73.38% | 73.38% | — | |||
| 25% | 황산암페타민[95] 암페타민 | (C9H13N)2•H2SO4 | 368.49 | 270.41 | 73.38% | 36.69% | 36.69% | |||
| 25% | 덱스트로암페타민 사카레이트[96] | (C9H13N)2•C6H10O8 | 480.55 | 270.41 | 56.27% | 56.27% | — | |||
| 25% | 암페타민 아스파라테 단수화물[97] | (C9H13N)•C4H7NO4•H2O | 286.32 | 135.21 | 47.22% | 23.61% | 23.61% | |||
| 리스덱삼페타민 디메실레이트[18] | C15H25N3O•(CH4O3S)2 | 455.49 | 135.21 | 29.68% | 29.68% | — | 8.9mg | — | 74.2mg | |
| 암페타민 베이스 서스펜션[98] | C9H13N | 135.21 | 135.21 | 100% | 76.19% | 23.81% | 22.9mg | 7.1mg | 22.0mg | |
역사
리스트삼페타민은 다케다제약이 샤이어제약 인수를 통해 사들인 뉴리버제약이 시판되기 직전 개발했다. 적혈구 내 효소를 통한 덱스트로암페타민으로의 전환 요건이 투여 경로에 관계없이 작용 시작을 지연시키므로 덱스트로암페타민에 대해 보다 오래 지속되고 쉽게 남용되지 않는 버전을 만들자는 취지로 개발되었다.[99]
2008년 4월 23일, FDA는 성인의 ADHD 치료를 위해 Lisdexamfetamine을 승인했다.[100] 2009년 8월 4일, Health Canada는 처방전 사용을 위한 Lisdexamfetamine 30mg과 50mg 캡슐의 마케팅을 승인했다.[101]
2015년 1월 미국 식품의약국(FDA)[102]으로부터 성인의 폭식장애 치료 승인을 받은 리스트덱삼페타민.
미국에서 2016년 생산 쿼터는 29,750kg이었다.[103]
브랜드명
Lisdexamfetamine은 L-Lysine-덱스트로암페타민의 수축이다.
2014년 7월 현재 Lisdexamfetamine은 Elvanse, Samexid, Tyvense, Venvanse, Vyvanse 등의 브랜드로 판매되고 있다.[104]
리서치
우울증
선택적 세로토닌 재흡수 억제제(SSRI)나 세로토닌-노레피네프린 재흡수 억제제(SNRI)를 첨가 치료제로 사용한 일부 임상시험에서는 이것이 SSRI나 SNRI만 사용하는 것보다 효과적이지 않다는 것을 보여주었다.[105] 다른 연구들은 심리 자극제가 항우울제를 촉진시켰고 치료 저항성 우울증에 대해 처방받지 못했다고 밝혔다. 그 연구에서 환자들은 에너지, 기분, 정신운동의 현저한 향상을 보였다.[106] 2014년 2월 샤이어는 두 번의 말기 임상실험에서 비반스가 우울증에 효과적인 치료법이 아니라는 것을 보여주었다고 발표했다.[107]
메모들
- ^ 장기 지속적 흥분제 치료에서 현저하게 개선된 결과의 비율이 가장 높은 ADHD 관련 결과 영역에는 학업(학업적 결과의 55%) 주행(운전 결과의 100%) 비의료용 약물 사용(중독 관련 결과의 47%) 비만(비만 관련 결과의 65%)이 포함된다. 개선), 자존감(자긍심 결과의 50%) 및 사회적 기능(사회적 기능 결과의 67%)이 향상되었다.[26]
장기 자극제 치료로 인한 결과 개선 효과의 가장 큰 크기는 학계(예: 성적 평균, 성취도 시험 점수, 교육 기간, 교육 수준), 자존감(예: 자존감 설문지 평가, 자살 시도 횟수, 자살률)과 사회 기능(예: 자살률)이 포함된 영역에서 발생한다.. 또래 지명 점수, 사회 기술 및 또래, 가족, 연애 관계의 질.[26]
ADHD에 대한 장기 조합 치료(즉, 각성제와 행동요법을 병행하는 치료)는 결과 개선에 대한 효과 크기가 훨씬 더 크며 장기 자극제 치료에만 비해 각 영역 전체에서 결과의 더 큰 비중을 개선한다.[26] - ^ Cochrane 리뷰는 무작위 제어 시험의 고품질의 메타 분석적 체계적 리뷰다.[33]
- ^ 4-히드록시암페타민은 시험관내 도파민 베타-히드록시라아제(DBH)에 의해 4-히드록시노레페드린으로 대사되는 것으로 나타났으며 체내에서도 비슷하게 대사되는 것으로 추정된다.[81][85] 연구에서 혈청 DBH 농도를 인체에4-hydroxyamphetamine 신진대사에 효과를 측정했습니다 증거는 다른 효소 4-hydroxyamphetamine의 4-hydroxynorephedrine로 변환하는 것이 중재할 수도 있고[85][87] 하지만, 동물 연구로 다른 증거는 이 반응 DBH에 의해 시냅스 소포에 촉매 작용이 있음을 의미한다.안에 뇌에 있는 [88][89]노라드레날린 뉴런들
- ^ 균일성을 위해 분자 질량은 Lenntech Mole Wealth Calculator를[92] 사용하여 계산되었으며, 발표된 의약품 값의 0.01g/mol 이내였습니다.
- ^ 암페타민 기본 백분율 = 분자 질량base/분자 질량total Adderall에 대한 암페타민 기본 백분율 = 성분 백분율 / 4의 합계.
- ^ 선량 = (1 / 암페타민 기준 비율) × 스케일링 계수 = (분자 질량total/분자 질량base) × 스케일링 계수. 이 열의 값은 30mg의 덱스트로암페타민 황산염으로 조정되었다. 이러한 약물들 간의 약리학적 차이(예: 방출, 흡수, 전환, 농도 차이, 항산화제, 반감기 등)로 인해 열거된 값은 등전위 선량으로 간주되지 않아야 한다.
참고 사항
참조
- ^ "Adderall vs Vyvanse - What's the difference between them?".
- ^ Goodman, D. W. (2010). "Lisdexamfetamine Dimesylate (Vyvanse), A Prodrug Stimulant for Attention-Deficit/Hyperactivity Disorder". P & T: A Peer-Reviewed Journal for Formulary Management. 35 (5): 273–287. PMC 2873712. PMID 20514273.
- ^ "Adderall vs Vyvanse - What's the difference between them?".
- ^ Goodman, D. W. (2010). "Lisdexamfetamine Dimesylate (Vyvanse), A Prodrug Stimulant for Attention-Deficit/Hyperactivity Disorder". P & T: A Peer-Reviewed Journal for Formulary Management. 35 (5): 273–287. PMC 2873712. PMID 20514273.
- ^ https://www.ema.europa.eu/documents/psusa/lisdexamfetamine-list-nationally-authorised-medicinal-products-psusa/00010289/202002_en.pdf
- ^ "Public Assessment Report Decentralised Procedure" (PDF). MHRA. p. 14. Retrieved 23 August 2014.
- ^ a b Millichap JG (2010). "Chapter 9: Medications for ADHD". In Millichap JG (ed.). Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd ed.). New York, USA: Springer. p. 112. ISBN 9781441913968.
Table 9.2 Dextroamphetamine formulations of stimulant medication
Dexedrine [Peak:2–3 h] [Duration:5–6 h] ...
Adderall [Peak:2–3 h] [Duration:5–7 h]
Dexedrine spansules [Peak:7–8 h] [Duration:12 h] ...
Adderall XR [Peak:7–8 h] [Duration:12 h]
Vyvanse [Peak:3–4 h] [Duration:12 h] - ^ a b Brams M, Mao AR, Doyle RL (September 2008). "Onset of efficacy of long-acting psychostimulants in pediatric attention-deficit/hyperactivity disorder". Postgrad. Med. 120 (3): 69–88. doi:10.3810/pgm.2008.09.1909. PMID 18824827. S2CID 31791162.
Onset of efficacy was earliest for d-MPH-ER at 0.5 hours, followed by d, l-MPH-LA at 1 to 2 hours, MCD at 1.5 hours, d, l-MPH-OR at 1 to 2 hours, MAS-XR at 1.5 to 2 hours, MTS at 2 hours, and LDX at approximately 2 hours. ... MAS-XR, and LDX have a long duration of action at 12 hours postdose
- ^ a b Stahl SM (March 2017). "Lisdexamfetamine". Prescriber's Guide: Stahl's Essential Psychopharmacology (6th ed.). Cambridge, United Kingdom: Cambridge University Press. pp. 379–384. ISBN 9781108228749.
- ^ a b c d e f g h i "Lisdexamfetamine Dimesylate Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved 15 April 2019.
- ^ a b c "Lisdexamfetamine (Vyvanse) Use During Pregnancy". Drugs.com. Retrieved 16 April 2019.
- ^ a b c British national formulary: BNF 76 (76 ed.). Pharmaceutical Press. 2018. pp. 348–349. ISBN 9780857113382.
- ^ Heal DJ, Smith SL, Gosden J, Nutt DJ (June 2013). "Amphetamine, past and present – a pharmacological and clinical perspective". J. Psychopharmacol. 27 (6): 479–496. doi:10.1177/0269881113482532. PMC 3666194. PMID 23539642.
- ^ a b c Blick SK, Keating GM (2007). "Lisdexamfetamine". Paediatric Drugs. 9 (2): 129–135, discussion 136–138. doi:10.2165/00148581-200709020-00007. PMID 17407369.
- ^ "The Top 300 of 2019". ClinCalc. Retrieved 16 October 2021.
- ^ "Lisdexamfetamine - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ Drugs of Abuse (PDF). Drug Enforcement Administration • U.S. Department of Justice. 2017. p. 22. Retrieved 16 April 2019.
- ^ a b c d e f g h i j k l m n "Vyvanse- lisdexamfetamine dimesylate capsule Vyvanse- lisdexamfetamine dimesylate tablet, chewable". DailyMed. Shire US Inc. 30 October 2019. Retrieved 22 December 2019.
- ^ Carvalho M, Carmo H, Costa VM, Capela JP, Pontes H, Remião F, Carvalho F, Bastos Mde L (August 2012). "Toxicity of amphetamines: an update". Archives of Toxicology. 86 (8): 1167–1231. doi:10.1007/s00204-012-0815-5. PMID 22392347. S2CID 2873101.
- ^ Berman S, O'Neill J, Fears S, Bartzokis G, London ED (October 2008). "Abuse of amphetamines and structural abnormalities in the brain". Annals of the New York Academy of Sciences. 1141 (1): 195–220. doi:10.1196/annals.1441.031. PMC 2769923. PMID 18991959.
- ^ a b Hart H, Radua J, Nakao T, Mataix-Cols D, Rubia K (February 2013). "Meta-analysis of functional magnetic resonance imaging studies of inhibition and attention in attention-deficit/hyperactivity disorder: exploring task-specific, stimulant medication, and age effects". JAMA Psychiatry. 70 (2): 185–198. doi:10.1001/jamapsychiatry.2013.277. PMID 23247506.
- ^ a b Spencer TJ, Brown A, Seidman LJ, Valera EM, Makris N, Lomedico A, Faraone SV, Biederman J (September 2013). "Effect of psychostimulants on brain structure and function in ADHD: a qualitative literature review of magnetic resonance imaging-based neuroimaging studies". The Journal of Clinical Psychiatry. 74 (9): 902–917. doi:10.4088/JCP.12r08287. PMC 3801446. PMID 24107764.
- ^ a b Frodl T, Skokauskas N (February 2012). "Meta-analysis of structural MRI studies in children and adults with attention deficit hyperactivity disorder indicates treatment effects". Acta Psychiatrica Scandinavica. 125 (2): 114–126. doi:10.1111/j.1600-0447.2011.01786.x. PMID 22118249. S2CID 25954331.
Basal ganglia regions like the right globus pallidus, the right putamen, and the nucleus caudatus are structurally affected in children with ADHD. These changes and alterations in limbic regions like ACC and amygdala are more pronounced in non-treated populations and seem to diminish over time from child to adulthood. Treatment seems to have positive effects on brain structure.
- ^ a b c d Huang YS, Tsai MH (July 2011). "Long-term outcomes with medications for attention-deficit hyperactivity disorder: current status of knowledge". CNS Drugs. 25 (7): 539–554. doi:10.2165/11589380-000000000-00000. PMID 21699268. S2CID 3449435.
Several other studies,[97-101] including a meta-analytic review[98] and a retrospective study,[97] suggested that stimulant therapy in childhood is associated with a reduced risk of subsequent substance use, cigarette smoking and alcohol use disorders. ... Recent studies have demonstrated that stimulants, along with the non-stimulants atomoxetine and extended-release guanfacine, are continuously effective for more than 2-year treatment periods with few and tolerable adverse effects. The effectiveness of long-term therapy includes not only the core symptoms of ADHD, but also improved quality of life and academic achievements. The most concerning short-term adverse effects of stimulants, such as elevated blood pressure and heart rate, waned in long-term follow-up studies. ... The current data do not support the potential impact of stimulants on the worsening or development of tics or substance abuse into adulthood. In the longest follow-up study (of more than 10 years), lifetime stimulant treatment for ADHD was effective and protective against the development of adverse psychiatric disorders.
- ^ a b c Millichap JG (2010). "Chapter 9: Medications for ADHD". In Millichap JG (ed.). Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd ed.). New York, USA: Springer. pp. 121–123, 125–127. ISBN 9781441913968.
Ongoing research has provided answers to many of the parents' concerns, and has confirmed the effectiveness and safety of the long-term use of medication.
- ^ a b c d e Arnold LE, Hodgkins P, Caci H, Kahle J, Young S (February 2015). "Effect of treatment modality on long-term outcomes in attention-deficit/hyperactivity disorder: a systematic review". PLOS ONE. 10 (2): e0116407. doi:10.1371/journal.pone.0116407. PMC 4340791. PMID 25714373.
The highest proportion of improved outcomes was reported with combination treatment (83% of outcomes). Among significantly improved outcomes, the largest effect sizes were found for combination treatment. The greatest improvements were associated with academic, self-esteem, or social function outcomes.
그림 3: 치료 유형 및 결과 그룹별 치료 혜택 - ^ a b c Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. pp. 154–157. ISBN 9780071481274.
- ^ a b c d e f Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 13: Higher Cognitive Function and Behavioral Control". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. pp. 318, 321. ISBN 9780071481274.
Therapeutic (relatively low) doses of psychostimulants, such as methylphenidate and amphetamine, improve performance on working memory tasks both in normal subjects and those with ADHD. ... stimulants act not only on working memory function, but also on general levels of arousal and, within the nucleus accumbens, improve the saliency of tasks. Thus, stimulants improve performance on effortful but tedious tasks ... through indirect stimulation of dopamine and norepinephrine receptors. ...
Beyond these general permissive effects, dopamine (acting via D1 receptors) and norepinephrine (acting at several receptors) can, at optimal levels, enhance working memory and aspects of attention. - ^ Bidwell LC, McClernon FJ, Kollins SH (August 2011). "Cognitive enhancers for the treatment of ADHD". Pharmacology Biochemistry and Behavior. 99 (2): 262–274. doi:10.1016/j.pbb.2011.05.002. PMC 3353150. PMID 21596055.
- ^ Parker J, Wales G, Chalhoub N, Harpin V (September 2013). "The long-term outcomes of interventions for the management of attention-deficit hyperactivity disorder in children and adolescents: a systematic review of randomized controlled trials". Psychology Research and Behavior Management. 6: 87–99. doi:10.2147/PRBM.S49114. PMC 3785407. PMID 24082796.
Only one paper53 examining outcomes beyond 36 months met the review criteria. ... There is high level evidence suggesting that pharmacological treatment can have a major beneficial effect on the core symptoms of ADHD (hyperactivity, inattention, and impulsivity) in approximately 80% of cases compared with placebo controls, in the short term.
- ^ Millichap JG (2010). "Chapter 9: Medications for ADHD". In Millichap JG (ed.). Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd ed.). New York, USA: Springer. pp. 111–113. ISBN 9781441913968.
- ^ "Stimulants for Attention Deficit Hyperactivity Disorder". WebMD. Healthwise. 12 April 2010. Retrieved 12 November 2013.
- ^ Scholten RJ, Clarke M, Hetherington J (August 2005). "The Cochrane Collaboration". European Journal of Clinical Nutrition. 59 (Suppl 1): S147–S149, discussion S195–S196. doi:10.1038/sj.ejcn.1602188. PMID 16052183. S2CID 29410060.
- ^ Castells X, Blanco-Silvente L, Cunill R (August 2018). "Amphetamines for attention deficit hyperactivity disorder (ADHD) in adults". Cochrane Database of Systematic Reviews. 2018 (8): CD007813. doi:10.1002/14651858.CD007813.pub3. PMC 6513464. PMID 30091808.
- ^ Punja S, Shamseer L, Hartling L, Urichuk L, Vandermeer B, Nikles J, Vohra S (February 2016). "Amphetamines for attention deficit hyperactivity disorder (ADHD) in children and adolescents". Cochrane Database of Systematic Reviews. 2: CD009996. doi:10.1002/14651858.CD009996.pub2. PMID 26844979.
- ^ Osland ST, Steeves TD, Pringsheim T (June 2018). "Pharmacological treatment for attention deficit hyperactivity disorder (ADHD) in children with comorbid tic disorders". Cochrane Database of Systematic Reviews. 2018 (6): CD007990. doi:10.1002/14651858.CD007990.pub3. PMC 6513283. PMID 29944175.
- ^ a b Spencer RC, Devilbiss DM, Berridge CW (June 2015). "The Cognition-Enhancing Effects of Psychostimulants Involve Direct Action in the Prefrontal Cortex". Biological Psychiatry. 77 (11): 940–950. doi:10.1016/j.biopsych.2014.09.013. PMC 4377121. PMID 25499957.
The procognitive actions of psychostimulants are only associated with low doses. Surprisingly, despite nearly 80 years of clinical use, the neurobiology of the procognitive actions of psychostimulants has only recently been systematically investigated. Findings from this research unambiguously demonstrate that the cognition-enhancing effects of psychostimulants involve the preferential elevation of catecholamines in the PFC and the subsequent activation of norepinephrine α2 and dopamine D1 receptors. ... This differential modulation of PFC-dependent processes across dose appears to be associated with the differential involvement of noradrenergic α2 versus α1 receptors. Collectively, this evidence indicates that at low, clinically relevant doses, psychostimulants are devoid of the behavioral and neurochemical actions that define this class of drugs and instead act largely as cognitive enhancers (improving PFC-dependent function). ... In particular, in both animals and humans, lower doses maximally improve performance in tests of working memory and response inhibition, whereas maximal suppression of overt behavior and facilitation of attentional processes occurs at higher doses.
- ^ Ilieva IP, Hook CJ, Farah MJ (June 2015). "Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis". Journal of Cognitive Neuroscience. 27 (6): 1069–1089. doi:10.1162/jocn_a_00776. PMID 25591060. S2CID 15788121.
Specifically, in a set of experiments limited to high-quality designs, we found significant enhancement of several cognitive abilities. ... The results of this meta-analysis ... do confirm the reality of cognitive enhancing effects for normal healthy adults in general, while also indicating that these effects are modest in size.
- ^ Bagot KS, Kaminer Y (April 2014). "Efficacy of stimulants for cognitive enhancement in non-attention deficit hyperactivity disorder youth: a systematic review". Addiction. 109 (4): 547–557. doi:10.1111/add.12460. PMC 4471173. PMID 24749160.
Amphetamine has been shown to improve consolidation of information (0.02 ≥ P ≤ 0.05), leading to improved recall.
- ^ Devous MD, Trivedi MH, Rush AJ (April 2001). "Regional cerebral blood flow response to oral amphetamine challenge in healthy volunteers". Journal of Nuclear Medicine. 42 (4): 535–542. PMID 11337538.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 266. ISBN 9780071481274.
Dopamine acts in the nucleus accumbens to attach motivational significance to stimuli associated with reward.
- ^ a b c Wood S, Sage JR, Shuman T, Anagnostaras SG (January 2014). "Psychostimulants and cognition: a continuum of behavioral and cognitive activation". Pharmacological Reviews. 66 (1): 193–221. doi:10.1124/pr.112.007054. PMC 3880463. PMID 24344115.
- ^ Twohey M (26 March 2006). "Pills become an addictive study aid". JS Online. Archived from the original on 15 August 2007. Retrieved 2 December 2007.
- ^ Teter CJ, McCabe SE, LaGrange K, Cranford JA, Boyd CJ (October 2006). "Illicit use of specific prescription stimulants among college students: prevalence, motives, and routes of administration". Pharmacotherapy. 26 (10): 1501–1510. doi:10.1592/phco.26.10.1501. PMC 1794223. PMID 16999660.
- ^ Weyandt LL, Oster DR, Marraccini ME, Gudmundsdottir BG, Munro BA, Zavras BM, Kuhar B (September 2014). "Pharmacological interventions for adolescents and adults with ADHD: stimulant and nonstimulant medications and misuse of prescription stimulants". Psychology Research and Behavior Management. 7: 223–249. doi:10.2147/PRBM.S47013. PMC 4164338. PMID 25228824.
misuse of prescription stimulants has become a serious problem on college campuses across the US and has been recently documented in other countries as well. ... Indeed, large numbers of students claim to have engaged in the nonmedical use of prescription stimulants, which is reflected in lifetime prevalence rates of prescription stimulant misuse ranging from 5% to nearly 34% of students.
- ^ Clemow DB, Walker DJ (September 2014). "The potential for misuse and abuse of medications in ADHD: a review". Postgraduate Medicine. 126 (5): 64–81. doi:10.3810/pgm.2014.09.2801. PMID 25295651. S2CID 207580823.
Overall, the data suggest that ADHD medication misuse and diversion are common health care problems for stimulant medications, with the prevalence believed to be approximately 5% to 10% of high school students and 5% to 35% of college students, depending on the study.
- ^ a b c Liddle DG, Connor DJ (June 2013). "Nutritional supplements and ergogenic AIDS". Primary Care: Clinics in Office Practice. 40 (2): 487–505. doi:10.1016/j.pop.2013.02.009. PMID 23668655.
Amphetamines and caffeine are stimulants that increase alertness, improve focus, decrease reaction time, and delay fatigue, allowing for an increased intensity and duration of training ...
Physiologic and performance effects
• Amphetamines increase dopamine/norepinephrine release and inhibit their reuptake, leading to central nervous system (CNS) stimulation
• Amphetamines seem to enhance athletic performance in anaerobic conditions 39 40
• Improved reaction time
• Increased muscle strength and delayed muscle fatigue
• Increased acceleration
• Increased alertness and attention to task - ^ Westfall DP, Westfall TC (2010). "Miscellaneous Sympathomimetic Agonists". In Brunton LL, Chabner BA, Knollmann BC (eds.). Goodman & Gilman's Pharmacological Basis of Therapeutics (12th ed.). New York, USA: McGraw-Hill. ISBN 9780071624428.
- ^ Bracken NM (January 2012). "National Study of Substance Use Trends Among NCAA College Student-Athletes" (PDF). NCAA Publications. National Collegiate Athletic Association. Retrieved 8 October 2013.
- ^ Docherty JR (June 2008). "Pharmacology of stimulants prohibited by the World Anti-Doping Agency (WADA)". British Journal of Pharmacology. 154 (3): 606–622. doi:10.1038/bjp.2008.124. PMC 2439527. PMID 18500382.
- ^ a b c d Parr JW (July 2011). "Attention-deficit hyperactivity disorder and the athlete: new advances and understanding". Clinics in Sports Medicine. 30 (3): 591–610. doi:10.1016/j.csm.2011.03.007. PMID 21658550.
In 1980, Chandler and Blair47 showed significant increases in knee extension strength, acceleration, anaerobic capacity, time to exhaustion during exercise, pre-exercise and maximum heart rates, and time to exhaustion during maximal oxygen consumption (VO2 max) testing after administration of 15 mg of dextroamphetamine versus placebo. Most of the information to answer this question has been obtained in the past decade through studies of fatigue rather than an attempt to systematically investigate the effect of ADHD drugs on exercise.
- ^ a b c Roelands B, de Koning J, Foster C, Hettinga F, Meeusen R (May 2013). "Neurophysiological determinants of theoretical concepts and mechanisms involved in pacing". Sports Medicine. 43 (5): 301–311. doi:10.1007/s40279-013-0030-4. PMID 23456493. S2CID 30392999.
In high-ambient temperatures, dopaminergic manipulations clearly improve performance. The distribution of the power output reveals that after dopamine reuptake inhibition, subjects are able to maintain a higher power output compared with placebo. ... Dopaminergic drugs appear to override a safety switch and allow athletes to use a reserve capacity that is 'off-limits' in a normal (placebo) situation.
- ^ Parker KL, Lamichhane D, Caetano MS, Narayanan NS (October 2013). "Executive dysfunction in Parkinson's disease and timing deficits". Frontiers in Integrative Neuroscience. 7: 75. doi:10.3389/fnint.2013.00075. PMC 3813949. PMID 24198770.
Manipulations of dopaminergic signaling profoundly influence interval timing, leading to the hypothesis that dopamine influences internal pacemaker, or "clock," activity. For instance, amphetamine, which increases concentrations of dopamine at the synaptic cleft advances the start of responding during interval timing, whereas antagonists of D2 type dopamine receptors typically slow timing;... Depletion of dopamine in healthy volunteers impairs timing, while amphetamine releases synaptic dopamine and speeds up timing.
- ^ Rattray B, Argus C, Martin K, Northey J, Driller M (March 2015). "Is it time to turn our attention toward central mechanisms for post-exertional recovery strategies and performance?". Frontiers in Physiology. 6: 79. doi:10.3389/fphys.2015.00079. PMC 4362407. PMID 25852568.
Aside from accounting for the reduced performance of mentally fatigued participants, this model rationalizes the reduced RPE and hence improved cycling time trial performance of athletes using a glucose mouthwash (Chambers et al., 2009) and the greater power output during a RPE matched cycling time trial following amphetamine ingestion (Swart, 2009). ... Dopamine stimulating drugs are known to enhance aspects of exercise performance (Roelands et al., 2008)
- ^ Roelands B, De Pauw K, Meeusen R (June 2015). "Neurophysiological effects of exercise in the heat". Scandinavian Journal of Medicine & Science in Sports. 25 (Suppl 1): 65–78. doi:10.1111/sms.12350. PMID 25943657. S2CID 22782401.
This indicates that subjects did not feel they were producing more power and consequently more heat. The authors concluded that the "safety switch" or the mechanisms existing in the body to prevent harmful effects are overridden by the drug administration (Roelands et al., 2008b). Taken together, these data indicate strong ergogenic effects of an increased DA concentration in the brain, without any change in the perception of effort.
- ^ a b c "Adderall XR- dextroamphetamine sulfate, dextroamphetamine saccharate, amphetamine sulfate and amphetamine aspartate capsule, extended release". DailyMed. Shire US Inc. 17 July 2019. Retrieved 22 December 2019.
- ^ Heedes G; Ailakis J. "Amphetamine (PIM 934)". INCHEM. International Programme on Chemical Safety. Retrieved 24 June 2014.
- ^ a b c d e "Adderall XR Prescribing Information" (PDF). United States Food and Drug Administration. Shire US Inc. December 2013. pp. 4–6. Retrieved 30 December 2013.
- ^ "FDA Pregnancy Categories" (PDF). United States Food and Drug Administration. 21 October 2004. Archived from the original (PDF) on 14 December 2010. Retrieved 31 October 2013.
- ^ "Dexamphetamine tablets". Therapeutic Goods Administration. Retrieved 12 April 2014.
- ^ a b "Adderall XR Prescribing Information" (PDF). United States Food and Drug Administration. Shire US Inc. December 2013. pp. 8–10. Retrieved 30 December 2013.
- ^ a b c d e f g Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". J. Neurochem. 116 (2): 164–176. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ a b c d Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Ann. N. Y. Acad. Sci. 1216 (1): 86–98. Bibcode:2011NYASA1216...86E. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC).
- ^ Sulzer D, Cragg SJ, Rice ME (August 2016). "Striatal dopamine neurotransmission: regulation of release and uptake". Basal Ganglia. 6 (3): 123–148. doi:10.1016/j.baga.2016.02.001. PMC 4850498. PMID 27141430.
Despite the challenges in determining synaptic vesicle pH, the proton gradient across the vesicle membrane is of fundamental importance for its function. Exposure of isolated catecholamine vesicles to protonophores collapses the pH gradient and rapidly redistributes transmitter from inside to outside the vesicle. ... Amphetamine and its derivatives like methamphetamine are weak base compounds that are the only widely used class of drugs known to elicit transmitter release by a non-exocytic mechanism. As substrates for both DAT and VMAT, amphetamines can be taken up to the cytosol and then sequestered in vesicles, where they act to collapse the vesicular pH gradient.
- ^ Ledonne A, Berretta N, Davoli A, Rizzo GR, Bernardi G, Mercuri NB (July 2011). "Electrophysiological effects of trace amines on mesencephalic dopaminergic neurons". Front. Syst. Neurosci. 5: 56. doi:10.3389/fnsys.2011.00056. PMC 3131148. PMID 21772817.
Three important new aspects of TAs action have recently emerged: (a) inhibition of firing due to increased release of dopamine; (b) reduction of D2 and GABAB receptor-mediated inhibitory responses (excitatory effects due to disinhibition); and (c) a direct TA1 receptor-mediated activation of GIRK channels which produce cell membrane hyperpolarization.
- ^ "TAAR1". GenAtlas. University of Paris. 28 January 2012. Retrieved 29 May 2014.
• tonically activates inwardly rectifying K(+) channels, which reduces the basal firing frequency of dopamine (DA) neurons of the ventral tegmental area (VTA)
- ^ Underhill SM, Wheeler DS, Li M, Watts SD, Ingram SL, Amara SG (July 2014). "Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons". Neuron. 83 (2): 404–416. doi:10.1016/j.neuron.2014.05.043. PMC 4159050. PMID 25033183.
AMPH also increases intracellular calcium (Gnegy et al., 2004) that is associated with calmodulin/CamKII activation (Wei et al., 2007) and modulation and trafficking of the DAT (Fog et al., 2006; Sakrikar et al., 2012). ... For example, AMPH increases extracellular glutamate in various brain regions including the striatum, VTA and NAc (Del Arco et al., 1999; Kim et al., 1981; Mora and Porras, 1993; Xue et al., 1996), but it has not been established whether this change can be explained by increased synaptic release or by reduced clearance of glutamate. ... DHK-sensitive, EAAT2 uptake was not altered by AMPH (Figure 1A). The remaining glutamate transport in these midbrain cultures is likely mediated by EAAT3 and this component was significantly decreased by AMPH
- ^ Vaughan RA, Foster JD (September 2013). "Mechanisms of dopamine transporter regulation in normal and disease states". Trends Pharmacol. Sci. 34 (9): 489–496. doi:10.1016/j.tips.2013.07.005. PMC 3831354. PMID 23968642.
AMPH and METH also stimulate DA efflux, which is thought to be a crucial element in their addictive properties [80], although the mechanisms do not appear to be identical for each drug [81]. These processes are PKCβ– and CaMK–dependent [72, 82], and PKCβ knock-out mice display decreased AMPH-induced efflux that correlates with reduced AMPH-induced locomotion [72].
- ^ a b Wishart, David S.; Djombou Feunang, Yannick; Guo, An Chi; Lo, Elvis J.; Marcu, Ana; Grant, Jason R.; Sajed, Tanvir; Johnson, Daniel; Li, Carin; Sayeeda, Zinat; Assempour, Nazanin; Iynkkaran, Ithayavani; Liu, Yifeng; Maciejewski, Adam; Gale, Nicola; Wilson, Alex; Chin, Lucy; Cummings, Ryan; Le, Diana; Pon, Allison; Knox, Craig; Wilson, Michael. "Lisdexamfetamine DrugBank Online". DrugBank. 5.0.
- ^ a b c Jasinski DR, Krishnan S (June 2009). "Abuse liability and safety of oral lisdexamfetamine dimesylate in individuals with a history of stimulant abuse". J. Psychopharmacol. (Oxford). 23 (4): 419–427. doi:10.1177/0269881109103113. PMID 19329547. S2CID 6138292.
- ^ "Adderall XR Prescribing Information" (PDF). United States Food and Drug Administration. pp. 1–18. Retrieved 7 October 2013.
- ^ Wishart, David S.; Djombou Feunang, Yannick; Guo, An Chi; Lo, Elvis J.; Marcu, Ana; Grant, Jason R.; Sajed, Tanvir; Johnson, Daniel; Li, Carin; Sayeeda, Zinat; Assempour, Nazanin; Iynkkaran, Ithayavani; Liu, Yifeng; Maciejewski, Adam; Gale, Nicola; Wilson, Alex; Chin, Lucy; Cummings, Ryan; Le, Diana; Pon, Allison; Knox, Craig; Wilson, Michael. "Dextroamphetamine DrugBank Online". DrugBank. 5.0.
- ^ a b c d e f g h i j k l m n "Adderall XR Prescribing Information" (PDF). United States Food and Drug Administration. Shire US Inc. December 2013. pp. 12–13. Retrieved 30 December 2013.
- ^ Wishart, David S.; Djombou Feunang, Yannick; Guo, An Chi; Lo, Elvis J.; Marcu, Ana; Grant, Jason R.; Sajed, Tanvir; Johnson, Daniel; Li, Carin; Sayeeda, Zinat; Assempour, Nazanin; Iynkkaran, Ithayavani; Liu, Yifeng; Maciejewski, Adam; Gale, Nicola; Wilson, Alex; Chin, Lucy; Cummings, Ryan; Le, Diana; Pon, Allison; Knox, Craig; Wilson, Michael. "Amphetamine DrugBank Online". DrugBank. 5.0.
- ^ a b c d e "Metabolism/Pharmacokinetics". Amphetamine. United States National Library of Medicine – Toxicology Data Network. Hazardous Substances Data Bank. Archived from the original on 2 October 2017. Retrieved 2 October 2017.
Duration of effect varies depending on agent and urine pH. Excretion is enhanced in more acidic urine. Half-life is 7 to 34 hours and is, in part, dependent on urine pH (half-life is longer with alkaline urine). ... Amphetamines are distributed into most body tissues with high concentrations occurring in the brain and CSF. Amphetamine appears in the urine within about 3 hours following oral administration. ... Three days after a dose of (+ or -)-amphetamine, human subjects had excreted 91% of the (14)C in the urine
- ^ a b c Santagati NA, Ferrara G, Marrazzo A, Ronsisvalle G (September 2002). "Simultaneous determination of amphetamine and one of its metabolites by HPLC with electrochemical detection". Journal of Pharmaceutical and Biomedical Analysis. 30 (2): 247–255. doi:10.1016/S0731-7085(02)00330-8. PMID 12191709.
- ^ "Compound Summary". p-Hydroxyamphetamine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Compound Summary". p-Hydroxynorephedrine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Compound Summary". Phenylpropanolamine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Pharmacology and Biochemistry". Amphetamine. Pubchem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 12 October 2013.
- ^ a b Glennon RA (2013). "Phenylisopropylamine stimulants: amphetamine-related agents". In Lemke TL, Williams DA, Roche VF, Zito W (eds.). Foye's principles of medicinal chemistry (7th ed.). Philadelphia, USA: Wolters Kluwer Health/Lippincott Williams & Wilkins. pp. 646–648. ISBN 9781609133450.
The simplest unsubstituted phenylisopropylamine, 1-phenyl-2-aminopropane, or amphetamine, serves as a common structural template for hallucinogens and psychostimulants. Amphetamine produces central stimulant, anorectic, and sympathomimetic actions, and it is the prototype member of this class (39). ... The phase 1 metabolism of amphetamine analogs is catalyzed by two systems: cytochrome P450 and flavin monooxygenase. ... Amphetamine can also undergo aromatic hydroxylation to p-hydroxyamphetamine. ... Subsequent oxidation at the benzylic position by DA β-hydroxylase affords p-hydroxynorephedrine. Alternatively, direct oxidation of amphetamine by DA β-hydroxylase can afford norephedrine.
- ^ Taylor KB (January 1974). "Dopamine-beta-hydroxylase. Stereochemical course of the reaction" (PDF). Journal of Biological Chemistry. 249 (2): 454–458. PMID 4809526. Retrieved 6 November 2014.
Dopamine-β-hydroxylase catalyzed the removal of the pro-R hydrogen atom and the production of 1-norephedrine, (2S,1R)-2-amino-1-hydroxyl-1-phenylpropane, from d-amphetamine.
- ^ Krueger SK, Williams DE (June 2005). "Mammalian flavin-containing monooxygenases: structure/function, genetic polymorphisms and role in drug metabolism". Pharmacology & Therapeutics. 106 (3): 357–387. doi:10.1016/j.pharmthera.2005.01.001. PMC 1828602. PMID 15922018.
표 5: FMO에 의해 산소가 함유된 N 함유 의약품 및 항생제 - ^ Cashman JR, Xiong YN, Xu L, Janowsky A (March 1999). "N-oxygenation of amphetamine and methamphetamine by the human flavin-containing monooxygenase (form 3): role in bioactivation and detoxication". Journal of Pharmacology and Experimental Therapeutics. 288 (3): 1251–1260. PMID 10027866.
- ^ a b c Sjoerdsma A, von Studnitz W (April 1963). "Dopamine-beta-oxidase activity in man, using hydroxyamphetamine as substrate". British Journal of Pharmacology and Chemotherapy. 20: 278–284. doi:10.1111/j.1476-5381.1963.tb01467.x. PMC 1703637. PMID 13977820.
Hydroxyamphetamine was administered orally to five human subjects ... Since conversion of hydroxyamphetamine to hydroxynorephedrine occurs in vitro by the action of dopamine-β-oxidase, a simple method is suggested for measuring the activity of this enzyme and the effect of its inhibitors in man. ... The lack of effect of administration of neomycin to one patient indicates that the hydroxylation occurs in body tissues. ... a major portion of the β-hydroxylation of hydroxyamphetamine occurs in non-adrenal tissue. Unfortunately, at the present time one cannot be completely certain that the hydroxylation of hydroxyamphetamine in vivo is accomplished by the same enzyme which converts dopamine to noradrenaline.
- ^ a b Badenhorst CP, van der Sluis R, Erasmus E, van Dijk AA (September 2013). "Glycine conjugation: importance in metabolism, the role of glycine N-acyltransferase, and factors that influence interindividual variation". Expert Opinion on Drug Metabolism & Toxicology. 9 (9): 1139–1153. doi:10.1517/17425255.2013.796929. PMID 23650932.
Figure 1. Glycine conjugation of benzoic acid. The glycine conjugation pathway consists of two steps. First benzoate is ligated to CoASH to form the high-energy benzoyl-CoA thioester. This reaction is catalyzed by the HXM-A and HXM-B medium-chain acid:CoA ligases and requires energy in the form of ATP. ... The benzoyl-CoA is then conjugated to glycine by GLYAT to form hippuric acid, releasing CoASH. In addition to the factors listed in the boxes, the levels of ATP, CoASH, and glycine may influence the overall rate of the glycine conjugation pathway.
- ^ Horwitz D, Alexander RW, Lovenberg W, Keiser HR (May 1973). "Human serum dopamine-β-hydroxylase. Relationship to hypertension and sympathetic activity". Circulation Research. 32 (5): 594–599. doi:10.1161/01.RES.32.5.594. PMID 4713201.
The biologic significance of the different levels of serum DβH activity was studied in two ways. First, in vivo ability to β-hydroxylate the synthetic substrate hydroxyamphetamine was compared in two subjects with low serum DβH activity and two subjects with average activity. ... In one study, hydroxyamphetamine (Paredrine), a synthetic substrate for DβH, was administered to subjects with either low or average levels of serum DβH activity. The percent of the drug hydroxylated to hydroxynorephedrine was comparable in all subjects (6.5-9.62) (Table 3).
- ^ Freeman JJ, Sulser F (December 1974). "Formation of p-hydroxynorephedrine in brain following intraventricular administration of p-hydroxyamphetamine". Neuropharmacology. 13 (12): 1187–1190. doi:10.1016/0028-3908(74)90069-0. PMID 4457764.
In species where aromatic hydroxylation of amphetamine is the major metabolic pathway, p-hydroxyamphetamine (POH) and p-hydroxynorephedrine (PHN) may contribute to the pharmacological profile of the parent drug. ... The location of the p-hydroxylation and β-hydroxylation reactions is important in species where aromatic hydroxylation of amphetamine is the predominant pathway of metabolism. Following systemic administration of amphetamine to rats, POH has been found in urine and in plasma.
The observed lack of a significant accumulation of PHN in brain following the intraventricular administration of (+)-amphetamine and the formation of appreciable amounts of PHN from (+)-POH in brain tissue in vivo supports the view that the aromatic hydroxylation of amphetamine following its systemic administration occurs predominantly in the periphery, and that POH is then transported through the blood-brain barrier, taken up by noradrenergic neurones in brain where (+)-POH is converted in the storage vesicles by dopamine β-hydroxylase to PHN. - ^ Matsuda LA, Hanson GR, Gibb JW (December 1989). "Neurochemical effects of amphetamine metabolites on central dopaminergic and serotonergic systems". Journal of Pharmacology and Experimental Therapeutics. 251 (3): 901–908. PMID 2600821.
The metabolism of p-OHA to p-OHNor is well documented and dopamine-β hydroxylase present in noradrenergic neurons could easily convert p-OHA to p-OHNor after intraventricular administration.
- ^ "Lisdexamfetamine". ChemSpider. Royal Society of Chemistry. 2015. Retrieved 22 April 2019.
- ^ Stahl, P. Heinrich; Wermuth, Camille G., eds. (2011). Pharmaceutical Salts: Properties, Selection, and Use (2nd ed.). John Wiley & Sons. ISBN 978-3-90639-051-2.
- ^ "Molecular Weight Calculator". Lenntech. Retrieved 19 August 2015.
- ^ a b "Dextroamphetamine Sulfate USP". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ a b "D-amphetamine sulfate". Tocris. 2015. Retrieved 19 August 2015.
- ^ a b "Amphetamine Sulfate USP". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ "Dextroamphetamine Saccharate". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ "Amphetamine Aspartate". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ Mattingly, G (May 2010). "Lisdexamfetamine dimesylate: a prodrug stimulant for the treatment of ADHD in children and adults". CNS Spectrums. 15 (5): 315–25. doi:10.1017/S1092852900027541. PMID 20448522. S2CID 46435024.
- ^ "FDA Adult Approval of Vyvanse – FDA Label and Approval History" (PDF).
- ^ "Drug Product Database". Government of Canada. Health Canada. 25 April 2012. Retrieved 5 November 2020.
- ^ "Press Announcements – FDA expands uses of Vyvanse to treat binge-eating disorder". FDA. 30 January 2015.
- ^ "DEA Office of Diversion Control" (PDF). DEA. Retrieved 1 July 2014.
- ^ "Lisdexamfetamine international brands". Drugs.com. Retrieved 10 July 2017.
- ^ Dale E, Bang-Andersen B, Sánchez C (May 2015). "Emerging mechanisms and treatments for depression beyond SSRIs and SNRIs". Biochem. Pharmacol. 95 (2): 81–97. doi:10.1016/j.bcp.2015.03.011. PMID 25813654.
- ^ Stotz, G.; Woggon, B.; Angst, J. (1999). "Psychostimulants in the therapy of treatment-resistant depression Review of the literature and findings from a retrospective study in 65 depressed patients". Dialogues Clin. Neurosci. 1 (3): 165–74. PMC 3181580. PMID 22034135.
- ^ Hirschler, Ben (7 February 2014). "UPDATE 2-Shire scraps Vyvanse for depression after failed trials". Reuters. Retrieved 13 February 2014.
외부 링크
- "Lisdexamfetamine". Drug Information Portal. U.S. National Library of Medicine.
- "Lisdexamfetamine dimesylate". Drug Information Portal. U.S. National Library of Medicine.