메탄설폰산
Methanesulfonic acid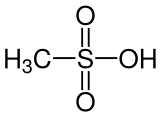 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 메탄설폰산 | |
| 기타 이름 MSA, 메틸설폰산 | |
| 식별자 | |
3D 모델(JSmol) | |
| 1446024 | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.000.817 |
| EC 번호 |
|
| 1681 | |
펍켐 CID | |
| 유니 | |
| UN 번호 | 2585 |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CH4O3S | |
| 어금질량 | 96.10 g·190−1 |
| 외관 | 투명한 무색 액체 |
| 밀도 | 1.48 g/cm3 |
| 녹는점 | 17~19°C(63~66°F, 290~292K) |
| 비등점 | 10mmHg, 122°C/1mmHg에서 167°C(333°F, 440K) |
| 그릇된 | |
| 용해성 | 메탄올, 디에틸에테르와 혼동 가능. 헥산(헥산) |
| 로그 P | -2.424[1] |
| 산도(pKa) | −1.9[2] |
| 위험 | |
| GHS 라벨 표시: | |
 | |
| 위험 | |
| H314 | |
| P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| 안전 데이터 시트(SDS) | 옥스퍼드 MSDS |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
Methanesulfonic acid (MsOH) 또는 Methanesulphonic acid (영국식 영어)는 화학식 CHSOH를33 함유한 무색 액체다. 그것은 알킬설폰산 중에서 가장 간단하다. 메탄설폰산의 소금과 에스테르는 메틸산(또는 에틸메탄설폰산(ethyl metanesulfonate)과 같이 메탄설폰산(metanesulfonate)으로 알려져 있다. 그것은 농축된 형태로 저광학적이다. 메탄설폰산은 광범위한 금속 염류를 용해시킬 수 있는데, 그 중 많은 염산은 염산이나 황산보다 상당히 높은 농도로 용해된다.[3]
적용들
메탄설폰산은 유기용매에 용해되는 비휘발성 강한 산이기 때문에 유기 반응에서 산성 촉매로 사용된다. 주변 온도에서는 액체인 반면 밀접하게 연관된 p-toluenesulfonic acid(PTSA)는 고체여서 산업용으로 편리하다. 그러나 실험실 환경에서는 고체 PTSA가 더 편리하다.
메탄설폰산은 THF나 DMS와 같은 무화과 용매에서 메탄설폰산을 NaBH와4 반응시켜 보란(BH3) 생성에 사용할 수 있으며, BH의3 복합체와 용매체가 형성된다.[4]
전기 도금
메탄설폰산의 용액은 주석과 주석 납땜자의 전기 도금에 사용된다. 부식성 및 휘발성 수소 불소를 배출하는 플루오르산 사용을 대체하고 있다.[5]
메탄설폰산은 녹과 체중계 제거제의 주요 성분이기도 하다.[6] 주로 산성 공격에 취약한 세라믹, 타일, 도자기 등의 표면 녹을 씻어내는 데 쓰인다.
참고 항목
- Trifluoromethanesulfonic acid - 보다 산성화된 Trifluoro 아날로그
참조
- ^ Towler, Christopher S.; Li, Tonglei; Wikström, Håkan; Remick, David M.; Sanchez-Felix, Manuel V.; Taylor, Lynne S. (December 2008). "An Investigation into the Influence of Counterion on the Properties of Some Amorphous Organic Salts". Molecular Pharmaceutics. 5 (6): 946–955. doi:10.1021/mp8000342. PMID 19434850.
- ^ Guthrie, J. Peter (September 1978). "Hydrolysis of esters of oxy acids: pKa values for strong acids; Brønsted relationship for attack of water at methyl; free energies of hydrolysis of esters of oxy acids; and a linear relationship between free energy of hydrolysis and pKa holding over a range of 20 pK units". Canadian Journal of Chemistry. 56 (17): 2342–2354. doi:10.1139/v78-385.
- ^ Gernon, M. D.; Wu, M.; Buszta, T.; Janney, P. (1999). "Environmental benefits of methanesulfonic acid: comparative properties and advantages". Green Chemistry. 1 (3): 127–140. doi:10.1039/a900157c.
- ^ Lobben, Paul C.; Leung, Simon Shun-Wang; Tummala, Srinivas (2004). "Integrated Approach to the Development and Understanding of the Borane Reduction of a Carboxylic Acid". Org. Process Res. Dev. 8 (6): 1072–1075. doi:10.1021/op049910h.
- ^ Balaji, R.; Pushpavanam, Malathy (2003). "Methanesulphonic acid in electroplating related metal finishing industries". Transactions of the Imf. 81 (5): 154–158. doi:10.1080/00202967.2003.11871526. S2CID 91584456.
- ^ "Archived copy" (PDF). Archived from the original (PDF) on 2016-03-04. Retrieved 2015-12-01.
{{cite web}}: CS1 maint: 타이틀로 보관된 사본(링크)

