막관통단백질
Transmembrane protein트랜스막 단백질(TP)은 세포막 전체에 걸쳐 있는 일체형 막 단백질의 일종이다.많은 막 통과 단백질은 막을 통해 특정 물질을 운반할 수 있도록 관문 역할을 한다.그들은 종종 막을 통해 물질을 이동시키기 위해 중요한 구조 변화를 겪는다.그것들은 보통 매우 소수성이며 집합체이며 물에 침전된다.추출을 위해 세제 또는 비극성 용제가 필요하지만, 일부(베타 배럴)는 변성제를 사용하여 추출할 수도 있습니다.
막을 가로지르는 펩타이드 배열 또는 막 통과 세그먼트는 대부분 소수성이며 수경 [1]플롯을 사용하여 시각화할 수 있다.트랜스막 분절의 수에 따라 트랜스막 단백질은 단일 스팬(또는 역학적) 또는 다중 스팬(다발성)으로 분류될 수 있다.다른 일부 일체형 막 단백질은 단조라고 불리는데, 이것은 또한 막에 영구적으로 부착되어 있지만,[2] 그것을 통과하지는 않는다는 것을 의미합니다.
종류들
구조별 구분
막 통과 [3]단백질에는 알파 헬리컬과 베타 배럴의 두 가지 기본적인 유형이 있습니다.알파 나선 단백질은 세균 세포의 내막이나 진핵 세포의 혈장 막, 그리고 때로는 세균의 [4]외막에 존재한다.이것은 막 통과 단백질의 주요 범주이다.인간에서, 모든 단백질의 27%가 알파 나선 막 [5]단백질인 것으로 추정되었습니다.베타배럴 단백질은 지금까지 그램음성균의 외막, 그램양성균의 세포벽, 미토콘드리아와 엽록체의 외막에서만 발견되거나 모공형성 독소로 분비될 수 있다.모든 베타 장벽 통과 단백질은 가장 단순한 위아래 토폴로지를 가지며, 이는 공통의 진화적 기원과 유사한 접힘 메커니즘을 반영할 수 있다.
단백질 도메인 외에도 펩타이드에 의해 형성되는 특이한 막 통과 요소들이 있다.대표적인 예로는 이합체 트랜스막 [6]β-나선을 형성하는 펩타이드인 그래미시딘 A가 있다.이 펩타이드는 항생제로서 그램 양성균에 의해 분비된다.천연 단백질에서는 막간 폴리프롤린 II 나선이 보고되지 않았다.그럼에도 불구하고 이 구조는 특별히 설계된 인공 [7]펩타이드에서 실험적으로 관찰되었다.
토폴로지별 분류
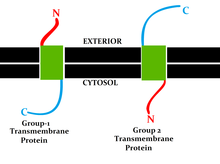
이 분류는 지질 이중층의 서로 다른 측면에 있는 단백질 N-termini와 C-termini의 위치를 나타낸다.타입 I, II, III 및 IV는 단일 패스 분자입니다.I형 막외 단백질은 정지전달 앵커 배열을 통해 지질막에 고정되며 합성 중 N말단 도메인은 내소형 망막(ER) 내강을 목표로 한다(성숙한 형태가 세포막 상에 있는 경우에는 세포외 공간).타입 II 및 III는 신호 앵커시퀀스로 고정되며 타입 II는 C 말단 도메인과 함께 ER 루멘을 대상으로 하고 타입 III는 ER 루멘을 대상으로 한N 말단 도메인이 있습니다.타입 IV는 IV-A로 세분되며, N 말단 도메인은 세포졸 및 IV-B를 대상으로 하며, N 말단 도메인은 [8]내강을 대상으로 한다.4가지 유형의 분열에 대한 영향은 단백질이 유형에 따라 ER 막을 통과해야 하는 전위 및 ER 결합 변환 시 특히 뚜렷하다.
3차원 구조
막 단백질 구조는 X선 결정학, 전자 현미경법 또는 NMR 분광법에 의해 결정될 [10]수 있다.이러한 단백질의 가장 일반적인 3차 구조는 경막 나선 다발과 베타 배럴이다.지질 이중층에 부착된 막 단백질의 부분은 대부분 소수성 [11]아미노산으로 구성됩니다.
소수성 표면을 가진 막 단백질은 비교적 유연하고 비교적 낮은 수준에서 발현된다.이것은 충분한 단백질을 얻고 결정체를 키우는 데 어려움을 일으킨다.따라서 막 단백질의 중요한 기능적 중요성에도 불구하고, 이러한 단백질에 대한 원자 분해능 구조를 결정하는 것은 구상 [12]단백질보다 더 어렵다.2013년 1월 현재 단백질 구조는 전체 [13]프로테옴의 20~30%임에도 불구하고 막 단백질로 확인된 단백질 구조는 0.1% 미만이었다.이러한 어려움과 수경 플롯에 기초한 단백질 구조 예측의 이 등급의 단백질 방법의 중요성으로 인해 양의 내부 규칙 및 다른 방법이 [14][15][16]개발되었습니다.
열역학적 안정성 및 접힘
α-나선막 통과 단백질의 안정성
막 통과 알파 헬리컬(α 헬리컬) 단백질은 세포막 내에서 완전히 펴지지 않기 때문에 열변성 연구에서 이례적으로 안정적이다(완전한 전개는 비극성 매체에서 너무 많은 α 헬리컬 H 결합을 분해해야 한다).한편, 이들 단백질은 막의 비원어민 응집, 용융구체 상태로의 이행, 비원어민 디술피드 결합의 형성 또는 국소적으로 [citation needed]안정성이 떨어지는 말초 영역 및 불규칙 루프의 전개에 의해 쉽게 잘못 접힌다.
전개 상태를 올바르게 정의하는 것도 중요합니다.세제 미셀에서 막 단백질의 전개 상태는 열변성 [citation needed]실험과 다르다.이 상태는 접힌 소수성 α-헬리쉬와 세제로 덮인 부분 전개 세그먼트의 조합을 나타냅니다.예를 들어, SDS 미셀의 "접히지 않은" 박테리올호돕신은 4개의 막간 α-헬리체가 접혀 있는 반면, 나머지 단백질은 미셀-수면에 위치하여 다른 유형의 비원어성 양친매 구조를 채택할 수 있다.이러한 세제 변성 상태와 고유 상태 사이의 자유 에너지 차이는 수용성 단백질의 안정성(< 10 kcal/mol)[citation needed]과 유사하다.
α-나선막 통과 단백질의 접힘
시험관내 α-헬리컬 트랜스막 단백질의 리폴딩은 기술적으로 어렵다.성공적인 리폴딩 실험의 예는 박테리올호돕신과 같이 비교적 적다.생체 내에서는 그러한 모든 단백질은 일반적으로 큰 막간 트랜스클로콘 내에서 동시 번역으로 접혀진다.트랜스클로콘 채널은 초기 트랜스막 α-헬리스를 위해 매우 이질적인 환경을 제공합니다.비교적 극성 양친매성 α-나선은 트랜스로콘의 중앙수 충전채널과 마주할 수 있기 때문에 트랜스로콘에서 트랜스막 배향을 채택할 수 있다(막 표면에 있거나 체외로 펼쳐질 수 있다).이러한 메커니즘은 극성 α-헬리스를 막 통과 단백질의 구조에 통합하기 위해 필요하다.양친매성 나선은 단백질이 완전히 합성되고 접힐 때까지 트랜스로콘에 부착되어 있습니다.단백질이 너무 오랫동안 펼쳐지고 트랜스로콘에 부착되어 있으면 특정 "품질 관리"[citation needed] 세포 시스템에 의해 분해됩니다.
베타배럴경막단백질의 안정성과 접힘
베타 배럴(β-barrel) 트랜스막 단백질의 안정성은 화학적 변성 연구에 기초한 수용성 단백질의 안정성과 유사하다.일부는 카오트로픽제나 고온에서도 매우 안정적입니다.이들의 생체내 접힘은 단백질 Skp와 같은 수용성 샤페론에 의해 촉진된다.β-배럴 막 단백질은 진화 과정에서 추가되거나 두 배로 증가할 수 있는 시트 수가 달라도 하나의 조상으로부터 나온 것으로 생각된다.어떤 연구들은 다른 유기체들 사이의 거대한 배열 보존을 보여주며 또한 구조를 유지하고 [17]접는 것을 돕는 보존된 아미노산들을 보여준다.
3D 구조
광흡수식 트랜스포터
산화흡입구동수송체
- 트랜스막 시토크롬 b 유사 단백질: 코엔자임 Q - 시토크롬 c 환원효소(cytochrome bc1), 시토크롬 b6f 복합체, 포름산 탈수소효소, 호흡기 질산 환원효소, 숙신산 코엔자임 Q 환원효소(후마레이트 환원효소) 및 숙신산 탈수소효소.전자 전달망을 참조하십시오.
- 박테리아 및 미토콘드리아로부터의 시토크롬c산화효소
전기화학 전위 구동 트랜스포터
- F형 및 V형 ATPase를 전위시키는 양성자 또는 나트륨
P-P결합 가수분해 구동 트랜스포터
포터(유니포터, 심포터, 안티포터)
- 미토콘드리아 운반단백질
- 주요촉진제 슈퍼패밀리(글리세롤-3-인산수송체, 유당투과효소 및 다제수송체 EmrD)
- 저항-조절-세포분할(다제유출수송체 AcrB, 다제내성 참조)
- 디카르본산/아미노산: 양이온 심포터(프로톤 글루탐산 심포터)
- 1가 양이온/프로톤 안티포터(나트륨/프로톤 안티포터 1 NhaA)
- 신경전달물질 나트륨 심포터
- 암모니아 수송체
- 약물/메타볼라이트 운반체(소형 다제내성 운반체 EmrE - 구조가 오류로 철회됨)
이온 채널을 포함한 알파 헬리컬 채널
- 칼륨 채널 KcsA 및 KvAP 및 내부 정류기 칼륨 이온 채널 Kirbac을 포함한 전압 게이트 이온 채널 유사
- 대형 컨덕턴스 기계 감응형 채널(MscL)
- Small-Conduction Mechanosensitive Ion Channel(MSCS)
- CorA 금속 이온 수송체
- 신경전달물질 수용체(아세틸콜린 수용체)의 리간드 게이트 이온 채널
- 아쿠아포린
- 염화물 채널
- 외막보조단백질(다당류수송체) - 외세균막의 α-나선전달막단백질
효소
- 메탄모노옥시게나아제
- 마름모단백질가수분해효소
- 디술피드결합형성단백질(DsbA-DsbB복합체)
알파 나선형 막 통과 앵커를 가진 단백질
- T세포수용체막간 이합체화 도메인]
- 시토크롬C아질산환원효소복합체
- 황산스테릴술포히드로라아제
- 스타닌
- 글리코포린 A 이합체
- 이노바이러스(필라멘탈파지)주피단백질
- 필린
- 폐계면활성제관련단백질
- 모노아민산화효소 A 및 B
- 지방산아미드 가수분해효소[18]
- 시토크롬P450산화효소
- 코르티코스테로이드 11β탈수소효소.
- 시그널펩티드펩티드가수분해효소
- 스토마틴 호몰로그 특이막단백질가수분해효소
단일 폴리펩타이드 사슬로 이루어진 베타배럴
- 8개의 베타 베터리에서 추출된 베타 배럴로, "베타 번호"가 10(n=8, S=10)입니다.다음과 같은 것이 있습니다.
- OmpA 유사막 통과 도메인(OmpA)
- 독성관련외막단백질패밀리(OmpX)
- 외막단백질W패밀리(OmpW)
- 항균성 펩타이드 내성 및 지질 A 아실화 단백질 패밀리(PagP)
- 지질A탈아실라아제PagL
- 불투명도 패밀리 포린(NspA)
- 자동 전송 도메인(n=12,S=14)
- 지방산수송체 FadL을 포함한 FadL 외막단백질수송패밀리(n=14,S=14)
- 일반 세균성 포린과로 알려진 (n=16,S=20)
- 말토포린 또는 설탕 포린(n=18,S=22)
- 뉴클레오시드 특이 포린(n=12,S=16)
- 외막포스포리파아제A1(n=12,S=16)
- TonB 의존성 수용체와 그 플러그 도메인.코발라민 운반체 BtuB, Fe(II)-피오셀린 수용체 FptA, 수용체 FepA, 철 하이드록사메이트 흡수 수용체 FhuA, 운반체 FecA 및 피오버딘 수용체 FpVA를 포함한 리간드 게이트 외막 채널(n=22, S=24)이다.
- 외막단백질OpcA족(n=10,S=12)으로 외막단백질OpcA단백질OmpT와 접착제/인바신OpcA단백질
- 외막단백질 G포린족 (n=14,S=16)
참고: n과 S는 각각 베타 스트랜드 수와 베타 배럴의 "전단 번호"[19]입니다.
여러 폴리펩타이드 사슬로 이루어진 베타배럴
- 삼중성 자동 트랜스포터(n=12,S=12)
- TolC 및 다제내성 단백질을 포함한 삼량체 외막 인자(n=12,S=18)로도 알려진 외막 유출 단백질
- MspA 포린(옥타머, n=S=16) 및 α-헵타머 n=S=14).이 단백질들은 분비된다.
「 」를 참조해 주세요.
레퍼런스
- ^ Manor, Joshua; Feldblum, Esther S.; Arkin, Isaiah T. (2012). "Environment Polarity in Proteins Mapped Noninvasively by FTIR Spectroscopy". The Journal of Physical Chemistry Letters. 3 (7): 939–944. doi:10.1021/jz300150v. PMC 3341589. PMID 22563521.
- ^ Steven R. Goodman (2008). Medical cell biology. Academic Press. pp. 37–. ISBN 978-0-12-370458-0. Retrieved 24 November 2010.
- ^ Jin Xiong (2006). Essential bioinformatics. Cambridge University Press. pp. 208–. ISBN 978-0-521-84098-9. Retrieved 13 November 2010.
- ^ 외막의 알파 나선 단백질은 스타닌과 특정 리포단백질 및 기타
- ^ Almén MS, Nordström KJ, Fredriksson R, Schiöth HB (2009). "Mapping the human membrane proteome: a majority of the human membrane proteins can be classified according to function and evolutionary origin". BMC Biol. 7: 50. doi:10.1186/1741-7007-7-50. PMC 2739160. PMID 19678920.
- ^ Nicholson, L. K.; Cross, T. A. (1989). "Gramicidin cation channel: an experimental determination of the right-handed helix sense and verification of .beta.-type hydrogen bonding". Biochemistry. 28 (24): 9379–9385. doi:10.1021/bi00450a019. PMID 2482072.
- ^ Kubyshkin, Vladimir; Grage, Stephan L.; Ulrich, Anne S.; Budisa, Nediljko (2019). "Bilayer thickness determines the alignment of model polyproline helices in lipid membranes". Physical Chemistry Chemical Physics. 21 (40): 22396–22408. Bibcode:2019PCCP...2122396K. doi:10.1039/c9cp02996f. PMID 31577299.
- ^ 하비 로디시 등분자세포생물학, 제6판, 페이지 546
- ^ Goder, Veit; Spiess, Martin (31 August 2001). "Topogenesis of membrane proteins: determinants and dynamics". FEBS Letters. 504 (3): 87–93. doi:10.1016/S0014-5793(01)02712-0. PMID 11532438.
- ^ Cross, Timothy A.; Sharma, Mukesh; Yi, Myunggi; Zhou, Huan-Xiang (2011). "Influence of Solubilizing Environments on Membrane Protein Structures". Trends in Biochemical Sciences. 36 (2): 117–125. doi:10.1016/j.tibs.2010.07.005. PMC 3161620. PMID 20724162.
- ^ 하얀색, 스티븐."막 단백질 접힘 및 안정성의 일반 원리"Stephen White Laboratory 홈페이지.2009년 11월 10일 웹.[verification needed]
- ^ Carpenter, Elisabeth P; Beis, Konstantinos; Cameron, Alexander D; Iwata, So (October 2008). "Overcoming the challenges of membrane protein crystallography". Current Opinion in Structural Biology. 18 (5): 581–586. doi:10.1016/j.sbi.2008.07.001. PMC 2580798. PMID 18674618.
- ^ 알려진 3D 구조의 막 단백질
- ^ Elofsson, Arne; Heijne, Gunnar von (7 June 2007). "Membrane Protein Structure: Prediction versus Reality". Annual Review of Biochemistry. 76 (1): 125–140. CiteSeerX 10.1.1.332.4023. doi:10.1146/annurev.biochem.76.052705.163539. PMID 17579561.
- ^ Chen, Chien Peter; Rost, Burkhard (2002). "State-of-the-art in membrane protein prediction". Applied Bioinformatics. 1 (1): 21–35. CiteSeerX 10.1.1.134.7424. PMID 15130854.
- ^ Hopf, Thomas A.; Colwell, Lucy J.; Sheridan, Robert; Rost, Burkhard; Sander, Chris; Marks, Debora S. (June 2012). "Three-Dimensional Structures of Membrane Proteins from Genomic Sequencing". Cell. 149 (7): 1607–1621. doi:10.1016/j.cell.2012.04.012. PMC 3641781. PMID 22579045.
- ^ Michalik, Marcin; Orwick-Rydmark, Marcella; Habeck, Michael; Alva, Vikram; Arnold, Thomas; Linke, Dirk; Permyakov, Eugene A. (3 August 2017). "An evolutionarily conserved glycine-tyrosine motif forms a folding core in outer membrane proteins". PLOS ONE. 12 (8): e0182016. Bibcode:2017PLoSO..1282016M. doi:10.1371/journal.pone.0182016. PMC 5542473. PMID 28771529.
- ^ Bracey MH, Hanson MA, Masuda KR, Stevens RC, Cravatt BF (November 2002). "Structural adaptations in a membrane enzyme that terminates endocannabinoid signaling". Science. 298 (5599): 1793–6. Bibcode:2002Sci...298.1793B. doi:10.1126/science.1076535. PMID 12459591. S2CID 22656813.
- ^ Murzin AG, Lesk AM, Chothia C (March 1994). "Principles determining the structure of beta-sheet barrels in proteins. I. A theoretical analysis". J. Mol. Biol. 236 (5): 1369–81. doi:10.1016/0022-2836(94)90064-7. PMID 8126726.




