코비메티니브
Cobimetinib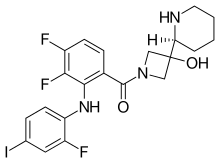 | |
| 임상 데이터 | |
|---|---|
| 발음 | /co-b-m-t-nb/ KOH-빔-ET-i-니브 |
| 상호 | 코텔릭 |
| 기타 이름 | GDC-0973, XL-518 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a615057 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로[1] |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 28%[3]에서 46%[1]로 보고되었습니다. |
| 단백질 결합 | 95%[1] |
| 대사 | 장내 및 저간 클리어런스(대부분 CYP3A4 산화 및 UGT2B7 글루쿠론화)[1][3] |
| 반감기 제거 | 44시간(평균)[1] |
| 배설물 | 대변(76–77%), 소변(17.9–18%) (구강 [1][4]및 링거 투여 후) |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| 화학 및 물리 데이터 | |
| 공식 | C21H21F3IN3O2 |
| 몰 질량 | 531.318 g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
코텔릭(Cotelic)이라는 상표명으로 판매되는 코비메티니브는 흑색종 [1][5]치료를 위해 베무라페닙(Zelboraf)과 함께 사용하거나 베무라페닙(Vemurafenib)과 아테졸리주맙(Tecentriq)과 함께 사용되는 항암제이다.코비메티닙은 MEK [1]억제제예요코텔릭, 젤보라프, 테센트리크는 모두 제넨텍에서 [1][5][6]판매하고 있다.
가장 일반적인 부작용으로는 설사, 발진, 메스꺼움(몸이 아픈 느낌), 구토, 발열(열감), 광감수성(광감수성) 반응, 특정 간 기능 테스트의 이상 결과(알라닌 아미노기전달효소, 아스파르트산 아미노기전달효소 수치 증가), 근육 붕괴와 관련된 효소의 이상 결과(생성 ph.오스포키나아제)[2]
코비메티니브는 2015년 [7][8]11월 미국에서 의료용으로 승인되었다.
의료용
코비메티니브는 수술로 제거할 수 없거나 [1][9]전이된 BRAF 돌연변이(V600E 또는 V600K)가 있는 진행성 흑색종 치료에 vemurafenib와 함께 사용하도록 승인되었습니다.
유럽 연합에서는, 코비메티니브는 BRAF V600 [2]돌연변이와 함께 절개할 수 없거나 전이성 흑색종을 가진 성인의 치료에 vemurafenib와 함께 사용하도록 지시되어 있습니다.
BRAF V600 돌연변이 양성 절단 불능 또는 전이성 [5][10]흑색종 환자의 치료를 위해 코비메티니브 및 베무라페니브와 함께 Atzolizumab을 투여한다.
부작용
임상시험에서 코비메티니브와 베무라페닙의 공동치료자에게서 관찰된 일반적인 부작용에는 설사, 메스꺼움, 구토, 발진, 광감작성,[11] 발열 등이 있었다.
역사
코비메티닙은 2014년 [12]BRAFV600 돌연변이를 동반한 악성 흑색종으로 미국 [13]식품의약국(FDA)으로부터, 2021년 조직세포 종양으로 고아 약물 지위를 부여받았다.
베무라페니브와 다브라페니브와 같은 BRAF 억제제에 대한 후천성 내성은 일반적으로 몇 달 동안의 진행 없는 종양 반응 후에 발생합니다.사전임상데이터는 발달된 저항성에 MAPK 경로와 MAPK 비의존적 시그널링이 관여함을 나타내며, BRAF 억제만으로 나타나는 종양반응의 수명을 증가시키기 위한 전략으로 MEK와 BRAF 키나제의 이중 억제를 시사했다.
3단계 임상시험에서는 BRAFV600 변이 전이성 흑색종 환자를 대상으로 코비메티니브와 베무라페닙의 조합을 시험하여 환자의 무진행 생존이 유의미하게 개선되었지만 독성이 다소 증가하였다.이 조합은 무진행 생존 기간을 평균 12.3개월로 증가시켰으며, 베무라페니브만 해도 7.2개월이었다.이 임상 데이터는 또한 복합 치료로 치료 시작 17개월 후 환자의 생존율이 65%로 vemurafenib 치료만 받은 환자의 50%보다 증가했음을 보여주었다.코비메티니브를 추가하면 전체 평균 생존기간이 25.6개월로 늘어났는데, 베무라페니브만 [14][11]18개월이었다.
임상 전 조사에 따르면 코비메티니브를 PI3K 억제와 함께 사용하면 폐암 [15][16]세포주에서 상승 반응이 관찰되면서 약물의 항암 효과를 높일 수 있다.
미국 식품의약국(FDA)은 진행 중이거나 수술로 제거할 수 없는 BRAF V600 돌연변이를 포함한 흑색종 환자 495명을 대상으로 한 임상시험의 증거를 근거로 코비메티니브를 승인했다.이번 시험은 북미, 유럽, 호주 [8]등 19개국 133곳에서 진행됐다.
레퍼런스
- ^ a b c d e f g h i j k "Cotellic- cobimetinib tablet, film coated". DailyMed. 5 November 2019. Retrieved 19 October 2020.
- ^ a b c "Cotellic EPAR". European Medicines Agency. Retrieved 21 September 2021. 텍스트는 이 소스인 © 유럽 의약품청에서 복사한 것입니다.출처가 확인되면 복제가 허가됩니다.
- ^ a b Takahashi RH, Choo EF, Ma S, Wong S, Halladay J, Deng Y, et al. (January 2016). "Absorption, Metabolism, Excretion, and the Contribution of Intestinal Metabolism to the Oral Disposition of [14C]Cobimetinib, a MEK Inhibitor, in Humans". Drug Metabolism and Disposition. 44 (1): 28–39. doi:10.1124/dmd.115.066282. PMID 26451002.
- ^ Choo E, Takahashi R, Rooney I, Gates M, Deng A, Musib L (January 30, 2014). "Abstract B160: Assessing Human Absorption, Metabolism, Routes of Excretion and the Contribution of Intestinal Metabolism to the Oral Clearance of Cobimetinib, a MEK Inhibitor". Molecular Cancer Therapeutics. 12 (11 Supplement): B160. doi:10.1158/1535-7163.TARG-13-B160.
- ^ a b c "Tecentriq- atezolizumab injection, solution". DailyMed. Retrieved 21 September 2021.
- ^ "Zelboraf- vemurafenib tablet, film coated". DailyMed. Retrieved 21 September 2021.
- ^ "Cotellic (cobimetinib) tablet". U.S. Food and Drug Administration (FDA). 8 December 2015. Retrieved 21 September 2021.
- ^ a b "Drug Trials Snapshots: Cotellic". U.S. Food and Drug Administration (FDA). 30 July 2020. Retrieved 21 September 2021.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ "FDA approves Cotellic as part of combination treatment for advanced melanoma". U.S. Food and Drug Administration (FDA). 10 November 2015. Archived from the original on 8 December 2015. Retrieved 2 December 2015.
- ^ "FDA approves atezolizumab for BRAF V600 unresectable or metastatic melanoma". U.S. Food and Drug Administration (FDA). 31 July 2020. Retrieved 21 September 2021.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b Larkin J, Ascierto PA, Dréno B, Atkinson V, Liszkay G, Maio M, et al. (November 2014). "Combined vemurafenib and cobimetinib in BRAF-mutated melanoma" (PDF). The New England Journal of Medicine. 371 (20): 1867–76. doi:10.1056/NEJMoa1408868. PMID 25265494.
- ^ "Cobimetinib Orphan Drug Designations and Approvals". U.S. Food and Drug Administration (FDA). 31 January 2014. Retrieved 4 July 2022.
- ^ "Cobimetinib Orphan Drug Designations and Approvals". U.S. Food and Drug Administration (FDA). 26 April 2021. Retrieved 4 July 2022.
- ^ Staton T (11 November 2015). "Ready to rumble, Novartis? Roche targets melanoma-fighting combo market with new FDA nod". FiercePharma. FierceMarkets. Questex. Retrieved 2 December 2015.
- ^ Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Young, Vincent; Ryan, Ronan; Nicholson, Siobhan; Leonard, Niamh; McVeigh, Niall; Barr, Martin; O'Byrne, Kenneth; Gately, Kathy (2016-11-29). "In pursuit of synergy: An investigation of the PI3K/mTOR/MEK co-targeted inhibition strategy in NSCLC". Oncotarget. 7 (48): 79526–79543. doi:10.18632/oncotarget.12755. ISSN 1949-2553. PMC 5346733. PMID 27765909.
- ^ Heavey, Susan; O'Byrne, Kenneth J.; Gately, Kathy (April 2014). "Strategies for co-targeting the PI3K/AKT/mTOR pathway in NSCLC". Cancer Treatment Reviews. 40 (3): 445–456. doi:10.1016/j.ctrv.2013.08.006. ISSN 1532-1967. PMID 24055012.
외부 링크
- "Cobimetinib". Drug Information Portal. U.S. National Library of Medicine.
- "Cobimetinib fumarate". Drug Information Portal. U.S. National Library of Medicine.