글라스데기브
Glasdegib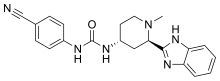 | |
| 임상자료 | |
|---|---|
| 상명 | 도리스모 |
| 기타 이름 | PF-04449913 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a619004 |
| 임신 범주 | |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| ECHA InfoCard | 100.244.738 |
| 화학 및 물리적 데이터 | |
| 공식 | C21H22N6O |
| 어금질량 | 374.448 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
글라스데기브는 다우리스모라는 상표명으로 판매되며 75세 이상 성인이나 집중유도화학요법을 사용하지 못하게 하는 혼수상태의 성인들에게 새로 진단된 급성 골수성 백혈병(AML)을 치료하는 약이다.[3][4][5]입으로 복용하며 저선량 시타라빈과 결합하여 사용한다.[4]
glasdegib 권장량은 허용되지 않는 독성이나 질병 통제 상실이 없는 경우, 각 28일 주기의 1~10일 동안 하루에 두 번 피하 2회씩 시타라빈 20mg과 결합하여 1일부터 28일까지 1일 동안 하루에 한 번 100mg씩 구두로 투여한다.[4]
가장 흔한 부작용으로는 빈혈, 피로, 출혈, 열 중성미자, 근골격계통, 메스꺼움, 부종, 혈소판감소증, 호흡곤란, 식욕 저하, 이질, 점막염, 변비, 발진 등이 있다.[3]
소닉 고슴도치의 작은 분자 억제제로 여러 종류의 암에서 과압된 단백질이다.그것은 같은 등급의 대부분의 약물과 마찬가지로 소닉 고슴도치 수용체 평활화(SMO)를 억제한다.[6]
역사
글래스데기브는 2018년 12월 미국에서 의료용 허가를 받았다.[3][4][7][8][9]
FDA 승인은 a) 75세 이상, b) 중증 심장질환, c) 기준 동부협동조합 종양군 성과현황(2, d) 기준 혈청 중 하나 이상을 충족한 신규 진단 AML을 가진 115개 피험자를 포함한 다중점, 개방형 라벨, 무작위 연구(BRINT AML 1003, NCT01546038)를 기반으로 했다.아티닌 > 1.3 mg/dL.[3]대상자는 글라스데기브(glasdegib)[3]를 매일 100mg씩 무작위로 2:1로 투여했으며, LDAC 20mg은 28일 주기 중 1~10일 동안 매일 2회 피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하피하(LD이 재판은 미국, 캐나다, 유럽에서 실시되었다.[10]
전체적인 생존의 향상(어떤 원인에 의해서든 무작위로 죽는 날짜)을 바탕으로 효능이 확립되었다.[3]중위수 추적 20개월에서 중위수 생존은 글라스데기브 + LDAC 암의 경우 8.3개월(95% CI: 4.4, 12.2), LDAC 단독 암과 HR의 경우 4.3개월(95% CI: 1.9, 5.7)이었다(95% CI:[3] 0.3만1, p=0.2).
글래스데기브는 미국 식품의약국(FDA)으로부터 우선 검토와 고아 약물 지정을 받았다.[3][11]2017년 10월 유럽 의약청(EMA)으로부터 고아 약품 지정을 받았다.[12]
글래스데기브는 2020년 6월 유럽연합(EU)에서 의료용 허가를 받았다.[2]
참조
- ^ "Glasdegib (Daurismo) Use During Pregnancy". Drugs.com. 14 December 2018. Retrieved 25 March 2020.
- ^ a b "Daurismo EPAR". European Medicines Agency (EMA). 28 April 2020. Retrieved 25 September 2020.
- ^ a b c d e f g h "FDA approves glasdegib for AML in adults age 75 or older or who have comorbidities". U.S. Food and Drug Administration (FDA) (Press release). 21 November 2018. Retrieved 25 March 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ a b c d "Daurismo- glasdegib tablet, film coated". DailyMed. 26 November 2019. Retrieved 25 March 2020.
- ^ Thomas X, Heiblig M (April 2020). "An evaluation of glasdegib for the treatment of acute myelogenous leukemia". Expert Opinion on Pharmacotherapy. 21 (5): 523–530. doi:10.1080/14656566.2020.1713094. PMID 32027196. S2CID 211044663.
- ^ "Glasdegib - AdisInsight". Adisinsight.springer.com. Retrieved 2017-05-22.
- ^ "Drug Approval Package: Daurismo (glasdegib)". U.S. Food and Drug Administration (FDA). 17 December 2018. Retrieved 25 March 2020.
- ^ "Daurismo: FDA-Approved Drugs". U.S. Food and Drug Administration (FDA). Retrieved 25 March 2020.
- ^ Hoy SM (February 2019). "Glasdegib: First Global Approval". Drugs. 79 (2): 207–213. doi:10.1007/s40265-018-1047-7. PMID 30666593. S2CID 58541521.
- ^ "Drug Trial Snapshot: Daurismo". U.S. Food and Drug Administration (FDA). 21 November 2018. Retrieved 25 March 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ "Search Orphan Drug Designations and Approvals". U.S. Food and Drug Administration (FDA). 24 December 1999. Retrieved 25 March 2020.
- ^ "EU/3/17/1923". European Medicines Agency (EMA). 17 September 2018. Retrieved 25 March 2020.
외부 링크
- "Glasdegib". Drug Information Portal. U.S. National Library of Medicine.
- ClinicalTrials.gov의 "급성 골수성 백혈병 또는 골수이식성 증후군 환자의 화학요법을 이용한 PF-04449913 평가 연구" 임상시험 번호 NCT01546038


