8-히드록시퀴놀린
8-Hydroxyquinoline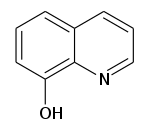 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 퀴놀린-8-올 | |
| 기타 이름 1-아자나프탈렌-8-올, 페노산H 30, 히드록시벤조피리딘, 옥시벤조피리딘, 옥시치놀린, 옥시퀴놀린, 페노피리딘, 퀴노페놀, 옥신, 8-퀴놀린올 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.005.193 |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C9H7NO | |
| 어금질량 | 145.16 g/190 |
| 외관 | 백색 결정 바늘 |
| 밀도 | 1.034 g/cm3 |
| 녹는점 | 76°C(169°F, 349K) |
| 비등점 | 276°C(529°F, 549K) |
| 약리학 | |
| G01AC30 (WHO) A01AB07 (WHO) D08AH03 (WHO) R02AA14 (WHO) | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 인화성의 |
| 안전 데이터 시트(SDS) | 외부 MSDS |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
8-히드록시퀴놀린(일명 옥신이라고도 함)은 금속 이온의 정량적 결정에 사용된 킬레이트화제다.
수용액에서 8-히드록시퀴놀린은 pKa 값이 ca. 9.9이며[1] 금속 이온과 반응하여 양성자를 잃고 8-히드록시퀴놀리나토-셸 콤플렉스를 형성한다.
알루미늄 단지는[2] 유기발광다이오드(OLED)의 공통 구성품이다. 퀴놀린 링의 대체물의 변화는 그것의 발광 특성에 영향을 미친다.[3]
광화학적으로 유도된 흥분상태 zwitterionic isomer는 수소 원자가 산소에서 질소로 전달되는 형태로 형성된다.[4]
이단층뿐만 아니라 이단층 자체도 소독제, 소독제, 살충제 성질을 보이며 전사 억제제 역할을 한다.[5][6][7] 알코올에 함유된 그것의 용액은 액체 붕대에 사용된다. 한때 항암제로서 관심이 많았던 적이 있다.[8]
침습성 식물 센타우레아 디퓨사의 뿌리는 8-히드록시퀴놀린을 방출하는데, 이것은 그것과 함께 진화하지 않은 식물에 부정적인 영향을 미친다.[10]
참고 항목
참조
- ^ Albert, A.; Phillips, J. N. (1956). "264. Ionization Constants of Heterocyclic Substances. Part II. Hydroxy-Derivatives of Nitrogenous Six-Membered Ring-Compounds". Journal of the Chemical Society (Resumed). 1956: 1294–1304. doi:10.1039/JR9560001294.
- ^ Katakura, R.; Koide, Y. (2006). "Configuration-Specific Synthesis of the Facial and Meridional Isomers of Tris(8-hydroxyquinolinate)aluminum (Alq3)". Inorganic Chemistry. 45 (15): 5730–5732. doi:10.1021/ic060594s. PMID 16841973.
- ^ Montes, V. A.; Pohl, R.; Shinar, J.; Anzenbacher, P. Jr. (2006). "Effective Manipulation of the Electronic Effects and Its Influence on the Emission of 5-Substituted Tris(8-quinolinolate) Aluminum(III) Complexes". Chemistry: A European Journal. 12 (17): 4523–4535. doi:10.1002/chem.200501403. PMID 16619313.
- ^ Bardez, E.; Devol, I.; Larrey, B.; Valeur, B. (1997). "Excited-State Processes in 8-Hydroxyquinoline: Photoinduced Tautomerization and Solvation Effects". The Journal of Physical Chemistry B. 101 (39): 7786–7793. doi:10.1021/jp971293u.
- ^ Phillips, J. P. (1956). "The Reactions of 8-Quinolinol". Chemical Reviews. 56 (2): 271–297. doi:10.1021/cr50008a003.
- ^ "8-Hydroxyquinoline". Medical Dictionary Online. Archived from the original on 2016-10-09. Retrieved 2016-03-09.
- ^ "8-Hydroxyquinoline". Sigma-Aldrich. Retrieved 2012-05-23.
- ^ Shen, A. Y.; Wu, S. N.; Chiu, C. T. (1999). "Synthesis and Cytotoxicity Evaluation of some 8-Hydroxyquinoline Derivatives". Journal of Pharmacy and Pharmacology. 51 (5): 543–548. doi:10.1211/0022357991772826. PMID 10411213. S2CID 33085238.
- ^ 플라이셔, 홀저 "티올레이트 리간드를 대체한 β-N-도너로 (n - 1)dns10m 금속 이온의 구조 화학 (m=0, 2)" 조정 화학 리뷰 2005, 제249권, 페이지 799-827. doi:10.1016/j.cr.2004.08.024.
- ^ Vivanco, J.M.; Bais, H.P.; Stermitz, F.R.; Thelen, G.C.; Callaway, R.M. (2004). "Biogeographical variation in community response to root allelochemistry: novel weapons and exotic invasion". Ecology Letters. 7 (4): 285–292. doi:10.1111/j.1461-0248.2004.00576.x.
- ^ Cölle, M.; Dinnebier, R. E.; Brütting, W. (2002). "The structure of the blue luminescent δ-phase of tris(8-hydroxyquinoline)aluminium(III) (Alq3)". Chemical Communications. 2002 (23): 2908–9. doi:10.1039/b209164j. PMID 12478807.


