비후성 심근병증
Hypertrophic cardiomyopathy| 비후성 심근병증 | |
|---|---|
| 기타이름 | 비대칭중격비대증; 특발성 비대성 비대성 아대동맥 협착증;[1] 비대성 폐쇄성 심근병증 (HOCM) |
 | |
| 전문 | 심장학 |
| 증상 | 피로감, 다리부종, 호흡곤란, 가슴통증, 실신[2] |
| 합병증 | 심부전, 불규칙한 심장박동, 갑작스런 심장사[3][4] |
| 원인들 | 유전학, 파브리병, 프리드리히의 무약, 특정 약물들이[5][6] |
| 진단방법 | 심전도, 심장 초음파, 스트레스 검사, 유전자 검사[7] |
| 감별진단 | 고혈압성 심장질환, 대동맥 협착, 운동선수 심장[5] |
| 치료 | 약물, 이식형 심장 제세동기, 수술[7] |
| 약 | 베타차단제, 베라파밀, 디소피라마이드[8] |
| 예후 | 연간 사망 위험 1% 미만(치료 시)[9] |
| 빈도수. | 최대[8] 200명 중 1명 |
비후성 심근병증 (HCM, 또는 폐쇄성일 때 HOCM)은 심장의 근육 조직이 뚜렷한 원인 없이 두꺼워지는 상태입니다.[8]심장의 가장 일반적인 영향을 받는 부분은 심실간 중격과 심실입니다.[10]이것은 심장이 혈액을 효과적으로 공급하는 능력이 떨어지는 결과를 초래하고 또한 전기 전도 문제를 일으킬 수 있습니다.[3]
HCM이 있는 사람들은 다양한 증상을 보일 수 있습니다.사람들은 무증상이거나 피로, 다리 붓기, 호흡 곤란이 있을 수 있습니다.[2]가슴 통증이나 실신을 유발할 수도 있습니다.[2]탈수 상태가 되면 증상이 더 심해질 수 있습니다.[10]합병증에는 심부전, 불규칙한 심장박동, 갑작스러운 심장사 등이 포함될 수 있습니다.[3][4]
HCM은 상염색체 우성 패턴으로 가장[6] 일반적으로 유전됩니다.[10]그것은 종종 심장 근육 단백질을 만드는 것과 관련된 특정 유전자의 돌연변이 때문입니다.[6]좌심실 비대증의 다른 유전적인 원인으로는 파브리병, 프리드리히 무긴장증, 타콜리무스와 같은 특정 약물이 있을 수 있습니다.[5]심장 비대의 원인에 대한 다른 고려 사항으로는 운동선수의 심장과 고혈압이 있습니다.[10]HCM의 진단은 종종 가족력이나 혈통, 심전도, 심장 초음파, 스트레스 검사를 포함합니다.[7]유전자 검사도 할 수 있습니다.[7]HCM은 상염색체 우성 패턴으로 심근병증의 다른 유전성 원인과 구별될 수 있는 반면, Fabry disease는 X-연쇄이고, Friedreich의 악액증은 상염색체 우성 패턴으로 유전됩니다.[10]
치료는 증상 및 기타 위험 요소에 따라 달라질 수 있습니다.약물에는 베타 차단제, 베라파밀 또는 디소피라마이드의 사용이 포함될 수 있습니다.[8]특정 유형의 불규칙한 심장박동을 가진 사람에게는 이식형 심장 제세동기가 권장될 수 있습니다.[7]수술은 중격근절제술이나 심장이식의 형태로 다른 방법으로 호전되지 않는 사람들에게 시행될 수 있습니다.[7]치료를 받으면 이 질병으로 인한 사망 위험은 매년 1퍼센트 미만입니다.[9]
HCM은 200명 중 1명까지 영향을 미칩니다.[8]남성과 여성의 비율은 거의 같습니다.[11]모든 연령대의 사람들이 영향을 받을 수 있습니다.[11]이 병에 대한 현대적인 최초의 설명은 1958년 Donald Tear에 의한 것입니다.[12][13]
징후 및 증상
많은 사람들이 무증상이거나 가벼운 증상을 가지고 있고, HCM을 위한 질병 유전자를 가지고 있는 사람들 중 많은 사람들은 임상적으로 발견할 수 있는 질병을 가지고 있지 않습니다.[14]HCM의 증상으로는 뻣뻣해지고 심실의 혈액 충전이 줄어 숨이 차고, 관상동맥으로 가는 혈류 감소로 인한 운동성 흉통(협심증이라고도 함), 심장 박동에 대한 불편한 인식(팔뚝), 비정상적으로 흐르는 전기 시스템의 장애 등이 있습니다.심장 근육, 가벼운 머리, 허약함, 실신 및 갑작스런 심장 사망.[15][16]
호흡곤란은 좌심실(LV)의 두께가 증가하여 심실의 충만을 저해하지만, 또한 심실간 중격이 좌심실 유출을 방해하여 두께가 증가하여 좌심실과 좌심방의 압력이 상승하기도 합니다.폐에 요압과 간질성 충혈을 일으킵니다.증상은 유출 경로 구배의 유무 또는 심각도와 밀접한 관련이 없습니다.[17]종종 증상은 울혈성 심부전(특히 활동 불내증과 호흡 곤란)의 증상을 모방하지만 각각의 치료법은 다릅니다.베타 차단제는 두 경우 모두 사용되지만 CHF 치료의 주축인 이뇨제를 사용하는 치료는 심실 예압 부피를 감소시키고 그에 따라 유출 저항성을 증가시킴으로써 비후성 폐쇄성 심근병증에서 증상을 악화시킬 것입니다.[18]
HCM 환자의 주요 돌연사 위험인자로는 심정지 또는 심실세동의 과거력, 자발적인 지속적 심실빈맥, 비정상적인 운동혈압 및 비지속적 심실빈맥,[19][20] 설명되지 않은 실경, 조기 돌연사의 가족력, 15 m 이상의 LVW 두께 등이 있습니다심장 초음파 검사에서 m에서 30 mm.
또한 HCM은 프리로드(Valsalva maneuver 또는 standing) 감소 또는 애프터로드(vasodilator 투여) 감소에 따라 강도가 증가하는 수축기 분출 소음을 나타냅니다.반면에, 잡음은 예하(스쿼팅에서와 같이) 또는 후하(손잡이 조작에서와 같이)가 증가함에 따라 강도가 감소합니다.[16]신체검사에서 발견할 수 있는 또 다른 징후로는 "스파이크 앤 돔" 펄스와 "트리플 리플리파이컬 임펄스"가 있습니다.[21]
유전학
| 유전자 | 로커스 | 유형 |
|---|---|---|
| MYH7 | 14q12 | CMH1 (192600) |
| TNNT2 | 1q32 | CMH2(115195) |
| TPM1 | 15q22.1 | CMH3(115196) |
| MYBPC3 | 11p11.2 | CMH4(115197) |
| ? | ? | CMH5 |
| PRKAG2 | 7q36 | CMH6(600858) |
| TNNI3 | 19q13.4 | CMH7 (613690) |
| MYL3 | 3p | CMH8(608751) |
| TTN | 2q24.3 | CMH9(613765) |
| MYL2 | 12q23-q24 | CMH10 (608758) |
| ACTC1 | 15q14 | CMH11(612098) |
| CSRP3 | 11p15.1 | CMH12 (612124) |
가족성 비대성 심근병증은 상염색체 우성 형질로 유전되며 사코미어 단백질을 암호화하는 여러 유전자 중 하나의 돌연변이에 기인합니다.[23][10]
현재 HCM에 대한 임상적 의심의 지수가 높은 사람의 약 50-60%는 적어도 9개의 육종 유전자 중 하나에서 돌연변이가 확인될 것입니다.이러한 돌연변이의 약 40%는 14 q11.2-3 염색체의 β-미오신 중쇄 유전자에서 발생하며, 약 40%는 심장 마이오신 결합 단백질 C 유전자를 포함합니다.HCM은 일반적으로 상염색체 우성 형질이기 때문에, HCM 부모 한 명의 자녀는 질병을 유발하는 돌연변이를 물려받을 확률이 50%입니다.그러한 변이가 확인될 때마다, 임상적 심각도와 발병 연령을 예측할 수는 없지만, 질병에 위험에 처한 친척을 확인하기 위해 가족별 유전자 검사를 사용할 수 있습니다.[24]

안지오텐신 전환효소(ACE)에 대한 유전자 암호화에서 삽입/삭제 다형성은 질병의 임상적 표현형을 변경합니다.ACE의 D/D(삭제/삭제) 유전자형은 좌심실의 현저한 비대와 관련이 있으며 부정적인 결과의 위험이 더 높을 수 있습니다.[25][26]
일부 돌연변이는 다른 돌연변이(β-미오신 중쇄)에 비해 더 많은 유해 가능성을 가질 수 있습니다.예를 들어, 트로포닌 T 돌연변이는 원래 40세 이전에 50%의 사망률과 관련이 있었습니다.그러나, 더 최근에 그리고 더 큰 연구에서 다른 육종성 단백질 돌연변이와 비슷한 위험을 발견했습니다.[27]MYH7을 가진 HCM의 질병 발병 연령은 더 빠르며 더 심각한 증상으로 이어집니다.[28]또한 트로포닌 C에 대한 돌연변이는 심장 근육의 힘 발달에 대한 Ca+2 감수성을 변화시킬 수 있으며, 이러한 돌연변이는 A8V, A31S, C84Y 및 D145E와 같이 발생한 위치 이후에 변화된 아미노산의 이름을 따서 명명되었습니다.[29]
병태생리학
심실 비대는 좌심실 유출관(LVOT)에 걸쳐 동적 압력 구배를 유발하며, 이는 수축기 동안 유출을 더욱 좁히는 것과 관련이 있습니다.승모판 전단을 격막 쪽으로 끌어당기면 유출이 방해됩니다.이러한 당김 현상은 몇 가지 제안된 메커니즘에 의해 발생하는 것으로 생각되는데, 여기에는 좁아진 유출로를 통한 혈액의 흐름이 더 높은 속도를 가지며 벤투리 효과를 통한 압력은 더 적게 발생한다는 것이 포함됩니다.[16]그러면 이 저압으로 인해 승모판의 전방 리플릿이 유출 경로로 당겨져 추가적인 방해가 발생합니다.[30]
진단.
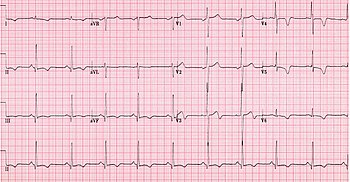
비후성 심근병증의 진단은 질병 과정의 여러 특징에 근거합니다.심장 초음파, 심장 카테터 또는 심장 MRI를 질병 진단에 사용할 수 있지만, 다른 중요한 고려 사항으로는 심전도, 유전자 검사(진단에 주로 사용되지는 않음),[31] HCM의 가족력 또는 건강한 사람의 설명할 수 없는 돌연사가 있습니다.[citation needed]약 60~70%의 경우 심장 MRI에서 심실중격 하부가 15mm 이상 두꺼워지는 소견을 보입니다.T1 가중치 영상은 심장 조직의 흉터를 식별할 수 있는 반면 T2 가중치 영상은 흉통 및 실신 증상의 급성 임상 징후와 관련된 심장 조직의 부종 및 염증을 식별할 수 있습니다.[32]
심전도는 가장 민감한 진단 검사입니다.[16]좌심실 비대와 우심방 비대가 심전도상에 나타나는 것이 HCM을 강하게 시사합니다.[16]
변형
정상적인 심장 해부학의 왜곡이 심장의 좌심실에서 혈액의 유출을 방해하는지에 따라 HCM은 폐쇄성 또는 비폐쇄성으로 분류될 수 있습니다.[33]역사적으로 특발성 특발성 비대흉부협착증(IHSS) 또는 비대칭중격비대증(ASH)으로도 알려진, HCM의 폐쇄형 변종은 비후성 폐쇄성 심근병증(HOCM)입니다.[34]좌심실 유출관 폐쇄의 진단은 보통 심장 초음파 평가에 의해 이루어지며, ≥ 30 mmHg의 최대 좌심실 유출관 구배로 정의됩니다.
HCM의 또 다른 비장애적인 변종은 야마구치 증후군이라고도 불리는 척추성 비후성 심근병증(AHC)[36]입니다.그것은 일본계 사람들에게서 처음 기술되었습니다.
심장 카테터 삽입술

AO = 하강 대동맥, LV = 좌심실, ECG = 심전도.
세 번째 QRS complex(QRS complex(QRS complex) 후에는 심실에 채울 시간이 더 많습니다.채울 시간이 더 많기 때문에 좌심실은 확장기 끝에 더 많은 볼륨을 갖게 됩니다(예하량 증가).심장의 Frank-Starling 법칙으로 인해 좌심실의 수축(및 좌심실에서 발생하는 압력)은 이후의 박동(이 사진에서 #4 비트)에서 더 커집니다.HCM에서 유출 폐색의 동적 특성 때문에 좌심실 압력 증가보다 폐색이 더 많이 증가합니다.이는 좌심실 압력이 상승함에 따라 대동맥 압력이 떨어집니다(사진에서 노란색 음영 지역으로 표시됨).
심장 카테터 삽입 시 카테터를 좌심실과 상행 대동맥에 배치하여 이들 구조 간의 압력 차이를 측정할 수 있습니다.정상인의 경우 심실 수축기 동안 상행 대동맥과 좌심실의 압력이 같아지고 대동맥 판막이 열립니다.대동맥 협착증이 있거나 유출로 구배가 있는 HCM이 있는 사람의 경우 좌심실과 대동맥 사이에 압력 구배(차)가 존재하며 좌심실 압력이 대동맥 압력보다 높습니다.이 기울기는 좌심실에서 혈액을 배출하기 위해 극복해야 하는 폐색 정도를 나타냅니다.[citation needed]
브로큰브로–브라운왈드–모로우 부호는 유출 경로 구배를 가진 HCM을 가진 개체에서 관찰됩니다.이 기호는 HCM과 대동맥 협착을 구별하는 데 사용될 수 있습니다.대동맥 협착증이 있는 사람의 경우 조기 심실 수축(PVC) 후에 다음 심실 수축이 더 강력해지고 좌심실에서 발생하는 압력이 더 높아집니다.협착성 대동맥 판막이 나타내는 고정된 폐색 때문에 PVC 상승 후 대동맥 압력도 증가할 것입니다.그러나 HCM을 가진 사람의 경우 PVC 후 비트에서 수축력이 증가하는 것보다 방해의 정도가 더 증가할 것입니다.그 결과 좌심실압이 증가하고 상행 대동맥압이 감소하여 LVOT 구배가 증가합니다.[citation needed]
Brockenbrough–Braunwald–Morrow 부호는 심장내 및 동맥내 카테터를 동시에 사용하여 가장 극적으로 입증되지만, 일상적인 신체 검사에서 HCM을 가진 개인의 PVC 후 비트의 펄스 압력 감소로 볼 수 있습니다.[citation needed]
상영
HCM은 무증상일 수도 있지만, 영향을 받은 사람들은 소아기부터 노인기까지 어느 시점에서든 가벼운 심부전에서 심각한 심부전 및 갑작스러운 심장 사망에 이르는 증상을 보일 수 있습니다.[14][37]HCM은 미국의 어린 운동선수들의 갑작스러운 심장 사망의 주요 원인이며, 가장 흔한 유전적 심혈관 질환입니다.[4]한 연구에 따르면 이탈리아 베네토 지역에서는 1982년 선수들에게 정기적인 심장 검진을 도입한 이후 젊은 경쟁 선수들의 갑작스러운 심장 사망 발생률이 비정상적으로 높은 수준에서 89% 감소했습니다.[38]그러나 2010년 현재, 연구에 따르면 HCM을 가진 모든 사람들 중 갑작스러운 심장 사망의 발생률이 1% 이하로 감소했습니다.[39]심장병 진단을 받은 스크린 양성 환자들은 대개 경쟁적인 운동을 피하라고 합니다.[citation needed]
HCM은 80% 이상의 정확도로 심장 초음파(ECO)로 검출할 수 있으며,[citation needed] 심장 이상 여부를 검사하기 위해 심전도(ECG)로 검사하는 것이 선행될 수 있습니다.좌심실 벽의 물리적 특성을 결정하는 금본위제로 간주되는 심장 자기공명영상(CMR)은 심장 초음파가 결정적이지 않은 결과를 제공할 때 대체 선별 도구의 역할을 할 수 있습니다.[40]예를 들어, 분절적 측심실 비대의 확인은 심장 초음파만으로 이루어질 수 없습니다.또한 좌심실 비대증은 13세 미만의 어린이에게는 없을 수 있습니다.이것은 청소년 이전의 심장 초음파 결과를 약화시킵니다.[14]그러나 연구자들은 CMR의 사용을 통해 HCM을 유발하는 돌연변이의 무증상 보균자를 연구했고 이 사람들의 심실간 중격 조직의 암호를 확인할 수 있었습니다.이러한 crypts의 형성은 나중에 HCM의 임상적 발현을 초래할 수 있는 근세포 무질서 및 변화된 혈관 벽의 징후라고 제안되었습니다.[40]이에 대한 하나의 가능한 설명은 전형적인 가족사 모임이 급사 여부에만 초점을 맞춘다는 것입니다.친척들이 갑작스러운 심장 사망에 이르게 된 나이는 물론 심장 사건의 빈도도 인정하지 않고 있습니다.또한, 갑작스런 심장사에 대한 위험성을 고려해야 하는 여러 가지 요인들을 고려할 때, 대부분의 요인들이 개별적으로 강한 예측값을 가지고 있지는 않지만, 특별한 치료를 언제 시행할 것인지에 대해서는 모호함이 존재합니다.[41]
미국
미국에서 HCM에 대한 일상적인 검사와 관련하여 몇 가지 잠재적인 문제가 있습니다.[42]첫째, 1,500만 명의 미국 선수 인구는 이탈리아의 추정 선수 인구보다 거의 두 배나 많습니다.[42]둘째, 이러한 행사들은 희귀하며, 경쟁력 있는 운동선수들의 HCM으로 인해 미국에서 매년 100명 이하의 사망자가 발생하거나, 220,000명의 운동선수들 당 약 1명의 사망자가 발생합니다.[43][44]마지막으로, 유전자 검사는 최종 진단을 제공할 것이지만, 수많은 HCM을 유발하는 돌연변이 때문에, 이 방법은 복잡하고 비용 효율적이지 않습니다.[14]따라서 미국의 유전자 검사는 HCM의 분명한 증상을 보이는 개인과 그 가족으로 제한됩니다.이를 통해 (낮은 민감도로 인해) 심실 비대의 다른 원인을 탐지하는 데 검사가 낭비되지 않도록 보장하고, 개인의 가족 구성원들이 돌연변이 유전자의 매개체가 될 수 있는 잠재적 위험성에 대해 교육받을 수 있습니다.[45]
캐나다
HCM 진단을 받은 사람에 대한 캐나다 유전자 검사 지침 및 권장 사항은 다음과 같습니다.[31]
- 유전자 검사의 주된 목적은 가족을 선별하는 것입니다.
- 그 결과에 따르면, 위험에 처한 친척들은 광범위한 검사를 받도록 권장될 수 있습니다.
- 유전자 검사는 진단을 확인하기 위한 것이 아닙니다.
- 진단받은 사람에게 위험한 친척이 없는 경우 유전자 검사는 필요하지 않습니다.
- 유전자 검사는 위험 평가나 치료 결정을 위한 것이 아닙니다.
- 증거는 HCM의 진행과 합병증 발생 위험을 예측하는 데 있어 임상 시험만 지원합니다.
HCM에 걸린 것으로 의심되는 사람의 경우:
- 좌심실 비대의 다른 원인(예: "운동선수 심장", 고혈압, 심장 아밀로이드증)을 확인하기 위해 유전자 검사를 권장하지 않습니다.
- HCM은 임상 기록과 임상 시험을 통해 다른 비대를 유발하는 상태와 구별될 수 있습니다.
치료
무증상자
비후성 심근병증을 가진 많은 사람들은 특별한 격렬한 활동이나 경쟁적인 운동을 피해야 하지만 아무런 증상이 없고 정상적인 수명을 가질 것입니다.증상이 없는 사람은 갑작스러운 심장사의 위험인자를 검사받아야 합니다.휴식 중이거나 유도성 유출 장애가 있는 사람은 탈수나 혈관 확장(혈관 확장제 또는 이뇨제 혈압제 사용 등)을 유발하는 상황을 피해야 합니다.증상이 없는 사람에게는 중격 감소 치료가 권장되지 않습니다.[7]
약물
약물치료의 주된 목적은 흉통, 호흡곤란, 두근거림과 같은 증상을 완화시키는 것입니다.베타 차단제는 심장 박동을 늦추고 이소성 박동의 가능성을 감소시킬 수 있기 때문에 1차 작용제로 여겨집니다.베타 차단제를 견딜 수 없는 사람들에게는 베라파밀과 같은 비디히드로피리딘 칼슘 채널 차단제가 사용될 수 있지만, 혈압이 낮거나 휴식 중에 호흡 곤란이 심한 사람들에게는 잠재적으로 해로울 수 있습니다.또한 이러한 약물은 심박수를 감소시키지만, 심각한 유출 폐색, 폐동맥 쐐기압 상승, 저혈압을 가진 사람들에게 사용되는 것은 주의해야 합니다.디히드로피리딘 칼슘 채널 차단제는 폐색의 증거가 있는 사람에게는 피해야 합니다.위의 치료법으로 증상이 완화되지 않는 사람의 경우, 디소피라마이드를 사용하여 증상 완화를 더 고려할 수 있습니다.이뇨제는 유체 과부하의 증거가 있는 사람들에게 고려될 수 있지만, 폐색의 증거가 있는 사람들에게는 조심스럽게 사용됩니다.[16]약물 치료에도 불구하고 증상이 계속되는 사람들은 더 침습적인 치료를 고려할 수 있습니다.수액 투여에 반응하지 않는 폐쇄성 비후성 심근병증 환자의 저혈압 급성 설정에는 정맥 페닐에프린(또는 다른 순수 혈관 수축제)을 사용할 수 있습니다.[7]
2022년 4월 미국에서 의료용 허가를 받았습니다.[46]
수술중격근절제술
수술적 중격근 절제술은 의학적 치료에도 불구하고 증상이 심한 사람들의 증상을 완화시키기 위해 시행되는 개심 수술입니다.그것은 1960년대 초부터 성공적으로 공연되었습니다.[19]수술적 중격근 절제술은 균일하게 좌심실 유출관 폐쇄를 감소시키고 증상을 호전시키며, 경험이 풍부한 센터에서는 수술 사망률이 1% 미만일 뿐만 아니라 성공률도 85%에 이릅니다.[37]중앙 흉골절개술(전면마취, 흉부개열, 심폐우회)과 심실중격의 일부를 제거하는 것을 포함합니다.[14]흉막하중격에만 초점을 맞춘 수술적 근절제술은 벤투리 힘을 줄이기 위해 유출관의 크기를 증가시키기 위해 승모판의 전방엽의 수축기 전방운동(SAM)을 제거하기에 불충분할 수 있습니다.이렇게 제한적으로 절제하면 잔류 중격 팽대부는 여전히 흐름을 후방으로 리디렉션합니다. 흐름이 승모판 뒤에 있기 때문에 SAM이 지속됩니다.중격 팽대부의 더 깊은 부분을 절제할 때에만 흐름이 승모판으로부터 전방으로 이동하여 SAM을 제거합니다.이 점을 염두에 두고, 확장된 내근 절제술, 동원, 그리고 유두 근육의 부분 절제술이라고 불리는 내일의 내근 절제술의 변형이 선택의 절제가 되었습니다.[47][48][49][50]특히 큰 중복 승모판을 가진 사람의 경우, 전방 리플릿 적용을 추가하여 승모판과 유출을 완전히 분리할 수 있습니다.[50]중격근절제술의 합병증으로는 사망 가능성, 부정맥, 감염, 끊임없는 출혈, 중격천공/결함, 뇌졸중 등이 있습니다.[37]
알코올중격절제술
1994년 울리히 시그워트(Ulrich Sigwart)에 의해 소개된 알코올 중격 절제술은 좌측 전방 하행 동맥의 하나 이상의 중격 가지에 알코올을 주입하는 경피적 기법입니다.이것은 외과적 중격근절제술과 유사한 결과를 가지고 있지만 일반적인 마취와 흉벽 및 심낭의 개방(중격근절제술에서 행해지는)을 수반하지 않기 때문에 덜 침습적인 카테터 기술입니다.높은 유출 경로 기울기에 이차적으로 증상이 있는 일부 모집단에서 알코올 중격 절제술은 HCM의 증상을 감소시킬 수 있습니다.또한 나이 든 사람들과 수술적 근절제술이 증가하는 시술 위험을 초래하는 다른 의학적 문제가 있는 사람들은 덜 침습적인 중격 절제술의 혜택을 받을 것입니다.[14][51]
술 중격절개술이 제대로 시행되면 좌심실 유출관을 포함하는 심실중격의 부분이 경색되어 흉터로 수축되는 조절된 심장마비를 유도합니다.어떤 사람들이 수술적 근절제술, 알코올중격절제술, 또는 의학적 치료를 가장 잘 받을 수 있는지에 대한 논쟁이 있습니다.[52]
승모 클립
2013년부터 중증 폐색성 HCM 환자에서 승모판의 운동을 교정하기 위한 새로운 전략으로 승모판 클립을 카테터를 통해 이식하고 있습니다.이 장치는 승모판 전단을 함께 조여 심장의 혈액 유출을 개선합니다.승모판 클립은 아직 중격근절제술이나 알코올 중격절제술과 같은 장기적인 신뢰성을 확립하지 못했지만, HCM 전문가들은 점점 더 덜 침습적인 치료 방법으로 클립을 제공하고 있습니다.[53][54]
이식형 심박동기 또는 제세동기
좌심실의 비동기적 수축을 유발하기 위해 일부 개인들에게서 심박동기의 사용이 권장되고 있습니다.심박동기가 좌심실 자유벽보다 먼저 심실간 중격을 활성화하기 때문에 좌심실 유출관을 가로지르는 구배가 감소할 수 있습니다.이러한 형태의 치료는 수술적 근절제술과 비교할 때 증상의 완화와 좌심실 유출로 구배의 감소를 덜 제공하는 것으로 나타났습니다.[55]기술의 발전은 또한 필요할 때만 작동되는 이중 챔버 심박동기의 개발로 이어졌습니다 (일정한 자극을 제공하는 일반적인 심박동기와는 대조적으로).이중 챔버 심박동기가 심실 유출 통로 폐쇄를 감소시키는 것으로 나타났지만, 실험 결과 증상이 개선된 사람은 극히 일부에 불과했습니다.[41]연구원들은 증상이 개선되었다는 이러한 보고들이 위약 효과 때문인 것으로 추측하고 있습니다.[37]
시술은 쇄골 아래쪽 전측부 절개를 포함합니다.그 다음 두 개의 리드가 삽입됩니다. 하나는 우심방으로, 다른 하나는 쇄골하 정맥을 통해 우심실 꼭지점으로 삽입됩니다.제자리에 있으면 제너레이터에 고정되고 부착되며, 이 제너레이터는 가슴 근육 앞의 근막 내부에 남아 있게 됩니다.[37]이 절차의 합병증으로는 감염, 전기 납, 제너레이터 오작동 등이 있으며 이를 교체해야 합니다.[37]
심장 돌연사의 주요 위험 인자 중 하나 이상을 나타내는 HCM 환자의 경우 적절한 예방책으로 이식형 심장충격기(ICD) 또는 심장박동기/ICD 일체형 장치가 권장될 수 있습니다.[7][19][56][57]2014년, 유럽 심장학회는 그 위험을 계산하기 위해 실제적인 위험 점수를 제시했습니다.[58]
심장이식
다른 모든 형태의 치료에 반응하지 않는 경우에는 심장 이식이 하나의 선택입니다.또한 말기 심부전에 사용할 수 있는 유일한 치료법이기도 합니다.[41]그러나 이식이 성공하기 위해서는 폐혈관 고혈압, 신장 기능 이상, 혈전색전증 등의 증상이 나타나기 전에 이식이 이루어져야 합니다.연구에 따르면 이식 후 HCM을 가진 사람들의 7년 생존율은 94%입니다.[41]
예후
2002년의 체계적인 검토는 다음과 같이 결론지었습니다: "전반적으로, HCM은 연간 사망률을 약 1%로 부여합니다...HCM은 중요한 증상 및 조기 사망과 관련이 있을 수 있지만, 장애가 없거나 비교적 경미하고 평균 수명이 정상적인 경우가 더 많습니다."[14]
아이들.
비후성 심근병증(HCM)이 초기에 존재할 수 있고 선천적일 가능성이 높지만, 소아 심장학에서 마주치는 가장 드문 심장 기형 중 하나인데, 이는 주로 증상의 발현이 보통 없거나 불완전하거나 성인기까지 지연되기 때문입니다.HCM과 관련된 현재 정보의 대부분은 성인 모집단의 연구에서 발생하며, 이러한 관측치가 소아 모집단에 미치는 영향은 종종 불확실합니다.[59]그럼에도 불구하고, 소아 심장학의 최근 연구에 따르면 HCM은 소아 심근병증의 42%를 차지하며, 소아에서 연간 발생률은 0.47/100,000입니다.[60]또한, 증상이 없는 경우에 돌연사는 일부 소아과 인구에서 질병과 관련된 가장 두려운 합병증 중 하나로 간주됩니다.따라서 소아기 내내 감염된 사람의 아이들을 검사하여 심장 이상을 조기에 발견하는 것이 질병의 더 이상 합병증을 예방하기 위해 권장되는 방법입니다.[59]
일반적으로 소아 집단에서 HCM의 진단은 수음, 울혈성 심부전, 신체적 탈진 및 영향을 받은 환자의 자녀의 유전자 검사를 위한 평가 중에 수행됩니다.[59]특히, 심장 초음파(ECHO)는 거의 모든 어린이들에게 확실한 비침습적 진단 도구로 사용되어 왔습니다.에코는 심실 크기, 벽 두께, 수축기 및 이완기 기능 및 유출 장애를 평가합니다.따라서 EACH는 HCM에서 심장 근육의 과도한 벽 비후를 감지하는 이상적인 수단으로 선택되었습니다.[59]
HCM을 가진 아이들에게, 치료 전략은 질병 증상을 줄이고 갑작스러운 사망의 위험을 낮추는 것을 목표로 합니다.[61]질병의 이질성 때문에 치료는 대개 개인의 필요에 따라 변형됩니다.[61]β-차단제는 좌심실 충전과 이완을 개선시켜 증상을 완화시킵니다.일부 어린이에서는 β-차단제(예: 프로프라놀롤)가 돌연사 위험을 줄이는 데 효과적인 것으로 나타났습니다.[61]또한 칼슘 채널 차단제(베라파밀) 및 항부정맥제는 증상이 있는 소아에서 β-차단제의 보조요법으로 사용될 수 있습니다.그럼에도 불구하고 최종적인 이점을 파악하기 위해서는 추가 테스트가 필요합니다.[61]
역학
전 세계 일반 인구에서 HCM의 유병률은 심장 초음파 연구에서 확인된 바와 같이 0.2%(성인 500명 중 1명)입니다.[16]HCM은 여성보다 남성에게 더 흔합니다.[16]HCM의 가장 일반적인 제시는 신생아부터 노인까지 모든 연령에서 제시할 수 있지만, 인생의 30년째에 있습니다.[16]
기타동물


캣츠
고양이 비대성 심근병증(HCM)은 집에서 키우는 고양이에게 가장 흔한 심장병입니다.[62][63][64] 질병 과정과 유전학은 인간의 질병과 비슷하다고 여겨집니다.[65]메인쿤 고양이에서 HCM은 상염색체 우성 유전 형질로 확인되었습니다.[66]수많은 고양이 품종이 HCM을 문제로 삼고 있습니다.[67]고양이 HCM을 담당하는 첫 번째 유전적 돌연변이(심장 마이오신 결합 단백질 C)는 2005년 메인 쿤 고양이에서 발견되었습니다.[68]이 돌연변이(A31P)에 대한 테스트를 사용할 수 있습니다.[69]돌연변이 검사를 받은 메인쿤 고양이의 약 3분의 1이 이형접합성 또는 동형접합성 돌연변이이지만, 이형접합성이 있는 고양이들 중 많은 수는 심장 초음파 검사에서 이 질환에 대한 명백한 증거가 없습니다.비후성 심근병증의 임상적 증거가 있는 일부 메인쿤 고양이들은 이 돌연변이에 대해 음성 반응을 보였고, 이는 그 종에 또 다른 원인이 존재한다는 것을 강력히 시사합니다.메인쿤 고양이에서 확인된 심장 미오신 결합 단백질 C 돌연변이는 HCM을 가진 다른 고양이 품종에서 발견되지 않았지만, 최근에는 HCM을 가진 래그돌 고양이에서 또 다른 미오신 결합 단백질 C 돌연변이가 확인되었습니다.[70][71]인간과 마찬가지로 고양이 HCM은 태어날 때 존재하지 않지만 시간이 지남에 따라 발달합니다.생후 6개월 정도의 어린 고양이와 생후 7년 정도의 고양이에게서 처음으로 확인됐습니다.[citation needed]
임상적으로 비후성 심근병증이 있는 고양이는 승모판의 수축기 전방운동(SAM)이 일반적입니다(그림 참조).[72]HCM이 심한 고양이는 좌심실의 심한 이완기능 장애로 인해 좌심부전(폐부종; 흉수)이 발생하는 경우가 많습니다.그들은 또한 급성 통증과 후지 마비를 일으키는 가장 일반적으로 말단 대동맥을 색전하는 좌심방 혈전을 일으킬 수도 있습니다(아래 참조).돌연사도 일어날 수 있지만 흔하지 않은 것으로 보입니다.[73][74]
고양이의 HCM을 진단하기 위해서는 심장 초음파(심초음파)가 필요합니다.[75][76][77]N ‐ 말단 ‐ 프로BNP(NT ‐ 프로BNP) 및 트로포닌 I(TnI)와 같은 순환하는 심장 바이오마커의 측정은 심장 질환의 의심을 강화하기 위해 고양이에서 사용될 수 있습니다.고양이 NT-proBNP에 대한 Point-of-care test를 사용할 수 있으며, 심장 초음파를 수행할 수 없을 때 동물병원에서 사용할 수 있습니다.[81][82][83]
빈맥성(>220) 및/또는 에코에 유출 장애(SAM)가 있는 고양이는 아마도 치료해야 하지만 고양이 HCM에 대한 치료법은 없습니다.많은 고양이들이 그러나 모든 고양이들이 심장의 속삭임을 가지고 있는 것은 아닙니다.심잡한 소리를 내는 많은 고양이들은 HCM을 가지고 있지 않습니다.고양이가 HCM에 걸린 첫 번째 증상은 심부전이나 전신 혈전색전증으로 인한 급성 통증과 마비로 인한 빈맥성/호흡곤란입니다.임상 징후가 없는 HCM을 가진 고양이에게 일반적으로 약물 치료가 제공되지만, 이 단계에서 도움이 되는 약물은 없으며 ACE 억제제는 심부전이 있을[84] 때까지 (이뇨제가 가장 도움이 되는) 유익하지 않은 것으로 나타났습니다.딜티아젬은 일반적으로 입증 가능한 이익을 창출하지 못합니다.아데놀은 승모판의 심각한 수축기 전방 운동이 있을 때 흔히 투여됩니다.[citation needed]
고양이 동맥 혈전색전증(FATE)은 고양이 HCM과 다른 고양이 심근병증의 비교적 흔하고 파괴적인 합병증입니다.혈전은 일반적으로 좌심방, 가장 일반적으로 좌청에 형성됩니다.그 형성은 주로 혈류의 안정에 기인하는 것으로 생각됩니다.고전적으로 혈전색전증은 대동맥의 장골 삼차분화에 자리잡고, 일반적인 장골 동맥 중 하나 또는 둘 다를 막습니다.이 분열은 안장이라고 불리며 혈전의 가장 빈번한 위치이기 때문에 FATE는 일반적으로 안장 혈전이라고 알려져 있습니다.[85]임상적으로 이것은 한쪽 또는 양쪽 뒷다리의 기능을 완전히 상실한 고양이로 보입니다.뒷다리는 차갑고 고양이는 상당한 고통을 겪고 있습니다.색전증은 드물게는 다른 곳, 대개 오른쪽 앞다리와 신장 동맥에 자리 잡을 수도 있습니다.[citation needed]
클로피도그렐은 HCM과 큰 좌심방을 가진 고양이의 좌심방 혈전 형성을 막기 위해 사용됩니다.퍼듀 대학의 FATCAT 연구는 이미 혈전을 경험한 고양이들에게서 두 번째 혈전이 형성되는 것을 예방하기 위해 아스피린보다 더 뛰어나다는 것을 증명했습니다.혈전 용해제(예: 조직 플라스미노겐 활성제)는 기존의 대동맥 혈전색전증을 분해하는 데 어느 정도 성공적으로 사용되었지만, 비용이 많이 들고 결과는 고양이에게 자신의 응혈을 분해할 시간(48~72시간)을 주는 것보다 나을 것이 없는 것 같습니다.통증 관리는 매우 중요합니다.운명을 가진 고양이는 이미 상당한 HCM을 가지고 있을 가능성이 높고 운명이 반복될 가능성이 높기 때문에 종종 예후가 좋지 않습니다.[86]이러한 이유로 안락사는 종종 타당한 고려 사항이 됩니다.[citation needed]
고릴라
2013년 7월, 멜버른 동물원에 거주하는 42세의 서부 저지 고릴라이자 인공수정에 의해 태어난 첫 번째 고릴라인 Mzuri의 아버지인 Rigo는 HCM으로 인해 예기치 않게 사망했습니다.30세 이상 수컷 고릴라의 경우 이런 상태가 드물지 않고, 개체가 갑자기 죽을 때까지 병의 징후가 없는 경우도 많습니다.[87]
참고문헌
- ^ "Other Names for Cardiomyopathy". NHLBI. June 22, 2016. Archived from the original on 28 July 2016. Retrieved 31 August 2016.
- ^ a b c "What Are the Signs and Symptoms of Cardiomyopathy?". NHLBI. 22 June 2016. Archived from the original on 28 July 2016. Retrieved 10 November 2017.
- ^ a b c "What Is Cardiomyopathy?". NHLBI. 22 June 2016. Archived from the original on 10 November 2017. Retrieved 10 November 2017.
- ^ a b c Barsheshet A, Brenyo A, Moss AJ, Goldenberg I (October 2011). "Genetics of sudden cardiac death". Current Cardiology Reports. 13 (5): 364–76. doi:10.1007/s11886-011-0209-y. PMID 21789574. S2CID 25887172.
- ^ a b c Ferri FF (2017). Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1. Elsevier Health Sciences. p. 246. ISBN 9780323529570. Archived from the original on 2017-11-10. Retrieved 2017-11-10.
- ^ a b c "What Causes Cardiomyopathy?". NHLBI. 22 June 2016. Archived from the original on 5 October 2017. Retrieved 10 November 2017.
- ^ a b c d e f g h i Gersh BJ, Maron BJ, Bonow RO, Dearani JA, Fifer MA, Link MS, et al. (December 2011). "2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines". The Journal of Thoracic and Cardiovascular Surgery. 142 (6): 1303–38. doi:10.1016/j.jtcvs.2011.10.019. PMID 22093712.
- ^ a b c d e Cui, Hao; Schaff, Hartzell V. (2020). "80. Hypertrophic cardiomyopathy". In Raja, Shahzad G. (ed.). Cardiac Surgery: A Complete Guide. Switzerland: Springer. pp. 735–748. ISBN 978-3-030-24176-6. Archived from the original on 2023-01-10. Retrieved 2022-10-20.
- ^ a b Maron BJ, Ommen SR, Semsarian C, Spirito P, Olivotto I, Maron MS (July 2014). "Hypertrophic cardiomyopathy: present and future, with translation into contemporary cardiovascular medicine". Journal of the American College of Cardiology. 64 (1): 83–99. doi:10.1016/j.jacc.2014.05.003. PMID 24998133.
- ^ a b c d e f Basit, Hajira; Brito, Daniel; Sharma, Saurabh (2020), "Hypertrophic Cardiomyopathy", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28613539, archived from the original on 2021-04-06, retrieved 2020-09-20
- ^ a b "Types of Cardiomyopathy". NHLBI. 22 June 2016. Archived from the original on 4 October 2017. Retrieved 10 November 2017.
- ^ Teare D (January 1958). "Asymmetrical hypertrophy of the heart in young adults". British Heart Journal. 20 (1): 1–8. doi:10.1136/hrt.20.1.1. PMC 492780. PMID 13499764.
- ^ McKenna WJ, Sen-Chowdhry S (December 2008). "From Teare to the present day: a fifty year odyssey in hypertrophic cardiomyopathy, a paradigm for the logic of the discovery process". Revista Espanola de Cardiologia. 61 (12): 1239–44. doi:10.1016/S1885-5857(09)60050-5. PMID 19080961. Archived from the original on 2017-11-11. Retrieved 2017-02-06.
- ^ a b c d e f g Maron BJ (March 2002). "Hypertrophic cardiomyopathy: a systematic review". JAMA. 287 (10): 1308–20. doi:10.1001/jama.287.10.1308. PMID 11886323. S2CID 19887576.
- ^ Fifer MA, Vlahakes GJ (January 2008). "Management of symptoms in hypertrophic cardiomyopathy". Circulation. 117 (3): 429–39. doi:10.1161/CIRCULATIONAHA.107.694158. PMID 18212300.
- ^ a b c d e f g h i Basit, Hajira; Brito, Daniel; Sharma, Saurabh (2023), "Hypertrophic Cardiomyopathy", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 28613539, retrieved 2023-10-25
- ^ Bonow R, Braunwald E, Zipes DP, Libby P (2005). "The Cardiomyopathies". Braunwald's heart disease: a textbook of cardiovascular medicine (7th ed.). Philadelphia: WB Saunders. ISBN 978-1-4160-0014-3.
- ^ Wigle ED, Rakowski H, Kimball BP, Williams WG (October 1995). "Hypertrophic cardiomyopathy. Clinical spectrum and treatment". Circulation. 92 (7): 1680–92. doi:10.1161/01.cir.92.7.1680. PMID 7671349.
- ^ a b c Maron BJ, McKenna WJ, Danielson GK, Kappenberger LJ, Kuhn HJ, Seidman CE, et al. (November 2003). "American College of Cardiology/European Society of Cardiology clinical expert consensus document on hypertrophic cardiomyopathy. A report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the European Society of Cardiology Committee for Practice Guidelines". Journal of the American College of Cardiology. 42 (9): 1687–713. doi:10.1016/S0735-1097(03)00941-0. PMID 14607462.
- ^ Kalyva A, Parthenakis FI, Marketou ME, Kontaraki JE, Vardas PE (April 2014). "Biochemical characterisation of Troponin C mutations causing hypertrophic and dilated cardiomyopathies". Journal of Muscle Research and Cell Motility. 35 (2): 161–78. doi:10.1007/s10974-014-9382-0. PMID 24744096. S2CID 1726747.
- ^ Murphy JG, Lloyd MA (2007). Mayo Clinic Cardiology Concise Textbook and Mayo Clinic Cardiology Board Review Questions & Answers: (TEXT AND Q&A SET). CRC Press. p. 1159. ISBN 9781439825457. Archived from the original on 2018-10-23. Retrieved 2018-10-22.
- ^ Sievert H, Qureshi SA, Wilson N, Hijazi ZM (2015). Interventions in Structural, Valvular and Congenital Heart Disease (second ed.). CRC Press. p. 46. ISBN 9781482215649. Archived from the original on 2018-01-03. Retrieved 2018-01-02.
- ^ Robert A. Chahine, M.D. Albert E. Raizner, M.D. Robert J. Luchi, M.D. "The Genetics and Semantics of Hypertrophic Cardiomyopathy". chestnet.org. Archived from the original on 2023-08-09. Retrieved 2023-04-02.
{{cite web}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - ^ Cirino AL, Ho C (2014). "Hypertrophic Cardiomyopathy Overview". In Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, Amemiya A (eds.). GeneReviews. University of Washington, Seattle. PMID 20301725. Archived from the original on 2017-01-18. Retrieved 2017-02-11.
- ^ Doolan G, Nguyen L, Chung J, Ingles J, Semsarian C (August 2004). "Progression of left ventricular hypertrophy and the angiotensin-converting enzyme gene polymorphism in hypertrophic cardiomyopathy". International Journal of Cardiology. 96 (2): 157–63. doi:10.1016/j.ijcard.2004.05.003. PMID 15314809.
- ^ Marian AJ, Yu QT, Workman R, Greve G, Roberts R (October 1993). "Angiotensin-converting enzyme polymorphism in hypertrophic cardiomyopathy and sudden cardiac death". Lancet. 342 (8879): 1085–6. doi:10.1016/0140-6736(93)92064-Z. PMID 8105312. S2CID 39088276.
- ^ Pasquale F, Syrris P, Kaski JP, Mogensen J, McKenna WJ, Elliott P (February 2012). "Long-term outcomes in hypertrophic cardiomyopathy caused by mutations in the cardiac troponin T gene". Circulation: Cardiovascular Genetics. 5 (1): 10–7. doi:10.1161/CIRCGENETICS.111.959973. PMID 22144547.
- ^ Sedaghat-Hamedani F, Kayvanpour E, Tugrul OF, Lai A, Amr A, Haas J, et al. (January 2018). "Clinical outcomes associated with sarcomere mutations in hypertrophic cardiomyopathy: a meta-analysis on 7675 individuals". Clinical Research in Cardiology. 107 (1): 30–41. doi:10.1007/s00392-017-1155-5. PMID 28840316. S2CID 23723131.
- ^ Cheng Y, Regnier M (July 2016). "Cardiac troponin structure-function and the influence of hypertrophic cardiomyopathy associated mutations on modulation of contractility". Archives of Biochemistry and Biophysics. 601: 11–21. doi:10.1016/j.abb.2016.02.004. PMC 4899195. PMID 26851561.
- ^ "Venturi effect". www.healio.com. Retrieved 2023-10-25.
- ^ a b Gollob MH, Blier L, Brugada R, Champagne J, Chauhan V, Connors S, et al. (2011). "Recommendations for the use of genetic testing in the clinical evaluation of inherited cardiac arrhythmias associated with sudden cardiac death: Canadian Cardiovascular Society/Canadian Heart Rhythm Society joint position paper". The Canadian Journal of Cardiology. 27 (2): 232–45. doi:10.1016/j.cjca.2010.12.078. PMID 21459272.
- ^ Amano Y, Kitamura M, Takano H, Yanagisawa F, Tachi M, Suzuki Y, et al. (April 2018). "Cardiac MR Imaging of Hypertrophic Cardiomyopathy: Techniques, Findings, and Clinical Relevance". Magnetic Resonance in Medical Sciences. 17 (2): 120–131. doi:10.2463/mrms.rev.2017-0145. PMC 5891337. PMID 29343659.
- ^ null, null; Ommen, Steve R.; Mital, Seema; Burke, Michael A.; Day, Sharlene M.; Deswal, Anita; Elliott, Perry; Evanovich, Lauren L.; Hung, Judy; Joglar, José A.; Kantor, Paul; Kimmelstiel, Carey; Kittleson, Michelle; Link, Mark S.; Maron, Martin S. (2020-12-22). "2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy". Circulation. 142 (25): e558–e631. doi:10.1161/CIR.0000000000000937. PMID 33215931. S2CID 227078319.
- ^ Kouchoukos, Nicholas; Blackstone, E. H.; Hanley, F. L.; Kirklin, J. K. (2013). Kirklin/Barratt-Boyes Cardiac Surgery E-Book (4th ed.). Elsevier. p. 770. ISBN 978-1-4160-6391-9. Archived from the original on 2023-08-09. Retrieved 2022-12-02.
- ^ null, null; Ommen, Steve R.; Mital, Seema; Burke, Michael A.; Day, Sharlene M.; Deswal, Anita; Elliott, Perry; Evanovich, Lauren L.; Hung, Judy; Joglar, José A.; Kantor, Paul; Kimmelstiel, Carey; Kittleson, Michelle; Link, Mark S.; Maron, Martin S. (2020-12-22). "2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy". Circulation. 142 (25): e558–e631. doi:10.1161/CIR.0000000000000937. PMID 33215931. S2CID 227078319.
- ^ Rivera-Diaz J, Moosvi AR (July 1996). "Apical hypertrophic cardiomyopathy". Southern Medical Journal. 89 (7): 711–3. doi:10.1097/00007611-199607000-00012. PMID 8685759.
- ^ a b c d e f Behr ER, McKenna WJ (December 2002). "Hypertrophic Cardiomyopathy". Current Treatment Options in Cardiovascular Medicine. 4 (6): 443–453. doi:10.1007/s11936-002-0039-8. PMID 12408787. S2CID 8041261.
- ^ Corrado D, Basso C, Pavei A, Michieli P, Schiavon M, Thiene G (October 2006). "Trends in sudden cardiovascular death in young competitive athletes after implementation of a preparticipation screening program". JAMA. 296 (13): 1593–601. doi:10.1001/jama.296.13.1593. PMID 17018804.
- ^ Critoph C, Elliott P (December 2010). "Hypertrophic Cardiomyopathy". Cardiac Electrophysiology Clinics. 2 (4): 587–598. doi:10.1016/j.ccep.2010.09.010. PMID 28770721.
- ^ a b Germans T, Wilde AA, Dijkmans PA, Chai W, Kamp O, Pinto YM, van Rossum AC (December 2006). "Structural abnormalities of the inferoseptal left ventricular wall detected by cardiac magnetic resonance imaging in carriers of hypertrophic cardiomyopathy mutations". Journal of the American College of Cardiology. 48 (12): 2518–23. doi:10.1016/j.jacc.2006.08.036. PMID 17174192.
- ^ a b c d Coats CJ, Elliott PM (December 2008). "Current management of hypertrophic cardiomyopathy". Current Treatment Options in Cardiovascular Medicine. 10 (6): 496–504. doi:10.1007/s11936-008-0042-9. PMID 19026180. S2CID 318803.
- ^ a b Maron BJ (March 2010). "National electrocardiography screening for competitive athletes: Feasible in the United States?". Annals of Internal Medicine. 152 (5): 324–6. CiteSeerX 10.1.1.668.3787. doi:10.7326/0003-4819-152-5-201003020-00012. PMID 20194239. S2CID 37588552.
- ^ Maron BJ, Doerer JJ, Haas TS, Tierney DM, Mueller FO (March 2009). "Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980-2006". Circulation. 119 (8): 1085–92. doi:10.1161/CIRCULATIONAHA.108.804617. PMID 19221222.
- ^ Maron BJ, Gohman TE, Aeppli D (December 1998). "Prevalence of sudden cardiac death during competitive sports activities in Minnesota high school athletes". Journal of the American College of Cardiology. 32 (7): 1881–4. doi:10.1016/S0735-1097(98)00491-4. PMID 9857867.
- ^ Hershberger RE, Lindenfeld J, Mestroni L, Seidman CE, Taylor MR, Towbin JA (March 2009). "Genetic evaluation of cardiomyopathy--a Heart Failure Society of America practice guideline". Journal of Cardiac Failure. 15 (2): 83–97. doi:10.1016/j.cardfail.2009.01.006. hdl:1805/15853. PMID 19254666.
- ^ "U.S. Food and Drug Administration Approves Camzyos (mavacamten) for the Treatment of Adults With Symptomatic New York Heart Association Class II-III Obstructive Hypertrophic Cardiomyopathy (HCM) to Improve Functional Capacity and Symptoms" (Press release). Bristol Myers Squibb. 28 April 2022. Retrieved 29 April 2022 – via Business Wire.
- ^ Sherrid MV, Chaudhry FA, Swistel DG (February 2003). "Obstructive hypertrophic cardiomyopathy: echocardiography, pathophysiology, and the continuing evolution of surgery for obstruction". The Annals of Thoracic Surgery. 75 (2): 620–32. doi:10.1016/S0003-4975(02)04546-0. PMID 12607696.
- ^ Messmer BJ (August 1994). "Extended myectomy for hypertrophic obstructive cardiomyopathy". The Annals of Thoracic Surgery. 58 (2): 575–7. doi:10.1016/0003-4975(94)92268-3. PMID 8067875.
- ^ Schoendube FA, Klues HG, Reith S, Flachskampf FA, Hanrath P, Messmer BJ (November 1995). "Long-term clinical and echocardiographic follow-up after surgical correction of hypertrophic obstructive cardiomyopathy with extended myectomy and reconstruction of the subvalvular mitral apparatus". Circulation. 92 (9 Suppl): II122-7. doi:10.1161/01.CIR.92.9.122. PMID 7586394.
- ^ a b Balaram SK, Sherrid MV, Derose JJ, Hillel Z, Winson G, Swistel DG (July 2005). "Beyond extended myectomy for hypertrophic cardiomyopathy: the resection-plication-release (RPR) repair". The Annals of Thoracic Surgery. 80 (1): 217–23. doi:10.1016/j.athoracsur.2005.01.064. PMID 15975370.
- ^ Sigwart U (July 1995). "Non-surgical myocardial reduction for hypertrophic obstructive cardiomyopathy". Lancet. 346 (8969): 211–4. doi:10.1016/S0140-6736(95)91267-3. PMID 7616800. S2CID 32959772.
- ^ Heldman AW, Wu KC, Abraham TP, Cameron DE (January 2007). "Myectomy or alcohol septal ablation surgery and percutaneous intervention go another round". Journal of the American College of Cardiology. 49 (3): 358–60. doi:10.1016/j.jacc.2006.10.029. PMID 17239718.
- ^ Dimitrow PP, Rajtar-Salwa R (May 2016). "Obstructive Form of Hypertrophic Cardiomyopathy-Left Ventricular Outflow Tract Gradient: Novel Methods of Provocation, Monitoring of Biomarkers, and Recent Advances in the Treatment". BioMed Research International. 2016: 1575130. doi:10.1155/2016/1575130. PMC 4877458. PMID 27247935.
- ^ Sorajja P, Pedersen WA, Bae R, Lesser JR, Jay D, Lin D, et al. (June 2016). "First Experience with Percutaneous Mitral Valve Plication as Primary Therapy for Symptomatic Obstructive Hypertrophic Cardiomyopathy". Journal of the American College of Cardiology. 67 (24): 2811–8. doi:10.1016/j.jacc.2016.03.587. PMID 27311518.
- ^ Ommen SR, Nishimura RA, Squires RW, Schaff HV, Danielson GK, Tajik AJ (July 1999). "Comparison of dual-chamber pacing versus septal myectomy for the treatment of patients with hypertrophic obstructive cardiomyopathy: a comparison of objective hemodynamic and exercise end points". Journal of the American College of Cardiology. 34 (1): 191–6. doi:10.1016/S0735-1097(99)00173-4. PMID 10400010.
- ^ Maron BJ, Spirito P, Shen WK, Haas TS, Formisano F, Link MS, et al. (July 2007). "Implantable cardioverter-defibrillators and prevention of sudden cardiac death in hypertrophic cardiomyopathy". JAMA. 298 (4): 405–12. doi:10.1001/jama.298.4.405. PMID 17652294.
- ^ "ICDs and Pacemakers". Hypertrophic Cardiomyopathy Association. Archived from the original on November 15, 2016. Retrieved November 14, 2016.
- ^ "2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy". Archived from the original on 2020-12-05. Retrieved 2020-11-22.
- ^ a b c d Colan SD (October 2010). "Hypertrophic cardiomyopathy in childhood". Heart Failure Clinics. 6 (4): 433–44, vii–iii. doi:10.1016/j.hfc.2010.05.004. PMC 2946944. PMID 20869644.
- ^ Lipshultz SE, Sleeper LA, Towbin JA, Lowe AM, Orav EJ, Cox GF, et al. (April 2003). "The incidence of pediatric cardiomyopathy in two regions of the United States". The New England Journal of Medicine. 348 (17): 1647–55. doi:10.1056/NEJMoa021715. PMID 12711739.
- ^ a b c d Maskatia SA (2012). "Hypertrophic cardiomyopathy: infants, children, and adolescents". Congenital Heart Disease. 7 (1): 84–92. doi:10.1111/j.1747-0803.2011.00613.x. PMID 22222117.
- ^ Payne JR, Brodbelt DC, Luis Fuentes V (December 2015). "Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study)" (PDF). Journal of Veterinary Cardiology. 17 (Suppl 1): S244-57. doi:10.1016/j.jvc.2015.03.008. PMID 26776583. Archived (PDF) from the original on 2022-01-24. Retrieved 2020-09-28.
- ^ Paige CF, Abbott JA, Elvinger F, Pyle RL (June 2009). "Prevalence of cardiomyopathy in apparently healthy cats". Journal of the American Veterinary Medical Association. 234 (11): 1398–403. doi:10.2460/javma.234.11.1398. hdl:10919/43704. PMID 19480619. Archived from the original on 2023-08-09. Retrieved 2020-09-14.
- ^ Wagner T, Fuentes VL, Payne JR, McDermott N, Brodbelt D (December 2010). "Comparison of auscultatory and echocardiographic findings in healthy adult cats" (PDF). Journal of Veterinary Cardiology. 12 (3): 171–82. doi:10.1016/j.jvc.2010.05.003. PMID 21075067. Archived from the original on 2023-08-09. Retrieved 2023-01-24.
- ^ "Hypertrophic Cardiomyopathy (HCM) in Cats". Cornell University Hospital for Animals. Archived from the original on 22 January 2018. Retrieved 24 February 2017.
- ^ Kittleson MD, Meurs KM, Munro MJ, Kittleson JA, Liu SK, Pion PD, Towbin JA (June 1999). "Familial hypertrophic cardiomyopathy in maine coon cats: an animal model of human disease". Circulation. 99 (24): 3172–80. doi:10.1161/01.CIR.99.24.3172. PMID 10377082.
- ^ Kittleson M, Gompf R, Little S. "Feline Hypertrophic Cardiomyopathy: Advice for Breeders". Cat Fancier's Association. Archived from the original on May 13, 2008.
- ^ Meurs KM, Sanchez X, David RM, Bowles NE, Towbin JA, Reiser PJ, et al. (December 2005). "A cardiac myosin binding protein C mutation in the Maine Coon cat with familial hypertrophic cardiomyopathy". Human Molecular Genetics. 14 (23): 3587–93. doi:10.1093/hmg/ddi386. PMID 16236761.
- ^ "Genetics: Maine Coon Cat Hypertrophic Cardiomyopathy". North Carolina State University, College of Veterinary Medicine. Archived from the original on September 3, 2019. Retrieved December 29, 2016.
- ^ Meurs KM, Norgard MM, Ederer MM, Hendrix KP, Kittleson MD (August 2007). "A substitution mutation in the myosin binding protein C gene in ragdoll hypertrophic cardiomyopathy". Genomics. 90 (2): 261–4. doi:10.1016/j.ygeno.2007.04.007. PMID 17521870.
- ^ "Genetics: Ragdoll Cat Hypertrophic Cardiomyopathy". North Carolina State University, College of Veterinary Medicine. Archived from the original on December 14, 2016. Retrieved December 29, 2016.
- ^ Schober K, Todd A (April 2010). "Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy". Journal of Veterinary Cardiology. 12 (1): 1–16. doi:10.1016/j.jvc.2009.09.004. PMID 20185379.
- ^ Fox PR, Keene BW, Lamb K, Schober KA, Chetboul V, Luis Fuentes V, et al. (May 2018). "International collaborative study to assess cardiovascular risk and evaluate long-term health in cats with preclinical hypertrophic cardiomyopathy and apparently healthy cats: The REVEAL Study". Journal of Veterinary Internal Medicine. 32 (3): 930–943. doi:10.1111/jvim.15122. PMC 5980443. PMID 29660848.
- ^ Fox PR, Keene BW, Lamb K, Schober KE, Chetboul V, Luis Fuentes V, et al. (November 2019). "Long-term incidence and risk of noncardiovascular and all-cause mortality in apparently healthy cats and cats with preclinical hypertrophic cardiomyopathy". Journal of Veterinary Internal Medicine. 33 (6): 2572–2586. doi:10.1111/jvim.15609. PMC 6872868. PMID 31605422.
- ^ Luis Fuentes V, Wilkie LJ (September 2017). "Asymptomatic Hypertrophic Cardiomyopathy: Diagnosis and Therapy" (PDF). The Veterinary Clinics of North America. Small Animal Practice. 47 (5): 1041–1054. doi:10.1016/j.cvsm.2017.05.002. PMID 28662873. Archived (PDF) from the original on 2021-01-22. Retrieved 2020-09-28.
- ^ Häggström J, Luis Fuentes V, Wess G (December 2015). "Screening for hypertrophic cardiomyopathy in cats". Journal of Veterinary Cardiology. 17 (Suppl 1): S134-49. doi:10.1016/j.jvc.2015.07.003. PMID 26776573.
- ^ Luis Fuentes V, Abbott J, Chetboul V, Côté E, Fox PR, Häggström J, et al. (May 2020). "ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats". Journal of Veterinary Internal Medicine. 34 (3): 1062–1077. doi:10.1111/jvim.15745. PMC 7255676. PMID 32243654.
- ^ Fox PR, Rush JE, Reynolds CA, Defrancesco TC, Keene BW, Atkins CE, et al. (September 2011). "Multicenter evaluation of plasma N-terminal probrain natriuretic peptide (NT-pro BNP) as a biochemical screening test for asymptomatic (occult) cardiomyopathy in cats". Journal of Veterinary Internal Medicine. 25 (5): 1010–6. doi:10.1111/j.1939-1676.2011.00776.x. PMID 21985136.
- ^ Wess G, Daisenberger P, Mahling M, Hirschberger J, Hartmann K (June 2011). "Utility of measuring plasma N-terminal pro-brain natriuretic peptide in detecting hypertrophic cardiomyopathy and differentiating grades of severity in cats". Veterinary Clinical Pathology. 40 (2): 237–44. doi:10.1111/j.1939-165X.2011.00305.x. PMID 21434959.
- ^ Borgeat K, Connolly DJ, Luis Fuentes V (December 2015). "Cardiac biomarkers in cats" (PDF). Journal of Veterinary Cardiology. 17 (Suppl 1): S74-86. doi:10.1016/j.jvc.2015.08.001. PMID 26776596. Archived (PDF) from the original on 2020-03-07. Retrieved 2020-09-28.
- ^ Hanås S, Holst BS, Höglund K, Häggström J, Tidholm A, Ljungvall I (May 2020). "Effect of feline characteristics on plasma N-terminal-prohormone B-type natriuretic peptide concentration and comparison of a point-of-care test and an ELISA test". Journal of Veterinary Internal Medicine. 34 (3): 1187–1197. doi:10.1111/jvim.15754. PMC 7255655. PMID 32200578.
- ^ Machen MC, Oyama MA, Gordon SG, Rush JE, Achen SE, Stepien RL, et al. (December 2014). "Multi-centered investigation of a point-of-care NT-proBNP ELISA assay to detect moderate to severe occult (pre-clinical) feline heart disease in cats referred for cardiac evaluation". Journal of Veterinary Cardiology. 16 (4): 245–55. doi:10.1016/j.jvc.2014.09.002. PMID 25456274.
- ^ Harris AN, Beatty SS, Estrada AH, Winter B, Bohannon M, Sosa I, et al. (July 2017). "Investigation of an N-Terminal Prohormone of Brain Natriuretic Peptide Point-of-Care ELISA in Clinically Normal Cats and Cats With Cardiac Disease". Journal of Veterinary Internal Medicine. 31 (4): 994–999. doi:10.1111/jvim.14776. PMC 5508306. PMID 28617995.
- ^ MacDonald KA, Kittleson MD, Larson RF, Kass P, Klose T, Wisner ER (2006). "The effect of ramipril on left ventricular mass, myocardial fibrosis, diastolic function, and plasma neurohormones in Maine Coon cats with familial hypertrophic cardiomyopathy without heart failure". Journal of Veterinary Internal Medicine. 20 (5): 1093–105. doi:10.1111/j.1939-1676.2006.tb00707.x. PMID 17063701.
- ^ "The Fragile Fate of FATEs: The Management and Prognosis of Feline Aortic Thromboembolism". Massachusetts Society for the Prevention of Cruelty to Animals-Angell. Archived from the original on October 9, 2018. Retrieved October 8, 2016.
- ^ Borgeat K, Wright J, Garrod O, Payne JR, Fuentes VL (2014). "Arterial thromboembolism in 250 cats in general practice: 2004-2012". Journal of Veterinary Internal Medicine. 28 (1): 102–8. doi:10.1111/jvim.12249. PMC 4895537. PMID 24237457.
- ^ Smith B (2013-07-26). "Silverback gorilla Rigo died of heart failure at Melbourne Zoo". The Age. Archived from the original on 2017-01-03. Retrieved 2013-07-26.


