시아노박테리아
Cyanobacteria| 시아노박테리아 시간 범위: | |
|---|---|
 | |
| 시아노박테리아의 필라멘트속인 Bylindrospermum의 현미경 이미지 | |
| 과학적 분류 | |
| 도메인: | 박테리아 |
| 클레이드: | 테라박테리아 |
| (순위 없음): | 시아노박테리아-멜라인박테리아군 |
| 문: | 시아노박테리아 스타니어, 1973 |
| 클래스: | 키아노피과 |
| 주문서[3] | |
| 동의어 | |
| 목록.
| |
시아노박테리아(/sa ɪˌæno ʊb æk ˈt ɪə리).ə/) 또는 시아노박테리아타(Cyanobacteriota) 또는 시아노피타(Cyanophyta)라고도 불리는 그람 음성 박테리아의 문입니다.시아노박테리아라는 이름은 그것들의 색깔(고대 그리스 νοςα κύ (쿠아노스) '파란색'에서 유래)을 가리키는데, 이것은 시아노박테리아의 일반적인 이름인 남조류의 기본을 형성하지만, 그것들은 보통 과학적으로 조류로 분류되지는 않습니다.그들은 민물이나 육지 환경에서 기원한 것으로 보입니다.[10]부생리학적이고 가장 기초적인 그룹의 제안된 이름인 세리시토크로마티아는 비광합성 그룹인 멜라이나박테리아와 또한 옥시광합성이라고 불리는 광합성 시아노박테리아의 조상입니다.[11]
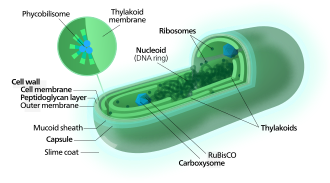
시아노박테리아는 빛으로부터 에너지를 흡수하는 카로티노이드, 피코빌린, 그리고 다양한 형태의 엽록소와 같은 광합성 색소를 사용합니다.이종영양 원핵생물과는 달리, 시아노박테리아는 내부 막을 가지고 있습니다.이것들은 광합성이 이루어지는 틸라코이드라고 불리는 납작한 주머니입니다.[12][13]녹색 식물과 같은 광영양 진핵생물은 시아노박테리아에 그들의 조상이 있는 것으로 생각되는 플라스티드에서 광합성을 수행하며, 이는 오래 전에 내생식증이라고 불리는 과정을 통해 획득되었습니다.진핵생물의 이러한 내공생성 시아노박테리아는 진화하여 엽록체, 발색체, 에티오플라스트, 류코플라스트와 같은 특수한 소기관으로 분화되었으며, 이는 집단적으로 플라스티즈로 알려져 있습니다.
시아노박테리아는 산소를 생산한 것으로 알려진 최초의 생물체입니다.광합성의 부산물로 산소를 생산하고 방출함으로써, 시아노박테리아는 초기의 산소가 부족했던 것을 산화적인 것으로 전환시킨 것으로 생각되며, 대기를 산화적인 것으로 환원시키고,[14] 대산화 사건과 지구의 생명체 구성을 극적으로 변화시켰습니다.[15]
시아노박테리아 Synechocystis와 Cyanothece는 바이오 에탄올 생산, 식용 착색제, 인간 및 동물 식품의 공급원, 식이 보충제 및 원료에 대한 바이오 기술에 잠재적인 응용을 가진 중요한 모델 생물입니다.[16]시아노박테리아는 인간과 동물에게 위험을 줄 수 있는 시아노톡신으로 알려진 다양한 독소를 생산합니다.
개요

시아노박테리아는 광자위축 원핵생물의 매우 크고 다양한 문입니다.[18]그들은 독특한 색소의 조합과 산소 광합성을 하는 능력에 의해 정의됩니다.그들은 종종 다양한 형태를 취할 수 있는 식민지 집합체에서 삽니다.[19]특히 관심을 끄는 것은 필라멘트 종으로 온천, 초염수, 사막, 극지방과 같은 극한 환경에서 발견되는 미생물 매트의 상층부를 지배하지만 [20]더 평범한 환경에서도 널리 분포합니다.[21]
시아노박테리아는 저산소 환경 조건에 진화적으로 최적화된 광합성 세균의 한 집단입니다.[22]일부 종은 질소를 고정시키고 다양한 습윤 토양과 물에서 자유롭게 또는 식물 또는 이끼를 형성하는 균류와 공생 관계에 있습니다.[23]그들은 단세포에서 필라멘트에 이르기까지 다양하고 식민지 종을 포함합니다.식민지는 필라멘트, 시트, 또는 심지어 속이 빈 구체를 형성할 수도 있습니다.

시아노박테리아는 전세계적으로 널리 퍼져있는 광합성 원핵생물이며 전세계적인 생물 지구화학 순환에 주요한 기여를 합니다.[24]그들은 유일한 산소광합성 원핵생물이며, 다양하고 극단적인 서식지에서 번성합니다.[25]그들은 적어도 21억년 전으로 거슬러 올라가는 화석 기록을 가진 지구상에서 가장 오래된 생물체 중 하나입니다.[26]그 이후로, 시아노박테리아는 지구 생태계에서 필수적인 역할을 해왔습니다.플랑크톤성 시아노박테리아는 해양 먹이 그물의 기본적인 구성 요소이며 전 지구적인 탄소와 질소 흐름의 주요 원인입니다.[27][28]일부 시아노박테리아는 유해한 녹조를 형성하여 마이크로시스틴, 삭시톡신, 실린더로스퍼모프신과 같은 강력한 독소(시아노톡신)의 생성으로 수생태계 서비스를 방해하고 야생동물과 인간을 중독시킵니다.[29][30]오늘날, 청록균 꽃은 수생 환경과 공중 보건에 심각한 위협이 되고 있으며, 전 세계적으로 그 빈도와 규모가 증가하고 있습니다.[31][24]
시아노박테리아는 해양 환경에서 어디에나 존재하며 주요 생산지로서 중요한 역할을 합니다.그들은 현재 지구 전체 주요 생산의 거의 절반을 기여하고 있는 해양 식물 플랑크톤의 일부입니다.[32]전 세계 해양 1차 생산의 약 25%가 시아노박테리아에 의해 기여됩니다.[33]
시아노박테리아 내에서는 몇 개의 계통만이 바다를 식민지로 삼았습니다.크로코스포라와 동족, 시아노박테리움 UCYN-A, 트리코데스뮴, 프로클로로코커스, 시네코커스.[34][35][36][37]이러한 계통에서 질소 고정 시아노박테리아는 질소 가스를 암모늄으로 전환하여 [34]1차 생산성을 조절하고 유기 탄소를 심해로 수출함으로써 나중에 아미노산과 단백질을 만드는 데 사용되기 때문에 특히 중요합니다.해양 피코시아노박테리아(Prochlorococcus 및 Synechococcus)는 현대 해양에서 대부분의 식물 플랑크톤 집합체를 수적으로 지배하여 1차 생산성에 중요한 기여를 합니다.[36][37][38]일부 플랑크톤성 시아노박테리아는 단세포이고 자유로운 살아있는 세포(예: 크로코스포라, 프로클로로코커스, 시네코코커스)인 반면, 다른 것들은 코콜리토포어와 같은 합생식물 조류와 공생 관계를 맺었습니다.[35]필라멘트 형태 중에서 트리코데스뮴은 자유 생물이며 골재 형태를 만듭니다.그러나 필라멘트 헤테로고리 형성 시아노박테리아(예: 리첼리아, 칼로스릭스)는 헤미아울루스, 리조솔레니아 및 카이토케로스와 같은 규조류와 관련되어 발견됩니다.[39][40][41][42]
해양 시아노박테리아는 알려진 가장 작은 광합성 생물을 포함합니다.가장 작은 프로클로로코커스는 지름이 0.5에서 0.8 마이크로미터에 불과합니다.[43]개체수 측면에서, 프로클로로코커스는 아마도 지구상에서 가장 풍부한 속일 것입니다: 바닷물 한 밀리리터는 이 속의 100,000개 혹은 그 이상의 세포를 포함할 수 있습니다.전 세계적으로 수 백억 명의 사람들이27 있는 것으로 추정됩니다.[44]프로클로로코커스는 위도 40°N에서 40°S 사이에 어디에나 존재하며, 해양의 올리고트로피 (영양이 부족한) 지역에서 지배적입니다.[45]이 박테리아는 지구 대기 중 산소의 약 20%를 차지합니다.[46]
형태학
시아노박테리아는 단세포와 필라멘트 형태에서 식민지 형태에 이르기까지 형태학적으로 다양합니다.필라멘트 형태는 헤테로시스트(질소 고정용), 키네티스(정지 단계 세포) 및 호르몬(생식, 운동성 필라멘트)과 같은 기능적 세포 분화를 나타냅니다.이것들은, 그것들이 가지고 있는 세포간 연결과 함께, 다세포성의 첫번째 신호로 여겨집니다.[47][48][49][24]
많은 시아노박테리아는 호르몬이라고 불리는 운동성 세포 필라멘트를 형성하는데, 이것은 주요 바이오매스로부터 떨어져 다른 곳에서 싹을 틔우고 새로운 집단을 형성합니다.[50][51]호르모고늄의 세포는 식물 상태보다 얇은 경우가 많으며, 운동성 사슬의 양쪽 끝에 있는 세포는 가늘어질 수 있습니다.부모 집단으로부터 벗어나기 위해, 호르모고늄은 종종 네크리듐이라고 불리는 필라멘트의 약한 세포를 찢어야 합니다.

• 비헤테로시테우스: (c) Arthrospira maxima,
일부 필라멘트 종들은 몇 가지 다른 세포 유형으로 분화할 수 있습니다.
- 식물 세포 – 양호한 성장 조건에서 형성되는 정상적인 광합성 세포
- 아키네티스 – 환경 조건이 가혹해지면 형성될 수 있는 기후 저항성 포자
- 두꺼운 벽을 가진 헤테로시스트 – 산소에 민감하기 때문에 혐기성 환경에서 질소 고정에[53][54][55] 필수적인 효소인 질소 분해 효소를 함유하고 있습니다.[55]
각각의 개별 세포(각각의 시아노박테리아)는 일반적으로 두껍고 젤라틴질의 세포벽을 갖습니다.[56]편모가 부족하지만 일부 종의 호르몬은 표면을 따라 활공하면서 움직일 수 있습니다.[57]다수의 다세포 필라멘트 형태의 오실레이터는 파동 운동이 가능합니다. 필라멘트는 앞뒤로 진동합니다.물기둥에서, 일부 시아노박테리아는 고균에서처럼 가스 소포를 형성함으로써 떠다닙니다.[58]이 소포들은 그와 같은 소기관이 아닙니다.그것들은 지질막에 의해서 경계가 되는 것이 아니라, 단백질 피복에 의해서 경계가 지어집니다.
질소고정

일부 시아노박테리아는 헤테로시스트라고 불리는 특수한 세포에 의해 대기 질소를 혐기성 조건에서 고정시킬 수 있습니다.[54][55]또한 고정 질소가 부족할 때 적절한 환경 조건(무산소)에서 헤테로시스트가 형성될 수 있습니다.헤테로시스트 형성종은 질소 고정에 특화되어 있으며, 질소 가스를 암모니아로 고정시킬 수 있습니다(NH3), 식물에 의해 흡수되어 단백질과 핵산으로 전환될 수 있는 질산염(NO-2) 또는 질산염(NO-3). 대기 질소는 내생균 질소 고정 박테리아, 특히 파바과(Fabaceae)를 가진 것을 제외하고는 식물이 생물학적으로 이용할 수 없습니다.
논 물 속에는 자유롭게 살아있는 시아노박테리아가 존재하며, 시아노박테리아는 녹조인 차라의 표면에 착생식물로 자라 질소를 고정시킬 수 있습니다.[59]아나베나(수생 양치식물 아졸라의 합성어)와 같은 시아노박테리아는 바이오 비료와 함께 벼 재배지를 제공할 수 있습니다.[60]
광합성

탄소고정
시아노박테리아는 빛의 에너지가 이산화탄소로부터 유기화합물을 합성하는데 사용되는 과정인 광합성을 촉진하기 위해 햇빛의 에너지를 사용합니다.이들은 일반적으로 수생생물이기 때문에 무기탄소2(CO 또는 중탄산염)의 획득을 돕기 위해 "CO2 농축 메커니즘"으로 통칭되는 다양한 방법을 사용합니다.더 구체적인 전략 중 하나는 카르복시좀으로 알려진 박테리아 미세 구획이 널리 보급되는 것인데,[62] 카르복시좀은 CO와2 중탄산염의 활성 수송체와 협력하여 중탄산염을 세포의 세포질에 축적하는 것입니다.[63]카르복시솜은 지름이 수백 나노미터가 될 수 있는 우리와 같은 구조로 조립되는 육면체의 껍질 단백질로 구성된 정이십면체 구조입니다.이러한 구조는 CO 고정2 효소인 RuBisCO를 껍질 내부에 고정시키고, 탄산 무수 효소를 이용하여 국부적인 CO2 농도를 증가시키고, 따라서 RuBis의 효율을 증가시키는 대사 채널링을 이용하여 탄소 무수 효소를 결합시키는 것으로 생각됩니다.CO 효소.[64]
전자수송
보라색 박테리아와 다른 박테리아가 산소 광합성을 하는 것과는 대조적으로, 시아노박테리아의 틸라코이드 막은 플라즈마 막과 연속적이지 않고 분리된 구획입니다.[65]광합성 기계는 대부분의 시아노박테리아에서 관찰되는 녹색 색소(450 nm에서 660 nm의 파장으로)를 제공하며, 파이코빌리좀이 빛을 얻는 더듬이 역할을 하는 틸라코이드 막에 내장되어 있습니다.[66]
물로부터 유도된 고에너지 전자의 대부분은 시아노박테리아 세포에 의해 그들의 필요를 위해 사용되지만, 이러한 전자의 일부는 전기유전 활성을 통해 외부 환경에 기부될 수 있습니다.[67]
호흡
시아노박테리아의 호흡은 광합성과 함께 틸라코이드 막에서 일어날 수 있으며,[68] 광합성 전자 수송은 호흡 전자 수송의 구성 요소와 같은 구획을 공유합니다.광합성의 목표가 이산화탄소로부터2 탄수화물을 생성함으로써 에너지를 저장하는 것이지만, 탄수화물이 에너지 방출을 수반하여 다시 이산화탄소로2 전환되면서 호흡은 그 반대입니다.
시아노박테리아는 호흡 사슬의 구성 요소만을 포함하는 그들의 혈장 막으로 이 두 과정을 분리하는 것으로 보이는 반면, 틸라코이드 막은 서로 연결된 호흡 및 광합성 전자 수송 사슬을 가지고 있습니다.[68]시아노박테리아는 호흡을 위해 NADPH보다 석신산 탈수소효소의 전자를 사용합니다.[68]
시아노박테리아는 전자 수송에 사용되는 시설들이 빛을 받는 동안 광합성을 위해 역으로 사용되기 때문에 밤 동안(또는 어둠 속)에만 호흡합니다.[69]
전자수송사슬
많은 시아노박테리아는 호기성 조건에서 질소와 이산화탄소를 줄일 수 있는데, 이것이 진화적이고 생태적인 성공에 책임이 있을지도 모르는 사실입니다.물을 산화시키는 광합성은 광계(PS) II와 I(Z-scheme)의 활성을 결합함으로써 이루어집니다.하나의 광계만 사용하는 녹색 황세균과 달리, 물을 전자 공여체로 사용하는 것은 두 개의 광계가 필요한 에너지 요구 사항입니다.[70]
틸라코이드 막에 부착된 피코빌리좀은 광계를 위한 광수확 안테나 역할을 합니다.[71]피코빌리좀 성분(피코빌리단백질)은 대부분의 시아노박테리아의 청록색 색소화의 원인입니다.[72]이 주제에 대한 변화는 주로 세포에 붉은 갈색을 띠게 하는 카로티노이드와 피코에리트린 때문입니다.일부 시아노박테리아에서 빛의 색은 피코빌리좀의 구성에 영향을 미칩니다.[73][74]녹색 빛에서는 세포가 녹색 빛을 흡수하는 피코에리트린을 더 많이 축적하는 반면, 적색 빛에서는 적색을 흡수하는 피코시아닌을 더 많이 생산합니다.따라서, 이 박테리아들은 녹색 빛에 노출되느냐 아니면 적색 빛에 노출되느냐에 따라 벽돌색에서 밝은 청록색으로 변할 수 있습니다.[75]이러한 "상보적 색 적응"의 과정은 세포가 광합성을 위해 사용 가능한 빛의 사용을 극대화하는 방법입니다.
몇몇 속들은 피코빌리좀이 부족하고 대신 엽록소 b를 가지고 있습니다(Prochloron, Prochlorococcus, Prochlorothrix.이것들은 원래 프로클로로피테스 또는 클로록시박테리아로 함께 분류되었지만, 몇몇 다른 계통의 시아노박테리아에서 발달한 것으로 보입니다.이러한 이유로, 그들은 현재 시아노박테리아 그룹의 일부로 여겨집니다.[76][77]
신진대사
일반적으로 시아노박테리아의 광합성은 물을 전자 공여체로 사용하고 부산물로 산소를 생산하지만, 일부는 황화수소를[78] 자주색 황균과 같은 다른 광합성 박테리아 사이에서 발생하는 과정을 사용할 수도 있습니다.
캘빈 회로를 통해 이산화탄소는 탄수화물을 형성하기 위해 감소됩니다.[79]대기 중의 많은 양의 산소는 고대 시아노박테리아의 활동에 의해 처음 만들어진 것으로 여겨집니다.[80]그들은 종종 균류(지의류), 산호, 익충류(아졸라), 속씨식물(거네라) 등과 같은 다른 생물군과 공생하는 것으로 발견됩니다.[81]시아노박테리아의 탄소 대사에는 불완전한 크렙스 사이클,[82] 오탄당 인산 경로, 해당과정이 포함됩니다.[83]
이종영양증 성장이 가능한 그룹이 있는 반면,[84] 다른 그룹들은 기생하여 무척추동물이나 해조류에 질병을 유발합니다([85][86][87]예: 흑대병).
생태학

시아노박테리아는 바다, 민물, 습한 토양, 사막의 일시적으로 습윤된 암석, 맨 바위와 토양, 심지어 남극의 암석 등 거의 모든 육상 및 수중 서식지에서 발견될 수 있습니다.그들은 플랑크톤 세포로 발생하거나 광영양 생물막을 형성할 수 있습니다.그들은 (내생대의 생태계에서) 돌과 껍질 안에서 발견됩니다.[89]일부는 이끼, 식물, 다양한 보호자 또는 해면동물에 있는 내상징이며 숙주에게 에너지를 제공합니다.일부는 나무늘보의 털 속에서 살며, 위장의 형태를 제공합니다.[90]
수생 시아노박테리아는 민물과 해양 환경 모두에서 형성될 수 있는 광범위하고 눈에 잘 띄는 꽃으로 알려져 있습니다.꽃은 청록색 물감이나 찌꺼기처럼 보일 수 있습니다.이 꽃들은 독성이 있을 수 있고, 종종 발견되면 휴양지의 폐쇄로 이어집니다.해양 박테리오파지는 단세포 해양 시아노박테리아의 중요한 기생충입니다.[91]
시아노박테리아의 성장은 물이 잔잔하고 난류 혼합이 거의 없는 연못과 호수에서 선호됩니다.[92]물줄기가 흐르는 물줄기나 분수의 출렁이는 물줄기에 의해 물이 자연적으로 혹은 인위적으로 섞일 때 그들의 생명 주기는 방해를 받습니다.이런 이유로 시아노박테리아의 꽃은 물이 천천히 흐르지 않는 한 강에서 거의 생기지 않습니다.또한 Microcystis 종들이 규조류와 녹조류를 능가하고 독소의 발생을 가능하게 하는 더 높은 온도에서 성장하는 것이 좋습니다.[92]
환경 추세에 근거하여, 모델과 관찰에 따르면 시아노박테리아는 수중 환경에서 그들의 지배력을 증가시킬 가능성이 있습니다.이는 심각한 결과를 초래할 수 있으며, 특히 식수 공급원의 오염을 초래할 수 있습니다.로버트 고든 대학의 린다 로튼을 포함한 연구원들은 이것들을 연구하기 위한 기술들을 개발했습니다.[93]시아노박테리아는 주로 필터(종종 큰 모래층과 유사한 매체)를 꽂고 섭취하면 심각한 질병을 일으킬 가능성이 있는 시아노톡신을 생성함으로써 다양한 방식으로 수처리를 방해할 수 있습니다.또한 수산업 및 폐기물 관리 관행에도 영향을 미칠 수 있습니다.인위적인 부영양화, 온도 상승, 수직 층화, 대기 이산화탄소 증가는 수생태계의 지배력을 증가시키는 시아노박테리아의 원인이 됩니다.[94]

시아노박테리아는 육상 서식지에서 중요한 역할을 하는 것으로 밝혀졌습니다.시아노박테리아의 토양 지각이 토양을 안정시켜 침식을 방지하고 물을 유지하는 데 도움을 준다는 것이 널리 보고되었습니다.[95]그렇게 하는 시아노박테리아 종의 예로는 Microcoleus vaginatus가 있습니다.M. vaginatus는 모래 입자에 결합하여 물을 흡수하는 다당류 피복을 이용하여 토양을 안정화 시킵니다.[96]
이 유기체들 중 일부는 지구 생태학과 산소 순환에 상당한 기여를 합니다.작은 해양성 시아노박테리움 프로클로로코커스는 1986년에 발견되었으며, 공해의 광합성의 절반 이상을 차지합니다.[97]생체리듬은 한때 진핵세포에만 존재하는 것으로 여겨졌지만 많은 시아노박테리아는 박테리아 생체리듬을 보여줍니다.
"시아노박테리아는 거의 틀림없이 지구상에서 가장 성공적인 미생물 집단입니다.그들은 유전적으로 가장 다양합니다; 그들은 민물, 해양, 그리고 육상 생태계에 널리 퍼져 있는, 모든 위도에 걸쳐 광범위한 서식지를 차지하고, 온천, 염전, 그리고 초염수 만과 같은 가장 극지방에서 발견됩니다.산소를 생성하는 광자위축성 시아노박테리아는 행성의 초기 대기에서 호기성 대사와 진핵 광합성의 진화를 이끌었던 환경을 만들었습니다.시아노박테리아는 전 세계의 바다에서 중요한 생태학적 기능을 수행하며 전 세계 탄소 및 질소 예산에 중요한 기여를 하고 있습니다." – Stewart and Falconer[98]
시아노비온츠

시아노박테리아에 의한 잎과 뿌리의 콜로니얼
(2) 뿌리 표면에서 시아노박테리아는 두 가지 유형의 식민지 패턴을 보이는데, 뿌리털에서 Anabaena 종과 Nostoc 종의 필라멘트가 느슨한 군락을 형성하고 뿌리 표면의 제한 구역에서 특정 Nostoc 종들이 시아노박테리아 군락을 형성합니다.
(3) 2,4-D 및 Nostoc spp와의 공동 접종.파라 nodule 형성과 질소 고정을 증가시킵니다.많은 수의 Nostoc spp. 분리체들은 뿌리 내층을 식민지화하고 파라-결절들을 형성합니다.[99]
일부 시아노박테리아, 소위 시아노박테리아(시아노박테리아 공생체)는 단세포 및 다세포인 다른 생물체와 공생 관계를 갖습니다.[100]오른쪽에 도시된 것처럼, 시아노박테리아는 육상 식물과 공생적으로 상호작용하는 많은 예들이 있습니다.[101][102][103][104]시아노박테리아는 기공을 통해 식물로 들어가 세포간 공간을 식민지화하여 고리와 세포내 코일을 형성할 수 있습니다.[105]Anabaena spp. 밀과 목화 식물의 뿌리를 식민지화합니다.[106][107][108]칼로스트릭스 sp.밀의 뿌리 체계에서도 발견되었습니다.[107][108]Nostoc spp.는 밀과 쌀과 같은 단공류를 식민지화하였고,[109][110][111][112] 1991년 Ganther 등은 Nostoc, Anabaena 및 Cylindrospermum을 포함한 다양한 이종 질소 고정 시아노박테리아를 식물 뿌리 및 토양에서 분리하였습니다.밀 모종 뿌리에 대한 평가는 Anabaena에 의한 뿌리털의 느슨한 식민지화와 Nostoc에 의한 제한된 구역 내에서의 뿌리 표면의 촘촘한 식민지화의 두 가지 유형의 연관성 패턴을 나타냈습니다.[109][99]

(a) O. 공생실이라 불리는 신굴의 상하 거들 목록(검은 화살촉)에 수많은 시안비온이 존재하는 웅장한 모습.
(b) 공생실에 서식하는 수많은 시아노비온을 가진 O. 스타이니이.
(c) (b)의 영역 확대는 이진 가로 핵분열(흰색 화살표)에 의해 분할되는 두 개의 시안비온을 보여줍니다.

일부 질소 고정 시아노박테리아(다이아조트로프)가 특히 질소가 제한된 올리고영양 해양에서 1차 생산에 중요한 역할을 하기 때문에, 시아노비온트(시아노박테리아 공생)와 프로티스탄트 숙주 사이의 관계는 특히 주목할 만하다.[113][114][115]시아노박테리아는 피코 크기의 Synechococcus와 Prochloroccus가 대부분 분포하고 있으며, 지구상에서 가장 풍부한 광합성 생물로 해양 생태계에 고정되어 있는 전체 탄소의 4분의 1을 차지하고 있습니다.[38][116][45]자유롭게 사는 해양 시아노박테리아와는 대조적으로, 일부 시아노비온트는 숙주에서 탄소 고정보다는 질소 고정을 담당하는 것으로 알려져 있습니다.[117][118]그러나, 대부분의 시안바이온트의 생리학적 기능은 알려지지 않은 채로 남아있습니다.시아노비온트는 다이노편모충류, 틴티니드류, 방사선학자, 아메배류, 규조류, 그리고 합생동물을 포함한 많은 원생동물 집단에서 발견되었습니다.[119][120]이러한 시아노바이온트 중에서 특히 다이노편모충 숙주와 관련하여 관련된 공생의 성질(예: 유전적 다양성, 숙주 또는 시아노바이온트 특이성, 시아노바이온트 계절성)에 대해서는 거의 알려져 있지 않습니다.[100]
집단행동

일부 시아노박테리아는 – 심지어 단세포 박테리아도 – 눈에 띄는 집단 행동을 보이며 물 위에 뜰 수 있고 중요한 생태학적 역할을 할 수 있는 집단 (또는 꽃)을 형성합니다.예를 들어, 수십억 년 전에, 해양 고생대성 청록균의 공동체는 탄소 화합물을 매장하고 대기 중에 산소를 최초로 축적할 수 있도록 함으로써 우리가 알고 있는 것처럼 생물권을 형성하는 데 도움을 줄 수 십억 년 전에.[122]한편, 독성 청록균 꽃은 독성이 동물에게 해로울 수 있기 때문에 사회적으로 증가하는 이슈입니다.[31]극단적인 개화는 또한 산소의 물을 고갈시키고 햇빛의 침투와 가시성을 감소시켜 빛에 의존하는 종들의 먹이와 교미 행동을 손상시킬 수 있습니다.[121]
오른쪽 그림처럼 박테리아는 개별 세포로서 현탁액에 머물 수 있고, 표면에 집단적으로 부착되어 생물막을 형성하거나, 수동적으로 침전물을 형성하거나, 응집하여 현탁액 응집체를 형성할 수 있습니다.시아노박테리아는 유황 다당류(세포 덩어리를 둘러싸고 있는 노란색 연무)를 생성할 수 있으며, 이는 그들이 떠다니는 응집체를 형성할 수 있게 합니다.2021년에 마에다 등은 시아노박테리아에 의해 생성된 산소가 다당류와 세포의 네트워크에 갇히게 되어 미생물이 부유성 꽃을 형성할 수 있다는 것을 발견했습니다.[123]pili로 알려진 특정한 단백질 섬유는 세포들을 서로 또는 표면에 연결하는 추가적인 방법으로 작용할 수 있다고 생각됩니다.일부 시아노박테리아는 또한 부유 보조제로서 정교한 세포내 가스 소포를 사용합니다.[121]


위의 왼쪽 도표는 미생물 분포, 공간 조직, 탄소 및2 O 사이클링의 제안된 모델을 보여줍니다. (a) 덩어리는 더 밀도가 높은 청록균 필라멘트와 이형영양 미생물을 포함합니다.밀도의 초기 차이는 시아노박테리아 운동성에 따라 달라지며 짧은 시간에 걸쳐 확립될 수 있습니다.덩어리 외부의 짙은 파란색은 덩어리에 인접한 부분의 산소 농도가 높다는 것을 나타냅니다.산소 매체는 덩어리를 떠나기 시작하는 필라멘트의 반전 주파수를 증가시켜 덩어리에서 멀어지는 순 이동을 줄입니다.이것은 짧은 시간 스케일에서 초기 덩어리의 지속성을 가능하게 합니다. (b) 덩어리에서 광합성과 호흡 사이의 공간적 결합.시아노박테리아에 의해 생성된 산소는 위의 배지로 확산되거나 호기성 호흡에 사용됩니다.용해된 무기 탄소(DIC)는 위의 매질로부터 덩어리 내로 확산되고, 또한 호흡에 의해 덩어리 내에서 생성됩니다.산소 용액에서 높은2 O 농도는 CO2 고정의 효율성을 감소시키고 글리콜레이트의 배설을 초래합니다.이러한 조건에서, 뭉침은 뭉침 내에서 시아노박테리아에 의한 탄소의 보유와 무기 탄소의 동화를 자극한다면 시아노박테리아에 이로울 수 있습니다.이 효과는 입자성 유기 탄소(세포, 피복 및 이종영양생물)의 덩어리 축적을 촉진하는 것으로 보입니다.[124]
왜 그리고 어떻게 시아노박테리아가 공동체를 형성하는지는 불명확합니다.응집은 일반적으로 다량의 세포 외 물질의 생산을 수반하기 때문에 더 많은 시아노박테리아를 만드는 핵심 사업에서 자원을 전환해야 합니다.게다가, 조밀한 골재의 중심에 있는 세포들은 또한 음영과 영양분의 부족으로 고통 받을 수 있습니다.[125][126]그렇다면, 이 공동생활이 시아노박테리아에 어떤 이점을 가져다 줄까요?[121]

시아노박테리아가 어떻게 꽃을 형성하는지에 대한 새로운 통찰력은 시아노박테리아 Synechocystis에 대한 2021년 연구에서 비롯되었습니다.이것들은 종종 해양 조류와 동물 조직에서 발견될 수 있는 황산 그룹으로 변형된 설탕 분자의 사슬인 황화 다당류의 생산과 수출을 조절하는 유전자 세트를 사용합니다.많은 박테리아가 세포 외 다당류를 생성하지만, 황화된 박테리아는 오직 시아노박테리아에서만 볼 수 있습니다.Synechocystis에서 이러한 황화된 다당류는 세포와 다당류의 끈적끈적한 거미줄에 산소 기포를 가둠으로써 시아노박테리아가 부력있는 응집체를 형성하는 것을 돕습니다.[123][121]
Synechocystis에 대한 이전의 연구들은 시아노박테리아의 표면을 장식하는 타입 IV pili가 꽃을 형성하는 역할도 한다는 것을 보여주었습니다.[128][125]이러한 수축성 및 접착성 단백질 섬유는 운동성, 기질에 대한 접착력 및 DNA 흡수에 중요합니다.[129]꽃의 형성은 타입 IV pili와 Synechan 둘 다를 필요로 할 수 있습니다 – 예를 들어, pili는 다당류를 세포 밖으로 내보내는 것을 도울 수 있습니다.실제로, 이러한 단백질 섬유의 활성은 필라멘트 시아노박테리아에서 세포 외 다당류의 생성과 관련이 있을 수 있습니다.[130]더 확실한 답은 pili가 세포들을 서로 또는 세포외 다당류와 결합시킴으로써 응집체를 형성하는 것을 돕는다는 것입니다.다른 종류의 박테리아와 마찬가지로,[131] pili의 특정 성분은 같은 종의 cyanobacteria가 서로를 인식하고 초기 접촉을 할 수 있게 할 수 있고, 그 후 세포 외 다당류 덩어리를 형성함으로써 안정화됩니다.[121]
마에다(Maeda) 등에 의해 발견된 기포 부유 메커니즘은 가스 소포를 사용하거나 탄수화물 밸러스트를 축적하는 것과 같은 시아노박테리아의 부력 조절을 가능하게 하는 다양한 공지된 방법에 합류합니다.[132]타입 IV pili 그 자체로도 점성 항력을 조절함으로써 물기둥에서 해양 시아노박테리아의 위치를 조절할 수 있었습니다.[133]세포 외 다당류는 부유 장치에서 식품 저장, 방어 메커니즘 및 이동 보조 장치에 이르기까지 시아노박테리아의 다목적 자산인 것으로 보입니다.[130][121]
세포사

시아노박테리아 환경생리학을 결정하는 가장 중요한 과정 중 하나는 세포사멸입니다.시아노박테리아에서 조절된 세포 사멸의 존재를 뒷받침하는 증거가 있으며, 다양한 형태의 세포 사멸은 생물학적 스트레스와 비생물학적 스트레스에 대한 반응으로 설명되어 왔습니다.그러나, 시아노박테리아의 세포사 연구는 비교적 젊은 분야이며, 이 근본적인 과정을 뒷받침하는 근본적인 메커니즘과 분자 기계에 대한 이해는 여전히 많은 부분이 어렵습니다.[24]그러나 해양 및 민물 시아노박테리아의 세포 사멸에 대한 보고는 이 과정이 미생물 군집의 생태에 주요한 영향을 미친다는 것을 나타냅니다./[135][136][137][138] 여러 스트레스 조건에서 시아노박테리아에서 다양한 형태의 세포 사멸이 관찰되었으며,[139][140] 세포 사멸은 다음과 같은 발달 과정에서 중요한 역할을 하는 것으로 제안되었습니다.키네틱과 헤테로시스트의 분화,[141][142][143][47][24] 그리고 인구 생존을 위한 전략.
시아노파지
시아노파지는 시아노박테리아를 감염시키는 바이러스입니다.시아노파지는 민물과 해양 환경 모두에서 발견될 수 있습니다.[144]해양과 민물 사이아노파지는 이중 가닥 DNA를 포함하는 정이십면체 머리를 가지고 있으며, 연결 단백질에 의해 꼬리에 붙어 있습니다.[145]머리와 꼬리의 크기는 시아노파지의 종에 따라 다릅니다.시아노파지는 다른 박테리오파지와 마찬가지로 브라운 운동에 의존하여 박테리아와 충돌한 후 수용체 결합 단백질을 사용하여 세포 표면 단백질을 인식하고, 이는 부착으로 이어집니다.수축된 꼬리를 가진 바이러스는 숙주 세포의 표면에서 고도로 보존된 단백질을 인식하기 위해 꼬리에 있는 수용체에 의존합니다.[146]
시아노파지는 다양한 종류의 시아노박테리아를 감염시키고 수생 환경에서 시아노박테리아 개체수의 주요 조절인자이며, 담수 및 해양 생태계에서 시아노박테리아의 꽃을 예방하는 데 도움을 줄 수 있습니다.이 꽃들은 인간과 다른 동물들에게 위험을 줄 수 있는데, 특히 부영양화된 담수호에서 그러합니다.이러한 바이러스에 의한 감염은 해양 환경에서 Synechococcus spp.에 속하는 세포에서 매우 널리 발생하는데, 해양 시아노박테리아 세포에 속하는 세포의 최대 5%가 성숙한 파지 입자를 포함하는 것으로 보고되었습니다.[147]
최초의 시아노파지인 LPP-1은 1963년에 발견되었습니다.[148]시아노파지는 박테리오파지과(예: AS-1, N-1), 포도비루스과(예: LPP-1) 및 시포비루스과(예: S-1)에 분류됩니다.[148]
움직임.

필라멘트 시아노박테리아가 표면 운동을 한다는 것은 오래 전부터 알려져 있었고, 이러한 운동은 유형 IV pili에서 비롯되었습니다.[149][130][150]또한, 해양 시아노박테리아인 Synechococcus는 박테리아 편모와 다른 메커니즘에 의해 25 μm/s의 속도로 헤엄치는 것으로 알려져 있습니다.[151]남세균 표면에 파도가 형성되는 것은 주변의 물을 뒤로 밀어내는 것으로 생각됩니다.[152][153]세포는 편모 운동을 수반하지 않는 새로운 특징 없는 비광택틱 수영 방법과[155] 활공 방법에[154] 의해 운동성이 있는 것으로 알려져 있습니다.
시아노박테리아의 많은 종들은 활공이 가능합니다.활공은 어떤 뚜렷한 외부 기관이나 세포 형태의 변화에 의존하지 않고 기질이 있을 때만 일어난다는 점에서 기어다니거나 헤엄치는 것과는 다른 세포 운동의 한 형태입니다.[156][157]필라멘트 형태의 시아노박테리아에서 활공하는 것은 추진력을 제공하는 수분을 공급함에 따라 세포가 빠르게 팽창하는 젤을 추출하는 "슬라임 제트" 메커니즘에 의해 동력을 받는 것처럼 보이지만,[158][159] 일부 단세포 시아노박테리아는 활공을 위해 유형 IV pili를 사용합니다.[160][21]
시아노박테리아는 엄격한 빛의 요구조건을 가지고 있습니다.빛이 너무 적으면 에너지 생산이 부족할 수 있고, 어떤 종에서는 세포가 이질영양 호흡에 의존하게 할 수도 있습니다.[20]너무 많은 빛은 세포를 억제하고, 광합성 효율을 떨어뜨리며, 탈색으로 인한 손상을 일으킬 수 있습니다.자외선은 시아노박테리아에 특히 치명적이며, 정상적인 태양 수준은 어떤 경우에는 이러한 미생물에 상당히 해롭습니다.[19][161][21]
미생물 매트에 서식하는 필라멘트 시아노박테리아는 광 손상에 대한 민감도와 광합성을 위한 빛 요구량의 균형을 맞추는 최적의 틈새를 찾기 위해 매트 내에서 수직 및 수평으로 이동하는 경우가 많습니다.예를 들어, 멕시코 게레로 니그로의 초염수 벤틱 매트에서 발견되는 필라멘트 시아노박테리아 오실레이터리아(Oscillatoria) sp.와 스피룰리나(Spirulina) 서브살사(subsalsa)는 강렬한 햇빛을 피해 낮에는 하층으로 이동하다가 해질녘에 수면 위로 떠오릅니다.[162]이와는 대조적으로, 프랑스 카마르그의 초염수 매트에서 발견되는 Microcoleus chthonoplastes의 개체수는 낮에는 매트의 상층부로 이동하고 밤에는 매트를 통해 균질하게 퍼집니다.[163]또한 포르미디움 운시나툼을 이용한 시험관 내 실험을 통해 이 종이 방사능 피해를 피하기 위해 이동하는 경향을 보여주었습니다.[19][161]이러한 이동은 일반적으로 일종의 사진 이동의 결과이지만, 다른 형태의 택시도 역할을 할 수 있습니다.[164][21]
광운동 – 입사광의 함수로서 세포 이동의 조절 – 은 시아노박테리아에 의해 그들의 환경에서 최적의 빛 조건을 찾는 수단으로 사용됩니다.광운동에는 광운동, 광택스, 광소포성 반응의 세 가지 유형이 있습니다.[165][166][167][21]
광동학적 미생물은 입사광 강도에 따라 활공 속도를 조절합니다.예를 들어, 포르미디움 어텀에일이 활공하는 속도는 입사광 강도에 따라 선형적으로 증가합니다.[168][21]
광유전증 미생물은 환경 내에서 빛의 방향에 따라 움직이며, 긍정적인 광유전증 종들은 빛과 대략 평행하게 그리고 광원을 향해 움직이는 경향이 있습니다.포르미듐 운시나툼과 같은 종들은 빛을 향해 직접 방향을 잡을 수 없지만, 그들이 올바른 방향으로 방향을 잡기 위해 무작위의 충돌에 의존하고, 그 후에 그들은 광원을 향해 더 많이 움직이는 경향이 있습니다.Anabaena variabilis와 같은 다른 것들은 트리홈을 구부려 조종할 수 있습니다.[169][21]
마지막으로, 광소포성 미생물은 공간적 및 시간적 광구배에 반응합니다.단계적 광공포증 반응은 생물이 더 어두운 영역에서 더 밝은 영역으로 들어갔다가 방향을 반대로 바꾸면서 밝은 빛을 피할 때 발생합니다.스텝다운 반응이라고 불리는 그 반대의 반응은 생물이 밝은 영역에서 어두운 영역으로 들어갔다가 방향을 반대로 바꾸어 빛에 남아있을 때 발생합니다.[21]
진화
지구사
−4500 — – — – −4000 — – — – −3500 — – — – −3000 — – — – −2500 — – — – −2000 — – — – −1500 — – — – −1000 — – — – −500 — – — – 0 — |
| |||||||||||||||||||||||||||||||||||||||||||||
스트로마톨라이트(stromatolite)는 미생물, 특히 시아노박테리아의 생물막(microbial mat)에 의한 퇴적 알갱이의 포획, 결합 및 시멘트화에 의해 얕은 물에서 형성되는 층상 생화학적 재량 구조체입니다.[170]
선캄브리아기 동안, 미생물의 스트로마톨라이트 군집은 대부분의 해양 환경과 포토존의 비해양 환경에서 성장했습니다.캄브리아기 해양동물의 폭발 이후 초식동물에 의한 스트로마톨라이트 매트의 방목은 해양 환경에서 스트로마톨라이트의 발생을 크게 감소시켰습니다.그 이후로, 그들은 주로 방목하는 무척추동물들이 살 수 없는 과염성 환경에서 발견됩니다 (예: 웨스턴 오스트레일리아의 샤크 베이).스트로마톨라이트는 3.5 Ga 전의 화석 유적에 의해 지구상의 생명체에 대한 고대의 기록을 제공합니다.[171]시아노박테리아의 가장 오래된 증거는 2.1 Ga 전으로 거슬러 올라가지만, 2.7 Ga 전으로 거슬러 올라가는 증거가 있습니다.[26]시아노박테리아도 3.5년 전에 출현했을 수도 있습니다.[172]대기 중 산소 농도는 2.4가 전까지 현재 수준의 약 1% 이하에 머물렀습니다(대산소화 사건).산소의 증가는 대기 중 메탄 농도의 감소를 일으켰을 수 있으며, 약 2.4에서 2.1 Ga 전에 휴로니아 빙하를 촉발시켰습니다.이런 식으로, 시아노박테리아는 그 당시의 다른 박테리아 대부분을 죽였을지도 모릅니다.[173]
온콜라이트는 시안균의 성장에 의해 형성된 층상 구조인 온코이드로 구성된 퇴적 구조입니다.온콜라이트는 스트로마톨라이트와 유사하지만, 기둥을 형성하는 대신에, 그것들은 그것들이 형성될 때 기저 기판에 부착되지 않은 대략적인 구형의 구조를 형성합니다.[174]온코이드는 종종 껍질 조각과 같은 중심핵 주위에 형성되고,[175] 미생물을 둘러싸서 탄산칼슘 구조가 축적됩니다.온콜라이트는 광수역의 따뜻한 물을 나타내는 지표이지만, 현대 담수 환경에서도 알려져 있습니다.[176]이 구조물들은 지름이 10cm를 넘는 경우가 거의 없습니다.
이전의 시아노박테리아 화석 분류 체계에서는 이 화석들을 포로스트로마타와 해면충으로 나누었습니다.이것들은 현재 형태 분류학으로 인식되고 분류학적으로 더 이상 쓸모가 없는 것으로 여겨지지만, 일부 저자들은 박테리아 화석의 형태와 구조를 설명하기 위해 비공식적으로 남아있는 용어들을 옹호해왔습니다.[177]
-
시아노박테리아에 의해 남겨진 스트로마톨라이트는 지구상에서 가장 오래된 생명체의 화석입니다.이 화석은 10억년 된 것입니다.
-
시아노박테리아에 의해 침전된 탄산칼슘의 연속된 층으로 형성된 정치적 석회석
-
네바다의 데본기 후기 알라모볼라이드 영향으로 인한 온콜라이트
-
광합성의 기원
우리가 알 수 있는 한, 산소광합성은 단 한 번 (원핵 남조류에서) 진화했고, 모든 광합성 진핵생물은 (모든 식물과 조류를 포함하여) 이 능력을 얻었습니다.다시 말해서, 호기성 생물이 대기를 호흡할 수 있도록 만드는 모든 산소는 원래 시아노박테리아나 그 후의 후손으로부터 옵니다.[179]
시아노박테리아는 원생대 에온 (2500–543 Ma) 기간 동안 주요 생산지로 남아 있었는데, 이는 바다의 산화 환원 구조가 질소 고정이 가능한 광자성영양소를 선호했기 때문입니다.녹조류는 원생대 말기에 대륙붕에서 주요한 주요 생산지로 합류했지만, 해양붕에서 다이노편모충, 코콜리토포리드, 규조류의 중생대 (251–65 Ma) 방사선으로만 주요 생산지가 현대적인 형태를 띠었습니다.시아노박테리아는 해양 회오리의 주요 생산지로서, 생물학적 질소 고정의 매개체로서, 그리고 변형된 형태로서, 해양 진핵 조류의 플라스티즈로서 해양 생태계에 매우 중요합니다.[180]
엽록체의 원산지
일차 엽록체는 광합성을 수행하는 데 특화된 일부 진핵생물 계통에서 발견되는 세포 소기관입니다.그들은 내공생성 청색 박테리아로부터 진화한 것으로 여겨집니다.[181][182]몇 년 간의 논쟁 끝에,[183] 이제는 주요 내생성 진핵생물의 세 개의 주요 그룹(즉, 녹색 식물, 홍조류, 녹조류)이 독특한 내생성 사건 이후에 진화한 아르카이플라스티다(Archaeplastida)라고 불리는 하나의 큰 단일 계통 그룹을 형성한다는 것이 일반적으로 받아들여지고 있습니다.[184][185][186][187]
엽록체와 시아노박테리아의 형태학적 유사성은 19세기[188] 독일 식물학자 안드레아스 프란츠 빌헬름 심퍼에 의해 처음 보고되었습니다. 엽록체는 식물과 조류에서만 발견되며,[189] 따라서 러시아 생물학자 콘스탄틴 메레슈코프스키가 1905년에 이 플라스티드의 공생 기원을 제안할 수 있는 길을 열었습니다.[190]린 마굴리스는 60년 이상 후에[191] 이 가설을 다시 주목하게 만들었지만, 이 아이디어는 보완적인 데이터가 축적되기 전까지는 완전히 받아들여지지 않았습니다.플라스티즈의 시아노박테리아 기원은 현재 다양한 계통발생학적,[192][184][187] [193]게놈적[194][195], 생화학적, 구조적 증거에 의해 뒷받침되고 있습니다.[196]시아노박테리움과 별도의 진핵생물 계통 사이의 또 다른 독립적이고 더 최근의 일차적인 내공생 사건에 대한 설명은 또한 플라스티즈의 내공생 기원에 대한 신뢰를 줍니다.[197]
이러한 일차적인 내생성 외에도, 많은 진핵생물 계통들은 2차 또는 심지어 3차 내생성 사건의 대상이 되어 왔습니다. 즉, 플라스틱을 가진 또 다른 진핵생물의 진핵생물에 의한 "마트료슈카와 같은" 삼킴입니다.[199][181]
엽록체는 원형 염색체, 원핵생물 형태의 리보솜, 광합성 반응 중심에 있는 유사한 단백질 등 시아노박테리아와 많은 유사점을 가지고 있습니다.[200][201]내공생체 이론은 광합성 박테리아가 초기 진핵세포에 의해 (내세포화에 의해) 첫 번째 식물 세포를 형성했다는 것을 암시합니다.그러므로, 엽록체는 식물 세포 안의 생명체에 적응한 광합성 박테리아일지도 모릅니다.미토콘드리아처럼 엽록체는 식물 숙주 세포의 핵 DNA와는 별개로 여전히 자신의 DNA를 가지고 있으며 이 엽록체 DNA 속 유전자는 시아노박테리아 속 유전자와 유사합니다.[202]엽록체의 DNA는 광합성 반응 중심과 같은 산화환원 단백질을 코드화합니다.CoRR 가설은 산화환원 조절을 위해 이 공동 위치가 필요함을 시사합니다.
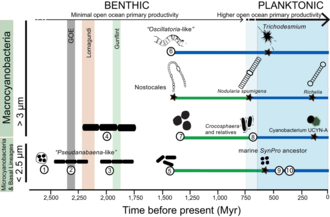
해양기원
| 시리즈의 일부(on) |
| 플랑크톤 |
|---|
 |
시아노박테리아는 지구의 지구화학을 근본적으로 변화시켰습니다.[206][203]지구화학적 증거의 여러 줄은 원생대(2,500–542 Mya)의 시작과 끝에서 심각한 지구 환경 변화의 간격의 발생을 뒷받침합니다.[207][208][209] 초기 화석 기록에 분자 산소의 존재가 시아노박테리아 활동의 결과라는 것은 널리 인정되고 있지만, 시아노박테리아의 진화(예: 서식지 선호)가 지구 역사를 통해 생물 지구화학적 순환의 변화에 어떻게 기여했는지에 대해서는 거의 알려져 있지 않습니다.지구화학적 증거는 고생대 초기(2,500–1,600 Mya)에 지구 표면의 산소화(GOE)가 최초로 단계적으로 증가했다는 것을 나타냈습니다.[206][203]신생대 산소화 사건(NOE)으로 알려진 산소 수준의 두 번째이지만 훨씬 더 가파른 증가는 약 800에서 500 Mya에서 발생했습니다.[208][80][210][209][211]최근의 크롬 동위원소 자료는 원생대 중기 동안 지구 표면의 낮은 대기 산소 수준을 가리키는데,[207] 이것은 극저온기 동안 해양 플랑크톤 시아노박테리아의 늦은 진화와 일치합니다.[212] 두 가지 증거 모두 동물의 늦은 출현과 다양화를 설명하는 데 도움이 됩니다.[213][42]
플랑크톤성 시아노박테리아의 진화를 이해하는 것은 중요한데, 이는 플랑크톤들이 캄브리아기 이전에 질소와 탄소 순환을 근본적으로 변화시켰기 때문입니다.[211]그러나 어떤 진화적 사건들이 남조류 박테리아 내에서 바다 외 플랑크톤 형태의 출현을 이끌었는지 그리고 캄브리아기 이전의 지구화학적 증거와 어떻게 관련이 있는지는 여전히 불분명합니다.[208]지금까지, 해양 지구화학(예를 들어, 원생대 초중반 동안의 요독성 상태)[208][210][214]과 영양 가용성이 신생대 동안 플랑크톤성 시안박테리아에 의한 해양 환경의 다양화와 광범위한 식민화의 명백한 지연에 기여했을 가능성이 있습니다.[211][42]
유전학
시아노박테리아는 자연적인 유전자 변형이 가능합니다.[216][217][218]자연적인 유전자 변형은 세포 주변으로부터 외인성 DNA를 직접 흡수하고 혼합함으로써 발생하는 세포의 유전적 변형입니다.박테리아 변형이 일어나기 위해서는 수용 박테리아가 자연에서 기아, 높은 세포 밀도 또는 DNA 손상제 노출과 같은 조건에 대한 반응으로 발생할 수 있는 능력 상태에 있어야 합니다.염색체 변형에서 상동 형질전환 DNA는 상동 재조합에 의해 수용체 게놈에 통합될 수 있으며, 이 과정은 DNA 손상을 복구하기 위한 적응으로 보입니다.[219]
DNA 수복
시아노박테리아는 환경 스트레스와 DNA 손상을 일으키는 내부적으로 생성된 활성산소종에 의해 도전을 받습니다.시아노박테리아는 수많은 대장균 유사 DNA 복구 유전자를 가지고 있습니다.[220]몇몇 DNA 복구 유전자들은 심지어 작은 유전자에서도 시아노박테리아에 매우 보존되어 있으며, 이는 시아노박테리아들 사이에서 재조합 복구, 뉴클레오티드 절제 복구 및 메틸-방향 DNA 불일치 복구와 같은 핵심 DNA 복구 과정이 일반적임을 시사합니다.[220]
분류
계통발생학
| 16SrRNA기반 LTP_12_2021[221][222][223] | GTB 08-RS214 유전체 분류 데이터베이스에[224][225][226] 의한 GTB 08-RS214 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
분류학

역사적으로, 박테리아는 처음에 Schizomycetes를 구성하는 식물로 분류되었고, Schizophyceae (파랑 녹조/시아노박테리아)와 함께 Schizophyta 문을 형성하였고,[227] 그 후 1866년에 Haeckel에 의해 Protista 왕국의 Monera 문에서 Prototogenes, Protamaeba, Vampyrella, Protomonae, 그리고 Vibrio를 포함하고 노스토크와해조류와 함께 분류되었던 다른 시아노박테리아는 나중에 채튼에 의해 원핵생물로 재분류되었습니다.[228][229]
시아노박테리아는 전통적으로 형태학적으로 5개의 섹션으로 분류되었고, 숫자 I-V로 언급되었습니다.처음 세 가지는 크로오구균, 플뢰로캡스, 발진균으로 계통발생학적 연구에서 뒷받침되지 않습니다.노토칼레스(Nostocales)와 스티고네마탈레스(Stigonematales)는 하나의 단위로서 단일 계통이며, 이세포성 청록균을 구성합니다.[230][231]
크로코칼레스의 구성원들은 단세포이고 보통 집단으로 뭉쳐있습니다.고전적인 분류학적 기준은 세포 형태학과 세포 분열의 평면이었습니다.플뢰로캡스에서, 세포는 내부 포자(배아세포)를 형성하는 능력을 가지고 있습니다.나머지 부분은 필라멘트 종을 포함합니다.오실레이터에서는 세포가 불규칙적으로 배열되어 있으며 특수한 세포(아키네티스 및 헤테로 고리)를 형성하지 않습니다.[232]노토칼레스와 스티고네마탈레스에서, 세포는 특정한 조건에서 헤테로 세포를 발달시키는 능력을 가지고 있습니다.Stigonematales는 Nostocales와 달리 정말로 분기된 트리홈을 가진 종들을 포함합니다.[230]
시아노박테리아과에 포함된 대부분의 분류군은 다음을 제외하고는 아직 국제 원핵생물 명명법(ICNP)에 따라 유효하게 출판되지 않았습니다.
- 크로오박테리아, 호르모고네아, 글로오박테리아 등급
- Chroococcales, Gloeobacterales, Nostocales, Oscillatores, Pleurocapsale, Stigonematales목
- Prochloraceae 과와 Prochlorotrichaceae 과
- 할로스피룰리나속, 플랑크토트리코이데스속, 프로클로로코커스속, 프로클로론속, 프로클로로트릭스속
나머지는 조류, 곰팡이, 식물에 대한 국제 명명법에 따라 유효하게 출판됩니다.
이전에는 베기아토아와 같은 일부 박테리아가 무색의 시아노박테리아로 여겨졌습니다.[233]
현재 받아들여지고 있는 분류법은 원핵생물의 명명법(LPSN)[234]과 국립 생명공학 정보 센터(NCBI)를 기반으로 합니다.[235]키아노박테리아 분류군
- 아강 "Gloeobacteria" Cavalier-Smith 2002
- 글뢰박테리아속 캐벌리어 스미스 2002
- 하위 분류 "Phycobacteria" Cavalier-Smith 2002
- Acaryochloridales Miyashita et al. 2003 ex Struneck ý & Maresh 2022 [포함]열신경구균]
- 에게구균 스트루넥 ý 앤 마레쉬 2022
- 엘라이넬레스
- 에우리코케일러스
- 가이트레린털쥐속 스트루넥 ý 앤 마레쉬 2022
- 글뢰마르가리알레스 모레이라 외 2016
- 2022년 스트루넥 ý 앤 마레쉬
- 노도실린속 스트루넥 ý 앤 마레쉬 2022
- 오큘라텔랄레스과 스트루넥 ý 앤 마레쉬 2022
- 포르미데스미알레스
- 프로클로로코쿠스과 코마렉 & 스트루네키 2020 {"PCC-6307"}
- 프루다나베날레스 호프만, 코마렉 & 카스토프스키 2005
- "가짜 중간고사리"
- 서모스칼레속 코마렉 & 스트루넥 ý 2020
- 호프만(Synechococcopycidae Hoffmann, Komarrek & Kastovsky 2005)
- 림노트리케일
- Prochlorotrichales Struneck ý & Maresh 2022 (PCC-9006)
- 구균류 호프만, 코마렉 & 카스토프스키 2005
- 호프만과 (Nosophycidae Hoffmann), 코마렉과 (Komarrek & Kastovsky
- Cyanobacteres Rippka & Cohen-Bazire 1983 (Chamaesiponales, Chroococcales, Chroococcidiopsidales, Nostocales, 오실로스코프, 플뢰로캡세일즈, 스피루리날레스, Stigonematales)
인간과의 관계
생명공학

단세포 시아노박테리움 Synechocystis sp. PCC6803은 게놈이 완전히 서열화된 세 번째 원핵 생물이자 첫 번째 광합성 생물이었습니다.[236]그것은 계속해서 중요한 모델 생물입니다.[237]Cyanothece ATCC 51142는 중요한 디아조트로피 모델 유기체입니다.가장 작은 유전체는 Prochlorocococcus spp. (1.7 Mb)[238][239]에서 발견되었고 가장 큰 유전체는 Nostoc punctiforme (9 Mb)에서 발견되었습니다.[143]칼로스릭스 spp의 그것들.효모만큼 [240]큰 12-15 Mb로 추정됩니다.
최근의 연구는 햇빛을 직접 전기로 변환함으로써 재생 가능한 에너지 생성에 시아노박테리아의 잠재적인 적용 가능성을 제시하고 있습니다.내부 광합성 경로는 전자를 외부 전극으로 전달하는 화학 매개체와 연결될 수 있습니다.[241][242]단기적으로는 디젤, 가솔린, 제트 연료 등 조류 기반 연료의 상용화를 위한 노력이 진행되고 있습니다.[67][243][244]시아노박테리아는 또한[245] 에탄올을 생산하도록 설계되었으며 실험에 따르면 하나 또는 두 개의 CBB 유전자가 과발현될 때 수율이 훨씬 더 높아질 수 있습니다.[246][247]
시아노박테리아는 언젠가 항염증제 역할을 할 수 있고 인간의 세균 감염과 싸울 수 있는 물질을 생산할 수 있는 능력을 가지고 있을지도 모릅니다.[248]시아노박테리아의 광합성 작용에 의한 설탕과 산소의 생산은 심장마비를 가진 쥐들에게 치료적인 가치가 있음이 증명되었습니다.[249]시아노박테리아는 자연적으로 다양한 2차 대사산물을 생산할 수 있지만, 시스템 생물학 및 합성 생물학의 생명공학적 발전으로 인해 식물 유래 대사산물 생산에 유리한 숙주 역할을 할 수 있습니다.[250]
스피루리나의 추출된 블루 컬러는 천연 식용 색소로 사용됩니다.[251]
몇몇 우주 기관의 연구원들은 시아노박테리아가 화성에서 사용 가능한 물질을 변형시킴으로써 미래에 화성에 있는 승무원 전초기지에서 인간이 소비할 상품을 생산하는데 사용될 수 있다고 주장합니다.[252]
인체영양

일부 시아노박테리아는 음식으로 판매되는데, 특히 Arthrosspira platensis(Spirulina)와 다른 것들(Aphanizomenon flos-aquae)이 있습니다.[253]
일부 미세 조류는 다불포화 지방산, 아미노산, 단백질, 색소, 항산화제, 비타민, 미네랄과 같은 높은 생물학적 가치를 가진 물질을 포함하고 있습니다.[254]식용 남조류는 대식세포와 비장세포에서 NF-κB 경로를 억제함으로써 소염성 사이토카인의 생성을 감소시킵니다.황산 다당류는 면역조절, 항종양, 항혈전, 항응고제, 항돌연변이원, 항염증, 항균제, 그리고 심지어 HIV, 헤르페스, 간염에 대한 항바이러스 활성을 나타냅니다.[256]
건강위험
일부 시아노박테리아는 신경독소, 세포독소, 내독소 및 간독소(예: 마이크로시스틴 생성 박테리아 속 마이크로시스티스)를 생성할 수 있으며, 이는 시아노톡신으로 통칭됩니다.
특정 독소는 아나톡신-a, 구아니톡신, 폴리시아톡신, 시아노펩톨린, 실린더로스페르모프신, 도모산, 노둘라린 R(노둘라리아에서 유래), 네오삭시톡신 및 삭시톡신을 포함합니다.시아노박테리아는 특정 조건에서 폭발적으로 번식합니다.이것은 녹조의 결과를 낳는데, 녹조는 다른 종들에게 해로울 수 있고 만약 관련된 청록균이 독소를 생산한다면 인간과 동물들에게 위험을 줄 수 있습니다.인간중독의 여러 사례들이 기록되어 있지만, 지식이 부족하면 그 위험성에 대한 정확한 평가를 할 수가 없습니다. 애버딘의 로버트 고든 대학의 FRSE인 린다 로튼의 연구와 협력자들은 그 현상과 수질 안전을 개선하는 방법을 30년간 연구해 왔습니다.[257][258][259][260][261]
최근의 연구들은 BMAA와 같은 독소를 생산하는 높은 수준의 시아노박테리아에 상당한 노출이 근위축성 측색 경화증(ALS)을 일으킬 수 있다고 시사합니다.시안박테리아로 오염된 호수에서 반 마일 이내에 사는 사람들은 다른 사람들보다 ALS에 걸릴 위험이 2.3배 더 높습니다. 뉴햄프셔의 마스코마 호수 주변의 사람들은 ALS에 걸릴 위험이 예상 발생률보다 최대 25배 더 높았습니다.[262]카타르 전역에서 발견된 사막 지각의 BMAA는 걸프전 참전용사들의 ALS 발병률을 높이는 데 기여했을 것입니다.[258][263]
화학 제어
몇몇 화학물질들은 수영장과 같은 더 작은 수성 시스템으로부터 청록균 꽃을 제거할 수 있습니다.차아염소산칼슘, 황산구리, 구리구리, 시마진 등이 포함됩니다.[264]차아염소산칼슘은 청록균의 개화에 따라 필요량이 달라지며 주기적으로 치료가 필요합니다.호주 농무부에 따르면, 물 1000 L에 70% 물질 12 g의 비율이 종종 꽃을 치료하는데 효과적이라고 합니다.[264]황산구리는 가축, 갑각류, 물고기를 죽이기 때문에 일반적으로 사용되지만 호주 농무부에서는 더 이상 권장하지 않습니다.[264]구리 구리는 황산구리보다 독성 위험이 낮은 블룸을 제거하는 킬레이트 구리 제품입니다.용량 권장량은 1000m당2 190mL에서 4.8L까지 다양합니다.[264]50mg/L의 속도로 백반철을 처리하면 녹조가 줄어듭니다.[264][265]제초제이기도 한 시마진은 신청 후에도 며칠 동안 꽃을 죽일 것입니다.시마진은 다양한 강도(25, 50, 90%)로 시판되며, 제품당 1입방미터의 물이 필요한 권장량은 25% 제품 8mL, 50% 제품 4mL 또는 90% 제품 2.2mL입니다.[264]
기후 변화
기후 변화는 많은 부영양화된 호수, 저수지 및 하구에서 청록균의 개화 빈도, 강도 및 지속 시간을 증가시킬 가능성이 있습니다.[266][31]꽃을 형성하는 시아노박테리아는 다양한 신경독소, 간독소 및 피부독소를 생산하는데, 이는 조류 및 포유류(물새, 소 및 개 포함)에 치명적일 수 있으며, 레크리에이션, 식수 생산, 농업 관개 및 어업을 위한 물의 사용을 위협합니다.[31]독성이 있는 시아노박테리아는 주요 수질 문제를 야기시켰는데, 예를 들어 타이후 호수(중국), 이리 호수(미국), 오키초비 호수(미국), 빅토리아 호수(아프리카) 그리고 발트해에서 발생했습니다.[31][267][268][269]
기후 변화는 직간접적으로 청록균 꽃을 선호합니다.[31]꽃을 형성하는 많은 청록균들은 비교적 높은 온도에서 자랄 수 있습니다.[270]호수와 저수지의 증가된 열 층화는 부유한 시아노박테리아가 위로 떠서 밀집된 표면 꽃을 형성할 수 있게 해주는데, 이것은 빛에 더 잘 접근할 수 있게 해주고 따라서 부유하지 않은 식물성 플랑크톤 생물보다 선택적인 이점을 줍니다.[271][92]여름철 가뭄의 장기화로 저수지, 하천 및 하구의 물 체류시간이 증가하고, 이러한 정체된 따뜻한 물은 청록균 꽃의 발달에 이상적인 조건을 제공할 수 있습니다.[272][269]
유해한 시안박테리아 속 Microcystis의 CO 수치2 상승에 적응하는 능력은 실험실 및 현장 실험에서 모두 입증되었습니다.[273]microcystis spp.는 CO와2 HCO를−
3 차지하고 카르복시좀에 무기탄소를 축적하며, 균주 경쟁력은 무기탄소의 농도에 따라 달라지는 것으로 나타났습니다.결과적으로 기후 변화와 CO2 수치 증가는 시아노박테리아 꽃의 균주 구성에 영향을 미칠 것으로 예상됩니다.[273][269]
갤러리
-
Cyanobacteria 활동은 Coatepeque Caldera 호수를 청록색으로 바꿉니다.
-
피지 근처에서 피어난 시아노박테리아
-
쾨일리오 호수의 시아노박테리아.
-
비디오 – 오실레이터리아와 글레오캡사 – 오실레이터리아의 필라멘트가 빛을 향하도록 하여 진동 운동을 합니다.
참고 항목
메모들
참고문헌
- ^ Silva PC, Moe RL (December 2019). "Cyanophyceae". AccessScience. McGraw Hill Education. doi:10.1036/1097-8542.175300. Retrieved 21 April 2011.
- ^ Oren A (September 2004). "A proposal for further integration of the cyanobacteria under the Bacteriological Code". International Journal of Systematic and Evolutionary Microbiology. 54 (Pt 5): 1895–1902. doi:10.1099/ijs.0.03008-0. PMID 15388760.
- ^ Komárek J, Kaštovský J, Mareš J, Johansen JR (2014). "Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach" (PDF). Preslia. 86: 295–335.
- ^ Sinha RP, Häder DP (2008). "UV-protectants in cyanobacteria" (PDF). Plant Science. 174 (3): 278–289. doi:10.1016/j.plantsci.2007.12.004. Archived from the original (PDF) on 15 April 2021.
- ^ Harper, Douglas. "cyan". Online Etymology Dictionary. Retrieved 21 January 2018.
- ^ κύα νος. 리델, 헨리 조지; 스콧, 로버트; 페르세우스 프로젝트의 그리스-영어 어휘록.
- ^ "Life History and Ecology of Cyanobacteria". University of California Museum of Paleontology. Archived from the original on 19 September 2012. Retrieved 17 July 2012.
- ^ "Taxonomy Browser – Cyanobacteria". National Center for Biotechnology Information. NCBI:txid1117. Retrieved 12 April 2018.
- ^ Allaby M, ed. (1992). "Algae". The Concise Dictionary of Botany. Oxford: Oxford University Press.
- ^ Stal LJ, Cretoiu MS (2016). The Marine Microbiome: An Untapped Source of Biodiversity and Biotechnological Potential. Springer Science+Business Media. ISBN 978-3319330006.
- ^ Monchamp ME, Spaak P, Pomati F (27 July 2019). "Long Term Diversity and Distribution of Non-photosynthetic Cyanobacteria in Peri-Alpine Lakes". Frontiers in Microbiology. 9: 3344. doi:10.3389/fmicb.2018.03344. PMC 6340189. PMID 30692982.
- ^ Liberton M, Pakrasi HB (2008). "Chapter 10. Membrane Systems in Cyanobacteria". In Herrero A, Flore E (eds.). The Cyanobacteria: Molecular Biology, Genomics, and Evolution. Norwich, United Kingdom: Horizon Scientific Press. pp. 217–287. ISBN 978-1-904455-15-8.
- ^ Liberton M, Page LE, O'Dell WB, O'Neill H, Mamontov E, Urban VS, Pakrasi HB (February 2013). "Organization and flexibility of cyanobacterial thylakoid membranes examined by neutron scattering". The Journal of Biological Chemistry. 288 (5): 3632–3640. doi:10.1074/jbc.M112.416933. PMC 3561581. PMID 23255600.
- ^ Whitton BA, ed. (2012). "The fossil record of cyanobacteria". Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer Science+Business Media. p. 17. ISBN 978-94-007-3855-3.
- ^ "Bacteria". Basic Biology. 18 March 2016.
- ^ Pathak J, Rajneesh, Maurya PK, Singh SP, Haeder DP, Sinha RP (2018). "Cyanobacterial Farming for Environment Friendly Sustainable Agriculture Practices: Innovations and Perspectives". Frontiers in Environmental Science. 6. doi:10.3389/fenvs.2018.00007. ISSN 2296-665X.
- ^ Morrison J (11 January 2016). "Living Bacteria Are Riding Earth's Air Currents". Smithsonian Magazine. Retrieved 10 August 2022.
- ^ Whitton BA, Potts M (2012). "Introduction to the Cyanobacteria". In Whitton BA (ed.). Ecology of Cyanobacteria II. pp. 1–13. doi:10.1007/978-94-007-3855-3_1. ISBN 978-94-007-3854-6.
- ^ a b c Tamulonis C, Postma M, Kaandorp J (2011). "Modeling filamentous cyanobacteria reveals the advantages of long and fast trichomes for optimizing light exposure". PLOS ONE. 6 (7): e22084. Bibcode:2011PLoSO...622084T. doi:10.1371/journal.pone.0022084. PMC 3138769. PMID 21789215.
- ^ a b Stay LJ (5 July 2012). "Cyanobacterial Mats and Stromatolites". In Whitton BA (ed.). Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer Science & Business Media. ISBN 9789400738553. Retrieved 15 February 2022 – via Google Books.
- ^ a b c d e f g h Tamulonis C, Postma M, Kaandorp J (2011). "Modeling filamentous cyanobacteria reveals the advantages of long and fast trichomes for optimizing light exposure". PLOS ONE. 6 (7): e22084. Bibcode:2011PLoSO...622084T. doi:10.1371/journal.pone.0022084. PMC 3138769. PMID 21789215.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Weiss KR (30 July 2006). "A Primeval Tide of Toxins". Los Angeles Times. Archived from the original on 14 August 2006.
- ^ Dodds WK, Gudder DA, Mollenhauer D (1995). "The ecology of 'Nostoc'". Journal of Phycology. 31: 2–18. doi:10.1111/j.0022-3646.1995.00002.x. S2CID 85011483.
- ^ a b c d e f Aguilera A, Klemenčič M, Sueldo DJ, Rzymski P, Giannuzzi L, Martin MV (2021). "Cell Death in Cyanobacteria: Current Understanding and Recommendations for a Consensus on Its Nomenclature". Frontiers in Microbiology. 12: 631654. doi:10.3389/fmicb.2021.631654. PMC 7965980. PMID 33746925.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Raven RA (5 July 2012). "Physiological Ecology: Carbon". In Whitton BA (ed.). Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer. p. 442. ISBN 9789400738553.
- ^ a b Schirrmeister BE, de Vos JM, Antonelli A, Bagheri HC (January 2013). "Evolution of multicellularity coincided with increased diversification of cyanobacteria and the Great Oxidation Event". Proceedings of the National Academy of Sciences of the United States of America. 110 (5): 1791–1796. Bibcode:2013PNAS..110.1791S. doi:10.1073/pnas.1209927110. PMC 3562814. PMID 23319632.
- ^ Bullerjahn GS, Post AF (2014). "Physiology and molecular biology of aquatic cyanobacteria". Frontiers in Microbiology. 5: 359. doi:10.3389/fmicb.2014.00359. PMC 4099938. PMID 25076944.
- ^ Tang W, Wang S, Fonseca-Batista D, Dehairs F, Gifford S, Gonzalez AG, et al. (February 2019). "Revisiting the distribution of oceanic N2 fixation and estimating diazotrophic contribution to marine production". Nature Communications. 10 (1): 831. doi:10.1038/s41467-019-08640-0. PMC 6381160. PMID 30783106.
- ^ Bláha L, Babica P, Maršálek B (June 2009). "Toxins produced in cyanobacterial water blooms - toxicity and risks". Interdisciplinary Toxicology. 2 (2): 36–41. doi:10.2478/v10102-009-0006-2. PMC 2984099. PMID 21217843.
- ^ Paerl HW, Otten TG (May 2013). "Harmful cyanobacterial blooms: causes, consequences, and controls". Microbial Ecology. 65 (4): 995–1010. doi:10.1007/s00248-012-0159-y. PMID 23314096. S2CID 5718333.
- ^ a b c d e f Huisman J, Codd GA, Paerl HW, Ibelings BW, Verspagen JM, Visser PM (August 2018). "Cyanobacterial blooms". Nature Reviews. Microbiology. 16 (8): 471–483. doi:10.1038/s41579-018-0040-1. PMID 29946124. S2CID 49427202.
- ^ Field CB, Behrenfeld MJ, Randerson JT, Falkowski P (July 1998). "Primary production of the biosphere: integrating terrestrial and oceanic components". Science. 281 (5374): 237–240. Bibcode:1998Sci...281..237F. doi:10.1126/science.281.5374.237. PMID 9657713.
- ^ Cabello-Yeves PJ, Scanlan DJ, Callieri C, Picazo A, Schallenberg L, Huber P, et al. (October 2022). "α-cyanobacteria possessing form IA RuBisCO globally dominate aquatic habitats". The ISME Journal. Springer Science and Business Media LLC. 16 (10): 2421–2432. doi:10.1038/s41396-022-01282-z. PMC 9477826. PMID 35851323.
 이 소스에서 수정된 텍스트가 복사되었으며 크리에이티브 커먼즈 속성 4.0 국제 라이센스로 제공됩니다.
이 소스에서 수정된 텍스트가 복사되었으며 크리에이티브 커먼즈 속성 4.0 국제 라이센스로 제공됩니다. - ^ a b Zehr JP (April 2011). "Nitrogen fixation by marine cyanobacteria". Trends in Microbiology. 19 (4): 162–173. doi:10.1016/j.tim.2010.12.004. PMID 21227699.
- ^ a b Thompson AW, Foster RA, Krupke A, Carter BJ, Musat N, Vaulot D, et al. (September 2012). "Unicellular cyanobacterium symbiotic with a single-celled eukaryotic alga". Science. 337 (6101): 1546–1550. Bibcode:2012Sci...337.1546T. doi:10.1126/science.1222700. PMID 22997339. S2CID 7071725.
- ^ a b Johnson ZI, Zinser ER, Coe A, McNulty NP, Woodward EM, Chisholm SW (March 2006). "Niche partitioning among Prochlorococcus ecotypes along ocean-scale environmental gradients". Science. 311 (5768): 1737–1740. Bibcode:2006Sci...311.1737J. doi:10.1126/science.1118052. PMID 16556835. S2CID 3549275.
- ^ a b Scanlan DJ, Ostrowski M, Mazard S, Dufresne A, Garczarek L, Hess WR, et al. (June 2009). "Ecological genomics of marine picocyanobacteria". Microbiology and Molecular Biology Reviews. 73 (2): 249–299. doi:10.1128/MMBR.00035-08. PMC 2698417. PMID 19487728.
- ^ a b Flombaum P, Gallegos JL, Gordillo RA, Rincón J, Zabala LL, Jiao N, et al. (June 2013). "Present and future global distributions of the marine Cyanobacteria Prochlorococcus and Synechococcus". Proceedings of the National Academy of Sciences of the United States of America. 110 (24): 9824–9829. Bibcode:2013PNAS..110.9824F. doi:10.1073/pnas.1307701110. PMC 3683724. PMID 23703908.
- ^ Foster RA, Kuypers MM, Vagner T, Paerl RW, Musat N, Zehr JP (September 2011). "Nitrogen fixation and transfer in open ocean diatom-cyanobacterial symbioses". The ISME Journal. 5 (9): 1484–1493. doi:10.1038/ismej.2011.26. PMC 3160684. PMID 21451586.
- ^ Villareal TA (1990). "Laboratory Culture and Preliminary Characterization of the Nitrogen-Fixing Rhizosolenia-Richelia Symbiosis". Marine Ecology. 11 (2): 117–132. Bibcode:1990MarEc..11..117V. doi:10.1111/j.1439-0485.1990.tb00233.x.
- ^ Janson S, Wouters J, Bergman B, Carpenter EJ (October 1999). "Host specificity in the Richelia-diatom symbiosis revealed by hetR gene sequence analysis". Environmental Microbiology. 1 (5): 431–438. doi:10.1046/j.1462-2920.1999.00053.x. PMID 11207763.
- ^ a b c d e Sánchez-Baracaldo P (December 2015). "Origin of marine planktonic cyanobacteria". Scientific Reports. 5: 17418. Bibcode:2015NatSR...517418S. doi:10.1038/srep17418. PMC 4665016. PMID 26621203.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Kettler GC, Martiny AC, Huang K, Zucker J, Coleman ML, Rodrigue S, et al. (December 2007). "Patterns and implications of gene gain and loss in the evolution of Prochlorococcus". PLOS Genetics. 3 (12): e231. doi:10.1371/journal.pgen.0030231. PMC 2151091. PMID 18159947.
- ^ Nemiroff R, Bonnell J, eds. (27 September 2006). "Earth from Saturn". Astronomy Picture of the Day. NASA.
- ^ a b Partensky F, Hess WR, Vaulot D (March 1999). "Prochlorococcus, a marine photosynthetic prokaryote of global significance". Microbiology and Molecular Biology Reviews. 63 (1): 106–127. doi:10.1128/MMBR.63.1.106-127.1999. PMC 98958. PMID 10066832.
- ^ "The Most Important Microbe You've Never Heard Of". npr.org.
- ^ a b Claessen D, Rozen DE, Kuipers OP, Søgaard-Andersen L, van Wezel GP (February 2014). "Bacterial solutions to multicellularity: a tale of biofilms, filaments and fruiting bodies" (PDF). Nature Reviews. Microbiology. 12 (2): 115–124. doi:10.1038/nrmicro3178. hdl:11370/0db66a9c-72ef-4e11-a75d-9d1e5827573d. PMID 24384602. S2CID 20154495.
- ^ Nürnberg DJ, Mariscal V, Parker J, Mastroianni G, Flores E, Mullineaux CW (March 2014). "Branching and intercellular communication in the Section V cyanobacterium Mastigocladus laminosus, a complex multicellular prokaryote". Molecular Microbiology. 91 (5): 935–949. doi:10.1111/mmi.12506. hdl:10261/99110. PMID 24383541. S2CID 25479970.
- ^ Herrero A, Stavans J, Flores E (November 2016). "The multicellular nature of filamentous heterocyst-forming cyanobacteria". FEMS Microbiology Reviews. 40 (6): 831–854. doi:10.1093/femsre/fuw029. hdl:10261/140753. PMID 28204529.
- ^ Risser DD, Chew WG, Meeks JC (April 2014). "Genetic characterization of the hmp locus, a chemotaxis-like gene cluster that regulates hormogonium development and motility in Nostoc punctiforme". Molecular Microbiology. 92 (2): 222–233. doi:10.1111/mmi.12552. PMID 24533832. S2CID 37479716.
- ^ Khayatan B, Bains DK, Cheng MH, Cho YW, Huynh J, Kim R, et al. (May 2017). "A Putative O-Linked β-N-Acetylglucosamine Transferase Is Essential for Hormogonium Development and Motility in the Filamentous Cyanobacterium Nostoc punctiforme". Journal of Bacteriology. 199 (9): e00075–17. doi:10.1128/JB.00075-17. PMC 5388816. PMID 28242721.
- ^ Esteves-Ferreira AA, Cavalcanti JH, Vaz MG, Alvarenga LV, Nunes-Nesi A, Araújo WL (2017). "Cyanobacterial nitrogenases: phylogenetic diversity, regulation and functional predictions". Genetics and Molecular Biology. 40 (1 suppl 1): 261–275. doi:10.1590/1678-4685-GMB-2016-0050. PMC 5452144. PMID 28323299.
- ^ Meeks JC, Elhai J, Thiel T, Potts M, Larimer F, Lamerdin J, et al. (2001). "An overview of the genome of Nostoc punctiforme, a multicellular, symbiotic cyanobacterium". Photosynthesis Research. 70 (1): 85–106. doi:10.1023/A:1013840025518. PMID 16228364. S2CID 8752382.
- ^ a b Golden JW, Yoon HS (December 1998). "Heterocyst formation in Anabaena". Current Opinion in Microbiology. 1 (6): 623–629. doi:10.1016/s1369-5274(98)80106-9. PMID 10066546.
- ^ a b c Fay P (June 1992). "Oxygen relations of nitrogen fixation in cyanobacteria". Microbiological Reviews. 56 (2): 340–373. doi:10.1128/MMBR.56.2.340-373.1992. PMC 372871. PMID 1620069.
- ^ Singh V, Pande PC, Jain DK (eds.). "Cyanobacteria, Actinomycetes, Mycoplasma, and Rickettsias". Text Book of Botany Diversity of Microbes And Cryptogams. Rastogi Publications. p. 72. ISBN 978-8171338894.
- ^ "Differences between Bacteria and Cyanobacteria". Microbiology Notes. 29 October 2015. Retrieved 21 January 2018.
- ^ Walsby AE (March 1994). "Gas vesicles". Microbiological Reviews. 58 (1): 94–144. doi:10.1128/MMBR.58.1.94-144.1994. PMC 372955. PMID 8177173.
- ^ Sims GK, Dunigan EP (1984). "Diurnal and seasonal variations in nitrogenase activity C
2H
2 reduction) of rice roots". Soil Biology and Biochemistry. 16: 15–18. doi:10.1016/0038-0717(84)90118-4. - ^ Bocchi S, Malgioglio A (2010). "Azolla-Anabaena as a Biofertilizer for Rice Paddy Fields in the Po Valley, a Temperate Rice Area in Northern Italy". International Journal of Agronomy. 2010: 1–5. doi:10.1155/2010/152158.
- ^ Huokko T, Ni T, Dykes GF, Simpson DM, Brownridge P, Conradi FD, et al. (June 2021). "Probing the biogenesis pathway and dynamics of thylakoid membranes". Nature Communications. 12 (1): 3475. Bibcode:2021NatCo..12.3475H. doi:10.1038/s41467-021-23680-1. PMC 8190092. PMID 34108457.
- ^ Kerfeld CA, Heinhorst S, Cannon GC (2010). "Bacterial microcompartments". Annual Review of Microbiology. 64 (1): 391–408. doi:10.1146/annurev.micro.112408.134211. PMC 6022854. PMID 20825353.
- ^ Rae BD, Long BM, Badger MR, Price GD (September 2013). "Functions, compositions, and evolution of the two types of carboxysomes: polyhedral microcompartments that facilitate CO2 fixation in cyanobacteria and some proteobacteria". Microbiology and Molecular Biology Reviews. 77 (3): 357–379. doi:10.1128/MMBR.00061-12. PMC 3811607. PMID 24006469.
- ^ Long BM, Badger MR, Whitney SM, Price GD (October 2007). "Analysis of carboxysomes from Synechococcus PCC7942 reveals multiple Rubisco complexes with carboxysomal proteins CcmM and CcaA". The Journal of Biological Chemistry. 282 (40): 29323–29335. doi:10.1074/jbc.M703896200. PMID 17675289.
- ^ Vothknecht UC, Westhoff P (December 2001). "Biogenesis and origin of thylakoid membranes". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1541 (1–2): 91–101. doi:10.1016/S0167-4889(01)00153-7. PMID 11750665.
- ^ Sobiechowska-Sasim M, Stoń-Egiert J, Kosakowska A (February 2014). "Quantitative analysis of extracted phycobilin pigments in cyanobacteria-an assessment of spectrophotometric and spectrofluorometric methods". Journal of Applied Phycology. 26 (5): 2065–2074. doi:10.1007/s10811-014-0244-3. PMC 4200375. PMID 25346572.
- ^ a b Pisciotta JM, Zou Y, Baskakov IV (May 2010). Yang CH (ed.). "Light-dependent electrogenic activity of cyanobacteria". PLOS ONE. 5 (5): e10821. Bibcode:2010PLoSO...510821P. doi:10.1371/journal.pone.0010821. PMC 2876029. PMID 20520829.
- ^ a b c Vermaas WF (2001). "Photosynthesis and Respiration in Cyanobacteria". Photosynthesis and Respiration in Cyanobacteria. eLS. John Wiley & Sons, Ltd. doi:10.1038/npg.els.0001670. ISBN 978-0-470-01590-2. S2CID 19016706.
- ^ Armstronf JE (2015). How the Earth Turned Green: A Brief 3.8-Billion-Year History of Plants. The University of Chicago Press. ISBN 978-0-226-06977-7.
- ^ Klatt JM, de Beer D, Häusler S, Polerecky L (2016). "Cyanobacteria in Sulfidic Spring Microbial Mats Can Perform Oxygenic and Anoxygenic Photosynthesis Simultaneously during an Entire Diurnal Period". Frontiers in Microbiology. 7: 1973. doi:10.3389/fmicb.2016.01973. PMC 5156726. PMID 28018309.
- ^ Grossman AR, Schaefer MR, Chiang GG, Collier JL (September 1993). "The phycobilisome, a light-harvesting complex responsive to environmental conditions". Microbiological Reviews. 57 (3): 725–749. doi:10.1128/MMBR.57.3.725-749.1993. PMC 372933. PMID 8246846.
- ^ "Colors from bacteria Causes of Color". www.webexhibits.org. Retrieved 22 January 2018.
- ^ Garcia-Pichel F (2009). "Cyanobacteria". In Schaechter M (ed.). Encyclopedia of Microbiology (third ed.). pp. 107–24. doi:10.1016/B978-012373944-5.00250-9. ISBN 978-0-12-373944-5.
- ^ Kehoe DM (May 2010). "Chromatic adaptation and the evolution of light color sensing in cyanobacteria". Proceedings of the National Academy of Sciences of the United States of America. 107 (20): 9029–9030. Bibcode:2010PNAS..107.9029K. doi:10.1073/pnas.1004510107. PMC 2889117. PMID 20457899.
- ^ Kehoe DM, Gutu A (2006). "Responding to color: the regulation of complementary chromatic adaptation". Annual Review of Plant Biology. 57: 127–150. doi:10.1146/annurev.arplant.57.032905.105215. PMID 16669758.
- ^ Palenik B, Haselkorn R (January 1992). "Multiple evolutionary origins of prochlorophytes, the chlorophyll b-containing prokaryotes". Nature. 355 (6357): 265–267. Bibcode:1992Natur.355..265P. doi:10.1038/355265a0. PMID 1731224. S2CID 4244829.
- ^ Urbach E, Robertson DL, Chisholm SW (January 1992). "Multiple evolutionary origins of prochlorophytes within the cyanobacterial radiation". Nature. 355 (6357): 267–270. Bibcode:1992Natur.355..267U. doi:10.1038/355267a0. PMID 1731225. S2CID 2011379.
- ^ Cohen Y, Jørgensen BB, Revsbech NP, Poplawski R (February 1986). "Adaptation to Hydrogen Sulfide of Oxygenic and Anoxygenic Photosynthesis among Cyanobacteria". Applied and Environmental Microbiology. 51 (2): 398–407. Bibcode:1986ApEnM..51..398C. doi:10.1128/AEM.51.2.398-407.1986. PMC 238881. PMID 16346996.
- ^ Blankenship RE (2014). Molecular Mechanisms of Photosynthesis. Wiley-Blackwell. pp. 147–73. ISBN 978-1-4051-8975-0.
- ^ a b Och LM, Shields-Zhou GA (January 2012). "The Neoproterozoic oxygenation event: Environmental perturbations and biogeochemical cycling". Earth-Science Reviews. 110 (1–4): 26–57. Bibcode:2012ESRv..110...26O. doi:10.1016/j.earscirev.2011.09.004.
- ^ Adams DG, Bergman B, Nierzwicki-Bauer SA, Duggan PS, Rai AN, Schüßler A (2013). "Cyanobacterial-Plant Symbioses". In Rosenberg E, DeLong EF, Lory S, Stackebrandt E, Thompson F (eds.). The Prokaryotes. Springer, Berlin, Heidelberg. pp. 359–400. doi:10.1007/978-3-642-30194-0_17. ISBN 978-3-642-30193-3.
- ^ Zhang, Shuyi; Bryant, Donald A. (16 December 2011). "The tricarboxylic acid cycle in cyanobacteria". Science. 334 (6062): 1551–1553. Bibcode:2011Sci...334.1551Z. doi:10.1126/science.1210858. ISSN 1095-9203. PMID 22174252. S2CID 206536295.
- ^ Xiong, Wei; Lee, Tai-Chi; Rommelfanger, Sarah; Gjersing, Erica; Cano, Melissa; Maness, Pin-Ching; Ghirardi, Maria; Yu, Jianping (7 December 2015). "Phosphoketolase pathway contributes to carbon metabolism in cyanobacteria". Nature Plants. 2 (1): 15187. doi:10.1038/nplants.2015.187. ISSN 2055-0278. PMID 27250745. S2CID 40094360.
- ^ Smith A (1973). "Synthesis of metabolic intermediates". In Carr NG, Whitton BA (eds.). The Biology of Blue-green Algae. University of California Press. pp. 30–. ISBN 978-0-520-02344-4.
- ^ Jangoux M (1987). "Diseases of Echinodermata. I. Agents microorganisms and protistans". Diseases of Aquatic Organisms. 2: 147–62. doi:10.3354/dao002147.
- ^ Kinne O, ed. (1980). Diseases of Marine Animals (PDF). Vol. 1. Chichester, UK: John Wiley & Sons. ISBN 978-0-471-99584-5.
- ^ Kristiansen A (1964). "Sarcinastrum urosporae, a Colourless Parasitic Blue-green Alga" (PDF). Phycologia. 4 (1): 19–22. doi:10.2216/i0031-8884-4-1-19.1. Archived from the original (PDF) on 6 January 2015.
- ^ Mazard S, Penesyan A, Ostrowski M, Paulsen IT, Egan S (May 2016). "Tiny Microbes with a Big Impact: The Role of Cyanobacteria and Their Metabolites in Shaping Our Future". Marine Drugs. 14 (5): 97. doi:10.3390/md14050097. PMC 4882571. PMID 27196915.
- ^ de los Ríos A, Grube M, Sancho LG, Ascaso C (February 2007). "Ultrastructural and genetic characteristics of endolithic cyanobacterial biofilms colonizing Antarctic granite rocks". FEMS Microbiology Ecology. 59 (2): 386–395. doi:10.1111/j.1574-6941.2006.00256.x. PMID 17328119.
- ^ Vaughan T (2011). Mammalogy. Jones and Barlett. p. 21. ISBN 978-0763762995.
- ^ Schultz N (30 August 2009). "Photosynthetic viruses keep world's oxygen levels up". New Scientist.
- ^ a b c Jöhnk KD, Huisman J, Sharples J, Sommeijer B, Visser PM, Stroom JM (1 March 2008). "Summer heatwaves promote blooms of harmful cyanobacteria". Global Change Biology. 14 (3): 495–512. Bibcode:2008GCBio..14..495J. doi:10.1111/j.1365-2486.2007.01510.x. S2CID 54079634.
- ^ "Linda Lawton – 11th International Conference on Toxic Cyanobacteria". Retrieved 25 June 2021.
- ^ Paerl HW, Paul VJ (April 2012). "Climate change: links to global expansion of harmful cyanobacteria". Water Research. 46 (5): 1349–1363. Bibcode:2012WatRe..46.1349P. doi:10.1016/j.watres.2011.08.002. PMID 21893330.
- ^ Thomas AD, Dougill AJ (15 March 2007). "Spatial and temporal distribution of cyanobacterial soil crusts in the Kalahari: Implications for soil surface properties". Geomorphology. 85 (1): 17–29. Bibcode:2007Geomo..85...17T. doi:10.1016/j.geomorph.2006.03.029.
- ^ Belnap J, Gardner JS (1993). "Soil Microstructure in Soils of the Colorado Plateau: The Role of the Cyanobacterium Microcoleus Vaginatus". The Great Basin Naturalist. 53 (1): 40–47. JSTOR 41712756.
- ^ Nadis S (December 2003). "The cells that rule the seas" (PDF). Scientific American. 289 (6): 52–53. Bibcode:2003SciAm.289f..52N. doi:10.1038/scientificamerican1203-52. PMID 14631732. Archived from the original (PDF) on 19 April 2014. Retrieved 19 April 2014.
- ^ Stewart I, Falconer IR (2 September 2011). "Cyanobacteria and cyanobacterial toxins". In Walsh PJ, Smith S, Fleming L, Solo-Gabriele H, Gerwick WH (eds.). Oceans and Human Health: Risks and Remedies from the Seas. Academic Press. pp. 271–296. ISBN 978-0-08-087782-2.
- ^ a b c Lee SM, Ryu CM (4 February 2021). "Algae as New Kids in the Beneficial Plant Microbiome". Frontiers in Plant Science. Frontiers Media SA. 12: 599742. doi:10.3389/fpls.2021.599742. PMC 7889962. PMID 33613596.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ a b c Kim M, Choi DH, Park MG (May 2021). "Cyanobiont genetic diversity and host specificity of cyanobiont-bearing dinoflagellate Ornithocercus in temperate coastal waters". Scientific Reports. 11 (1): 9458. Bibcode:2021NatSR..11.9458K. doi:10.1038/s41598-021-89072-z. PMC 8097063. PMID 33947914.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Gantar M, Elhai J (1999). "Colonization of wheatpara-nodules by the N2-fixing cyanobacterium Nostocsp. Strain 2S9B". New Phytologist. 141 (3): 373–379. doi:10.1046/j.1469-8137.1999.00352.x.
- ^ Gantar M (2000). "Mechanical damage of roots provides enhanced colonization of the wheat endorhizosphere by the dinitrogen-fixing cyanobacterium Nostoc sp. Strain 2S9B". Biology and Fertility of Soils. 32 (3): 250–255. doi:10.1007/s003740000243. S2CID 7590731.
- ^ Treves H, Raanan H, Kedem I, Murik O, Keren N, Zer H, et al. (June 2016). "The mechanisms whereby the green alga Chlorella ohadii, isolated from desert soil crust, exhibits unparalleled photodamage resistance". The New Phytologist. 210 (4): 1229–1243. doi:10.1111/nph.13870. PMID 26853530.
- ^ Zhu H, Li S, Hu Z, Liu G (December 2018). "Molecular characterization of eukaryotic algal communities in the tropical phyllosphere based on real-time sequencing of the 18S rDNA gene". BMC Plant Biology. 18 (1): 365. doi:10.1186/s12870-018-1588-7. PMC 6299628. PMID 30563464.
- ^ Krings M, Hass H, Kerp H, Taylor TN, Agerer R, Dotzler N (2009). "Endophytic cyanobacteria in a 400-million-yr-old land plant: A scenario for the origin of a symbiosis?". Review of Palaeobotany and Palynology. 153 (1–2): 62–69. Bibcode:2009RPaPa.153...62K. doi:10.1016/j.revpalbo.2008.06.006.
- ^ Karthikeyan N, Prasanna R, Sood A, Jaiswal P, Nayak S, Kaushik BD (2009). "Physiological characterization and electron microscopic investigation of cyanobacteria associated with wheat rhizosphere". Folia Microbiologica. 54 (1): 43–51. doi:10.1007/s12223-009-0007-8. PMID 19330544. S2CID 23420342.
- ^ a b Babu S, Prasanna R, Bidyarani N, Singh R (2015). "Analysing the colonisation of inoculated cyanobacteria in wheat plants using biochemical and molecular tools". Journal of Applied Phycology. 27: 327–338. doi:10.1007/s10811-014-0322-6. S2CID 17353123.
- ^ a b Bidyarani N, Prasanna R, Chawla G, Babu S, Singh R (April 2015). "Deciphering the factors associated with the colonization of rice plants by cyanobacteria". Journal of Basic Microbiology. 55 (4): 407–419. doi:10.1002/jobm.201400591. PMID 25515189. S2CID 5401526.
- ^ a b Gantar M, Kerby NW, Rowell P (1991). "Colonization of wheat (Triticum vulgare L.) by N2-fixing cyanobacteria: II. An ultrastructural study". New Phytologist. 118 (3): 485–492. doi:10.1111/j.1469-8137.1991.tb00031.x.
- ^ Ahmed M, Stal LJ, Hasnain S (2010). "Association of non-heterocystous cyanobacteria with crop plants". Plant and Soil. 336 (1–2): 363–375. doi:10.1007/s11104-010-0488-x. S2CID 21309970.
- ^ Hussain A, Hamayun M, Shah ST (November 2013). "Root colonization and phytostimulation by phytohormones producing entophytic Nostoc sp. AH-12". Current Microbiology. 67 (5): 624–630. doi:10.1007/s00284-013-0408-4. PMID 23794014. S2CID 14704537.
- ^ Hussain A, Shah ST, Rahman H, Irshad M, Iqbal A (2015). "Effect of IAA on in vitro growth and colonization of Nostoc in plant roots". Frontiers in Plant Science. 6: 46. doi:10.3389/fpls.2015.00046. PMC 4318279. PMID 25699072.
- ^ Capone DG (1997). "Trichodesmium, a Globally Significant Marine Cyanobacterium". Science. 276 (5316): 1221–1229. doi:10.1126/science.276.5316.1221.
- ^ Falkowski PG, Barber RT, Smetacek V (July 1998). "Biogeochemical Controls and Feedbacks on Ocean Primary Production". Science. 281 (5374): 200–207. doi:10.1126/science.281.5374.200. PMID 9660741.
- ^ Hutchins DA, Fu FX, Zhang Y, Warner ME, Feng Y, Portune K, Bernhardt PW, Mulholland MR (2007). "CO2 control of Trichodesmium N2 fixation, photosynthesis, growth rates, and elemental ratios: Implications for past, present, and future ocean biogeochemistry". Limnology and Oceanography. 52 (4): 1293–1304. Bibcode:2007LimOc..52.1293H. doi:10.4319/lo.2007.52.4.1293. S2CID 55606811.
- ^ Huang S, Wilhelm SW, Harvey HR, Taylor K, Jiao N, Chen F (February 2012). "Novel lineages of Prochlorococcus and Synechococcus in the global oceans". The ISME Journal. 6 (2): 285–297. doi:10.1038/ismej.2011.106. PMC 3260499. PMID 21955990.
- ^ Srivastava AK, Rai AM, Neilan BA (March 2013). Stress Biology of Cyanobacteria: Molecular Mechanisms to Cellular Responses. CRC Press. ISBN 9781466504783 – via Google Books.
- ^ Zehr JP, Bench SR, Carter BJ, Hewson I, Niazi F, Shi T, et al. (November 2008). "Globally distributed uncultivated oceanic N2-fixing cyanobacteria lack oxygenic photosystem II". Science. 322 (5904): 1110–1112. Bibcode:2008Sci...322.1110Z. doi:10.1126/science.1165340. PMID 19008448. S2CID 206516012.
- ^ Decelle J, Colin S, Foster RA (2015). "Photosymbiosis in Marine Planktonic Protists". Marine Protists. pp. 465–500. doi:10.1007/978-4-431-55130-0_19. ISBN 978-4-431-55129-4.
- ^ Foster RA, Zehr JP (September 2019). "Diversity, Genomics, and Distribution of Phytoplankton-Cyanobacterium Single-Cell Symbiotic Associations". Annual Review of Microbiology. 73: 435–456. doi:10.1146/annurev-micro-090817-062650. PMID 31500535. S2CID 202414294.
- ^ a b c d e f g Mullineaux CW, Wilde A (June 2021). "The social life of cyanobacteria". eLife. 10. doi:10.7554/eLife.70327. PMC 8208810. PMID 34132636.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Kamennaya NA, Zemla M, Mahoney L, Chen L, Holman E, Holman HY, et al. (May 2018). "High pCO2-induced exopolysaccharide-rich ballasted aggregates of planktonic cyanobacteria could explain Paleoproterozoic carbon burial". Nature Communications. 9 (1): 2116. Bibcode:2018NatCo...9.2116K. doi:10.1038/s41467-018-04588-9. PMC 5974010. PMID 29844378.
- ^ a b Maeda K, Okuda Y, Enomoto G, Watanabe S, Ikeuchi M (June 2021). "Biosynthesis of a sulfated exopolysaccharide, synechan, and bloom formation in the model cyanobacterium Synechocystis sp. strain PCC 6803". eLife. 10. doi:10.7554/eLife.66538. PMC 8205485. PMID 34127188.
- ^ a b Sim MS, Liang B, Petroff AP, Evans A, Klepac-Ceraj V, Flannery DT, et al. (2012). "Oxygen-Dependent Morphogenesis of Modern Clumped Photosynthetic Mats and Implications for the Archean Stromatolite Record". Geosciences. 2 (4): 235–259. Bibcode:2012Geosc...2..235S. doi:10.3390/geosciences2040235.
 자료는 크리에이티브 커먼즈 Attribution 3.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 3.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ a b Conradi FD, Zhou RQ, Oeser S, Schuergers N, Wilde A, Mullineaux CW (October 2019). "Factors Controlling Floc Formation and Structure in the Cyanobacterium Synechocystis sp. Strain PCC 6803". Journal of Bacteriology. 201 (19). doi:10.1128/JB.00344-19. PMC 6755745. PMID 31262837.
- ^ Enomoto G, Ikeuchi M (March 2020). "Blue-/Green-Light-Responsive Cyanobacteriochromes Are Cell Shade Sensors in Red-Light Replete Niches". iScience. 23 (3): 100936. Bibcode:2020iSci...23j0936E. doi:10.1016/j.isci.2020.100936. PMC 7063230. PMID 32146329.
- ^ Galluzzi L, Bravo-San Pedro JM, Vitale I, Aaronson SA, Abrams JM, Adam D, et al. (January 2015). "Essential versus accessory aspects of cell death: recommendations of the NCCD 2015". Cell Death and Differentiation. 22 (1): 58–73. doi:10.1038/cdd.2014.137. PMC 4262782. PMID 25236395.
- ^ Allen R, Rittmann BE, Curtiss R (April 2019). "Axenic Biofilm Formation and Aggregation by Synechocystis sp. Strain PCC 6803 Are Induced by Changes in Nutrient Concentration and Require Cell Surface Structures". Applied and Environmental Microbiology. 85 (7). Bibcode:2019ApEnM..85E2192A. doi:10.1128/AEM.02192-18. PMC 6585507. PMID 30709828.
- ^ Schuergers N, Wilde A (March 2015). "Appendages of the cyanobacterial cell". Life. 5 (1): 700–715. Bibcode:2015Life....5..700S. doi:10.3390/life5010700. PMC 4390875. PMID 25749611.
- ^ a b c Khayatan B, Meeks JC, Risser DD (December 2015). "Evidence that a modified type IV pilus-like system powers gliding motility and polysaccharide secretion in filamentous cyanobacteria". Molecular Microbiology. 98 (6): 1021–1036. doi:10.1111/mmi.13205. PMID 26331359. S2CID 8749419.
- ^ Adams DW, Stutzmann S, Stoudmann C, Blokesch M (September 2019). "DNA-uptake pili of Vibrio cholerae are required for chitin colonization and capable of kin recognition via sequence-specific self-interaction". Nature Microbiology. 4 (9): 1545–1557. doi:10.1038/s41564-019-0479-5. PMC 6708440. PMID 31182799.
- ^ Kromkamp J, Walsby AE (1990). "A computer model of buoyancy and vertical migration in cyanobacteria". Journal of Plankton Research. 12: 161–183. doi:10.1093/plankt/12.1.161.
- ^ Aguilo-Ferretjans MD, Bosch R, Puxty RJ, Latva M, Zadjelovic V, Chhun A, et al. (March 2021). "Pili allow dominant marine cyanobacteria to avoid sinking and evade predation". Nature Communications. 12 (1): 1857. Bibcode:2021NatCo..12.1857A. doi:10.1038/s41467-021-22152-w. PMC 7994388. PMID 33767153.
- ^ Hu, Chenlin; Rzymski, Piotr (December 2019). "Programmed Cell Death-Like and Accompanying Release of Microcystin in Freshwater Bloom-Forming Cyanobacterium Microcystis: From Identification to Ecological Relevance". Toxins. 11 (12): 706. doi:10.3390/toxins11120706. ISSN 2072-6651. PMC 6950475. PMID 31817272.
- ^ Agustí S (June 2004). "Viability and niche segregation of Prochlorococcus and Synechococcus cells across the Central Atlantic Ocean". Aquatic Microbial Ecology. 36 (1): 53–59. doi:10.3354/ame036053.
- ^ Agusti S, Alou EV, Hoyer MV, Frazer TK, Canfield DE (2006). "Cell death in lake phytoplankton communities". Freshwater Biology. 51 (8): 1496–1506. doi:10.1111/j.1365-2427.2006.01584.x.
- ^ Franklin DJ, Brussaard CP, Berges JA (2006). "What is the role and nature of programmed cell death in phytoplankton ecology?". European Journal of Phycology. 41: 1–14. doi:10.1080/09670260500505433. S2CID 53599616.
- ^ Sigee DC, Selwyn A, Gallois P, Dean AP (2007). "Patterns of cell death in freshwater colonial cyanobacteria during the late summer bloom". Phycologia. 46 (3): 284–292. doi:10.2216/06-69.1. S2CID 86268392.
- ^ Berman-Frank I, Bidle KD, Haramaty L, Falkowski PG (2004). "The demise of the marine cyanobacterium, Trichodesmium SPP., via an autocatalyzed cell death pathway". Limnology and Oceanography. 49 (4): 997–1005. Bibcode:2004LimOc..49..997B. doi:10.4319/lo.2004.49.4.0997.
- ^ Hu C, Rzymski P (December 2019). "Programmed Cell Death-Like and Accompanying Release of Microcystin in Freshwater Bloom-Forming Cyanobacterium Microcystis: From Identification to Ecological Relevance". Toxins. 11 (12): 706. doi:10.3390/toxins11120706. PMC 6950475. PMID 31817272.
- ^ Hu, Chenlin; Rzymski, Piotr (4 December 2019). "Programmed Cell Death-Like and Accompanying Release of Microcystin in Freshwater Bloom-Forming Cyanobacterium Microcystis: From Identification to Ecological Relevance". Toxins. 11 (12): 706. doi:10.3390/toxins11120706. ISSN 2072-6651. PMC 6950475. PMID 31817272.
- ^ Rzymski, Piotr; Klimaszyk, Piotr; Jurczak, Tomasz; Poniedziałek, Barbara (2020). "Oxidative Stress, Programmed Cell Death and Microcystin Release in Microcystis aeruginosa in Response to Daphnia Grazers". Frontiers in Microbiology. 11: 1201. doi:10.3389/fmicb.2020.01201. ISSN 1664-302X. PMC 7311652. PMID 32625177.
- ^ a b Meeks JC, Elhai J, Thiel T, Potts M, Larimer F, Lamerdin J, et al. (2001). "An overview of the genome of Nostoc punctiforme, a multicellular, symbiotic cyanobacterium". Photosynthesis Research. 70 (1): 85–106. doi:10.1023/A:1013840025518. PMID 16228364. S2CID 8752382.
- ^ Suttle CA (1 January 2000). "Cyanophages and Their Role in the Ecology of Cyanobacteria". In Whitton BA, Potts M (eds.). The Ecology of Cyanobacteria. Springer Netherlands. pp. 563–589. doi:10.1007/0-306-46855-7_20. ISBN 9780792347354.
- ^ Suttle CA, Chan AM (1993). "Marine cyanophages infecting oceanic and coastal strains of Synechococcus: abundance, . morphology, cross-infectivity and growth characteristics". Marine Ecology Progress Series. 92: 99–109. Bibcode:1993MEPS...92...99S. doi:10.3354/meps092099.
- ^ Fokine A, Rossmann MG (January 2014). "Molecular architecture of tailed double-stranded DNA phages". Bacteriophage. 4 (1): e28281. doi:10.4161/bact.28281. PMC 3940491. PMID 24616838.
- ^ Proctor LM, Fuhrman JA (1990). "Viral mortality of marine bacteria and cyanobacteria". Nature. 343 (6253): 60–62. Bibcode:1990Natur.343...60P. doi:10.1038/343060a0. S2CID 4336344.
- ^ a b Sarma TA.시아노박테리아 핸드북의 '시아노파지' (CRC Press; 2012) (ISBN 1466559411)
- ^ Duggan PS, Gottardello P, Adams DG (June 2007). "Molecular analysis of genes in Nostoc punctiforme involved in pilus biogenesis and plant infection". Journal of Bacteriology. 189 (12): 4547–4551. doi:10.1128/JB.01927-06. PMC 1913353. PMID 17416648.
- ^ Wilde A, Mullineaux CW (December 2015). "Motility in cyanobacteria: polysaccharide tracks and Type IV pilus motors". Molecular Microbiology. 98 (6): 998–1001. doi:10.1111/mmi.13242. PMID 26447922. S2CID 22585994.
- ^ Waterbury JB, Willey JM, Franks DG, Valois FW, Watson SW (October 1985). "A cyanobacterium capable of swimming motility". Science. 230 (4721): 74–76. Bibcode:1985Sci...230...74W. doi:10.1126/science.230.4721.74. PMID 17817167. S2CID 29180516.
- ^ Ehlers K, Oster G (2012). "On the mysterious propulsion of Synechococcus". PLOS ONE. 7 (5): e36081. Bibcode:2012PLoSO...736081E. doi:10.1371/journal.pone.0036081. PMC 3342319. PMID 22567124.
- ^ Miyata M, Robinson RC, Uyeda TQ, Fukumori Y, Fukushima SI, Haruta S, et al. (January 2020). "Tree of motility - A proposed history of motility systems in the tree of life". Genes to Cells. 25 (1): 6–21. doi:10.1111/gtc.12737. PMC 7004002. PMID 31957229.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Castenholz RW (1982). "Motility and taxes". In Carr NG, Whitton BA (eds.). The biology of cyanobacteria. University of California Press, Berkeley and Los Angeles. pp. 413–439. ISBN 978-0-520-04717-4.
- ^ Waterbury JB, Willey JM, Franks DG, Valois FW, Watson SW (October 1985). "A cyanobacterium capable of swimming motility". Science. 230 (4721): 74–76. Bibcode:1985Sci...230...74W. doi:10.1126/science.230.4721.74. PMID 17817167. S2CID 29180516.
- ^ McBride MJ (2001). "Bacterial gliding motility: multiple mechanisms for cell movement over surfaces". Annual Review of Microbiology. 55: 49–75. doi:10.1146/annurev.micro.55.1.49. PMID 11544349.
- ^ Reichenbach H (1981). "Taxonomy of the gliding bacteria". Annual Review of Microbiology. 35: 339–364. doi:10.1146/annurev.mi.35.100181.002011. PMID 6794424.
- ^ Hoiczyk E, Baumeister W (October 1998). "The junctional pore complex, a prokaryotic secretion organelle, is the molecular motor underlying gliding motility in cyanobacteria". Current Biology. 8 (21): 1161–1168. doi:10.1016/S0960-9822(07)00487-3. PMID 9799733. S2CID 14384308.
- ^ Hoiczyk E (2000). "Gliding motility in cyanobacterial: observations and possible explanations". Archives of Microbiology. 174 (1–2): 11–17. doi:10.1007/s002030000187. PMID 10985737. S2CID 9927312.
- ^ Bhaya D, Watanabe N, Ogawa T, Grossman AR (March 1999). "The role of an alternative sigma factor in motility and pilus formation in the cyanobacterium Synechocystis sp. strain PCC6803". Proceedings of the National Academy of Sciences of the United States of America. 96 (6): 3188–3193. Bibcode:1999PNAS...96.3188B. doi:10.1073/pnas.96.6.3188. PMC 15917. PMID 10077659.
- ^ a b Donkor VA, Amewowor DH, Häder DP (1993). "Effects of tropical solar radiation on the motility of filamentous cyanobacteria". FEMS Microbiology Ecology. 12 (2): 143–147. doi:10.1111/j.1574-6941.1993.tb00026.x.
- ^ Garcia-Pichel F, Mechling M, Castenholz RW (May 1994). "Diel Migrations of Microorganisms within a Benthic, Hypersaline Mat Community". Applied and Environmental Microbiology. 60 (5): 1500–1511. Bibcode:1994ApEnM..60.1500G. doi:10.1128/aem.60.5.1500-1511.1994. PMC 201509. PMID 16349251.
- ^ Fourçans A, Solé A, Diestra E, Ranchou-Peyruse A, Esteve I, Caumette P, Duran R (September 2006). "Vertical migration of phototrophic bacterial populations in a hypersaline microbial mat from Salins-de-Giraud (Camargue, France)". FEMS Microbiology Ecology. 57 (3): 367–377. doi:10.1111/j.1574-6941.2006.00124.x. PMID 16907751.
- ^ Richardson LL, Castenholz RW (September 1987). "Diel Vertical Movements of the Cyanobacterium Oscillatoria terebriformis in a Sulfide-Rich Hot Spring Microbial Mat". Applied and Environmental Microbiology. 53 (9): 2142–2150. Bibcode:1987ApEnM..53.2142R. doi:10.1128/aem.53.9.2142-2150.1987. PMC 204072. PMID 16347435.
- ^ Häder DP (1987). "EFFECTS OF UV-B IRRADIATION ON PHOTOMOVEMENT IN THE DESMID, Cosmarium cucumis". Photochemistry and Photobiology. 46: 121–126. doi:10.1111/j.1751-1097.1987.tb04745.x. S2CID 97100233.
- ^ Nultsch W, Häder DP (June 1988). "Photomovement in motile microorganisms--II". Photochemistry and Photobiology. 47 (6): 837–869. doi:10.1111/j.1751-1097.1988.tb01668.x. PMID 3064112. S2CID 26445775.
- ^ Checkucci, G., Sgarbossa, A. and Lenci, F. (2004) "미생물의 광운동:소개.CRC 유기광화학 및 광생물학 핸드북, 제2판, CRC Press.
- ^ 널치, 빌헬름(1962) "시아노피센의 리히테스 오프 디에프 디에프: III. 미테일룽: 포토포보탁스IS 폰 포르미디움 언키나툼." 플랜타, 58(6): 647–63.
- ^ Nultsch W, Schuchart H, Höhl M (1979). "Investigations on the phototactic orientation of Anabaena variabilis". Archives of Microbiology. 122: 85–91. doi:10.1007/BF00408050. S2CID 12242837.
- ^ Riding R (2007). "The term stromatolite: towards an essential definition". Lethaia. 32 (4): 321–30. doi:10.1111/j.1502-3931.1999.tb00550.x.
- ^ Baumgartner RJ, Van Kranendonk MJ, Wacey D, Fiorentini ML, Saunders M, Caruso S, et al. (2019). "Nano-porous pyrite and organic matter in 3.5-billion-year-old stromatolites record primordial life" (PDF). Geology. 47 (11): 1039–43. Bibcode:2019Geo....47.1039B. doi:10.1130/G46365.1. S2CID 204258554.
- ^ Schopf JW, Packer BM (July 1987). "Early Archean (3.3-billion to 3.5-billion-year-old) microfossils from Warrawoona Group, Australia". Science. 237 (4810): 70–73. Bibcode:1987Sci...237...70S. doi:10.1126/science.11539686. PMID 11539686.
- ^ Lane N (6 February 2010). "First breath: Earth's billion-year struggle for oxygen". New Scientist. pp. 36–39. 첨부된 그래프도 참조하십시오.
- ^ Corsetti FA, Awramik SM, Pierce D (April 2003). "A complex microbiota from snowball Earth times: microfossils from the Neoproterozoic Kingston Peak Formation, Death Valley, USA". Proceedings of the National Academy of Sciences of the United States of America. 100 (8): 4399–4404. Bibcode:2003PNAS..100.4399C. doi:10.1073/pnas.0730560100. PMC 153566. PMID 12682298.
- ^ Gutschick RC, Perry TG (1 November 1959). "Sappington (Kinderhookian) sponges and their environment [Montana]". Journal of Paleontology. 33 (6): 977–85. Retrieved 28 June 2007.
- ^ Riding R (1991). Calcareous Algae and Stromatolites. Springer-Verlag Press. p. 32.
- ^ Monty CL (1981). "Spongiostromate vs. Porostromate Stromatolites and Oncolites". In Monty CL (ed.). Phanerozoic Stromatolites. Berlin, Heidelberg: Springer. pp. 1–4. doi:10.1007/978-3-642-67913-1_1. ISBN 978-3-642-67913-1.
- ^ Castellani C, Maas A, Eriksson ME, Haug JT, Haug C, Waloszek D (2018). "First record of Cyanobacteria in Cambrian Orsten deposits of Sweden". Palaeontology. 61 (6): 855–880. Bibcode:2018Palgy..61..855C. doi:10.1111/pala.12374. S2CID 134049042.
- ^ "How do plants make oxygen? Ask cyanobacteria". Phys.org. Science X. 30 March 2017. Retrieved 26 October 2017.
- ^ Herrero A (2008). Flores E (ed.). The Cyanobacteria: Molecular Biology, Genomics and Evolution (1st ed.). Caister Academic Press. ISBN 978-1-904455-15-8.
- ^ a b Keeling PJ (2013). "The number, speed, and impact of plastid endosymbioses in eukaryotic evolution". Annual Review of Plant Biology. 64: 583–607. doi:10.1146/annurev-arplant-050312-120144. PMID 23451781. S2CID 207679266.
- ^ Moore KR, Magnabosco C, Momper L, Gold DA, Bosak T, Fournier GP (2019). "An Expanded Ribosomal Phylogeny of Cyanobacteria Supports a Deep Placement of Plastids". Frontiers in Microbiology. 10: 1612. doi:10.3389/fmicb.2019.01612. PMC 6640209. PMID 31354692.
- ^ Howe CJ, Barbrook AC, Nisbet RE, Lockhart PJ, Larkum AW (August 2008). "The origin of plastids". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 363 (1504): 2675–2685. doi:10.1098/rstb.2008.0050. PMC 2606771. PMID 18468982.
- ^ a b Rodríguez-Ezpeleta N, Brinkmann H, Burey SC, Roure B, Burger G, Löffelhardt W, et al. (July 2005). "Monophyly of primary photosynthetic eukaryotes: green plants, red algae, and glaucophytes". Current Biology. 15 (14): 1325–1330. doi:10.1016/j.cub.2005.06.040. PMID 16051178.
- ^ Adl SM, Simpson AG, Lane CE, Lukeš J, Bass D, Bowser SS, et al. (September 2012). "The revised classification of eukaryotes". The Journal of Eukaryotic Microbiology. 59 (5): 429–493. doi:10.1111/j.1550-7408.2012.00644.x. PMC 3483872. PMID 23020233.
- ^ Price DC, Chan CX, Yoon HS, Yang EC, Qiu H, Weber AP, et al. (February 2012). "Cyanophora paradoxa genome elucidates origin of photosynthesis in algae and plants". Science. 335 (6070): 843–847. Bibcode:2012Sci...335..843P. doi:10.1126/science.1213561. PMID 22344442. S2CID 17190180.
- ^ a b Ponce-Toledo RI, Deschamps P, López-García P, Zivanovic Y, Benzerara K, Moreira D (February 2017). "An Early-Branching Freshwater Cyanobacterium at the Origin of Plastids". Current Biology. 27 (3): 386–391. doi:10.1016/j.cub.2016.11.056. PMC 5650054. PMID 28132810.
- ^ Schimper AF (1883). "Über die Entwicklung der Chlorophyllkörner und Farbkörper" [About the development of the chlorophyll grains and stains]. Bot. Zeitung (in German). 41: 105–14, 121–31, 137–46, 153–62. Archived from the original on 19 October 2013.
- ^ Alberts B (2002). "Chloroplasts and Photosynthesis". Molecular Biology of the Cell (4. ed.). New York [u.a.]: Garland. ISBN 978-0-8153-4072-0.
- ^ Mereschkowsky C (1905). "Über Natur und Ursprung der Chromatophoren im Pflanzenreiche" [About the nature and origin of chromatophores in the vegetable kingdom]. Biol Centralbl (in German). 25: 593–604.
- ^ Sagan L (March 1967). "On the origin of mitosing cells". Journal of Theoretical Biology. 14 (3): 255–274. Bibcode:1967JThBi..14..225S. doi:10.1016/0022-5193(67)90079-3. PMID 11541392.
- ^ Schwartz RM, Dayhoff MO (January 1978). "Origins of prokaryotes, eukaryotes, mitochondria, and chloroplasts". Science. 199 (4327): 395–403. Bibcode:1978Sci...199..395S. doi:10.1126/science.202030. PMID 202030.
- ^ Archibald JM (August 2015). "Genomic perspectives on the birth and spread of plastids". Proceedings of the National Academy of Sciences of the United States of America. 112 (33): 10147–10153. Bibcode:2015PNAS..11210147A. doi:10.1073/pnas.1421374112. PMC 4547232. PMID 25902528.
- ^ Blankenship RE (October 2010). "Early evolution of photosynthesis". Plant Physiology. 154 (2): 434–438. doi:10.1104/pp.110.161687. PMC 2949000. PMID 20921158.
- ^ Rockwell NC, Lagarias JC, Bhattacharya D (2014). "Primary endosymbiosis and the evolution of light and oxygen sensing in photosynthetic eukaryotes". Frontiers in Ecology and Evolution. 2 (66). doi:10.3389/fevo.2014.00066. PMC 4343542. PMID 25729749.
- ^ 요약:
- ^ Nowack EC, Melkonian M, Glöckner G (March 2008). "Chromatophore genome sequence of Paulinella sheds light on acquisition of photosynthesis by eukaryotes". Current Biology. 18 (6): 410–418. doi:10.1016/j.cub.2008.02.051. PMID 18356055.
- ^ Keeling PJ (October 2004). "Diversity and evolutionary history of plastids and their hosts". American Journal of Botany. 91 (10): 1481–1493. doi:10.3732/ajb.91.10.1481. PMID 21652304.
- ^ Archibald JM (January 2009). "The puzzle of plastid evolution". Current Biology. 19 (2): R81–R88. doi:10.1016/j.cub.2008.11.067. PMID 19174147.
- ^ Douglas SE (December 1998). "Plastid evolution: origins, diversity, trends". Current Opinion in Genetics & Development. 8 (6): 655–661. doi:10.1016/S0959-437X(98)80033-6. PMID 9914199.
- ^ Reyes-Prieto A, Weber AP, Bhattacharya D (2007). "The origin and establishment of the plastid in algae and plants". Annual Review of Genetics. 41: 147–168. doi:10.1146/annurev.genet.41.110306.130134. PMID 17600460.
- ^ Raven JA, Allen JF (2003). "Genomics and chloroplast evolution: what did cyanobacteria do for plants?". Genome Biology. 4 (3): 209. doi:10.1186/gb-2003-4-3-209. PMC 153454. PMID 12620099.
- ^ a b c Bekker A, Holland HD, Wang PL, Rumble D, Stein HJ, Hannah JL, et al. (January 2004). "Dating the rise of atmospheric oxygen". Nature. 427 (6970): 117–120. Bibcode:2004Natur.427..117B. doi:10.1038/nature02260. PMID 14712267. S2CID 4329872.
- ^ Kump LR, Junium C, Arthur MA, Brasier A, Fallick A, Melezhik V, et al. (December 2011). "Isotopic evidence for massive oxidation of organic matter following the great oxidation event". Science. 334 (6063): 1694–1696. Bibcode:2011Sci...334.1694K. doi:10.1126/science.1213999. PMID 22144465. S2CID 27680273.
- ^ Fralick P, Davis DW, Kissin SA (2002). "The age of the Gunflint Formation, Ontario, Canada: Single zircon U–Pb age determinations from reworked volcanic ash". Canadian Journal of Earth Sciences. 39 (7): 1085–1091. Bibcode:2002CaJES..39.1085F. doi:10.1139/e02-028.
- ^ a b Holland HD (June 2006). "The oxygenation of the atmosphere and oceans". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 361 (1470): 903–915. doi:10.1098/rstb.2006.1838. PMC 1578726. PMID 16754606.
- ^ a b c d Lyons TW, Reinhard CT, Planavsky NJ (February 2014). "The rise of oxygen in Earth's early ocean and atmosphere". Nature. 506 (7488): 307–315. Bibcode:2014Natur.506..307L. doi:10.1038/nature13068. PMID 24553238. S2CID 4443958.
- ^ a b Sahoo SK, Planavsky NJ, Kendall B, Wang X, Shi X, Scott C, et al. (September 2012). "Ocean oxygenation in the wake of the Marinoan glaciation". Nature. 489 (7417): 546–549. Bibcode:2012Natur.489..546S. doi:10.1038/nature11445. PMID 23018964. S2CID 4391882.
- ^ a b Canfield DE, Poulton SW, Narbonne GM (January 2007). "Late-Neoproterozoic deep-ocean oxygenation and the rise of animal life". Science. 315 (5808): 92–95. Bibcode:2007Sci...315...92C. doi:10.1126/science.1135013. PMID 17158290. S2CID 24761414.
- ^ a b c Fike DA, Grotzinger JP, Pratt LM, Summons RE (December 2006). "Oxidation of the Ediacaran ocean". Nature. 444 (7120): 744–747. Bibcode:2006Natur.444..744F. doi:10.1038/nature05345. PMID 17151665. S2CID 4337003.
- ^ Sánchez-Baracaldo P, Ridgwell A, Raven JA (March 2014). "A neoproterozoic transition in the marine nitrogen cycle". Current Biology. 24 (6): 652–657. doi:10.1016/j.cub.2014.01.041. PMID 24583016. S2CID 16756351.
- ^ Erwin DH, Laflamme M, Tweedt SM, Sperling EA, Pisani D, Peterson KJ (November 2011). "The Cambrian conundrum: early divergence and later ecological success in the early history of animals". Science. 334 (6059): 1091–1097. Bibcode:2011Sci...334.1091E. doi:10.1126/science.1206375. PMID 22116879. S2CID 7737847.
- ^ Poulton SW, Canfield DE (2011). "Ferruginous Conditions: A Dominant Feature of the Ocean through Earth's History". Elements. 7 (2): 107–112. doi:10.2113/gselements.7.2.107.
- ^ Anbar AD, Knoll AH (August 2002). "Proterozoic ocean chemistry and evolution: a bioinorganic bridge?". Science. 297 (5584): 1137–1142. Bibcode:2002Sci...297.1137A. doi:10.1126/science.1069651. PMID 12183619. S2CID 5578019.
- ^ Orkwiszewski KG, Kaney AR (June 1974). "Genetic transformation of the blue-green bacterium, Anacystis nidulans". Archiv Fur Mikrobiologie. 98 (1): 31–37. doi:10.1007/BF00425265. PMID 4209657. S2CID 5635245.
- ^ Stevens SE, Porter RD (October 1980). "Transformation in Agmenellum quadruplicatum". Proceedings of the National Academy of Sciences of the United States of America. 77 (10): 6052–6056. Bibcode:1980PNAS...77.6052S. doi:10.1073/pnas.77.10.6052. PMC 350211. PMID 16592896.
- ^ Grigorieva G, Shestakov S (1982). "Transformation in the cyanobacterium Synechocystis sp. 6803". FEMS Microbiology Letters. 13 (4): 367–70. doi:10.1111/j.1574-6968.1982.tb08289.x.
- ^ Bernstein H, Bernstein C, Michod RE (January 2018). "Sex in microbial pathogens". Infection, Genetics and Evolution. 57: 8–25. doi:10.1016/j.meegid.2017.10.024. PMID 29111273.
- ^ a b Cassier-Chauvat C, Veaudor T, Chauvat F (2016). "Comparative Genomics of DNA Recombination and Repair in Cyanobacteria: Biotechnological Implications". Frontiers in Microbiology. 7: 1809. doi:10.3389/fmicb.2016.01809. PMC 5101192. PMID 27881980.
- ^ "The LTP". Retrieved 23 February 2021.
- ^ "LTP_all tree in newick format". Retrieved 23 February 2021.
- ^ "LTP_12_2021 Release Notes" (PDF). Retrieved 23 February 2021.
- ^ "GTDB release 08-RS214". Genome Taxonomy Database. Retrieved 10 May 2023.
- ^ "bac120_r214.sp_label". Genome Taxonomy Database. Retrieved 10 May 2023.
- ^ "Taxon History". Genome Taxonomy Database. Retrieved 10 May 2023.
- ^ Von Nägeli C (1857). Caspary R (ed.). "Bericht über die Verhandlungen der 33. Versammlung deutscher Naturforscher und Ärzte, gehalten in Bonn von 18 bis 24 September 1857" [Report on the Proceedings of the 33rd Meeting of German Natural Scientists and Physicians, held in Bonn, 18 to 24 September 1857]. Botanische Zeitung. 15: 749–776.
- ^ Haeckel E (1867). Generelle Morphologie der Organismen. Reimer, Berlin.
- ^ Chatton É (1925). "Pansporella perplexa: amœbien à spores protégées parasite des daphnies réflexions sur la biologie et la phylogénie des protozoaires" [Pansporella perplexa: amoebian with protected spores parasite of daphnia reflections on the biology and phylogeny of protozoa]. Ann. Sci. Nat. Zool. 10 (in French). VII: 1–84.
- ^ a b Gugger MF, Hoffmann L (March 2004). "Polyphyly of true branching cyanobacteria (Stigonematales)". International Journal of Systematic and Evolutionary Microbiology. 54 (Pt 2): 349–357. doi:10.1099/ijs.0.02744-0. PMID 15023942.
- ^ Howard-Azzeh M, Shamseer L, Schellhorn HE, Gupta RS (November 2014). "Phylogenetic analysis and molecular signatures defining a monophyletic clade of heterocystous cyanobacteria and identifying its closest relatives". Photosynthesis Research. 122 (2): 171–185. doi:10.1007/s11120-014-0020-x. PMID 24917519. S2CID 17745718.
- ^ Komárek J, Kaštovský J, Mareš J, Johansen JR (2014). "Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach" (PDF). Preslia. 86: 295–335.
- ^ Pringsheim EG (1963). Farblose Algen: Ein Beitrag zur Evolutionsforschung [Colorless Algae: A Contribution to Evolutionary Research] (in German). Gustav Fischer Verlag.
- ^ Euzéby JP. ""Cyanobacteria"". List of Prokaryotic names with Standing in Nomenclature (LPSN). Retrieved 22 January 2022.
- ^ "Cyanobacteria". National Center for Biotechnology Information (NCBI) taxonomy database. Retrieved 20 March 2021.
- ^ Kaneko T, Sato S, Kotani H, Tanaka A, Asamizu E, Nakamura Y, et al. (June 1996). "Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions". DNA Research. 3 (3): 109–136. doi:10.1093/dnares/3.3.109. PMID 8905231.
- ^ Tabei Y, Okada K, Tsuzuki M (April 2007). "Sll1330 controls the expression of glycolytic genes in Synechocystis sp. PCC 6803". Biochemical and Biophysical Research Communications. 355 (4): 1045–1050. doi:10.1016/j.bbrc.2007.02.065. PMID 17331473.
- ^ Rocap G, Larimer FW, Lamerdin J, Malfatti S, Chain P, Ahlgren NA, et al. (August 2003). "Genome divergence in two Prochlorococcus ecotypes reflects oceanic niche differentiation". Nature. 424 (6952): 1042–1047. Bibcode:2003Natur.424.1042R. doi:10.1038/nature01947. PMID 12917642. S2CID 4344597.
- ^ Dufresne A, Salanoubat M, Partensky F, Artiguenave F, Axmann IM, Barbe V, et al. (August 2003). "Genome sequence of the cyanobacterium Prochlorococcus marinus SS120, a nearly minimal oxyphototrophic genome". Proceedings of the National Academy of Sciences of the United States of America. 100 (17): 10020–10025. Bibcode:2003PNAS..10010020D. doi:10.1073/pnas.1733211100. PMC 187748. PMID 12917486.
- ^ Herdman M, Janvier M, Rippka R, Stanier RY (1979). "Genome Size of Cyanobacteria". Journal of General Microbiology. 111: 73–85. doi:10.1099/00221287-111-1-73.
- ^ Quintana N, Van der Kooy F, Van de Rhee MD, Voshol GP, Verpoorte R (August 2011). "Renewable energy from Cyanobacteria: energy production optimization by metabolic pathway engineering". Applied Microbiology and Biotechnology. 91 (3): 471–490. doi:10.1007/s00253-011-3394-0. PMC 3136707. PMID 21691792.
- ^ Chen X, Lawrence JM, Wey LT, Schertel L, Jing Q, Vignolini S, et al. (July 2022). "3D-printed hierarchical pillar array electrodes for high-performance semi-artificial photosynthesis". Nature Materials. 21 (7): 811–818. Bibcode:2022NatMa..21..811C. doi:10.1038/s41563-022-01205-5. PMID 35256790. S2CID 247255146.
- ^ "파란 녹색 박테리아가 '녹색' 전기를 만드는 것을 도울지도 모릅니다", 힌두어, 2010년 6월 21일
- ^ "Joule wins key patent for GMO cyanobacteria that create fuels from sunlight, CO2 and water : Biofuels Digest". 14 September 2010. Retrieved 10 August 2022.
- ^ Deng MD, Coleman JR (February 1999). "Ethanol synthesis by genetic engineering in cyanobacteria". Applied and Environmental Microbiology. 65 (2): 523–528. Bibcode:1999ApEnM..65..523D. doi:10.1128/AEM.65.2.523-528.1999. PMC 91056. PMID 9925577.
- ^ Liang F, Lindberg P, Lindblad P (20 November 2018). "Engineering photoautotrophic carbon fixation for enhanced growth and productivity". Sustainable Energy & Fuels. 2 (12): 2583–2600. doi:10.1039/C8SE00281A.
- ^ Roussou S, Albergati A, Liang F, Lindblad P (June 2021). "Engineered cyanobacteria with additional overexpression of selected Calvin-Benson-Bassham enzymes show further increased ethanol production". Metabolic Engineering Communications. 12: e00161. doi:10.1016/j.mec.2021.e00161. PMC 7820548. PMID 33520653. S2CID 231727024.
- ^ Choi H, Mascuch SJ, Villa FA, Byrum T, Teasdale ME, Smith JE, et al. (May 2012). "Honaucins A-C, potent inhibitors of inflammation and bacterial quorum sensing: synthetic derivatives and structure-activity relationships". Chemistry & Biology. 19 (5): 589–598. doi:10.1016/j.chembiol.2012.03.014. PMC 3361693. PMID 22633410.
- ^ Frischkorn K (19 June 2017). "Need to Fix a Heart Attack? Try Photosynthesis". Smithsonian. Retrieved 20 May 2021.
- ^ Jeong Y, Cho SH, Lee H, Choi HK, Kim DM, Lee CG, et al. (November 2020). "Current Status and Future Strategies to Increase Secondary Metabolite Production from Cyanobacteria". Microorganisms. 8 (12): 1849. doi:10.3390/microorganisms8121849. PMC 7761380. PMID 33255283.
- ^ Newsome AG, Culver CA, van Breemen RB (July 2014). "Nature's palette: the search for natural blue colorants". Journal of Agricultural and Food Chemistry. 62 (28): 6498–6511. doi:10.1021/jf501419q. PMID 24930897.
- ^ Verseux C, Baqué M, Lehto K, de Vera JP, Rothschild LJ, Billi D (2016). "Sustainable life support on Mars – the potential roles of cyanobacteria". International Journal of Astrobiology. 15 (1): 65–92. Bibcode:2016IJAsB..15...65V. doi:10.1017/S147355041500021X.
- ^ Spolaore P, Joannis-Cassan C, Duran E, Isambert A (February 2006). "Commercial applications of microalgae". Journal of Bioscience and Bioengineering. 101 (2): 87–96. doi:10.1263/jbb.101.87. PMID 16569602. S2CID 16896655.
- ^ Christaki E, Florou-Paneri P, Bonos E (December 2011). "Microalgae: a novel ingredient in nutrition". International Journal of Food Sciences and Nutrition. 62 (8): 794–799. doi:10.3109/09637486.2011.582460. PMID 21574818. S2CID 45956239.
- ^ Ku CS, Pham TX, Park Y, Kim B, Shin MS, Kang I, Lee J (April 2013). "Edible blue-green algae reduce the production of pro-inflammatory cytokines by inhibiting NF-κB pathway in macrophages and splenocytes". Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (4): 2981–2988. doi:10.1016/j.bbagen.2013.01.018. PMC 3594481. PMID 23357040.
- ^ Mišurcová L, Škrovánková S, Samek D, Ambrožová J, Machů L (2012). "Health benefits of algal polysaccharides in human nutrition". Advances in Food and Nutrition Research. 66: 75–145. doi:10.1016/B978-0-12-394597-6.00003-3. ISBN 978-0-12-394597-6. PMID 22909979.
- ^ Thébault L, Lesne J, Boutin JP (1995). "[Cyanobacteria, their toxins and health risks]". Medecine Tropicale. 55 (4): 375–380. PMID 8830224.
- ^ a b "Blue-Green Algae (Cyanobacteria) and Their Toxins - Drinking Water". 30 May 2008. Archived from the original on 30 May 2008. Retrieved 10 August 2022.
- ^ "Harmful Bloom in Lake Atitlán, Guatemala". earthobservatory.nasa.gov. 3 December 2009. Retrieved 10 August 2022. NASA 지구 관측소에서,
- ^ Weirich CA, Miller TR (January 2014). "Freshwater harmful algal blooms: toxins and children's health". Current Problems in Pediatric and Adolescent Health Care. 44 (1): 2–24. doi:10.1016/j.cppeds.2013.10.007. PMID 24439026.
- ^ "Professor Linda Lawton". rgu-repository.worktribe.com. Retrieved 25 June 2021.
- ^ Caller TA, Doolin JW, Haney JF, Murby AJ, West KG, Farrar HE, et al. (2009). "A cluster of amyotrophic lateral sclerosis in New Hampshire: a possible role for toxic cyanobacteria blooms". Amyotrophic Lateral Sclerosis. 10 (Suppl 2): 101–108. doi:10.3109/17482960903278485. PMID 19929741. S2CID 35250897.
- ^ Cox PA, Richer R, Metcalf JS, Banack SA, Codd GA, Bradley WG (2009). "Cyanobacteria and BMAA exposure from desert dust: a possible link to sporadic ALS among Gulf War veterans". Amyotrophic Lateral Sclerosis. 10 (Suppl 2): 109–117. doi:10.3109/17482960903286066. PMID 19929742. S2CID 1748627.
- ^ a b c d e f Main DC (2006). "Toxic Algae Blooms" (PDF). Veterinary Pathologist, South Perth. agric.wa.gov.au. Archived from the original (PDF) on 1 December 2014. Retrieved 18 November 2014.
- ^ May V, Baker H (1978). "Reduction of toxic algae in farm dams by ferric alum". Techn. Bull. 19: 1–16.
- ^ Paerl HW, Huisman J (April 2008). "Climate. Blooms like it hot". Science. 320 (5872): 57–58. doi:10.1126/science.1155398. PMID 18388279. S2CID 142881074.
- ^ Sitoki L, Kurmayer R, Rott E (July 2012). "Spatial variation of phytoplankton composition, biovolume, and resulting microcystin concentrations in the Nyanza Gulf (Lake Victoria, Kenya)". Hydrobiologia. 691 (1): 109–122. doi:10.1007/s10750-012-1062-8. PMC 3968937. PMID 24683268.
- ^ Metcalf JS, Banack SA, Powell JT, Tymm FJ, Murch SJ, Brand LE, Cox PA (2018). "Public health responses to toxic cyanobacterial blooms: Perspectives from the 2016 Florida event". Water Policy. 20 (5): 919–932. doi:10.2166/wp.2018.012. S2CID 88502303.
- ^ a b c Cavicchioli R, Ripple WJ, Timmis KN, Azam F, Bakken LR, Baylis M, et al. (September 2019). "Scientists' warning to humanity: microorganisms and climate change". Nature Reviews. Microbiology. 17 (9): 569–586. doi:10.1038/s41579-019-0222-5. PMC 7136171. PMID 31213707.
 자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다.
자료는 크리에이티브 커먼즈 Attribution 4.0 International License에 따라 제공되는 이 소스에서 복사되었습니다. - ^ Visser PM, Verspagen JM, Sandrini G, Stal LJ, Matthijs HC, Davis TW, et al. (April 2016). "How rising CO2 and global warming may stimulate harmful cyanobacterial blooms". Harmful Algae. 54: 145–159. doi:10.1016/j.hal.2015.12.006. PMID 28073473.
- ^ Walsby AE, Hayes PK, Boje R, Stal LJ (July 1997). "The selective advantage of buoyancy provided by gas vesicles for planktonic cyanobacteria in the Baltic Sea". The New Phytologist. 136 (3): 407–417. doi:10.1046/j.1469-8137.1997.00754.x. PMID 33863010.
- ^ Lehman PW, Kurobe T, Lesmeister S, Baxa D, Tung A, Teh SJ (March 2017). "Impacts of the 2014 severe drought on the Microcystis bloom in San Francisco Estuary". Harmful Algae. 63: 94–108. doi:10.1016/j.hal.2017.01.011. PMID 28366405.
- ^ a b Sandrini G, Ji X, Verspagen JM, Tann RP, Slot PC, Luimstra VM, et al. (August 2016). "Rapid adaptation of harmful cyanobacteria to rising CO2". Proceedings of the National Academy of Sciences of the United States of America. 113 (33): 9315–9320. Bibcode:2016PNAS..113.9315S. doi:10.1073/pnas.1602435113. PMC 4995953. PMID 27482094.
귀속
![]() 이 문서에는 CC BY 2.5 라이센스에 따라 사용 가능한 텍스트가 포함되어 있습니다.
이 문서에는 CC BY 2.5 라이센스에 따라 사용 가능한 텍스트가 포함되어 있습니다.
추가열람
- Gillian C (1997). Nature's Superfood: the Blue-Green Algae Revolution (first ed.). Newleaf. ISBN 978-0-7522-0569-4.
- Savage M (1994). The Millennial Project: Colonizing the Galaxy in Eight Easy Steps. Little Brown & Co. ISBN 978-0-316-77163-4.
- Fogg GE, Stewart WD, Fay P, Walsby AE (1973). The Blue-green Algae. London and New York: Academic Press. ISBN 978-0-12-261650-1.
- "Architects of the earth's atmosphere, Introduction to the Cyanobacteria". University of California, Berkeley. 3 February 2006.
- Whitton BA (2002). "Phylum Cyanophyta (Cyanobacteria)". The Freshwater Algal Flora of the British Isles. Cambridge: Cambridge University Press. ISBN 978-0-521-77051-4.
- Pentecost A, Franke U (2010). "Photosynthesis and calcification of the stromatolitic freshwater cyanobacterium Rivularia". European Journal of Phycology. 45 (4): 345–53. doi:10.1080/09670262.2010.492914.
- Whitton BA, Potts M, eds. (2000). The Ecology of Cyanobacteria: their Diversity in Time and Space. Springer. ISBN 978-0-7923-4735-4.
- "From Micro-Algae to Blue Oil". ParisTech Review. December 2011. Archived from the original on 17 April 2016. Retrieved 2 March 2012.
외부 링크
- 시아노박테리아는 무엇이고 그 종류는 무엇입니까?
- 시아노박테리아 연구용 웹서버 (2019년 9월 16일 아카이브)
- 원시 생명체로 가득 찬 남극 타임캡슐 다이빙







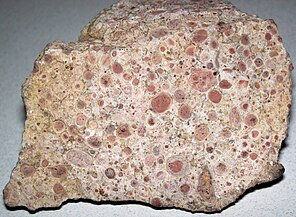

![Cyanobacterial remains of an annulated tubular microfossil Oscillatoriopsis longa [178] Scale bar: 100 μm](http://upload.wikimedia.org/wikipedia/commons/thumb/3/38/Oscillatoriopsis_longa_fossil.jpg/217px-Oscillatoriopsis_longa_fossil.jpg)









