양성자 운동
Protist locomotion| 다음에 대한 시리즈 일부 |
| 미생물 및 마이크로봇 이동 |
|---|
 |
| 마이크로스위머 |
| 분자 모터 |
원자는 식물, 곰팡이, 동물로 분류할 수 없는 진핵생물이다. 그들은 대부분 단세포적이고 미시적이다. 많은 단세포 원생들, 특히 원생동물들은 운동성이며 플라겔라, 칠리아 또는 유사동물을 이용하여 운동을 일으킬 수 있다. 이동에 플라겔라를 사용하는 세포는 보통 플라겔라테스라고 하고, 섬유를 사용하는 세포는 보통 섬유를, 가성비를 사용하는 세포는 보통 아메바나 아메보이드라고 부른다. 다른 양성자들은 운동성이 없고, 따라서 운동 메커니즘이 내장되어 있지 않다.
개요
단세포 원자는 사실상 모든 환경과 서식지를 망라하는 거대하고 다양한 유기체 그룹을 구성하며, 형태와 형태를 보여준다. 파라메슘 또는 편백유글레나의 수백 종은 해양, 고사리, 민물 저장고에서 발견된다; 녹조 클라미도모나스는 전세계적으로 토양과 민물에서 분포한다;[5] Giardia 속으로부터의 기생충은 몇몇 척추동물의 장을 식민지화한다.[6] 이러한 유기체의 공통적인 특징 중 하나는 영양소 획득과 위험의 회피에 중요한 운동성이다.[7] 진화 과정에서 단세포 생물이 다양한 방향으로 발달해 풍부한 형태학으로 인해 수영모드의 스펙트럼이 넓다.[8][2]
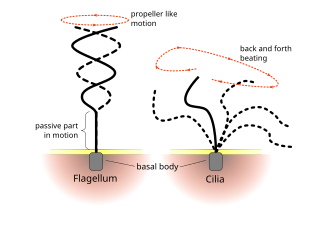
많은 수영 원자들은 필요한 추력을 내기 위해 플라젤라 또는 섬광이라고 불리는 꼬리 모양의 맹장을 작동시킨다.[9] 이는 플라겔럼을 따라 능동적으로 변형을 발생시켜 복잡한 파형을 발생시킴으로써 달성된다. 플라젤라 액소네임 자체는 2개의 중앙 마이크로튜브를 둘러싸고 있는 9쌍의 마이크로튜브 더블트(microtule double) 묶음으로 '9 + 2' 구조로 불리며,[10] ATP 가수분해로 구동되는 크로스링크링 다이네인 모터는 필라멘트의 상대적 슬라이딩을 촉진하여 기계적인 작업을 수행하여 휨변형을 초래한다.[2]
원생 플라겔라는 형태와 기능이 다양하지만, 플라겔라테와 킬리테 두 대가족은 플라겔라의 모양과 박동 패턴으로 구별할 수 있다.[11][2]
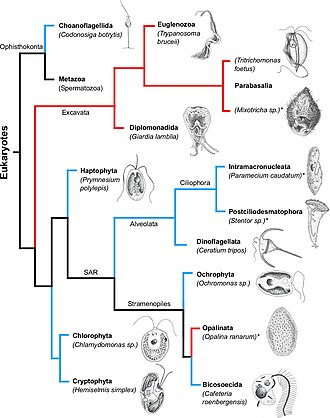
오른쪽의 계통생식수목에서는 수생생물(해양, 고사리, 담수환경에 서식하는 생물)이 푸른색으로 가지를 그은 반면 기생생물들은 빨간색으로 가지를 그린다. 필리핀 사람들은 그들의 이름 뒤에 별표를 붙인다. 굵은 글씨체로 표시된 각각의 망울에 대해, 그 이름 옆에 대표적인 유기체가 스케치되어 있다.[2]
교통수단
어떻게 움직이는가에 따라 양성자 | ||||||||
|---|---|---|---|---|---|---|---|---|
| 양성자 유형 | 이동 메커니즘 | 설명 | 예 | 기타 예 | ||||
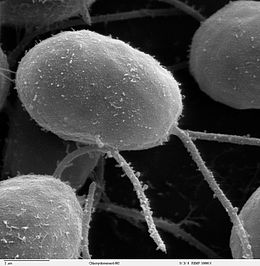
| 모틸레 | 플라겔라테스 | 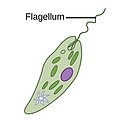 | 플라젤룸(회초용 라틴)은 일부 원생체의 세포체(일부 박테리아뿐만 아니라)에서 튀어나온 래쉬 같은 부속물이다. 플라겔라테는 1개에서 몇 개까지의 플라겔라를 이동에 사용하며 때로는 먹이를 주고 감각 기관지로 사용한다. |  | 암호학 | 모든 디노플라겔레이트 및 나노플라겔레이트(choanoflagellates, silicoflagellates, 대부분의 녹조)[12][13] | ||
| 킬리아테스 | 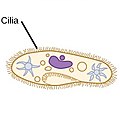 | 실륨(속눈썹용 라틴)은 아주 작은 플라겔럼이다. 이탈리아인들은 물을 통해 스스로 힘을 내기 위해 수백 개에 달하는 여러 개의 섬유를 사용한다. |  | 파라메키움부르사리아 섬유를 보려면 클릭하다. | 아미노산, 그리고 몇몇의 해양 아메배, 섬, 편백류. | |||
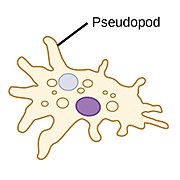
| 아메바스 (아메보이드) | 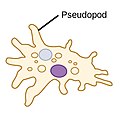 | 가성비(가짜 발을 뜻하는 그리스어)는 아메바(아메바)가 단단한 표면에 닻을 내리고 자신을 앞으로 당기기 위해 사용하는 로브 모양의 부속물이다. 그들은 이러한 가성비를 확장하고 축소함으로써 그들의 모양을 바꿀 수 있다.[14] | 아메바 | 모든 주요 양성자 혈통에서 발견된다. 아메보이드 세포는 원생대 사이에서 발생하지만 조류와 곰팡이에서도 발생한다.[15][16] | ||||
| 모티일이 아님 | 없는 | 디아톰 | 디아톰, 코콜리토포레스, 그리고[13] 비운동성 종. 원생동물 중 기생성 아피콤플렉타는 비운동성이다. | |||||
플라겔라테스
플라겔라는 원핵생물(아카리아와 박테리아)뿐만 아니라 원핵생물에도 사용된다. 또 플라겔라와 질리아는 모두 원생과는 별개로 진핵세포(식물 및 동물)에 널리 쓰인다.
진핵균과 플라겔라의 규칙적인 박동 패턴은 세포 수준에서 움직임을 생성한다. 예를 들면, 정자조아 수영과 같은 단일 세포의 추진에서부터 호흡기와 같은 고정된 세포층을 따라 액체를 운반하는 것까지 다양하다. 진핵 플라겔라와 운동성 섬유가 극단적으로 동일하지만 두 오르가넬의 박동 패턴은 다를 수 있다. 플라겔라의 경우 동작이 평면적이고 파동 같은 경우가 많은 반면, 운동성 실리아는 파워와 회복 스트로크로 더 복잡한 3차원 동작을 수행하는 경우가 많다.
진핵 플라겔라는 동물, 식물, 그리고 원생 세포의 그것들 중 하나로서 앞뒤로 부딪치는 복잡한 세포 투영이다. 진핵 플라겔라는 세포 기능이나 운동성에서 두드러진 웨이브 첨가 역할을 강조하기 위해 진핵 운동성 섬유증과 함께 운울리포디아로[17] 분류된다. 1차적 성욕은 불결하고, 불결하지 않다.
플라겔라테스는 전형적으로 몸체에 분포하는 소수의 긴 플라겔라를 가지고 있으며, 그것들은 그것들을 작동시켜 추력을 발생시킨다. 관측된 이동 시퀀스 집합은 평면 비탈진 파동과 기저에서 끝 또는 반대 방향으로 이동하는 나선 파동을 포함한다.[19][20] 같은 몸에 붙어 있는 플라겔라는 서로 다른 박동 패턴을 따를 수도 있어 세포 몸이 유체에 가해지는 저항에도 종종 의존하는 복잡한 운동전략으로 이어질 수 있다.[2]
킬리아테스
편모충과는 대조적으로, 편모충류의 추진은 빽빽하게 들어차 있고 집단적으로 움직이는 편모충의 층이 몸을 덮고 있는 짧은 머리카락 같은 편모충의 움직임에서 비롯된다. 브레넨과 위넷(1977)의 세미날 리뷰지에는 두 그룹의 몇 가지 예가 나열되어 있으며, 그 형태, 비트 형태, 기하학적 특성, 수영의 특성 등이 강조되어 있다.[20] Cilia는 주변 유체의 운반에도 사용될 수 있으며, 이들의 협조성은 유도된 흐름 생성으로 이어질 수 있다. 고등 생물체에서 이것은 식물 세포 내의 세포질 스트리밍과 [21]같이 내부 이동 과정이나 여성 포유류에서 난자에서 자궁으로 난자를 운반하는 과정에서 매우 중요하다.[22][2]
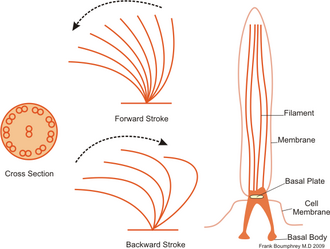
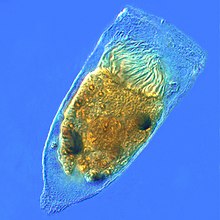
섬나라에는 일반적으로 수백에서 수천 마리의 섬이 밀집되어 있으며, 이 섬들은 빽빽하게 배열되어 있다. 플라겔라처럼, 킬리아는 특수 분자 모터에 의해 움직인다. 능률적인 전방 스트로크는 경직된 플레지럼으로 만들어지고, 그 다음에는 느긋한 플레지럼으로 만들어진 비효율적인 후방 스트로크가 이어진다. 이동 중에는 개별 실륨이 높은 마찰력 스트로크와 낮은 마찰력 회복 스트로크를 사용하면서 변형된다. 개별 유기체에 여러 개의 섬유가 포집되어 있기 때문에, 그들은 시대착오적인 리듬으로 집단 행동을 보여준다. 이것은 하나의 실륨의 변형이 그 이웃의 변형과 위상에 있어 유기체의 표면을 따라 전파되는 변형파를 발생시킨다는 것을 의미한다. 이러한 섬유의 전파 물결은 유기체가 섬유를 움직이기 위해 조정된 방식으로 사용할 수 있게 하는 것이다. 규산 미생물의 대표적인 예는 수천 마리의 섬유가 뒤덮인 단세포의 규산 원생동물인 파라메키움이다. 함께 뛰는 섬은 파라메슘이 초당 500마이크로미터의 속도로 물을 통과하도록 한다.[23]
박테리아를 먹고 있는 파라메슘
섬모가 뚜렷이 보이는 섬모세포의 옥시트리차 삼팔락스
수영실리테리어
| 외부 영상 | |
|---|---|
아메바스
세 번째 일반적인 형태의 양성자 세포 운동성은 행동 의존적인 세포 이동이다. 플라겔라 기반 수영의 진화는 잘 연구되어 왔으며, 강력한 증거는 현대의 진핵생물 다양화 이전에 발생한 진핵 플라겔룸에 대한 단일 진화 기원을 시사한다. 반면에, 행동 의존적 기어는 많은 다른 분자 메커니즘을 사용하며, 이러한 메커니즘이 어떻게 진화했는가에 대한 연구는 이제 막 시작에 불과하다.[25]
식민주의자들
고니움은 볼로보스과과에 속하는 식민지 해조류의 속이다. 전형적인 식민지는 모두 같은 크기의 4~16개의 세포를 평판으로 배열하여 전후분화가 없다. 16개의 세포로 이루어진 군집에서는 4개가 중앙에 있고, 나머지 12개는 각각 3개씩 4면에 있다.[28]
생물학의 세균성 이론에 관한 어거스트 와이스만의 연구와 진화론에서의 개인의 특성에 관한 줄리안 헉슬리의 연구 이후,[30] 볼로보스과과에 속하는 다양한 종류의 녹조가 단세포에서 다세포 생물로의 진화 전환 연구에 중요한 것으로 인식되어 왔다. 현대 생물학적 view,[31일]에서 이 중요성 이 조류의 특정한 형상의 사실이 아닌 현존하는 가족(필요성 미세 화석을 공부하기 위해 obviating), 쉽게 자연에서 얻어지는, 시각의 다양한(, 발달, 유전적 생화학적)에서 있으며, 상당한 적이 있습니다. 공부를 해왔다 등의 여러 생긴다. 환경논리적 연구 유동적인 역동적인 관점에서 보면,[32] 그들의 비교적 큰 크기와 쉬운 배양 조건들은 그들의 운동성, 플라겔라로 그들이 만들어내는 흐름, 유기체들 사이의 상호작용에 대한 정확한 연구를 가능하게 하는 반면, 그들의 높은 대칭성은 그러한 같은 현상에 대한 이론적 설명을 단순화시킨다.[33][26]
그들이 광합성을 하기 때문에, 이 해조류의 광축 실행 능력은 그들의 삶에 중심이 된다. 혈통은 단세포에서 큰 식민지 형태에 이르는 것이기 때문에 운동성의 다세포적 조정의 진화를 연구하는 데 사용될 수 있다. 운동성 녹조의 운동성과 광축은 최근 몇 년 동안 광범위한 문헌의 주제였으며, 주로 단세포 클라미도모나와 훨씬 큰 볼박스의 두 가지 극단적인 경우에 초점을 맞추고 있으며,[34][35][36][37][38][39][40] 종은 1000–50,000 세포로 구성되어 있다. 클라미도모나스는 추진력과 느린 몸 회전을 결합한 가슴 스트로크에 두 개의 플라겔라를 작동시켜 헤엄친다. 그것은 빛에 매우 민감한 작은 영역인 눈구멍을 가지고 있는데,[41][42] 이것은 두 개의 플라겔라를 다르게 촉발시킨다.[43] 이러한 반응은 세포 몸체의 회전 기간과 일치하는 시간에 적응하며, 세포가 환경을 스캔하고 빛을 향해 헤엄칠 수 있도록 한다.[44][45][46][47] 다세포 볼박스는 내부 세균세포와 추진 전용 체세포의 분화가 이뤄지며 복잡성이 더 높은 것으로 나타났다. 볼복스는 세포 조정에 중추신경계가 부족함에도 불구하고 정확한 광축이 나타난다. 이는 또한 변화하는 광도에 대한 적응적 반응에 의해 달성되며, 반응 시간은 군집 회전 기간에 맞춰 조정되어 스피로이드의 밝은 면과 어두운 면 사이에 차분하게 반응한다.[35][48][26]
이상에 비추어 볼 때 자연스러운 질문은 다음과 같다. 가장 단순하게 분화된 유기체는 어떻게 광축을 달성하는가? 볼보신 혈통에서 관심 종은 고니움이다. 이 8개 또는 16개 세포 군락은 진정한 다세포로 가는 첫 단계 중 하나를 나타내며,[49] 다른 볼보신 해조류보다 일찍 단세포 공통의 조상으로부터 진화한 것으로 추정된다.[50] 세포 분화를 보여주는 것도 처음이다.[26]
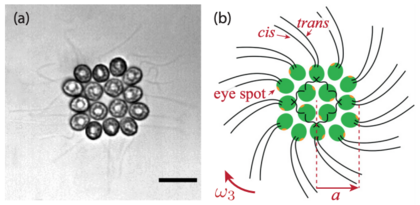
오른쪽 다이어그램에 나타난 16세포 고늄 군집은 각각 분리되어 있는 4세포와 12세포의 두 개의 동심원 사각형으로 구성되어 있으며, 세포외 매트릭스에 의해 결합되어 있다.[51] 모든 플라겔라는 같은 면을 지적한다. 볼복스(Volvox)보다 훨씬 낮은 대칭을 보이며, 전후 대칭이 결여되어 있다. 그러나 그것은 추진력과 신체 회전을 혼합하고 빛을 향해 효율적으로 헤엄칠 때 단세포와 큰 집락과 유사한 기능을 수행한다.[34][52][53] 내측세포와 말초세포의 편평조직은 깊은 차이가 있다:[54][55] 중심세포는 클라미도모나스와 유사하며, 두 편평이 반대되는 유방 뇌졸중으로 박동하며, 주로 식민지의 전진 추진에 기여한다. 그러나 주변 세포들은 플라겔라가 볼복스 세포에 가까운 방식으로 평행하게 박동한다.[27] 이것은 긴장된 상호작용을 최소화하고 플라젤라가 서로 교차하는 것을 방지한다.[34] 더욱이 이러한 플라젤라는 약간 각도를 심어 바람개비 방식으로 조직된다[그림 1(b)[54] 참조]. 이들의 구타는 그림 1(c)과 1(d) 및 보충 영화 1에서 강조된 식민지의 좌회전[29]을 유도한다. 따라서 고니움의 플라겔라 구조는 다세포와 세포 분화를 향한 진화의 중간지점으로서의 핵심 위치를 보강한다.[26]
이 작고 평평한 조립품들은 18세기 이후 자연주의자들의 관심을 끌었던 나선형 궤도를 따라 흥미진진하게 헤엄치는 모습을 보여준다.[52][53][56] 그러나 고니움 식민지가 빛을 향해 헤엄치는 방식은 여전히 불명확하다. 초기의 현미경 관측 결과 집단의 조명과 음영면 사이의 차등 편평활성이 광도 방향 전환의 근원으로 확인되었다.[52][53] 그러나 플라겔라 반응과 빛의 변화, 그리고 식민지에 작용하는 유체역학 힘과 토크를 양적으로 연결하는 완전한 유체역학 묘사는 여전히 부족하다. 진화론적 관점에서 고니움의 광축은 단세포 조상의 광전적 전략이 식민지 형태로 유지되는 정도, 광전 플라겔라 반응이 식민지의 기하와 대칭에 어떻게 적응하는지, 그리고 그것이 어떻게 효과적인 방향 전환으로 이어지는지 등의 근본적인 문제를 제기한다.[26]
양성자 택시: 방향 운동
광축
일부 시위자들은 택시라고 불리는 운동인 자극으로부터 멀어질 수 있다. 예를 들어, 광축이라고 불리는 빛을 향한 움직임은 그들의 운동 전략을 빛 감지 기관과 결합시킴으로써 이루어진다.[58] eukaryotes는 생명체 역사상 처음으로 열린 물에서 3차원의 빛 방향을 따라가는 능력을 진화했다. 진핵 감각 통합, 감각 처리, 전술 대응의 속도와 역학의 전략은 원핵생물에서 발견되는 것과 근본적으로 다르다.[59][57]
단세포와 다세포 진핵생성 광전자생물은 모두 일정한 형태를 가지고 있고, 편극화되어 있으며, 나선형으로 헤엄치고, 수영과 광전적 조향에 섬유를 사용한다. 신호 전달은 직접 광 트리거 이온 전류, 아데닐 사이클 또는 트리메릭 G-단백질을 통해 발생할 수 있다. 사용되는 광수용체도 매우 다를 수 있다(아래 참조). 그러나 모든 경우에 신호 전달은 결국 섬유의 구타 활동을 수정한다.[57] 광전자 방향의 역학은 모든 진핵생물에서 유사하다. 시야각이 제한된 광센서가 회전해 공간을 스캔하고 주기적으로 섬유를 향해 신호를 보내 구타를 변경하면 나선형 수영 궤적의 방향이 바뀐다. 3차원 광축은 6개의 진핵 주요 그룹 중 5개 그룹(오피스토콘츠, 아메보조아, 식물, 크로말볼레이트, 굴착물, 리자리아)에서 찾을 수 있다.[57]
녹조에는 펠라틱 광축이 존재하며, 글라코프 해조류나 홍조류에는 존재하지 않는다.[57] 녹조는 엽록체의 가장 바깥쪽 부분에 있는 두 개의 엽록체 막 바로 아래에 "스티그마"가 있다. 오명은 수십~수백 개의 지질 구상체로 만들어지는데, 육각형 배열을 형성하는 경우가 많고 하나 이상의 행으로 배열할 수 있다. 지질 구상체에는 카로티노이드 색소들이 복합적으로 섞여 있어 선별 기능과 주황색 적색을 제공하며,[60] 구상체를 안정시키는 단백질을 함유하고 있다.[61] 오명은 횡방향으로, 섬유를 기준으로 한 고정된 평면에 위치하지만, 기저부 몸체에 직접 인접하지는 않는다.[62][63] 담도 뿌리 중 하나에 엽록체를 부착하여 고정 위치를 확보한다.[64] 착색된 오명은 광수용체와 혼동해서는 안 된다. 오명은 인접한 막 삽입 광수용체에 대한 방향 음영만 제공한다(따라서 "eyespot"이라는 용어는 오해의 소지가 있다). 또한 지그마타는 오목한 거울처럼 빛을 반사하고 집중시킬 수 있어 감도를 높일 수 있다.[57]
가장 잘 연구된 녹색 알가(Chlamydomonas reinhardtiii)에서 광축은 망막 색소체의 유사성에 의해 맹목적인 돌연변이에서 정상 광자비우어의 회복에 의해 처음 입증된 것처럼 로도신 색소에 의해 매개된다.[65] 클라미도모나스에서는 두 개의 고고박테리아형 로돕신(channelrhodopsin-1과 -2)이 광축 수용체로 확인되었다.[66][67][68] 두 단백질은 모두 N-단자 7-transmembrane 부분을 가지고 있는데, 이는 고고학적 로닥신과 유사하며, 그 뒤에 약 400개의 잔류물 C-단자막 관련 부분이 뒤따른다. CSRA와 CSRB는 광 게이트 계통 역할을 하며, 광암호화폐의 탈분극화를 촉발한다.[68][69] CSRA는 면역유동 분석(Suzuki et al. 2003)을 사용하여 낙인 지역에 국부화하는 것으로 나타났다. CSRA와 CSRB의 개별 RNAi 고갈은 빛 유도 전류를 수정하여 CSRA가 빠르고 고포화 전류를 매개하는 반면 CSRB는 느리고 저포화 전류를 매개하는 것을 밝혀냈다. 두 수용기의 정확한 기여는 아직 분명하지 않지만 두 전류 모두 광공포성 반응을 유발할 수 있고 광축의 역할을 할 수 있다.[70][69][57]
모든 비콘(식물, 크로말볼레이트, 굴착물, 리자리아)에서와 같이 녹조에는 두 개의 섬이 있는데, 이는 동일하지 않다. 앞쪽은 항상 뒷쪽보다 젊다.[71][72] 모든 세포 주기마다, 하나의 딸 세포가 전두엽을 받아 후두엽으로 변형시킨다. 다른 딸은 후방의 성숙한 치실을 물려받았다. 그리고 나서 두 딸 모두 새로운 전두막을 기른다.[57]
다른 모든 담도 수영선수들처럼 녹조는 항상 나선형으로 헤엄친다. 나선형의 손길이 강직하고 섬유의 음운에 의해 보장된다. 녹조의 두 섬은 박동 패턴과 기능이 다르다. 클라미도모나스에서는 광전도 캐스케이드가 복잡한 패턴으로 두 신체의 뇌졸중 패턴과 박동 속도를 차등적으로 변화시킨다.[73][74] 이로 인해 나선형 수영 축이 광 벡터와 정렬되지 않는 한 나선형 수영 궤적이 방향을 바꾸게 된다.[57]
열축
생물 물질의 화학 반응률과 물리적 특성이 온도에 따라 크게 변할 수 있기 때문에 온도는 생물체에게 중요한 환경적 요인이다. 살아있는 유기체는 거주하기에 적합한 온도가 있는 환경으로 이동하는 능력을 포함하여 획득된 메커니즘을 사용하여 냉온 및 열 스트레스에 적응한다. 적절한 열 환경으로 이동하기 위한 가장 간단한 형태의 행동 중 하나는 열축이다. 열수축은 전충선충이나 드로필라 멜라노가스터와 같은 다세포 유기체와 파라메치움 카우다툼, 딕티오스텔리움 디스코이디움, 이물다두증, 대장균과 같은 단세포 유기체에서 발견되었다.[76] 다세포 유기체 내의 개별 세포도 열축이 나타난다. 예를 들어, 포유류의 정자는 난관을 통해 온도 상승에 의해 유도된 수정 장소로 이동한다.[77][78]
단세포 유기체가 선호하는 온도로 이동하는 방법에 대한 조사는 100여 년 전에 시작되었다.[76] 특히 파라메슘 세포의 열역학적 거동이 잘 연구되어 왔다. 파라메슘 세포는 경작 온도에 가까운 장소, 즉 세포가 자라는 온도에서 축적된다.[76] 이들 현장에서 축적이 발생하는 이유는 셀이 재배온도를 벗어나는 온도변화에 직면했을 때 수영 방향을 역전시키고 재배온도에 근접하는 온도변화를 경험했을 때 수영속도를 높이는 경우가 많기 때문이다.[79][80] 수영 방향의 반전은 탈분극 수용체 전위에 의해 유도되며, 이것은 신체에 작용 전위를 유발한다.[81] 파라메슘 세포에 대한 이러한 연구는 30여 년 전 단세포 유기체의 열축이 강조되었지만, 열감각과 신호 전도를 위한 분자 메커니즘은 아직 파악되지 않고 있다.[78]
열축에 대한 분자 메커니즘에 대한 이해는 최근 몇 년 동안 포유류 정자에 대한 조사로부터 크게 진전되었다. 인간의 정자는 29℃에서 41℃의 따뜻한 온도로 이동한다.[77] 정자는 0.014 °C/mm 정도의 작은 온도 구배를 감지할 수 있어 정자가 공간적 차이가 아닌 온도에서의 일시적 변화를 감지한다는 것을 시사한다.[77] TRPV1, TRPV4, TRPM8과 같은 opsin 및 과도 수용체 전위(TRP) 채널을 포함한 여러 개의 분자가 센서 분자로 제안되었다.[82][83][84] TRP 채널은 열, 화학 및 기계적 자극을 위한 다중 센서지만 열감지기로서의 opsin의 기능이 확립되기를 기다리고 있다.[78]
온도는 또한 클라미도모나스 세포에게도 중요한 환경 요인으로, 작은 열충격 단백질, 샤페로닌, HSP70 열충격 단백질을 생성하며, 열응력에 대처하기 위해 다른 열충격 반응을 겪기도 한다.[85][86][87][88] 4℃의 차가운 충격에 반응하여 세포는 증식을 멈추고 녹말과 설탕을 축적한다.[89] 클라미도모나스에는 스트레스 받는 따뜻하거나 추운 환경을 피하기 위한 행동 반응이 있을 것으로 예상된다. C.무우시 세포는 10℃~15℃ 구배에서 따뜻한 온도로 이동한다고 보고되었지만, 재배 온도와의 관계를 조사하기 위해 온도 범위를 체계적으로 조작한 보고는 없었다.[90] 2019년 연구는 클라미도모나스 라인하르티이에서 열축이 입증되었고, 10°C~30°C 사이의 클라미도모나스 세포가 재배 온도와 무관하게 낮은 온도로 이동한다는 것을 발견했다.[78]
열축과 대조적으로, 광축은 클라미도모나스에서 광범위하게 연구되어 왔다. 클라미도모나스의 두 개의 플라겔라는 앞으로 헤엄칠 때 패턴처럼 평영으로 박동하고, 광축 중에는 클라미도모나스 세포가 두 개의 플라겔라에 의해 발생하는 추진력의 균형을 조절하여 광원을 향해 또는 멀리 돌면서 만든다.[91][92] 균형이 평판내 칼슘 이온 농도에 따라 달라지기 때문에 ptx1 돌연변이의 칼슘 의존적 제어 상실은 광축 결함을 초래한다.[93][94][95] 클라미도모나스의 광축 방향은 광도에 따라 달라지지만 세포내 감소-산화(redox) 조건에도 영향을 받는다.[96] 광도가 약할 때 세포는 광원을 향해 이동하지만, 감소하는 조건에서는 방향이 반대로 바뀐다. 이와는 대조적으로, 세포는 강한 강도로 광원을 헤엄쳐 나가지만, 방향은 산화 조건에서 역전된다.[78]
수영 속도

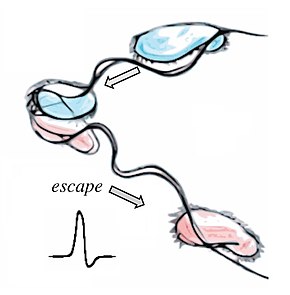
이스케이프 응답: 액션 포텐셜
편조류에서, 빛의 강도와 강렬한 광자 자극의 급격한 변화는 편조류 반전과 일시적인 역류를 유발한다.[98][99] 녹조에서, 이 작용은 기저체 사이의 각도를 바꾸는 수축성 뿌리 섬유에 의해 매개될 수 있다.[100] 세포는 또한 예상치 못한 기계적 자극에 속도감 있게 반응할 수 있다. 스토킹된 코리케이트 보르티첼라에서 전 또는 단 하나의 수축은 8 cms의−1 속도로 발생할 수 있다.[101] 어떤 종류의 헬리오조아에서, 악소포드는 포식증 때문에 갇힌 먹이를 끌어들이기 위해 20 ms 이내에 완전히 후퇴할 수 있다.[102][103][97]
이러한 빠른 반응은 대개 작용 전위 - 멤브레인 전위의 빠르고 재생적인 변화를 수반하는 단방향 전기 펄스에 의해 유도된다. 모든 세포가 약간의 전기적 활동을 보이는 반면, 계통생성학적 증거는 작용 전위를 전파하는 능력이 마지막 진핵 공통 조상에 의해 뒷받침된 조상 진핵생성 특성이었을 수도 있다는 것을 암시한다. 이것들은 우발적인 막 손상과 갑작스런 칼슘 유입에 대응하여 생겨났을지도 모른다.[104] 작용 전위의 형태로 이루어지는 생체전기 신호 전달은 화학적 확산, 단백질 인산화 등과 같은 다른 신호 방식보다 더 빠른 속도로 발생한다.[97]
빠른 탈출 반응을 시작하기 위해, 이것들은 운동성 기구, 특히 섬광과 유사성 같은 유연하고 막 연속적인 구조물에 직접 결합되었을 수 있다. 전압 게이트 나트륨/칼슘 채널의 손실은 많은 세금에서 섬유의 손실과 더욱 관련이 있다. 양성자에서는 일부 비실리성 규조류를 제외하고,[105][106][107] 전체 또는 단일 작용 전위는 거의 전적으로 담도막과 연관되어 발생한다.[108][109] 아메배에서 등급이 매겨진 전위는 이동 제어의 경우에도 발생한다.[110][97]
클라미도모나스에서는 작용전위성 플라겔라 전류가 (전압 게이트 칼슘 채널 Cav2를 통해) 광공포성 반응과 플라겔라 역전을 유도하는 반면 광수용체 전류가 훨씬 부드러운 반응을 이끌어낸다.[111] 여기서 과도수용체 전위 계열의 기계소감 채널이 담도기반에 국부화되며, Cav2는 담도의 원위부에만 국부화된다.[112][113] 파라메치움에서 초극화는 담도박동수를 증가시키는 반면, 탈극화는 정반대의 효과를 가져와 결국 담도역전을 초래한다. 일정 임계값을 초과하는 탈분극화는 담도막에 독점적으로 위치한 Cav 채널의 개방으로 인해 작용 전위가 발생한다.[114][115] 또한 막에 존재하는 칼륨 채널은 휴식 막 전위를 회복하는 데 도움이 된다.[97]
진핵생물은 다른 행동들 사이의 전환을 이루기 위해 그들의 막 전위를 조작한다. 복잡한 바이오 전기 시퀀스는 파벨라에서 통합된 공급 및 포식 행동과 관련하여 기록되었다.[116] 반복적인 행동은 리듬감 있는 스파이크로부터 발생한다. 촌극에서는 리듬 탈분극화가 서리라고 불리는 촉수성 복합 신리아에 의해 빠르고 느린 걸음걸이를 조절하여,[117] 막다른 골목에서 벗어나게 하고, 생식하는 게이메트에서 구애 의식을 행할 수 있게 한다.[119][120] 스텐토르에서는 행동 전위가 전신 수축 현상을 일으킨다.[121] 마지막으로 분기점에 가깝게 작동하는 흥분성 시스템은 제한 주기를 허용할 수 있으며, 이는 반복적이거나 리듬 있는 전기 스파이크 및 반복적인 행동으로 나타난다. 궁극적으로, 이것은 습관화로 이어질 수 있다.[122][123][97]
바이오하이브리드 마이크로스위머

하단: 키토산 코팅 철산화물 나노입자(CSIONPs)로 코팅된 맨 미세조류(왼쪽)와 바이오 하이브리드 미세조류(오른쪽)의 SEM 영상. 이미지는 유사했다. 오른쪽 SEM 영상의 진한 녹색은 미세조류 세포벽의 키토산 코팅을 나타낸다. 오렌지색 입자는 CSIONPs를 나타낸다.
바이오 하이브리드 마이크로스위머는 생물학적 성분과 인위적 성분으로 모두 구성된 마이크로스위머로 정의될 수 있다. 예를 들어, 하나 또는 여러 개의 살아있는 미생물이 한 개 또는 다양한 합성 부품에 부착되어 있다.[125][126] 시대를 앞선 이 분야의 개척자들은 몬테마그노와 바찬드였으며, NEMS라고 불리는 혼합 무기물/유기 나노전자기계 시스템을 준비할 수 있는 나노섬유 기판에 생물학적 분자의 특정 부착 전략에 관한 1999년 연구를 수행했다.[127] 그들은 전자 빔 리토그래피에 의해 생산된 금, 구리 또는 니클의 나노 배열 패턴에 고정된 F1-ATPase 바이오 분자 모터를 준비하기 위해 열선성 박테리아 바실러스 PS3로부터 다량의 F1-ATPase의 생산을 설명했다. 이 단백질들은 합성 펩타이드로 태그된 마이크로스피어 1개에 부착되었다. 그 결과 화학적으로 활성된 부지로 플랫폼의 준비를 완수하고 생체분자 모터의 에너지를 유용한 작업으로 변환할 수 있는 바이오 하이브리드 장치의 개발을 완수하였다.[126]
지난 10년 동안 살아있는 이동식 미생물이 길들이지 않은 인공구조물과 물리적으로 통합되는 바이오 하이브리드 마이크로로봇은 목표지점에 대한 적극적인 이동과 화물 운송이 가능하도록 관심이 높아지고 있다.[128][129][130][131] 운동성 외에도 인공적이고 환경적인 변화에 대한 적절한 반응을 감지하고 도출하는 내재적 능력은 세포 기반의 바이오 하이브리드 마이크로로봇을 만들어 진단 및 치료제의 국소적 능동적 전달을 위해 인체의 접근 불가능한 캐비티로 화물을 운송할 것을 호소한다.[132][133][134] 이동식 마이크로로봇에 내장된 집중 치료제와 진단제를 행동 현장에 능동적으로 이동, 표적화, 조종하면 기존 치료법의 난제를 극복할 수 있다.[135][136][137] 이를 위해, 박테리아는 일반적으로 구슬과 유령 세포 몸체와 함께 사용되어 왔다.[138][139][140][141][142][143][144][145][124]
클라미도모나스 라인하르티이는 단세포 녹색 마이크로알가이다. 야생형 C. reinhardtii는 평균 지름이 약 10µm인 구형 형태를 가지고 있다.[146] 이 미생물은 가시광선을 감지할 수 있으며 (즉, 광축) 100~200 µm의−1 범위에서 높은 수영 속도로 조향할 수 있다.[134] 라벨이 없는 형광 이미징이 가능한 천연 자폐를 가지고 있다.[146] C. reinhardtii는 치료법의 적극적인 전달을 위한 바이오 하이브리드 마이크로로봇의 활선 성분으로 적극적으로 탐구되어 왔다.[134] 건강한 포유류 세포와 생체 적합성이 있으며, 알려진 독소를 전혀 남기지 않으며, 생리학적으로 관련이 있는 매체에 이동성이 있으며, 세포벽에 화물을 운반할 수 있도록 표면을 개조할 수 있다.[134][147][148][149][150] C. reinhardtii에 대한 대체 부착 전략이 정전기 상호작용과[134][147] 공밸런트 결합에 의한 상호작용 표면의 수정을 통해 어셈블리에 제안되었다.[151] [124]
참고 항목
참조
- ^ Hinchliff, Cody E.; Smith, Stephen A.; Allman, James F.; Burleigh, J. Gordon; Chaudhary, Ruchi; Coghill, Lyndon M.; Crandall, Keith A.; Deng, Jiabin; Drew, Bryan T.; Gazis, Romina; Gude, Karl; Hibbett, David S.; Katz, Laura A.; Laughinghouse, H. Dail; McTavish, Emily Jane; Midford, Peter E.; Owen, Christopher L.; Ree, Richard H.; Rees, Jonathan A.; Soltis, Douglas E.; Williams, Tiffani; Cranston, Karen A. (2015). "Synthesis of phylogeny and taxonomy into a comprehensive tree of life". Proceedings of the National Academy of Sciences. 112 (41): 12764–12769. Bibcode:2015PNAS..11212764H. doi:10.1073/pnas.1423041112. PMC 4611642. PMID 26385966.
- ^ a b c d e f g h i Lisicki, Maciej, Velho 호드리게스, 마르코스 F;골드스타인, RaymondE.;Lauga, 에릭(2019년)."수영 진핵 미생물을 전시하다 보편적인 속도 분포". eLife.8.arXiv:1907.00906. doi:10.7554/eLife.44907.PMC6634970.PMID 31310238.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Wichterman, R. (6 December 2012). The Biology of Paramecium. ISBN 9781475703726.
- ^ Buetow, Dennis E. (2011). "Euglena". eLS. doi:10.1002/9780470015902.a0001964.pub3. ISBN 978-0470016176.
- ^ Harris, Elizabeth H. (7 March 2009). The Chlamydomonas Sourcebook: Introduction to Chlamydomonas and Its Laboratory Use: Volume 1. ISBN 9780080919553.
- ^ Adam, Rodney D. (2001). "Biology of Giardia lamblia". Clinical Microbiology Reviews. 14 (3): 447–475. doi:10.1128/CMR.14.3.447-475.2001. PMC 88984. PMID 11432808.
- ^ Bray, Dennis (2 November 2000). Cell Movements: From Molecules to Motility. ISBN 9781136844355.
- ^ Cappuccinelli, P. (1980). "The movement of eukaryotic cells". Motility of Living Cells. pp. 59–74. doi:10.1007/978-94-009-5812-8_4. ISBN 978-0-412-15770-7.
- ^ 썰매, M. A. (1974) 실리아와 플라젤라. 학술 출판사.
- ^ Nicastro, D.; McIntosh, J. R.; Baumeister, W. (2005). "3D structure of eukaryotic flagella in a quiescent state revealed by cryo-electron tomography". Proceedings of the National Academy of Sciences. 102 (44): 15889–15894. Bibcode:2005PNAS..10215889N. doi:10.1073/pnas.0508274102. PMC 1276108. PMID 16246999.
- ^ Moran, Jonathan; McKean, Paul G.; Ginger, Michael L. (2014). "Eukaryotic Flagella: Variations in Form, Function, and Composition during Evolution". BioScience. 64 (12): 1103–1114. doi:10.1093/biosci/biu175. ISSN 1525-3244.
- ^ Dawson, Scott C; Paredez, Alexander R (2013). "Alternative cytoskeletal landscapes: cytoskeletal novelty and evolution in basal excavate protists". Current Opinion in Cell Biology. 25 (1): 134–141. doi:10.1016/j.ceb.2012.11.005. PMC 4927265. PMID 23312067.
- ^ a b Atkinson, A.; Polimene, L.; Fileman, E.S.; Widdicombe, C.E.; McEvoy, A.J.; Smyth, T.J.; Djeghri, N.; Sailley, S.F.; Cornwell, L.E. (2018). ""Comment. What drives plankton seasonality in a stratifying shelf sea? Some competing and complementary theories"]" (PDF). Limnology and Oceanography. 63 (6): 2877–2884. Bibcode:2018LimOc..63.2877A. doi:10.1002/lno.11036. S2CID 91380765.
- ^ Singleton, Paul (2006). Dictionary of Microbiology and Molecular Biology, 3rd Edition, revised. Chichester, UK: John Wiley & Sons. pp. 32. ISBN 978-0-470-03545-0.
- ^ David J. Patterson. "Amoebae: Protists Which Move and Feed Using Pseudopodia". Tree of Life web project.
- ^ "The Amoebae". The University of Edinburgh. Archived from the original on 10 June 2009.
- ^ 생물학 사전, 2004년 2011-01-01에 접속했다.
- ^ 패터슨, 데이비드 J(2000년) "플레겔라테스: 플라겔라를 가진 이성애적 양성자" 생명의 나무
- ^ Jahn, T. L.; Votta, J. J. (1972). "Locomotion of Protozoa". Annual Review of Fluid Mechanics. 4: 93–116. Bibcode:1972AnRFM...4...93J. doi:10.1146/annurev.fl.04.010172.000521.
- ^ a b Brennen, C.; Winet, H. (1977). "Fluid Mechanics of Propulsion by Cilia and Flagella". Annual Review of Fluid Mechanics. 9: 339–398. Bibcode:1977AnRFM...9..339B. doi:10.1146/annurev.fl.09.010177.002011.
- ^ Allen, N. S.; Allen, R. D. (1978). "Cytoplasmic Streaming in Green Plants". Annual Review of Biophysics and Bioengineering. 7: 497–526. doi:10.1146/annurev.bb.07.060178.002433. PMID 352247.
- ^ Lyons, R.A.; Saridogan, E.; Djahanbakhch, O. (2006). "The reproductive significance of human Fallopian tube cilia". Human Reproduction Update. 12 (4): 363–372. doi:10.1093/humupd/dml012. PMID 16565155.
- ^ Lauga, Eric; Thomas R Powers (25 August 2009). "The hydrodynamics of swimming microorganisms". Reports on Progress in Physics. 72 (9): 096601. arXiv:0812.2887. Bibcode:2009RPPh...72i6601L. doi:10.1088/0034-4885/72/9/096601. S2CID 3932471.
- ^ a b Rode, Sebastian; Elgeti, Jens; Gompper, Gerhard (2021). "Multi-ciliated microswimmers–metachronal coordination and helical swimming". The European Physical Journal E. 44 (6): 76. arXiv:2103.11447. doi:10.1140/epje/s10189-021-00078-x. PMC 8187229. PMID 34101070.
- ^ Fritz-Laylin, Lillian K. (2020). "The evolution of animal cell motility". Current Biology. 30 (10): R477–R482. doi:10.1016/j.cub.2020.03.026. PMID 32428485. S2CID 218711237.
- ^ a b c d e f 드 Maleprade, 엘렌, Moisy, 프레데리크, 이시카와, Takuji, 골트 슈타인, RaymondE.(2020년)."Gonium의 Motility과 주광성, 그 가장 간단한 차별화된 식민 alga".피지컬 리뷰 E101(2):022416.arXiv:1911.08837.Bibcode:2020PhRvE.101b2416D. doi:10.1103/PhysRevE.101.022416.PMID 32168596.S2CID 211858528.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ a b Coleman, A. W. (2012). "A Comparative Analysis of the Volvocaceae (Chlorophyta)1". Journal of Phycology. 48 (3): 491–513. doi:10.1111/j.1529-8817.2012.01168.x. PMID 27011065. S2CID 422091.
- ^ Pennak, Robert W (1978). Fresh-Water Invertebrates of the United States (Second ed.). John Wiley & Sons. pp. 43. ISBN 0-471-04249-8.
- ^ Weismann, August (1889). "Essays Upon Heredity and Kindred Biological Problems: By Dr. August Weismann ... Ed. By Edward B. Poulton ... Selmar Schönland ... And Arthur e. Shipley...Authorised Translation".
- ^ Huxley, Julian S. (22 March 2012). The Individual in the Animal Kingdom. ISBN 9781107606074.
- ^ Kirk, David L. (8 September 2005). Volvox: A Search for the Molecular and Genetic Origins of Multicellularity and Cellular Differentiation. ISBN 9780521019149.
- ^ Goldstein, Raymond E. (2015). "Green Algae as Model Organisms for Biological Fluid Dynamics". Annual Review of Fluid Mechanics. 47: 343–375. doi:10.1146/annurev-fluid-010313-141426. PMC 4650200. PMID 26594068.
- ^ Goldstein, Raymond E. (2016). "Batchelor Prize Lecture Fluid dynamics at the scale of the cell". Journal of Fluid Mechanics. 807: 1–39. Bibcode:2016JFM...807....1G. doi:10.1017/jfm.2016.586. S2CID 55745525.
- ^ a b c Hoops, H. J. (1997). "Motility in the colonial and multicellular Volvocales: Structure, function, and evolution". Protoplasma. 199 (3–4): 99–112. doi:10.1007/BF01294499. S2CID 22315728.
- ^ a b Drescher, K.; Goldstein, R. E.; Tuval, I. (2010). "Fidelity of adaptive phototaxis". Proceedings of the National Academy of Sciences. 107 (25): 11171–11176. doi:10.1073/pnas.1000901107. PMC 2895142. PMID 20534560.
- ^ Drescher, Knut; Goldstein, Raymond E.; Michel, Nicolas; Polin, Marco; Tuval, Idan (2010). "Direct Measurement of the Flow Field around Swimming Microorganisms". Physical Review Letters. 105 (16): 168101. arXiv:1008.2681. Bibcode:2010PhRvL.105p8101D. doi:10.1103/PhysRevLett.105.168101. PMID 21231017. S2CID 8306079.
- ^ Guasto, Jeffrey S.; Johnson, Karl A.; Gollub, J. P. (2010). "Oscillatory Flows Induced by Microorganisms Swimming in Two Dimensions". Physical Review Letters. 105 (16): 168102. arXiv:1008.2535. Bibcode:2010PhRvL.105p8102G. doi:10.1103/PhysRevLett.105.168102. PMID 21231018. S2CID 9533722.
- ^ Bennett, Rachel R.; Golestanian, Ramin (2015). "A steering mechanism for phototaxis in Chlamydomonas". Journal of the Royal Society Interface. 12 (104). doi:10.1098/rsif.2014.1164. PMC 4345482. PMID 25589576.
- ^ Arrieta, Jorge; Barreira, Ana; Chioccioli, Maurizio; Polin, Marco; Tuval, Idan (2017). "Phototaxis beyond turning: Persistent accumulation and response acclimation of the microalga Chlamydomonas reinhardtii". Scientific Reports. 7 (1): 3447. arXiv:1611.08224. Bibcode:2017NatSR...7.3447A. doi:10.1038/s41598-017-03618-8. PMC 5471259. PMID 28615673.
- ^ Tsang, Alan C. H.; Lam, Amy T.; Riedel-Kruse, Ingmar H. (2018). "Polygonal motion and adaptable phototaxis via flagellar beat switching in the microswimmer Euglena gracilis". Nature Physics. 14 (12): 1216–1222. Bibcode:2018NatPh..14.1216T. doi:10.1038/s41567-018-0277-7. S2CID 126294173.
- ^ Foster, K. W.; Smyth, R. D. (1980). "Light Antennas in phototactic algae". Microbiological Reviews. 44 (4): 572–630. doi:10.1128/mr.44.4.572-630.1980. PMC 373196. PMID 7010112.
- ^ Hegemann, Peter (2008). "Algal Sensory Photoreceptors". Annual Review of Plant Biology. 59: 167–189. doi:10.1146/annurev.arplant.59.032607.092847. PMID 18444900.
- ^ Kamiya, R.; Witman, G. B. (1984). "Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas". Journal of Cell Biology. 98 (1): 97–107. doi:10.1083/jcb.98.1.97. PMC 2112995. PMID 6707098.
- ^ Josef, Keith; Saranak, Jureepan; Foster, Kenneth W. (2005). "Ciliary behavior of a negatively phototactic Chlamydomonas reinhardtii". Cell Motility and the Cytoskeleton. 61 (2): 97–111. doi:10.1002/cm.20069. PMID 15849714.
- ^ Josef, Keith; Saranak, Jureepan; Foster, Kenneth W. (2006). "Linear systems analysis of the ciliary steering behavior associated with negative-phototaxis in Chlamydomonas reinhardtii". Cell Motility and the Cytoskeleton. 63 (12): 758–777. doi:10.1002/cm.20158. PMID 16986140.
- ^ Yoshimura, Kenjiro; Kamiya, Ritsu (2001). "The Sensitivity of Chlamydomonas Photoreceptor is Optimized for the Frequency of Cell Body Rotation". Plant and Cell Physiology. 42 (6): 665–672. doi:10.1093/pcp/pce084. PMID 11427687.
- ^ Leptos, Kyriacos C.; Chioccioli, Maurizio; Furlan, Silvano; Pesci, Adriana I.; Goldstein, Raymond E. (2018). "An Adaptive Flagellar Photoresponse Determines the Dynamics of Accurate Phototactic Steering in Chlamydomonas". doi:10.1101/254714. S2CID 90374721.
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ Kirk, David L. (2004). "Volvox". Current Biology. 14 (15): R599–R600. doi:10.1016/j.cub.2004.07.034. PMID 15296767. S2CID 235312006.
- ^ Arakaki, Yoko; Kawai-Toyooka, Hiroko; Hamamura, Yuki; Higashiyama, Tetsuya; Noga, Akira; Hirono, Masafumi; Olson, Bradley J. S. C.; Nozaki, Hisayoshi (2013). "The Simplest Integrated Multicellular Organism Unveiled". PLOS ONE. 8 (12): e81641. Bibcode:2013PLoSO...881641A. doi:10.1371/journal.pone.0081641. PMC 3859500. PMID 24349103.
- ^ Herron, Matthew D.; Michod, Richard E. (2008). "Evolution of Complexity in the Volvocine Algae: Transitions in Individuality Through Darwin's Eye". Evolution. 62 (2): 436–451. doi:10.1111/j.1558-5646.2007.00304.x. PMID 18031303. S2CID 12139760.
- ^ Nozaki, Hisayoshi (1990). "Ultrastructure of the extracellular matrix of Gonium (Volvocales, Chlorophyta)". Phycologia. 29: 1–8. doi:10.2216/i0031-8884-29-1-1.1.
- ^ a b c Moore, A. R. (1916). "The mechanism of orientation in Gonium". Journal of Experimental Zoology. 21 (3): 431–432. doi:10.1002/jez.1400210306.
- ^ a b c Mast, S. O. (1916). "The process of orientation in the colonial organism, Gonium pectorale, and a study of the structure and function of the eye-spot". Journal of Experimental Zoology. 20: 1–17. doi:10.1002/jez.1400200102.
- ^ a b Greuel, Brian T.; Floyd, Gary L. (2004). "Development of the Flagellar Apparatus and Flagellar Orientation in the Colonial Green Alga Gonium Pectorale (Volvocales)1". Journal of Phycology. 21 (3): 358–371. doi:10.1111/j.0022-3646.1985.00358.x. S2CID 85760904.
- ^ Harper, R. A. (1912). "The Structure and Development of the Colony in Gonium". Transactions of the American Microscopical Society. 31 (2): 65–83. doi:10.2307/3221328. JSTOR 3221328.
- ^ 뮐러 O. F. (1782) 클라인 슈리프텐 아우스 데르 나투히스토리, 드사우, 헤르아스게벤 폰 재 고제, 페이지 15-21.
- ^ a b c d e f g h i j Jékely, Gáspár (2009). "Evolution of phototaxis". Philosophical Transactions of the Royal Society B: Biological Sciences. 364 (1531): 2795–2808. doi:10.1098/rstb.2009.0072. PMC 2781859. PMID 19720645.
 자료는 이 출처에서 복사되었으며, Creative Commons Accountation 4.0 International License에 따라 이용할 수 있다.
자료는 이 출처에서 복사되었으며, Creative Commons Accountation 4.0 International License에 따라 이용할 수 있다. - ^ Clark, M.A., Choi, J., Douglas, M. (2018) 원생생물학의 특성2e. 오픈스택스. ISBN 9781947172951.
 Creative Commons Attribution 4.0 International License에 따라 사용 가능한 이 소스로부터 자료를 복사했다.
Creative Commons Attribution 4.0 International License에 따라 사용 가능한 이 소스로부터 자료를 복사했다. - ^ Häder, D. -P; Lebert, M. (19 June 2001). Photomovement. ISBN 9780080538860.
- ^ Grung, Merete; Kreimer, Georg; Calenberg, Michael; Melkonian, Michael; Liaaen-Jensen, Synnøve (1994). "Carotenoids in the eyespot apparatus of the flagellate green alga Spermatozopsis similis: Adaptation to the retinal-based photoreceptor". Planta. 193. doi:10.1007/BF00191604. S2CID 29443649.
- ^ Renninger, S.; Backendorf, E.; Kreimer, G. (2001). "Subfractionation of eyespot apparatuses from the green alga Spermatozopsis similis : Isolation and characterization of eyespot globules". Planta. 213 (1): 51–63. doi:10.1007/s004250000473. PMID 11523656. S2CID 24880210.
- ^ Arnott, Howard J.; Brown, R. Malcolm (1967). "Ultrastructure of the Eyespot and its Possible Significance in Phototaxis of Tetracystis excentrica*†". The Journal of Protozoology. 14 (4): 529–539. doi:10.1111/j.1550-7408.1967.tb02038.x.
- ^ Melkonian, M.; Robenek, H. (1979). "The eyespot of the flagellate Tetraselmis cordiformis stein (Chlorophyceae): Structural spezialization of the outer chloroplast membrane and its possible significance in phototaxis of green algae". Protoplasma. 100 (2): 183–197. doi:10.1007/BF01283929. S2CID 24606055.
- ^ Melkonian, Michael (1978). "Structure and significance of cruciate flagellar root systems in green algae: Comparative investigations in species of Chlorosarcinopsis (Chlorosarcinales)". Plant Systematics and Evolution. 130 (3–4): 265–292. doi:10.1007/BF00982810. S2CID 22938771.
- ^ Foster, Kenneth W.; Saranak, Jureepan; Patel, Nayana; Zarilli, Gerald; Okabe, Masami; Kline, Toni; Nakanishi, Koji (1984). "A rhodopsin is the functional photoreceptor for phototaxis in the unicellular eukaryote Chlamydomonas". Nature. 311 (5988): 756–759. Bibcode:1984Natur.311..756F. doi:10.1038/311756a0. PMID 6493336. S2CID 4263301.
- ^ Nagel, G.; Ollig, D.; Fuhrmann, M.; Kateriya, S.; Musti, A. M.; Bamberg, E.; Hegemann, P. (2002). "Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae". Science. 296 (5577): 2395–2398. Bibcode:2002Sci...296.2395N. doi:10.1126/science.1072068. PMID 12089443. S2CID 206506942.
- ^ Nagel, G.; Szellas, T.; Huhn, W.; Kateriya, S.; Adeishvili, N.; Berthold, P.; Ollig, D.; Hegemann, P.; Bamberg, E. (2003). "Channelrhodopsin-2, a directly light-gated cation-selective membrane channel". Proceedings of the National Academy of Sciences. 100 (24): 13940–13945. Bibcode:2003PNAS..10013940N. doi:10.1073/pnas.1936192100. PMC 283525. PMID 14615590.
- ^ a b Sineshchekov, O. A.; Jung, K.-H.; Spudich, J. L. (2002). "Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii". Proceedings of the National Academy of Sciences. 99 (13): 8689–8694. doi:10.1073/pnas.122243399. PMC 124360. PMID 12060707.
- ^ a b Berthold, Peter; Tsunoda, Satoshi P.; Ernst, Oliver P.; Mages, Wolfgang; Gradmann, Dietrich; Hegemann, Peter (2008). "Channelrhodopsin-1 Initiates Phototaxis and Photophobic Responses in Chlamydomonas by Immediate Light-Induced Depolarization". The Plant Cell. 20 (6): 1665–1677. doi:10.1105/tpc.108.057919. PMC 2483371. PMID 18552201.
- ^ Govorunova, Elena G.; Jung, Kwang-Hwan; Sineshchekov, Oleg A.; Spudich, John L. (2004). "Chlamydomonas Sensory Rhodopsins a and B: Cellular Content and Role in Photophobic Responses". Biophysical Journal. 86 (4): 2342–2349. Bibcode:2004BpJ....86.2342G. doi:10.1016/S0006-3495(04)74291-5. PMC 1304083. PMID 15041672.
- ^ Cavalier-Smith, T. (2002). "The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa". International Journal of Systematic and Evolutionary Microbiology. 52 (2): 297–354. doi:10.1099/00207713-52-2-297. PMID 11931142.
- ^ Cavalier-Smith, Thomas (2009). "Megaphylogeny, Cell Body Plans, Adaptive Zones: Causes and Timing of Eukaryote Basal Radiations". Journal of Eukaryotic Microbiology. 56 (1): 26–33. doi:10.1111/j.1550-7408.2008.00373.x. PMID 19340985. S2CID 10205240.
- ^ Josef, Keith; Saranak, Jureepan; Foster, Kenneth W. (2005). "Ciliary behavior of a negatively phototactic Chlamydomonas reinhardtii". Cell Motility and the Cytoskeleton. 61 (2): 97–111. doi:10.1002/cm.20069. PMID 15849714.
- ^ Josef, Keith; Saranak, Jureepan; Foster, Kenneth W. (2006). "Linear systems analysis of the ciliary steering behavior associated with negative-phototaxis in Chlamydomonas reinhardtii". Cell Motility and the Cytoskeleton. 63 (12): 758–777. doi:10.1002/cm.20158. PMID 16986140.
- ^ Harris, Elizabeth H. (2009) "Clamydomonas" In The Chlamydomonas Sourcebook (제2판), 1장 1, 1권 24쪽. ISBN 9780080919553 도이:10.1016/B978-0-12-370873-1.00001-0
- ^ a b c 제닝스 H. S. (1907) "하위 유기체의 행동" 미국 자연주의자 41 (481) : 42-44.
- ^ a b c Bahat, Anat; Tur-Kaspa, Ilan; Gakamsky, Anna; Giojalas, Laura C.; Breitbart, Haim; Eisenbach, Michael (2003). "Thermotaxis of mammalian sperm cells: A potential navigation mechanism in the female genital tract". Nature Medicine. 9 (2): 149–150. doi:10.1038/nm0203-149. PMID 12563318. S2CID 36538049.
- ^ a b c d e Sekiguchi, 마사야, Kameda, Shigetoshi, 구로사와는, 사토시, 요시다, 메구미, Yoshimura, 겐지로(2018년)."Thermotaxis 클라 미도 모나스에 막 여자에 의해 산화 환원 반등 상태에 의해 초래된다".과학 보고서. 8(1):16114.Bibcode:2018NatSR...816114S.doi:10.1038/s41598-018-34487-4.PMC 6208428.PMID 30382191.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Tawada, K.; Oosawa, F. (1972). "Responses of Parameciumto Temperature Change". The Journal of Protozoology. 19 (1): 53–57. doi:10.1111/j.1550-7408.1972.tb03412.x. PMID 5008849.
- ^ Nakaoka, Yasuo; Oosawa, Fumio (1977). "Temperature-Sensitive Behavior of Paramecium caudatum". The Journal of Protozoology. 24 (4): 575–580. doi:10.1111/j.1550-7408.1977.tb01018.x.
- ^ Hennessey, Todd M.; Saimi, Yoshiro; Kung, Ching (1983). "A heat-induced depolarization of Paramecium and its relationship to thermal avoidance behavior". Journal of Comparative Physiology A. 153: 39–46. doi:10.1007/BF00610340. S2CID 7152549.
- ^ Pérez-Cerezales, Serafín; Boryshpolets, Sergii; Afanzar, Oshri; Brandis, Alexander; Nevo, Reinat; Kiss, Vladimir; Eisenbach, Michael (2015). "Involvement of opsins in mammalian sperm thermotaxis". Scientific Reports. 5: 16146. Bibcode:2015NatSR...516146P. doi:10.1038/srep16146. PMC 4633616. PMID 26537127.
- ^ Hamano, Koh-Ichi; Kawanishi, Tae; Mizuno, Atsuko; Suzuki, Makoto; Takagi, Yuji (2016). "Involvement of Transient Receptor Potential Vanilloid (TRPV) 4 in mouse sperm thermotaxis". Journal of Reproduction and Development. 62 (4): 415–422. doi:10.1262/jrd.2015-106. PMC 5004798. PMID 27180924.
- ^ De Blas, Gerardo A.; Darszon, Alberto; Ocampo, Ana Y.; Serrano, Carmen J.; Castellano, Laura E.; Hernández-González, Enrique O.; Chirinos, Mayel; Larrea, Fernando; Beltrán, Carmen; Treviño, Claudia L. (2009). "TRPM8, a Versatile Channel in Human Sperm". PLOS ONE. 4 (6): e6095. Bibcode:2009PLoSO...4.6095D. doi:10.1371/journal.pone.0006095. PMC 2705237. PMID 19582168.
- ^ Kloppstech, Klaus; Meyer, Gabriele; Schuster, Gadi; Ohad, Itzhak (1985). "Synthesis, transport and localization of a nuclear coded 22-kd heat-shock protein in the chloroplast membranes of peas and Chlamydomonas reinhardi". The EMBO Journal. 4 (8): 1901–1909. doi:10.1002/j.1460-2075.1985.tb03869.x. PMC 554439. PMID 16453628.
- ^ Van Lis, Robert; Atteia, Ariane; Mendoza-HernáNdez, Guillermo; GonzáLez-Halphen, Diego (2003). "Identification of Novel Mitochondrial Protein Components of Chlamydomonas reinhardtii. A Proteomic Approach". Plant Physiology. 132 (1): 318–330. doi:10.1104/pp.102.018325. PMC 166977. PMID 12746537.
- ^ von Gromoff, E. D.; Treier, U.; Beck, C. F. (1989). "Three light-inducible heat shock genes of Chlamydomonas reinhardtii". Molecular and Cellular Biology. 9 (9): 3911–3918. doi:10.1128/mcb.9.9.3911-3918.1989. PMC 362453. PMID 2779571.
- ^ Schroda, Michael; Hemme, Dorothea; Mühlhaus, Timo (2015). "The Chlamydomonasheat stress response". The Plant Journal. 82 (3): 466–480. doi:10.1111/tpj.12816. PMID 25754362.
- ^ Valledor, Luis; Furuhashi, Takeshi; Hanak, Anne-Mette; Weckwerth, Wolfram (2013). "Systemic Cold Stress Adaptation of Chlamydomonas reinhardtii". Molecular & Cellular Proteomics. 12 (8): 2032–2047. doi:10.1074/mcp.M112.026765. PMC 3734567. PMID 23564937.
- ^ Clegg, Mark R.; Maberly, Stephen C.; Jones, Roger I. (2003). "Behavioural responses of freshwater phytoplanktonic flagellates to a temperature gradient". European Journal of Phycology. 38 (3): 195–203. doi:10.1080/0967026031000121697. S2CID 85353895.
- ^ Foster, K. W.; Smyth, R. D. (1980). "Light Antennas in phototactic algae". Microbiological Reviews. 44 (4): 572–630. doi:10.1128/mr.44.4.572-630.1980. PMC 373196. PMID 7010112.
- ^ Isogai, Nahoko; Kamiya, Ritsu; Yoshimura, Kenjiro (2000). "Dominance between the Two Flagella during Phototactic Turning in Chlamydomonas". Zoological Science. 17 (9): 1261–1266. doi:10.2108/zsj.17.1261. S2CID 84890095.
- ^ Kamiya, R.; Witman, G. B. (1984). "Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas". Journal of Cell Biology. 98 (1): 97–107. doi:10.1083/jcb.98.1.97. PMC 2112995. PMID 6707098.
- ^ Horst, C. J.; Witman, G. B. (1993). "Ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance". Journal of Cell Biology. 120 (3): 733–741. doi:10.1083/jcb.120.3.733. PMC 2119553. PMID 8425899.
- ^ Okita, Noriko; Isogai, Nahoko; Hirono, Masafumi; Kamiya, Ritsu; Yoshimura, Kenjiro (2005). "Phototactic activity in Chlamydomonas non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein". Journal of Cell Science. 118 (3): 529–537. doi:10.1242/jcs.01633. PMID 15657081. S2CID 2379702.
- ^ Wakabayashi, K.-i.; Misawa, Y.; Mochiji, S.; Kamiya, R. (2011). "Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii". Proceedings of the National Academy of Sciences. 108 (27): 11280–11284. Bibcode:2011PNAS..10811280W. doi:10.1073/pnas.1100592108. PMC 3131381. PMID 21690384.
- ^ a b c d e f Wan, 커스티 Y, Jékely, Gáspár(2021년)."진핵 흥분성의 기원".는 '로열 소사이어티 B학회 철학적 거래는 반드시:생물학.376(1820년).arXiv:2007.13388. doi:10.1098/rstb.2019.0758.PMC7935092.PMID 33487111.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Foster, K. W.; Smyth, R. D. (1980). "Light Antennas in phototactic algae". Microbiological Reviews. 44 (4): 572–630. doi:10.1128/MR.44.4.572-630.1980. PMC 373196. PMID 7010112.
- ^ Holland, E.M.; Harz, H.; Uhl, R.; Hegemann, P. (1997). "Control of phobic behavioral responses by rhodopsin-induced photocurrents in Chlamydomonas". Biophysical Journal. 73 (3): 1395–1401. Bibcode:1997BpJ....73.1395H. doi:10.1016/S0006-3495(97)78171-2. PMC 1181038. PMID 9284306.
- ^ Hayashi, Masahito; Yagi, Toshiki; Yoshimura, Kenjiro; Kamiya, Ritsu (1998). "Real-time observation of Ca2+-induced basal body reorientation in Chlamydomonas". Cell Motility and the Cytoskeleton. 41 (1): 49–56. doi:10.1002/(SICI)1097-0169(1998)41:1<49::AID-CM4>3.0.CO;2-A. PMID 9744298.
- ^ Moriyama, Yasushige; Hiyama, Shigeo; Asai, Hiroshi (1998). "High-Speed Video Cinematographic Demonstration of Stalk and Zooid Contraction of Vorticella convallaria". Biophysical Journal. 74 (1): 487–491. Bibcode:1998BpJ....74..487M. doi:10.1016/s0006-3495(98)77806-3. PMC 1299401. PMID 9449349.
- ^ Moriyama, Yasushige; Hiyama, Shigeo; Asai, Hiroshi (1998). "High-Speed Video Cinematographic Demonstration of Stalk and Zooid Contraction of Vorticella convallaria". Biophysical Journal. 74 (1): 487–491. Bibcode:1998BpJ....74..487M. doi:10.1016/s0006-3495(98)77806-3. PMC 1299401. PMID 9449349.
- ^ Ando, Motonori; Shigenaka, Yoshinobu (1989). "Structure and function of the cytoskeleton in heliozoa: I. Mechanism of rapid axopodial contraction in Echinosphaerium". Cell Motility and the Cytoskeleton. 14 (2): 288–301. doi:10.1002/cm.970140214.
- ^ Brunet, Thibaut; Arendt, Detlev (2016). "From damage response to action potentials: Early evolution of neural and contractile modules in stem eukaryotes". Philosophical Transactions of the Royal Society B: Biological Sciences. 371 (1685). doi:10.1098/rstb.2015.0043. PMC 4685582. PMID 26598726.
- ^ Eckert, R.; Brehm, P. (1979). "Ionic Mechanisms of Excitation in Paramecium". Annual Review of Biophysics and Bioengineering. 8: 353–383. doi:10.1146/annurev.bb.08.060179.002033. PMID 383005.
- ^ Eckert, Roger; Naitoh, Yutaka (1972). "Bioelectric Control of Locomotion in the Ciliates*†". The Journal of Protozoology. 19 (2): 237–243. doi:10.1111/j.1550-7408.1972.tb03444.x. PMID 4624297.
- ^ Wood, David C. (1982). "Membrane permeabilities determining resting, action and mechanoreceptor potentials in Stentor coeruleus". Journal of Comparative Physiology A. 146 (4): 537–550. doi:10.1007/bf00609450. S2CID 21083419.
- ^ Taylor, Alison R. (2009). "A Fast Na+/Ca2+-Based Action Potential in a Marine Diatom". PLOS ONE. 4 (3): e4966. Bibcode:2009PLoSO...4.4966T. doi:10.1371/journal.pone.0004966. PMC 2654917. PMID 19305505.
- ^ Helliwell, Katherine E.; Chrachri, Abdul; Koester, Julie A.; Wharam, Susan; Verret, Frédéric; Taylor, Alison R.; Wheeler, Glen L.; Brownlee, Colin (2019). "Alternative Mechanisms for Fast Na+/Ca2+ Signaling in Eukaryotes via a Novel Class of Single-Domain Voltage-Gated Channels". Current Biology. 29 (9): 1503–1511.e6. doi:10.1016/j.cub.2019.03.041. PMC 6509283. PMID 31006567.
- ^ Bingley, M.S.; Thompson, C.M. (1962). "Bioelectric potentials in relation to movement in amoebae". Journal of Theoretical Biology. 2 (1): 16–32. Bibcode:1962JThBi...2...16B. doi:10.1016/s0022-5193(62)80024-1.
- ^ Harz, Hartmann; Hegemann, Peter (1991). "Rhodopsin-regulated calcium currents in Chlamydomonas". Nature. 351 (6326): 489–491. Bibcode:1991Natur.351..489H. doi:10.1038/351489a0. S2CID 4309593.
- ^ Fujiu, Kenta; Nakayama, Yoshitaka; Iida, Hidetoshi; Sokabe, Masahiro; Yoshimura, Kenjiro (2011). "Mechanoreception in motile flagella of Chlamydomonas". Nature Cell Biology. 13 (5): 630–632. doi:10.1038/ncb2214. PMID 21478860. S2CID 19883187.
- ^ Fujiu, Kenta; Nakayama, Yoshitaka; Yanagisawa, Ayaka; Sokabe, Masahiro; Yoshimura, Kenjiro (2009). "Chlamydomonas CAV2 Encodes a Voltage- Dependent Calcium Channel Required for the Flagellar Waveform Conversion". Current Biology. 19 (2): 133–139. doi:10.1016/j.cub.2008.11.068. PMID 19167228. S2CID 14063142.
- ^ Umbach JA (1981) "Ph와 Paramecium caudatum의 막 흥분성" 캘리포니아 주 로스앤젤레스: 캘리포니아 대학교.
- ^ Dunlap, K. (1977). "Localization of calcium channels in Paramecium caudatum". The Journal of Physiology. 271 (1): 119–133. doi:10.1113/jphysiol.1977.sp011993. PMC 1353610. PMID 915829.
- ^ Echevarria, Michael L.; Wolfe, Gordon V.; Taylor, Alison R. (2015). "Feast or flee: Bioelectrical regulation of feeding and predator evasion behaviors in the planktonic alveolate Favella sp. (Spirotrichia)". Journal of Experimental Biology. 219 (Pt 3): 445–456. doi:10.1242/jeb.121871. PMID 26567352. S2CID 37255456.
- ^ Lueken, Wolfgang; Ricci, Nicola; Krüppel, Thomas (1996). "Rhythmic spontaneous depolarizations determine a slow-and-fast rhythm in walking of the marine hypotrich Euplotes vannus". European Journal of Protistology. 32: 47–54. doi:10.1016/s0932-4739(96)80038-1.
- ^ Kunita, Itsuki; Kuroda, Shigeru; Ohki, Kaito; Nakagaki, Toshiyuki (2014). "Attempts to retreat from a dead-ended long capillary by backward swimming in Paramecium". Frontiers in Microbiology. 5: 270. doi:10.3389/fmicb.2014.00270. PMC 4052044. PMID 24966852.
- ^ 증권 C, KrÜPpel T, KeyG, Lueken W"유플로 raikovi 내 성적 행동 이온의 전류를pheromone-induced 수정이 따른다"(1999년). JExp서, 202(4):475–483. PMID 9914154.
- ^ Kimball RF (1942) "The Nature and Inheritance of Mating Types in Euplotes Patella". 유전학, 27(3):269–285. PMID 17247040, PMCPMC1209158.
- ^ Wood, DC (1988). "Habituation in Stentor: Produced by mechanoreceptor channel modification". The Journal of Neuroscience. 8 (7): 2254–2258. doi:10.1523/JNEUROSCI.08-07-02254.1988. PMC 6569508. PMID 3249223.
- ^ Jennings, H. S. (1899). "Studies on Reactions to Stimuli in Unicellular Organisms. III Reactions to Localized Stimuli in Spirostomum and Stentor". The American Naturalist. 33 (389): 373–389. doi:10.1086/277256. S2CID 85272784.
- ^ Dexter, Joseph P.; Prabakaran, Sudhakaran; Gunawardena, Jeremy (2019). "A Complex Hierarchy of Avoidance Behaviors in a Single-Cell Eukaryote". Current Biology. 29 (24): 4323–4329.e2. doi:10.1016/j.cub.2019.10.059. PMID 31813604. S2CID 208652463.
- ^ a b c Akolpoglu, Mukrime Birgul, Dogan, Nihal Olcay, Bozuyuk, Ugur, Ceylan, 하칸, Kizilel, 세다, Sitti, Metin(2020년)."Biohybrid 조류의 On‐Demand 화물 생산의High‐Yield 생산".고급 과학. 7(16). doi:10.1002/advs.202001256.PMC7435244.PMID 32832367.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Schwarz, Lukas; Medina-Sánchez, Mariana; Schmidt, Oliver G. (2017). "Hybrid Bio Micromotors". Applied Physics Reviews. 4 (3): 031301. Bibcode:2017ApPRv...4c1301S. doi:10.1063/1.4993441.
- ^ a b Bastos-Arrieta, 훌리오, Revilla-Guarinos, Ainhoa, Uspal, WilliamE.;Simmchen, Juliane(2018년)."박테리아 Biohybrid Microswimmers".로봇 그리고 AI에 국경. 5:97.doi:10.3389/frobt.2018.00097.PMC7805739.PMID 33500976.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Montemagno, Carlo; Bachand, George (1999). "Constructing nanomechanical devices powered by biomolecular motors". Nanotechnology. 10 (3): 225–231. Bibcode:1999Nanot..10..225M. doi:10.1088/0957-4484/10/3/301.
- ^ Ricotti, Leonardo; Trimmer, Barry; Feinberg, Adam W.; Raman, Ritu; Parker, Kevin K.; Bashir, Rashid; Sitti, Metin; Martel, Sylvain; Dario, Paolo; Menciassi, Arianna (2017). "Biohybrid actuators for robotics: A review of devices actuated by living cells". Science Robotics. 2 (12): eaaq0495. doi:10.1126/scirobotics.aaq0495. PMID 33157905. S2CID 29776467.
- ^ Alapan, Yunus; Yasa, Oncay; Yigit, Berk; Yasa, I. Ceren; Erkoc, Pelin; Sitti, Metin (2019). "Microrobotics and Microorganisms: Biohybrid Autonomous Cellular Robots". Annual Review of Control, Robotics, and Autonomous Systems. 2: 205–230. doi:10.1146/annurev-control-053018-023803. S2CID 139819519.
- ^ Chu, Dafeng; Dong, Xinyue; Shi, Xutong; Zhang, Canyang; Wang, Zhenjia (2018). "Neutrophil-Based Drug Delivery Systems". Advanced Materials. 30 (22): e1706245. doi:10.1002/adma.201706245. PMC 6161715. PMID 29577477.
- ^ Carlsen, Rika Wright; Sitti, Metin (2014). "Bio-Hybrid Cell-Based Actuators for Microsystems". Small. 10 (19): 3831–3851. doi:10.1002/smll.201400384. PMID 24895215.
- ^ Nguyen, Van Du; Han, Ji-Won; Choi, Young Jin; Cho, Sunghoon; Zheng, Shaohui; Ko, Seong Young; Park, Jong-Oh; Park, Sukho (2016). "Active tumor-therapeutic liposomal bacteriobot combining a drug (Paclitaxel)-encapsulated liposome with targeting bacteria (Salmonella Typhimurium)". Sensors and Actuators B: Chemical. 224: 217–224. doi:10.1016/j.snb.2015.09.034.
- ^ Felfoul, Ouajdi; Mohammadi, Mahmood; Taherkhani, Samira; De Lanauze, Dominic; Zhong Xu, Yong; Loghin, Dumitru; Essa, Sherief; Jancik, Sylwia; Houle, Daniel; Lafleur, Michel; Gaboury, Louis; Tabrizian, Maryam; Kaou, Neila; Atkin, Michael; Vuong, Té; Batist, Gerald; Beauchemin, Nicole; Radzioch, Danuta; Martel, Sylvain (2016). "Magneto-aerotactic bacteria deliver drug-containing nanoliposomes to tumour hypoxic regions". Nature Nanotechnology. 11 (11): 941–947. Bibcode:2016NatNa..11..941F. doi:10.1038/nnano.2016.137. PMC 6094936. PMID 27525475.
- ^ a b c d e Yasa, Oncay; Erkoc, Pelin; Alapan, Yunus; Sitti, Metin (2018). "Microalga-Powered Microswimmers toward Active Cargo Delivery". Advanced Materials. 30 (45): e1804130. doi:10.1002/adma.201804130. PMID 30252963. S2CID 52823884.
- ^ Ceylan, Hakan; Giltinan, Joshua; Kozielski, Kristen; Sitti, Metin (2017). "Mobile microrobots for bioengineering applications". Lab on a Chip. 17 (10): 1705–1724. doi:10.1039/C7LC00064B. PMID 28480466.
- ^ Li, Jinxing; Esteban-Fernández De Ávila, Berta; Gao, Wei; Zhang, Liangfang; Wang, Joseph (2017). "Micro/Nanorobots for biomedicine: Delivery, surgery, sensing, and detoxification". Science Robotics. 2 (4): eaam6431. doi:10.1126/scirobotics.aam6431. PMC 6759331. PMID 31552379.
- ^ Erkoc, Pelin; Yasa, Immihan C.; Ceylan, Hakan; Yasa, Oncay; Alapan, Yunus; Sitti, Metin (2019). "Mobile Microrobots for Active Therapeutic Delivery". Advanced Therapeutics. 2. doi:10.1002/adtp.201800064. S2CID 88204894.
- ^ Park, Byung-Wook; Zhuang, Jiang; Yasa, Oncay; Sitti, Metin (2017). "Multifunctional Bacteria-Driven Microswimmers for Targeted Active Drug Delivery". ACS Nano. 11 (9): 8910–8923. doi:10.1021/acsnano.7b03207. PMID 28873304.
- ^ Behkam, Bahareh; Sitti, Metin (2007). "Bacterial flagella-based propulsion and on/Off motion control of microscale objects". Applied Physics Letters. 90 (2): 023902. Bibcode:2007ApPhL..90b3902B. doi:10.1063/1.2431454.
- ^ Behkam, Bahareh; Sitti, Metin (2008). "Effect of quantity and configuration of attached bacteria on bacterial propulsion of microbeads". Applied Physics Letters. 93 (22): 223901. Bibcode:2008ApPhL..93v3901B. doi:10.1063/1.3040318.
- ^ Mostaghaci, Babak; Yasa, Oncay; Zhuang, Jiang; Sitti, Metin (2017). "Bioadhesive Bacterial Microswimmers for Targeted Drug Delivery in the Urinary and Gastrointestinal Tracts". Advanced Science. 4 (6). doi:10.1002/advs.201700058. PMC 5473323. PMID 28638787.
- ^ Schauer, Oliver; Mostaghaci, Babak; Colin, Remy; Hürtgen, Daniel; Kraus, David; Sitti, Metin; Sourjik, Victor (2018). "Motility and chemotaxis of bacteria-driven microswimmers fabricated using antigen 43-mediated biotin display". Scientific Reports. 8 (1): 9801. Bibcode:2018NatSR...8.9801S. doi:10.1038/s41598-018-28102-9. PMC 6023875. PMID 29955099.
- ^ Singh, Ajay Vikram; Hosseinidoust, Zeinab; Park, Byung-Wook; Yasa, Oncay; Sitti, Metin (2017). "Microemulsion-Based Soft Bacteria-Driven Microswimmers for Active Cargo Delivery". ACS Nano. 11 (10): 9759–9769. doi:10.1021/acsnano.7b02082. PMID 28858477.
- ^ Stanton, Morgan M.; Park, Byung-Wook; Miguel-López, Albert; Ma, Xing; Sitti, Metin; Sánchez, Samuel (2017). "Biohybrid Microtube Swimmers Driven by Single Captured Bacteria". Small. 13 (19). doi:10.1002/smll.201603679. hdl:2445/123481. PMID 28299891.
- ^ Stanton, Morgan M.; Park, Byung-Wook; Vilela, Diana; Bente, Klaas; Faivre, Damien; Sitti, Metin; Sánchez, Samuel (2017). "Magnetotactic Bacteria Powered Biohybrids TargetE. Coli Biofilms". ACS Nano. 11 (10): 9968–9978. doi:10.1021/acsnano.7b04128. hdl:2445/123493. PMID 28933815.
- ^ a b Harris, Elizabeth H. (2001). "Chlamydomonasas Amodelorganism". Annual Review of Plant Physiology and Plant Molecular Biology. 52: 363–406. doi:10.1146/annurev.arplant.52.1.363. PMID 11337403.
- ^ a b Weibel, D. B.; Garstecki, P.; Ryan, D.; Diluzio, W. R.; Mayer, M.; Seto, J. E.; Whitesides, G. M. (2005). "Microoxen: Microorganisms to move microscale loads". Proceedings of the National Academy of Sciences. 102 (34): 11963–11967. Bibcode:2005PNAS..10211963W. doi:10.1073/pnas.0505481102. PMC 1189341. PMID 16103369.
- ^ Hopfner, Ursula; Schenck, Thilo-Ludwig; Chávez, Myra-Noemi; Machens, Hans-Günther; Bohne, Alexandra-Viola; Nickelsen, Jörg; Giunta, Riccardo-Enzo; Egaña, José-Tomás (2014). "Development of photosynthetic biomaterials for in vitro tissue engineering". Acta Biomaterialia. 10 (6): 2712–2717. doi:10.1016/j.actbio.2013.12.055. PMID 24406198.
- ^ Centeno-Cerdas, Carolina; Jarquín-Cordero, Montserrat; Chávez, Myra Noemi; Hopfner, Ursula; Holmes, Christopher; Schmauss, Daniel; Machens, Hans-Günther; Nickelsen, Jörg; Egaña, José Tomás (2018). "Development of photosynthetic sutures for the local delivery of oxygen and recombinant growth factors in wounds". Acta Biomaterialia. 81: 184–194. doi:10.1016/j.actbio.2018.09.060. PMID 30287280. S2CID 52922420.
- ^ Schenck, Thilo Ludwig; Hopfner, Ursula; Chávez, Myra Noemi; Machens, Hans-Günther; Somlai-Schweiger, Ian; Giunta, Riccardo Enzo; Bohne, Alexandra Viola; Nickelsen, Jörg; Allende, Miguel L.; Egaña, José Tomás (2015). "Photosynthetic biomaterials: A pathway towards autotrophic tissue engineering". Acta Biomaterialia. 15: 39–47. doi:10.1016/j.actbio.2014.12.012. PMID 25536030.
- ^ Ng, Wei Ming; Che, Hui Xin; Guo, Chen; Liu, Chunzhao; Low, Siew Chun; Chieh Chan, Derek Juinn; Mohamud, Rohimah; Lim, Jitkang (2018). "Artificial Magnetotaxis of Microbot: Magnetophoresis versus Self-Swimming". Langmuir. 34 (27): 7971–7980. doi:10.1021/acs.langmuir.8b01210. PMID 29882671. S2CID 46953567.