열수분출구 미생물군
Hydrothermal vent microbial communities열수분출구 미생물 집단은 열수분출구 주변의 화학적으로 구별되는 영역에서 살고 번식하는 모든 단세포 생물을 포함한다. 여기에는 미생물 매트에 있는 유기체, 자유 부유 세포, 동물과의 내분비생물학적 관계에 있는 박테리아가 포함된다. 화학석유자생균은 열수분출구의 지질활동으로부터 영양분과 에너지를 얻어 탄소를 유기형태로 고정시킨다. 바이러스는 열수분출물 미생물 집단의 한 부분이기도 하며 이러한 생태계의 미생물 생태계에 미치는 영향력은 급성장하고 있는 연구 분야다.[1]
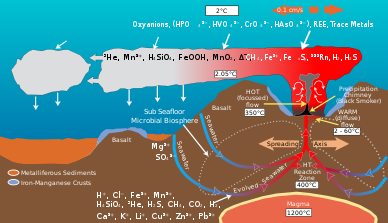
열수 분출구는 지각판이 분리되어 퍼지는 곳에 위치한다. 이것은 바다의 물이 마그마에 의해 가열되는 지구의 지각으로 들어갈 수 있게 해준다. 증가하는 압력과 온도는 물을 이 구멍에서 다시 나오게 하고, 나가는 길에, 물은 그들이 마주치는 바위로부터 용해된 미네랄과 화학물질을 축적한다. 일반적으로 3가지 종류의 환기구들이 발생하며, 온도 및 화학적 구성으로 특징지어진다. 확산 환풍구는 일반적으로 30 °C까지 맑은 물을 방출한다. 흰색 흡연자 통풍구는 약 200~330℃의 우유빛 물을 내뿜고, 검은색 흡연자 통풍구는 일반적으로 300~400℃의 다른 것들보다 뜨거운 물을 방출한다. 검은 흡연자의 물은 축적된 황화물의 침전물에 의해 어두워진다.[2] 이러한 바다 깊이의 햇빛의 부재로 인해, 에너지는 화학합성에 의해 제공되는데, 이 화학합성에 의해 공생균과 고고학이 먹이 사슬의 바닥을 형성하고, 리프트아 파키프틸라, 알비넬라 폼페야나 등 다양한 유기체를 지원할 수 있다. 이 유기체들은 이러한 열수분출구에 방출되는 화학적 에너지를 사용하고 얻기 위해 이 공생관계를 이용한다.[3]
환경 특성
계절적으로 열선 깊이가 변화하면서 수면에 기온 변화가 크지만 열선 밑의 온도와 심해 부근의 수온은 비교적 일정하다. 계절적 영향이나 연간 변화로 인한 변화는 없다. 이러한 온도는 최대 407°C까지 상승할 수 있는 열수 분출구를 바로 둘러싼 물을 제외하고 0-3°C 범위에 머무른다.[4][5] 이 물은 그 깊은 곳에서 작용하는 압력 때문에 끓는 것을 방지한다.
깊이가 높아지면서 압력의 영향이 나타나기 시작한다. 그 압력은 위에서 아래로 밀어 내려가는 물의 무게 때문이다. 바다의 압력 상승의 대략적인 속도는 해저로 이동하는 모든 킬로미터에 대해 10메가-파스칼(MPa)이다. 이는 참호 깊숙한 곳에서 정수압은 110MPa까지 도달할 수 있다는 것을 의미한다.[6]
염도는 전 세계 심해 공동체 내에서 1000분의 35로 비교적 일정하게 유지된다.[4]
열수분출기 환경에는 빛이 없기 때문에 광합성으로 에너지를 만들 수 있는 유기체가 없다. 대신에, 대부분의 유기체가 사용하는 에너지는 화학합성으로부터 온다. 그 유기체들은 환기구에서 나오는 미네랄과 화학물질을 사용한다.
적응
열수분출기 환경의 극한 조건은 이들 지역에 서식하는 미생물 집단이 이에 적응할 필요가 있다는 것을 의미한다. 이곳에 사는 미생물은 초열성 미생물, 90℃ 이상의 온도에서 자라는 미생물로 알려져 있다. 이 유기체들은 환기구에서 나온 액체가 배출되어 주변 물과 혼합되는 곳에서 발견된다. 이들 초열성 미생물에는 분자 내 상호작용에 의해 높은 온도에서 안정성을 연장한 단백질이 포함된 것으로 생각되지만 정확한 메커니즘은 아직 명확하지 않다. DNA에 대한 안정화 메커니즘은 알 수 없고 DNA의 변성은 고염 농도를 통해 최소화되는 것으로 생각되는데, 보다 구체적으로 초열성 물질에 고농축된 Mg, K, PO4가 그것이다. 이와 함께 많은 미생물들이 히스톤과 유사한 단백질을 가지고 있어 DNA에 결합되어 고온으로부터 보호해 줄 수 있다. 미생물들은 또한 열수분출기 환경에서 다른 유기체들과 공생 관계에 있는 것으로 밝혀졌는데, 이는 그들이 황화물이 풍부한 물을 대사할 수 있게 하는 해독 메커니즘을 가지고 있기 때문에, 미생물들과 미생물들에게 독성이 있을 것이다.[7]
미생물 생물 지질화학
소개.
열수 분출구의 미생물 집단은 지질학적 활동에 의해 생성되는 에너지와 광물의 유기 물질로의 변형을 중재한다. 자폐성 박테리아에 의해 생성된 유기 물질은 영양의 상위 수준을 지탱하는 데 사용된다. 열수분출액과 주변 바닷물은 철, 망간 등의 원소와 황화, 황산염, 황산염, 원소황 등 다양한 종류의 황이 풍부해 에너지나 영양분을 얻을 수 있다.[8] 미생물들은 원소를 산화시키거나 감소시킴으로써 에너지를 얻는다. 다른 미생물 종들은 신진대사 과정에서 다른 화학종류의 원소를 사용한다. 예를 들어, 일부 미생물 종은 황산염을 황산염으로 산화시키고 다른 종은 황산을 원소 황으로 감소시킬 것이다. 그 결과 서로 다른 미생물 종에 의해 매개된 화학적 경로의 거미줄은 탄소, 황, 질소, 수소 같은 원소를 한 종에서 다른 종으로 변형시킨다. 그들의 활동은 열수분출기 환경의 지질 활동에 의해 생성된 원래의 화학적 구성을 변화시킨다.[9]
카본 사이클
열수 분출구의 지질학적 활동은 풍부한 탄소 화합물을 생산한다.[10] 열수 분출구 플룸에는 메탄 농도가 주변 바닷물의 10배에7 이르는 메탄과 일산화탄소가 고농도로 함유되어 있다.[10][11] 심해수 또한 2.2mM 전후로 용해된 CO2, HCO와3− 같은 이산화탄소 종의 농도와 탄소의 대규모 저수지다.[12] 지질활동에 의해 생성된 풍부한 탄소 및 전자 수용체들은 황, 철, 망간, 수소, 메탄의 산화 등 원천에서 나오는 에너지를 이용한 CO와2, 같이 무기탄소를 고정하는 화학조생성 미생물 집단의 오아시스를 지원한다.[10] 이 박테리아는 열수 분출구에서 이질적 생명을 지탱하는 유기 탄소의 상당 부분을 공급한다.[13]
탄소 고정
탄소 고정은 무기 탄소를 유기 물질에 통합하는 것이다. 빛이 탄소 고정의 주요 에너지원인 지구 표면과 달리 열수분출구 화학성분비균은 필요한 에너지를 얻기 위해 화학적 산화에 의존한다.[14] CO2 고정은 열수 분출구에서 감마프로테오박테리아, 엡실론프로테오박테리아, 알파프로테오박테리아, 아르케아 도메인 구성원에게서 관찰된다. 미생물 통풍구 공동체에서 발견된 탄소 고정의 4가지 주요 대사 경로로는 캘빈-벤슨-바섬(CBB) 주기, 환원 트리카복시산(rTCA) 주기, 3-하이드록시프로피온(3-HP) 주기 및 환원 아세틸 코엔자임 A(acetyl-CoA) 경로가 있다.[14]
탄소 고정 대사 경로
CBB(Calvin-Benson-Bassham 사이클)
CBB(Calvin-Benson-Bassham) 사이클은 자가영양에서 발견된 가장 일반적인2 CO 고정 경로다.[15] 핵심 효소는 리불로스-1,5-비스인산염 카르복실라제/산소화효소(RuBisCO)이다.[14] 루비스코는 티오미크로스피라, 베기아토아, 제타프로테오박테리움, 튜브벌레, 바이발브, 위스트로포드의 감마프로테오박테리아 내시경 등 미생물 집단에서 확인됐다.[15]
환원성 카복실산 사이클(rTCA)
환원성 카르복실산 사이클(rTCA)은 열수 분출구에서 두 번째로 흔히 발견되는 탄소 고정 경로로,[15] rTCA 사이클은 근본적으로 유기 물질을 산화시키기 위해 사용되는 역 TCA 또는 Kreb 사이클 이성질체들이다. rTCA 사이클을 사용하는 유기체는 RTCA 사이클의 일부 효소가 O의2.[14] 유무에 민감하기 때문에 열수분출구계의 양극성 영역에 서식하는 것을 선호한다. 그것은 데설포박터, 아퀴피칼레스, 아퀴페섹스, 열단백과 등의 일부 성분과 같은 황산염 환원 델타프로테박테균에서 발견된다.[14]
3-HP 및 3-HP/4-HB 사이클
3-HP 및 3-HP/4-HB 사이클의 핵심 효소는 아세틸-CoA/프로피오닐-CoA 카르복실화효소, 말론릴-CoA 환원효소 및 프로피오닐-CoA 싱타아제다. 이 경로를 이용하는 유기체들은 대부분 탄소고정 외에 유기탄소를 사용할 수 있는 능력을 가진 혼합형식물이다.[14]
환원 아세틸 CoA 경로
환원성 아세틸 CoA 경로(Reducationctive Acetyl CoA 경로)는 화학 자가용에서만 발견되었다. 이 통로는 통로가 H. 이 통로를 통해 발견된 H2. 유기체의 감소와 직접 결합되기 때문에 ATP가 필요하지 않다. 이 통로를 통해 발견된 유기체는 H가2 풍부한 지역을 선호한다. 종으로는 들파프로테오박테리움(Dulfobacterium autotracyum), 아세토균, 메탄 유발 아르케아 등 델타프로테오박테리움이 있다.[14]
메탄 대사
열수 분출구는 지질학적, 생물학적 과정 모두에서 발생할 수 있는 많은 양의 메탄을 생산한다.[10][11] 열수분출기 플룸의 메탄 농도는 환기구마다 농도 300µM을 초과할 수 있다. 이에 비해 환기구 액에는 주변 심해수보다 10배67~10배 많은 메탄가스가 함유되어 있는데, 이 중 메탄가스의 농도 범위는 0.2~0.3nM이다.[11] 미생물 집단은 고농도의 메탄을 에너지원이자 탄소의 원천으로 사용한다.[10] 메탄을 에너지와 탄소원으로 모두 사용하는 메탄로테오박테리아가 메틸로코쿠스과 줄지어 있는 가운데 메탄노트로피아가 관찰됐다.[15] 메탄로프스는 메탄을 이산화탄소와 유기탄소로 변환시킨다.[11] 그것들은 전형적으로 세포간 막이 존재하며 세포간 막이 있는 미생물이 열수 분출구에서 미생물 매트의 20%를 차지하는 것으로 관찰되었다.[10][11]
메탄 산화
메탄 산화를 통한 에너지 생성은 황 산화 다음으로 가장 좋은 에너지원을 산출한다.[10] 미생물 산화가 열수 분출구에서 빠른 이전을 촉진하기 때문에 메탄의 상당 부분이 분출구에서 단거리 이내에서 산화된다는 것이 제안되어 왔다.[11] 열수분출기 공동체에서 메탄의 에어로빅 산화는 보통 환기구 동물의 내분비생물 미생물에서 발견된다.[16] 메탄의 혐기성 산화(AOM)는 일반적으로 열수 분출구에서 가장 풍부하기 때문에 단자 전자 수용체로서 황산염이나 Fe와 Mn의 감소와 결합된다.[11][17] AOM은 열수분출구의[18][17] 해양 퇴적물에서 광범위하게 발견되며, 이 열수분출구에서 발생하는 메탄의 75%를 소비하는 원인이 될 수 있다.[17] AOM을 수행하는 종으로는 식물성 크레나카게오타(Phyellum Crenarchaeota)[19]의 아르케아(Acosa)와 테르모코쿠스(Thermococcus
메타노제시스
메탄생식을 통한 메탄의 생산은 탄화수소의 분해, 이산화탄소 또는 포메이트와 같은 다른 화합물의 반응에서 비롯될 수 있다.[16] 메탄노제스의 증거는 퇴적물에서 AOM과 함께 발견될 수 있다.[18] 열성 메타노균은 55°C~80°C 온도에서 열수분출기 플룸에서 자라는 것으로 확인된다.[20] 그러나 많은 열성생종이 행하는 자기방성 메탄생식은 전자공여자로서 H를2 필요로 하기 때문에 H의2 가용성에 의해 미생물 성장이 제한된다.[20][13] 열수 분출구에서 발견되는 열수성 메탄노균의 종류로는 메탄노칼도코쿠스, 메탄노토코쿠스, 메탄노코쿠스 등이 있다.[20]
황 사이클
열수분출구의 미생물 집단은 지질 활동에 의해 생성된 HS와2 같은 유황을 에너지를 위해 황산염, 황산염, 원소황과 같은 다른 형태로 변환하거나 유기 분자로 동화시킨다.[9] 황화물은 열수분출구에 풍부하며, 농도가 1에서 수십 mM인 반면, 주변의 바닷물은 보통 몇 나노 어금니만을 함유하고 있다.[21]
황 산화
열수분출구에 의해 생성되는 HS와2 같은 감소된 유황 화합물은 미생물의 유황 신진대사를 위한 주요 에너지원이다.[10] 황산염, 티오황산염, 원소황 등의 형태로 환원된 황화합물을 산화시켜 무기탄소로부터 유기화합물을 합성하는 등 미생물 대사에 필요한 에너지를 생산한다.[9] 황산화에 사용되는 주요 대사경로는 SOX 경로와 탈염산화를 포함한다. 삭스 통로(Sox pathway)는 황화, 황산염, 원소황, 티오황산을 황산염으로 산화시킬 수 있는 다효소 통로다.[9] 불연산화는 황산염을 원소 황으로 바꾼다.[8] 유황 산화종에는 티오미크로스피라, 할로티오토바실루스, 베기아토아, 페르세포넬라, 유황리모나스 등이 있다. 가마프로테오박테리아, 엡실론단백질박테리아I급 공생종도 유황을 산화시킬 수 있다.[9]
황 감소
황 감소는 황산염을 전자 수용기로 사용하여 황산염을 동화시킨다. 황산염을 줄이는 미생물들은 전형적으로 전자 공여자로서 수소, 메탄 또는 유기 물질을 사용한다.[17][22] 메탄의 혐기성 산화(AOM)는 황산염을 전자 수용기로 사용하는 경우가 많다.[17] 이 방법은 열수분출구의 높은 음산화 영역에 사는 유기체가 선호하기 때문에 [22]퇴적물 내에서 발생하는 우성 과정 중 하나이다.[13] 고세아에서 황산염을 감소시키는 종들이 확인되었고 열수 분출구에서 데설포비브리오, 데설포불버스, 데설포박테리아, 데설푸로모나스 등의 델타프로테오박테리아 회원들이 확인되었다.[22]
질소 사이클
심해수에는 약 0.59mM의 용존 질소 가스를 가진 열수 분출구가 사용할 수 있는 가장 큰 질소 저장소가 포함되어 있다.[23][24] 암모늄은 용해된 무기질소의 지배적인 종으로 열수 분출구 아래에서 물의 질량을 혼합하여 배출할 수 있다.[24] 이용 가능한 암모늄의 양은 지질 활동과 미생물 구성에 따라 각 분출구에 따라 다양하다.[24] 열수 분출구에서 질산염과 질산염 농도가 주변 해수에 비해 고갈된다.[23]
열수분출구 미생물 공동체의 질소 순환에 대한 연구는 여전히 더 포괄적인 연구를 필요로 한다.[23] 그러나, 동위원소 데이터는 미생물이 용해된 무기질 질소 양과 구성물에 영향을 미치고 질소 주기의 모든 경로는 열수 분출구에서 발견될 가능성이 있음을 시사한다.[24] 생물학적 질소 고정은 질소 순환에 생물학적으로 이용 가능한 질소의 일부를 제공하기 위해 중요하다.[23] 특히 비치료 열수 분출구에서. 질소 고정은 메타노믹로비알레스, 메타노코칼레스, 메타노박테리알레스 순서로 메타노겐을 포함한 많은 다른 미생물에 의해 이루어진다.[23] 열성 미생물들은 92℃와 같은 높은 온도에서 질소를 고정할 수 있는 것으로 밝혀졌다.[23] 질소 고정은 특히 미생물 매트와 미립자 물질에서 미생물 밀도가 높고 혐기성 환경으로 인해 질소 고정 효소인 질소효소의 기능이 가능하기 때문에 생물학적으로 이용 가능한 질소 수준이 낮은 경우 널리 사용될 수 있다.[23] 또한 암모늄에 대한 동화, 질화, 변성화, 아나목스, 광물화 및 불소질 질산염 감소의 증거도 발견되었다.[24] 예를 들어, Begiatoa 종과 같은 황 산화 박테리아는 변성화를 수행하고 질산염을 감소시켜2 HS를 산화시킨다.[23] 질산동화는 리프트아 파키프틸라 튜브벌레의[23] 공생종들에 의해 이루어진다.
세균 다양성
열수 분출구에서 가장 풍부한 박테리아는 화학비석세포다. 이 박테리아는 이산화탄소를 유기탄소로 줄이기 위해 에너지원으로서 감소된 화학종, 가장 흔히 황을 사용한다.[10] 열수분출기 환경에서 화학적 영양소 풍부함은 이용 가능한 에너지원에 의해 결정된다. 온도분출기마다 영양소의 농도가 다르며, 이는 분출기 사이의 큰 변화를 시사한다. 일반적으로, 많은 미생물 집단은 따뜻한 환기구 물기둥(25°C), 따뜻한 환기구 연기에 노출된 표면 및 환기구 근처에 있는 특정 환기구 무척추동물 내의 공생 조직에서 발견된다.[10]
황산화
이 박테리아는 산소가 존재하는 곳에서 다양한 형태의 가용 황(S−2, S0, SO23−2)을 사용한다. 그들은 대부분의 열수 분출구에서 우세한 개체로, 에너지의 원천이 널리 이용가능하고, 에어로빅 조건에서 화학합성률이 증가하기 때문이다. 열수 분출구의 박테리아는 티오미크로스피라가 티오미코빌루스(Tiomicrospira)를 대체했다는 점을 제외하면 다른 HS가 풍부한2 환경에서 발견되는 유황세균의 종류와 유사하다. 다른 흔한 종으로는 티오트릭스와 베기아토아가 있는데, 이것은 질소를 고정하는 능력 때문에 특히 중요하다.[10]
메탄산화
메탄은 특정 열수 분출구에서 상당한 에너지원이지만 다른 것은 아니다: 메탄은 수소보다 따뜻한 분출구(25°C)에서 더 풍부하다.[10] 많은 종류의 메탄퇴화성 박테리아가 존재하는데, 이것은 산소를 필요로 하고 CO와322 CO를 포함한 다른41 C 화합물들을 고친다.[10] 이러한 종류의 박테리아는 리프트리아 영양소에서도 발견되는데 이는 공생 관계를 나타낸다.[10] 여기서 메탄산화세균은 메탄노트로피스를 말하며 메탄노균과 같지 않다. 메타노코쿠스와 메타노칼도코쿠스 잔나스치이는 열수 분출구에서 발견되는 [10]메타노균류인 반면 메틸로시스토과는 열수 분출구 공동체에서도 발견되는 메타노트로피루스다.[25]
수소산화
수소를 에너지의 원천으로 사용하는 미생물에 대해서는 거의 알려져 있지 않지만, 연구결과에 따르면 수소가 에어로빅이며 리프트리아(아래 참조)[10][26]와 공생한다는 것이 밝혀졌다. 이 박테리아는 지구에서 생산된 H가2 이 과정을 위해 취하기 때문에 유기탄소의 1차 생산에 중요하다.[10] NO 함유3− 바닥 바닷물이 열수액과 혼합된 환기구에는 수소산화 및 탈염균이 풍부할 수 있다.[10] 데스울포넛쿠스 잠수함(Desulfonaticus submarinus)은 따뜻한 환기구에서 유황 혼합물을 감소시키는 수소화합물로, 관벌레 R. 파키프틸라와 알비넬라 폼페야나에서 발견되었다.[27]
철 및 망간산화
이러한 박테리아는 열수분 및 해저 바닷물에 간헐적으로 노출되는 표면의 철분과 망간 퇴적물에서 흔히 발견된다. 그러나 중성 및 알칼리성 수역(즉, 담수 및 해수)에서 Fe의2+ 빠른 산화로 인해 철의 산화 증착을 일으키는 박테리아가 산성 수역에서 더 흔하게 발견될 것이다.[10] 망간산화세균은 가용 금속의 농도가 높아 철산화세균에 비해 담수나 바닷물에 풍부하다.[10]
생태학
공생관계
공생 화학합성술은 열수분출기 공동체에 중요한 과정이다.[10] 따뜻한 통풍구에서는 박테리아에 대한 일반적인 공생동물로는 심해조개, 칼피토겐아 장엄, 바스요모디올루스 열포닐루스, 포고노포란 관벌레 등의 홍합, 리프트아 파키프틸라, 알비넬라 폼페자나가 있다.[10][26][self-published source?][27] 이 동물들의 영양소는 화학합성을 위한 귀중한 분자를 포함하는 공생을 위한 특정 기관이다. 이 유기체들은 그들의 공생에 너무 의존하게 되어 박테리아가 HS와2 무료 O를2 제공하지만, 섭취와 소화와 관련된 모든 형태학적 특징을 잃었다.[10] 게다가, 메탄 산화 박테리아는 C. magnifica와 R. pachyptila로부터 격리되었는데, 이것은 메탄 동화가 이 유기체들의 영양분 내에서 일어날 수 있다는 것을 나타낸다.[8]
필라와 제네라
열수분출구의 놀라운 다양성을 설명하기 위해 아래 목록은 박테리아 식물과 생식체를 알파벳 순으로 누적하여 나타낸 것이다. 그림과 같이 프로테오박테리아는 심해 환기구에서 존재하는 식물 중 가장 우세한 것으로 보인다.
- 악티노박테리아[15]
- 수과
- 클로로플렉시[15]
- 클로로비 - 클로로비움
- 지연작성
- 젬마티모나데츠[15]
- 니트로스피레아과
- 니트로스피나과[15]
- 렙토스피릴룸페리필룸
- 프로페디쿠테스
- 프로테오박테리아
- 산디티오백실리아속
- 알파프로테오박테리아[15]
- 베타프로테오박테리아
- 감마프로테오박테리아 - 주요 공생동물[10][14][15]
- 알로크로마튬
- 티오미크로스피라
- 티오알칼리비브리오
- 메틸로코쿠스과
- 베기아토아
- 티오플로카
- 델타프로테오박테리아 - 황산염 감소, 세균 집단의[14][15][22] 25% 이상을 차지한다.
- 데설포비프리오
- 데설포불버스
- 데술푸로모나스속
- 엡실론단백질균[10][14][15]
- 설푸로봄석류
- 유황모나스파라비넬라과
- 니트라티프랙터살수기니스
- 수소이모나스 보온병
- 티오보룸속
- 테르메데설포박테리아[10]
- 제타프로테오박테리아
DNA 수리
심해 열수분출기 굴뚝에 서식하는 미생물 집단은 DNA 불일치 수리와 동질 재조합에 고용된 효소를 인코딩하는 유전자가 고농축된 것으로 보인다.[28] 이 발견은 이러한 미생물 집단이 그들이 존재하는 극단적인 DNA 손상 조건에 대처하기 위해 광범위한 DNA 수리 능력을 진화시켰음을 시사한다.[28]
바이러스 및 심해 열수 분출구
바이러스는 바다에서 가장 풍부한 생명체로 유전적 다양성의 가장 큰 저장소를 가지고 있다.[29] 그들의 감염은 종종 치명적이기 때문에, 그들은 사망의 중요한 원천을 구성하며, 따라서 해양 내 생물학적 해양학 과정, 진화 및 생물 화학적 순환에 광범위한 영향을 미친다.[30] 그러나 환기구 서식지에서 발견된 바이러스가 그들이 존재하는 극단적이고 휘발성 있는 환경에서 살아남기 위해 기생 진화 전략보다 상호주의적인 전략을 채택했다는 증거가 발견되었다.[31]
심해 열수 분출구는 바이러스 생산량이 높다는 것을 나타내는 바이러스의 수가 많은 것으로 밝혀졌다.[32] 브리티시 컬럼비아 남서부의 엔데버 열수 분출구에서 추출한 샘플은 흑인 흡연자의 활성 배출이 mL당 1.45x10에서5 9.90x10까지의7 바이러스 분비를 보였으며 열수-발광 플룸(mL당 3.5x106)과 배기가스 시스템 외부(mL당 2.94x106)에서 검출되었다. 바이러스의 높은 밀도와 따라서 (주변 심해에 비해) 바이러스 생성은 바이러스가 환기구에서 미생물 사망의 중요한 원천이라는 것을 암시한다.[32] 다른 해양 환경과 마찬가지로 심해 열수 바이러스는 원핵생물의 풍부함과 다양성에 영향을 미치며, 따라서 숙주에게 복제를 허용함으로써 미생물 생물 지질화학 순환에 영향을 미친다.[33]
그러나, 사망률과 인구 조절의 원천으로서의 역할과 대조적으로, 바이러스는 또한 유전 정보의 저장고 역할을 하면서 극한 환경에서의 원핵생물의 생존을 증진시키기 위해 가정되었다. 따라서 환경적 스트레스를 받는 미생물과 바이로스피어의 상호작용은 수평유전자전달을 통해 숙주유전자 분산을 통한 미생물 생존에 도움이 된다고 생각된다.[34]
매초 "해상에서는 대략 아보가드로의 감염 건수가 발생하고 있으며, 이 모든 상호작용은 바이러스와 숙주 사이에 유전 정보가 전달되는 결과를 초래할 수 있다" — 커티스 서틀[35]
용균성 파지(그 즉각적인 용해를 일으키는 것도 아니)가끔[7]은 용원 라이프 사이클에 안정적으로 바이러스의 이것은 allo 수 있는 유전자(과정 용원화 변환으로 알려진)수 있도록 함으로써 호스트의 표현형을 바꿀 수 있는 감염된 박테리아와의 수천세대 동안 지속될 수 있는 원핵 생물들에 건강을 향상시키는 표현형을 부여할 수 있다.wh서로 다른 환경에 대처하기 위한 [36]osts 숙주 모집단에 대한 혜택은 또한 페이지는 인코딩된 체력 강화 표현형식의 표현으로 제공될 수 있다.[37]

2015년에 발표된 열수 분출구의 바이러스 연구 검토 결과, 분출구는 리소겐 숙주의 상당 부분을 포함하고 있으며, 많은 양의 바이러스가 온대하여 분출 환경이 발작에 유리할 수 있음을 알 수 있다.[38]
확산-흐름 열수분출기 환경에서 바이러스-호스트 상호작용에 대한 한 연구는 리소겐 호스트와 온대 바이러스의 많은 집단이 그 규모에서 고유하며 이러한 바이러스가 원핵생물의 시스템 생태계에 중요할 가능성이 높다는 것을 발견했다. 같은 연구의 유전자 분석 결과, 바이러스 메타게놈 시퀀스의 51%가 알려지지 않은(동질학에서 시퀀싱된 데이터까지 해킹) 환기구 환경 전반에 걸쳐 다양성은 높지만 특정 환기구 현장의 다양성은 낮아 바이러스 표적에 대한 고유성을 나타내는 것으로 나타났다.[37]
심해 열수분출구 비롬에 대한 메타게놈 분석 결과 바이러스 유전자가 박테리아 대사를 조작해 대사 경로에 참여했고 미생물 대사에서 갈라진 경로를 형성해 극한 환경 적응을 촉진했다.[39]
이것의 한 예는 황을 소모하는 박테리아 SUP05와 관련이 있었다. 한 연구에 따르면, 분출성 플럼 샘플에서 서열화된 18개의 바이러스 게놈 중 15개는 SUP05 화학석소자체들이 유황 화합물에서 에너지를 추출하기 위해 사용하는 효소와 밀접한 관련이 있는 유전자를 포함하고 있었다. 저자들은 숙주의 황산화대사를 강화할 수 있는 그러한 페이징 유전자(보조대사유전자)가 바이러스(지속적인 감염과 복제)에 선택적 이점을 제공할 수 있다고 결론지었다.[40] 유황 대사에 대한 바이러스 유전자와 SUP05 유전자의 유사성은 과거에 유전자의 교환을 의미하며 바이러스를 진화의 매개체로 연관시킬 수 있다.[41]
또 다른 유전체학 연구는 바이러스 유전자가 신진대사, 비타민, 공작용 유전자의 비율이 상대적으로 높다는 것을 밝혀내 바이러스 유전자가 보조 대사 유전자를 암호화하는 것으로 나타났다. 이는 리소겐 바이러스의 높은 비율의 관찰과 결합하여 바이러스가 자유유동 바이러스보다는 통합형 친바이러스(pro-virus)로 선택되고, 보조 유전자를 발현하여 숙주와 통합형 바이러스 모두에게 이익이 된다는 것을 나타낸다. 그 바이러스는 신진대사를 증진시키거나 그들이 속한 숙주들에게 더 큰 신진대사의 유연성을 제공함으로써 건강을 증진시킨다. 그 증거는 심해 열수 분출물 바이러스 진화 전략이 숙주 통합을 장기화하며, 고전적 기생충에 대한 일종의 상호주의를 선호한다는 것을 암시한다.[31]
해저 물질을 위한 열수 분출구로서, 또한 분출 바이러스와 지각의 열수 분출구 사이에 연관성이 있을 가능성이 있다.[38]
참고 항목
참조
- ^ Anderson, Rika E.; Brazelton, William J.; Baross, John A. (2011). "Is the Genetic Landscape of the Deep Subsurface Biosphere Affected by Viruses?". Frontiers in Microbiology. 2: 219. doi:10.3389/fmicb.2011.00219. PMC 3211056. PMID 22084639.
- ^ Lutz, Richard A.; Kennish, Michael J. (1993). "Ecology of deep-sea hydrothermal vent communities: A review". Reviews of Geophysics. 31 (3): 211. Bibcode:1993RvGeo..31..211L. doi:10.1029/93rg01280.
- ^ Kádár, Enikõ; Costa, Valentina; Santos, Ricardo S.; Powell, Jonathan J. (July 2006). "Tissue partitioning of micro-essential metals in the vent bivalve Bathymodiolus azoricus and associated organisms (endosymbiont bacteria and a parasite polychaete) from geochemically distinct vents of the Mid-Atlantic Ridge". Journal of Sea Research. 56 (1): 45–52. Bibcode:2006JSR....56...45K. doi:10.1016/j.seares.2006.01.002.
- ^ a b Bergman, Jennifer (16 February 2011). "Temperature of Ocean Water". Windows to the Universe.
- ^ Haase, K. M.; Petersen, S.; Koschinsky, A.; Seifert, R.; Devey, C. W.; Keir, R.; Lackschewitz, K. S.; Melchert, B.; Perner, M.; Schmale, O.; Süling, J.; Dubilier, N.; Zielinski, F.; Fretzdorff, S.; Garbe-Schönberg, D.; Westernströer, U.; German, C. R.; Shank, T. M.; Yoerger, D.; Giere, O.; Kuever, J.; Marbler, H.; Mawick, J.; Mertens, C.; Stöber, U.; Walter, M.; Ostertag-Henning, C.; Paulick, H.; Peters, M.; Strauss, H.; Sander, S.; Stecher, J.; Warmuth, M.; Weber, S. (November 2007). "Young volcanism and related hydrothermal activity at 5°S on the slow-spreading southern Mid-Atlantic Ridge" (PDF). Geochemistry, Geophysics, Geosystems. 8 (11): n/a. Bibcode:2007GGG.....811002H. doi:10.1029/2006gc001509.
- ^ Jebbar, Mohamed; Franzetti, Bruno; Girard, Eric; Oger, Philippe (July 2015). "Microbial diversity and adaptation to high hydrostatic pressure in deep-sea hydrothermal vents prokaryotes". Extremophiles. 19 (4): 721–740. doi:10.1007/s00792-015-0760-3. PMID 26101015. S2CID 17213654.
- ^ Zierenberg, Robert A.; Adams, Michael W. W.; Arp, Alissa J. (21 November 2000). "Life in extreme environments: Hydrothermal vents". Proceedings of the National Academy of Sciences of the United States of America. 97 (24): 12961–12962. Bibcode:2000PNAS...9712961Z. doi:10.1073/pnas.210395997. PMC 34077. PMID 11058150.
- ^ a b c Kletzin, Arnulf; Urich, Tim; Müller, Fabian; Bandeiras, Tiago M.; Gomes, Cláudio M. (February 2004). "Dissimilatory Oxidation and Reduction of Elemental Sulfur in Thermophilic Archaea". Journal of Bioenergetics and Biomembranes. 36 (1): 77–91. doi:10.1023/b:jobb.0000019600.36757.8c. PMID 15168612. S2CID 45653369.
- ^ a b c d e Sievert, Stefan M.; Hügler, Michael; Taylor, Craig D.; Wirsen, Carl O. (2008). "Sulfur Oxidation at Deep-Sea Hydrothermal Vents". Microbial Sulfur Metabolism. pp. 238–258. doi:10.1007/978-3-540-72682-1_19. ISBN 978-3-540-72679-1.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Jannasch, Holger W.; Mottl, Michael J. (1985). "Geomicrobiology of Deep-Sea Hydrothermal Vents". Science. 229 (4715): 717–725. Bibcode:1985Sci...229..717J. doi:10.1126/science.229.4715.717. JSTOR 1696097. PMID 17841485. S2CID 24859537.
- ^ a b c d e f g de Angelis, Marie Agatha (1989). Studies of microbial methane oxidation in deep sea hydrothermal vent environments (Thesis). ProQuest 303750552.
- ^ Dunk, Rachel M.; Peltzer, Edward T.; Walz, Peter M.; Brewer, Peter G. (December 2005). "Seeing a Deep Ocean CO2 Enrichment Experiment in a New Light: Laser Raman Detection of Dissolved CO 2 in Seawater". Environmental Science & Technology. 39 (24): 9630–9636. Bibcode:2005EnST...39.9630D. doi:10.1021/es0511725. PMID 16475344.
- ^ a b c Ver Eecke, Helene C.; Butterfield, David A.; Huber, Julie A.; Lilley, Marvin D.; Olson, Eric J.; Roe, Kevin K.; Evans, Leigh J.; Merkel, Alexandr Y.; Cantin, Holly V.; Holden, James F. (21 August 2012). "Hydrogen-limited growth of hyperthermophilic methanogens at deep-sea hydrothermal vents". Proceedings of the National Academy of Sciences of the United States of America. 109 (34): 13674–13679. Bibcode:2012PNAS..10913674V. doi:10.1073/pnas.1206632109. PMC 3427048. PMID 22869718.
- ^ a b c d e f g h i j k l Nakagawa, Satoshi; Takai, Ken (July 2008). "Deep-sea vent chemoautotrophs: diversity, biochemistry and ecological significance: Chemoautotrophy in deep-sea vents". FEMS Microbiology Ecology. 65 (1): 1–14. doi:10.1111/j.1574-6941.2008.00502.x. PMID 18503548.
- ^ a b c d e f g h i j k l m n o Cerqueira, Teresa; Barroso, Cristina; Froufe, Hugo; Egas, Conceição; Bettencourt, Raul (August 2018). "Metagenomic Signatures of Microbial Communities in Deep-Sea Hydrothermal Sediments of Azores Vent Fields". Microbial Ecology. 76 (2): 387–403. doi:10.1007/s00248-018-1144-x. PMID 29354879. S2CID 7879639.
- ^ a b Martin, William; Baross, John; Kelley, Deborah; Russell, Michael J. (November 2008). "Hydrothermal vents and the origin of life". Nature Reviews Microbiology. 6 (11): 805–814. doi:10.1038/nrmicro1991. PMID 18820700. S2CID 1709272.
- ^ a b c d e Wankel, Scott D.; Adams, Melissa M.; Johnston, David T.; Hansel, Colleen M.; Joye, Samantha B.; Girguis, Peter R. (October 2012). "Anaerobic methane oxidation in metalliferous hydrothermal sediments: influence on carbon flux and decoupling from sulfate reduction: Anaerobic methane oxidation in hydrothermal vents". Environmental Microbiology. 14 (10): 2726–2740. doi:10.1111/j.1462-2920.2012.02825.x. PMID 22827909.
- ^ a b Biddle, Jennifer F; Cardman, Zena; Mendlovitz, Howard; Albert, Daniel B; Lloyd, Karen G; Boetius, Antje; Teske, Andreas (May 2012). "Anaerobic oxidation of methane at different temperature regimes in Guaymas Basin hydrothermal sediments". The ISME Journal. 6 (5): 1018–1031. doi:10.1038/ismej.2011.164. PMC 3329104. PMID 22094346.
- ^ Brazelton, William J.; Schrenk, Matthew O.; Kelley, Deborah S.; Baross, John A. (September 2006). "Methane- and Sulfur-Metabolizing Microbial Communities Dominate the Lost City Hydrothermal Field Ecosystem". Applied and Environmental Microbiology. 72 (9): 6257–6270. Bibcode:2006ApEnM..72.6257B. doi:10.1128/AEM.00574-06. PMC 1563643. PMID 16957253.
- ^ a b c Topçuoğlu, Begüm D.; Stewart, Lucy C.; Morrison, Hilary G.; Butterfield, David A.; Huber, Julie A.; Holden, James F. (5 August 2016). "Hydrogen Limitation and Syntrophic Growth among Natural Assemblages of Thermophilic Methanogens at Deep-sea Hydrothermal Vents". Frontiers in Microbiology. 7: 1240. doi:10.3389/fmicb.2016.01240. PMC 4974244. PMID 27547206.
- ^ Radford-Knoery, Joël; German, C. R.; Charlou, J.-L.; Donval, J.-P.; Fouquet, Y. (March 2001). "Distribution and behavior of dissolved hydrogen sulfide in hydrothermal plumes". Limnology and Oceanography. 46 (2): 461–464. Bibcode:2001LimOc..46..461R. doi:10.4319/lo.2001.46.2.0461.
- ^ a b c d Frank, Kiana L; Rogers, Daniel R; Olins, Heather C; Vidoudez, Charles; Girguis, Peter R (July 2013). "Characterizing the distribution and rates of microbial sulfate reduction at Middle Valley hydrothermal vents". The ISME Journal. 7 (7): 1391–1401. doi:10.1038/ismej.2013.17. PMC 3695286. PMID 23535916.
- ^ a b c d e f g h i Mehta, Mausmi P.; Butterfield, David A.; Baross, John A. (February 2003). "Phylogenetic Diversity of Nitrogenase (nifH) Genes in Deep-Sea and Hydrothermal Vent Environments of the Juan de Fuca Ridge". Applied and Environmental Microbiology. 69 (2): 960–970. Bibcode:2003ApEnM..69..960M. doi:10.1128/aem.69.2.960-970.2003. PMC 143675. PMID 12571018.
- ^ a b c d e Bourbonnais, Annie; Lehmann, Moritz F.; Butterfield, David A.; Juniper, S. Kim (February 2012). "Subseafloor nitrogen transformations in diffuse hydrothermal vent fluids of the Juan de Fuca Ridge evidenced by the isotopic composition of nitrate and ammonium". Geochemistry, Geophysics, Geosystems. 13 (2): n/a. Bibcode:2012GGG....13.2T01B. doi:10.1029/2011gc003863.
- ^ Skennerton, Connor T.; Ward, Lewis M.; Michel, Alice; Metcalfe, Kyle; Valiente, Chanel; Mullin, Sean; Chan, Ken Y.; Gradinaru, Viviana; Orphan, Victoria J. (23 December 2015). "Genomic Reconstruction of an Uncultured Hydrothermal Vent Gammaproteobacterial Methanotroph (Family Methylothermaceae) Indicates Multiple Adaptations to Oxygen Limitation". Frontiers in Microbiology. 6: 1425. doi:10.3389/fmicb.2015.01425. PMC 4688376. PMID 26779119.
- ^ a b "Hydrothermal vents - microbewiki". microbewiki.kenyon.edu. Retrieved 2018-10-22.
- ^ a b Audiffrin, Carine; Cayol, Jean-Luc; Joulian, Catherine; Casalot, Laurence; Thomas, Pierre; Garcia, Jean-Louis; Ollivier, Bernard (1 September 2003). "Desulfonauticus submarinus gen. nov., sp. nov., a novel sulfate-reducing bacterium isolated from a deep-sea hydrothermal vent". International Journal of Systematic and Evolutionary Microbiology. 53 (5): 1585–1590. doi:10.1099/ijs.0.02551-0. PMID 13130052.
- ^ a b Xie W, Wang F, Guo L, Chen Z, Siebert SM, Men J, Huang G, Li Y, Yan Q, Wu S, Wang X, Chen S, He G, Xiao X, 쉬에 A. 심해 열수 분출 굴뚝에 서식하는 미생물 집단의 비교 메타게노믹스와 대조 화학 물질. ISME J. 2011년 3월 5일:414-26. 도이: 10.1038/ismej.2010.144. Epub 2010년 10월 7일. PMID 20927138; PMCID: PMC3105715
- ^ Suttle, Curtis A. (September 2005). "Viruses in the sea". Nature. 437 (7057): 356–361. Bibcode:2005Natur.437..356S. doi:10.1038/nature04160. PMID 16163346. S2CID 4370363.
- ^ Suttle, Curtis A. (October 2007). "Marine viruses — major players in the global ecosystem". Nature Reviews Microbiology. 5 (10): 801–812. doi:10.1038/nrmicro1750. PMID 17853907. S2CID 4658457.
- ^ a b Anderson, Rika E.; Sogin, Mitchell L.; Baross, John A. (3 October 2014). "Evolutionary Strategies of Viruses, Bacteria and Archaea in Hydrothermal Vent Ecosystems Revealed through Metagenomics". PLOS ONE. 9 (10): e109696. Bibcode:2014PLoSO...9j9696A. doi:10.1371/journal.pone.0109696. PMC 4184897. PMID 25279954.
- ^ a b Ortmann, Alice C.; Suttle, Curtis A. (August 2005). "High abundances of viruses in a deep-sea hydrothermal vent system indicates viral mediated microbial mortality". Deep Sea Research Part I: Oceanographic Research Papers. 52 (8): 1515–1527. Bibcode:2005DSRI...52.1515O. doi:10.1016/j.dsr.2005.04.002.
- ^ Breitbart, Mya (15 January 2012). "Marine Viruses: Truth or Dare". Annual Review of Marine Science. 4 (1): 425–448. Bibcode:2012ARMS....4..425B. doi:10.1146/annurev-marine-120709-142805. PMID 22457982.
- ^ Goldenfeld, Nigel; Woese, Carl (January 2007). "Biology's next revolution". Nature. 445 (7126): 369. arXiv:q-bio/0702015. Bibcode:2007Natur.445..369G. doi:10.1038/445369a. PMID 17251963. S2CID 10737747.
- ^ Callaway, Ewen (21 August 2008). "New viral way of life discovered in deep-sea vents". New Scientist.
- ^ Clokie, Martha R.J.; Millard, Andrew D.; Letarov, Andrey V.; Heaphy, Shaun (January 2011). "Phages in nature". Bacteriophage. 1 (1): 31–45. doi:10.4161/bact.1.1.14942. PMC 3109452. PMID 21687533.
- ^ a b Williamson, Shannon J; Cary, S Craig; Williamson, Kurt E; Helton, Rebekah R; Bench, Shellie R; Winget, Danielle; Wommack, K Eric (November 2008). "Lysogenic virus–host interactions predominate at deep-sea diffuse-flow hydrothermal vents". The ISME Journal. 2 (11): 1112–1121. doi:10.1038/ismej.2008.73. PMID 18719614. S2CID 23516254.
- ^ a b Culley, Alexander I; Shakya, Migun; Lang, Andrew S (2015). "Viral evolution at the limits". In Bakermans, Corien (ed.). Microbial Evolution under Extreme Conditions. Walter de Gruyter GmbH & Co KG. pp. 209–222. ISBN 978-3-11-038964-7.
- ^ He, Tianliang; Li, Hongyun; Zhang, Xiaobo (6 September 2017). "Deep-Sea Hydrothermal Vent Viruses Compensate for Microbial Metabolism in Virus-Host Interactions". mBio. 8 (4): mBio.00893–17, e00893–17. doi:10.1128/mBio.00893-17. PMC 5513705. PMID 28698277.
- ^ Anantharaman, Karthik; Duhaime, Melissa B.; Breier, John A.; Wendt, Kathleen A.; Toner, Brandy M.; Dick, Gregory J. (16 May 2014). "Sulfur Oxidation Genes in Diverse Deep-Sea Viruses". Science. 344 (6185): 757–760. Bibcode:2014Sci...344..757A. doi:10.1126/science.1252229. hdl:1912/6700. PMID 24789974. S2CID 692770.
- ^ Wall, Tim (2 May 2014). "Viruses make zombies of deep sea vent bacteria". ABC News.