캠크
CAMK| Ca2+/calmodulin 의존 단백질 키나아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 2.7.11.17 | ||||||||
| CAS 번호. | 97350-82-8 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
CAMK(CaMK)라고도 쓰여진 CAMK는 효소의 Ca2+/calmodulin 의존 단백질 키나아제 등급의 약칭이다. CAMK는 세포내 칼슘 이온(Ca2+)과 칼모듈린 농도의 증가에 의해 활성화된다. 활성화되면 효소는 인산염을 ATP에서 다른 단백질에 정의된 세린이나 트레오닌 잔류물로 전달하기 때문에 세린/스레오닌 특이 단백질 키나제다. 활성화된 CAMK는 전사 인자의 인산화 작용에 관여하며, 따라서 반응하는 유전자의 발현 조절에 관여한다. CAMK는 또한 세포 수명 주기(즉, 프로그램된 세포 사망), 세포의 세포골격계 네트워크의 재배열, 유기체의 학습과 기억력에 관련된 메커니즘을 조절하기 위해 일한다.[1]
종류들
CAM키나아제 단백질에는 특화 CAM키나제 및 다기능 CAM키나제 등 2가지 일반적인 유형이 있다.
- 기판별 CAM 키나제
- 미오신 라이트 체인 키나제처럼 인산화할 수 있는 표적은 단 하나뿐입니다.[1] 이 단백질 그룹은 CAMK III를 포함한다. CAMK에 대한 자세한 정보III는 이 링크에 따라 찾을 수 있다.
- 다기능 CAM 키나제스
- 그들이 인산화할 수 있고 신경전달물질의 분비, 글리코겐의 대사, 그리고 다양한 전사인자의 조절을 포함한 과정들에서 발견된다.[1] CAMK II는 이 부분집합의 주요 단백질이다. CAMK에 대한 자세한 정보이 링크를 따라 II를 찾을 수 있다.
기질인산화
세포 내 칼슘 농도가 올라가면 CAM 키나아제는 포화 상태가 되며 최대 4개의 칼슘 분자를 결합한다.[1] 이 칼슘 포화는 키나아제를 활성화시키고 키나아제가 인산화 표적 부지에 결합할 수 있도록 하는 순응적인 변화를 겪게 한다. CAMK는 ATP에서 인산염 그룹을 제거하는데, 대부분 Mg2+ 이온을 사용하여 CAM 단백질에 첨가하여 활성 상태로 만든다.[2] CAM 키나아제는 고농축 글리신 루프를 함유하고 있으며, 공여 ATP 분자의 감마인산염은 효소에 쉽게 결합할 수 있으며, 이 효소는 금속 이온을 활용하여 대상 단백질로의 원활한 인산염 전달을 촉진한다.[3] 이 인산염 전달은 키나제의 대상을 활성화하고 인산화 사이클을 완료한다.
그림 1은 칼슘이나 캘리모듈린의 존재가 어떻게 CAM 키나제(CAMK II)의 활성화를 가능하게 하는지를 보여준다.
구조
모든 키나아제는 더 큰 기질 결합 부위와 함께 ATP 결합 부지를 포함한 촉매 코어의 공통 구조를 가지고 있다.[4] 촉매 코어는 일반적으로 α-헬리크로 구성된 기질 결합 부위가 있는 β-스트란드로 구성된다.[5] 대부분의 CAM 키나제에는 촉매 도메인, 규제 도메인, 연관 도메인, 칼슘/칼모듈린 결합 도메인을 포함한 다양한 도메인이 포함된다.[6]
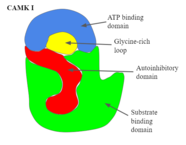
- CAMK I
- 그림 2와 같이, 이중으로 된 구조를 가지고 있으며, 촉매, 기질 결합 영역 및 자동 억제 영역으로 구성된다.[1] 자동 억제 영역이 기능하기 위해서는 이 도메인이 기질 영역을 완전히 차단하는 방식으로 단백질이 순응하도록 해야 한다. 그림 2는 CAMK I의 구조와 도메인을 자세히 보여준다.
- CAMK II
- 그림 3과 같이 CAMK 2A가 가장 흔하게 나타나는 등 다양한 형태를 가지고 있다. CAMK 2A는 링과 같은 결정 구조를 가지고 있으며, 더 작은 기능 그룹으로 구성되어 있다. 이러한 그룹은 대상의 CaM 의존적 인산화도 허용하지만, 또한 구조물이 그림 1에서 보는 바와 같이 스스로 자인화하여 CaM 독립성이 되는 것도 허용한다.[7] 이는 CAMK 2A 단백질이 처음에는 칼슘이나 칼모듈린에 의해 활성화되면, 다시 그 자체로 더욱 활성화될 수 있기 때문에 칼슘이나 칼모듈린이 없어도 활성화가 되지 않는다는 것을 의미한다.
가족구성원
CAMK 효소 등급의 구성원은 다음을 포함하지만 이에 국한되지는 않는다.
유사균류
가성질(pseokinases)은 구조적으로 효소를 닮았지만 촉매 활성도가 부족한 단백질인 가성질이다.
CAMK 계열과 관련된 이러한 가성비에는 다음이 포함된다.
참조
- ^ a b c d e f Swulius MT, Waxham MN (September 2008). "Ca(2+)/calmodulin-dependent protein kinases". Cellular and Molecular Life Sciences. 65 (17): 2637–57. doi:10.1007/s00018-008-8086-2. PMC 3617042. PMID 18463790.
- ^ Adams JA (August 2001). "Kinetic and catalytic mechanisms of protein kinases". Chemical Reviews. 101 (8): 2271–90. doi:10.1021/cr000230w. PMID 11749373.
- ^ Hemmer W, McGlone M, Tsigelny I, Taylor SS (July 1997). "Role of the glycine triad in the ATP-binding site of cAMP-dependent protein kinase". The Journal of Biological Chemistry. 272 (27): 16946–54. doi:10.1074/jbc.272.27.16946. PMID 9202006. S2CID 33795382.
- ^ Hanks SK (2003). "Genomic analysis of the eukaryotic protein kinase superfamily: a perspective". Genome Biology. 4 (5): 111. doi:10.1186/gb-2003-4-5-111. PMC 156577. PMID 12734000.
- ^ Taylor SS, Yang J, Wu J, Haste NM, Radzio-Andzelm E, Anand G (March 2004). "PKA: a portrait of protein kinase dynamics". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1697 (1–2): 259–69. doi:10.1016/j.bbapap.2003.11.029. PMID 15023366.
- ^ Hudmon A, Schulman H (2002-06-01). "Neuronal CA2+/calmodulin-dependent protein kinase II: the role of structure and autoregulation in cellular function". Annual Review of Biochemistry. 71 (1): 473–510. doi:10.1146/annurev.biochem.71.110601.135410. PMID 12045104.
- ^ "CAMK2A calcium/calmodulin dependent protein kinase II alpha [Homo sapiens (human)] - Gene - NCBI". www.ncbi.nlm.nih.gov. Retrieved 2020-03-20.




