활동구역
Active zone| 활동구역 | |
|---|---|
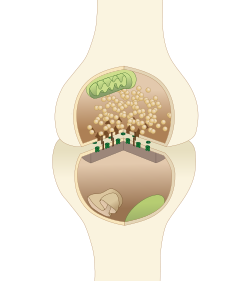 일반적인 중추신경계 시냅스의 다이어그램. 활동영역의 단백질은 상부 뉴런 단자의 암갈색 피라미드로 표현된다. | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 조나 액티카 |
| TH | H2.00.06.2.00012 |
| 미세조영술의 해부학적 용어 | |
활성 영역 또는 시냅스 활성 영역은 1970년 쿠투와 페콧 데차바시네인이 신경전달물질 방출 부위를 정의하기 위해 처음 사용한 용어다. 두 개의 뉴런은 시냅스라고 불리는 구조를 통해 가까이 접촉하여 서로 의사소통을 한다. 인접한 도표에서 볼 수 있듯이 시냅스는 신경전달물질(그림의 맨 위)이 포함된 염소를 저장하는 뉴런 1개와 신경전달물질(하단에) 수용체를 갖는 시냅스 후 뉴런 2개의 프리시냅스 부톤(시냅스 광고)과 시냅스 구획(시냅스 광고와 함께)이라는 두 개의 틈새로 구성된다.Hesion 분자, SAMs, 이 둘을 함께[1] 잡고 있다). 작용 전위가 시냅스 부톤에 도달하면, 음낭의 내용물이 시냅스 구획으로 방출되고 방출된 신경전달물질은 구획을 가로질러 시냅스 뉴런(사진의 하부 구조)으로 이동하며 시냅스 막의 수용체를 활성화시킨다.
활성 영역은 신경전달물질 방출을 매개하는 사전 시냅스 부톤 내 영역이며, 활성 영역(CAZ)에서 시토마트릭스라고 불리는 단백질의 밀집된 집합체와 프리시냅스 막으로 구성되어 있다. CAZ는 전자현미경 아래에서 막에 가까운 어두운(전자밀도) 영역으로 보인다. CAZ 테더 시냅스 입자 내의 단백질은 시냅스 전 막에 도달하여 시냅스 입자 융합을 중재하므로 작용 전위가 도착했을 때 신경전달물질이 안정적이고 빠르게 방출될 수 있다.
함수
활성 영역의 기능은 신경전달물질이 뉴런의 특정 위치에서 안정적으로 방출되고 뉴런이 작용 전위를 발사할 때에만 방출될 수 있도록 하는 것이다.[2] 작용 전위가 액손 아래로 전파되면 그것은 사전 시냅스 부톤이라고 불리는 액손 단자에 도달한다. 사전 시냅스 부톤에서는 작용 전위가 칼슘의 국소 유입을 일으키는 칼슘 통로(VDCC)를 활성화한다. 칼슘의 증가는 활동영역의 단백질에 의해 감지되며 신경전달물질을 함유한 베실체가 막과 융합하도록 강제한다. 이 염소와 막의 융합은 신경전달물질을 시냅스 구획(사전 시냅스 부톤과 사후 시냅스 막 사이의 공간)으로 방출한다. 신경전달물질은 이후 구획에 걸쳐 확산되어 시냅스 후 막에 있는 리간드 게이트 이온 채널과 G단백 결합 수용체에 결합한다. 신경전달물질이 시냅스 후 수용체에 결합되면 시냅스 후 뉴런의 변화를 유도한다. 신경전달물질을 방출하고 시냅스 후 수용체에 결합시켜 시냅스 후 뉴런에 변화를 일으키는 과정을 신경전달이라고 한다.
구조
활동 영역은 지금까지 조사된 모든 화학 시냅스에 존재하며 모든 동물 종에 존재한다. 지금까지 조사된 활성 구역은 공통점이 적어도 두 가지 있는데, 모두 막과 가까운 테더 시냅틱 방광에서 투영되는 단백질 밀도 물질을 가지고 있으며, 그들은 막에서 발원하여 전시냅스 막에서 약간 더 멀리 떨어진 방광에서 종착하는 긴 필라멘트 투영을 가지고 있다. 단백질 밀도 투영은 검사한 시냅스의 유형에 따라 크기와 모양이 다르다. 밀도 투영의 한 눈에 띄는 예로는 시냅스의 후광으로 둘러싸인 단백질 밀도 물질의 "리본"을 포함하고 시냅스 전 막에 수직으로 확장되며 최대 500nm까지 길 수 있는 리본 시냅스(아래 참조)[3]이다. 글루타메이트 시냅스에는 막에서 약 50nm 확장되는 구조물과 같은 더 작은 피라미드가 들어 있다.[4] 신경근 시냅스에는 긴 단백질의 띠를 사이에 두고 두 줄의 베시클이 들어 있는데, 이 띠와 수직으로 뻗어 있고 막과 평행하게 일정한 간격을 두고 있는 수평 늑골과 연결되어 있다. 그런 다음 이 갈비는 각각 막의 peg 위에 위치하는 vesicle에 연결된다(아마도 칼슘 통로일 것이다.[5] 이전의 연구는 글루타마테라믹 뉴런의 활동 영역이 매우 규칙적인 피라미드 모양의 단백질 밀도 물질을 포함하고 있다는 것을 보여주었고, 이 피라미드들이 필라멘트로 연결되어 있다는 것을 보여주었다. 이 구조물은 방수포를 격자 구멍으로 안내하는 기하학적 격자와 흡사했다.[4] 이 매력적인 모델은 최근의 실험에 의해 문제 삼게 되었다. 최근 데이터에 따르면 글루타마테라믹 활성 구역은 고밀도 단백질 물질 투영을 포함하지만 이러한 투영은 규칙적인 배열은 아니며 세포질에 약 80 nm의 긴 필라멘트를 투영하는 것을 포함하고 있다.[6]
활성 구역에서 농축된 주요 비계 단백질은 UNC13B/Munc13, RIMS1(Rab3-인터랙션 분자), 바순, 피콜로/aczonin, ELKS, liprins-α 등 최소 5개 있다. 이러한 비계 단백질은 활동지대의 구조처럼 밀집된 피라미드의 성분으로 생각되며 시냅스성 염소를 시냅스 전막과 칼슘 통로에 근접하게 하는 것으로 생각된다. ELKS 단백질은 세포 접착 단백질인 β-네레신, 그리고 피콜로와 바순과 같은 콤플렉스 내의 다른 단백질과 결합한다.[7] β-네우렉신은 이후 시냅스 막에 위치한 세포 접착 분자인 뉴롤리긴과 결합한다. 그리고 나서 뉴롤리긴은 시냅스 수용체와 결합하는 단백질과 상호작용을 한다. 피콜로/ELKS/β-네우렉신/네우롤리긴 사이에 보이는 것과 같은 단백질 상호작용은 베시클 융합을 매개하는 기계가 칼슘 채널에 근접하고, 베시클 융접이 시냅스 수용체와 인접해 있음을 보장한다. 이와 같이 가까운 근접 음소결핵융합 수용체와 시냅스 후 수용체는 시냅스 후 수용체의 활성화와 신경전달물질 방출 사이에 거의 지연이 없음을 보장한다.
신경전달물질 방출 메커니즘

신경전달물질의 방출은 신경전달물질인 Vesicle이 시냅스 전 막에 융합됨으로써 이루어진다. 비록 이 메커니즘의 세부사항들이 여전히 연구되고 있지만, 그 과정의 세부사항들에 대한 의견 일치가 있다. 시냅스성 소두막과 전시냅스막 융합은 단 하나의 밀접하게 연관된 칼슘 통로에서[10] 칼슘을[9] 국소적으로 증가시키고 안정성이 높은 ROGG 복합체를 형성해야 하는 것으로 알려져 있다. 시냅스 vesicle fusion의 대표적인 모델은 문c18, Munc13, RIM과 같은 활성 영역의 단백질에 의해 ROGG 복합 형성이 촉매화되는 것이다. 이 콤플렉스의 형성은 신경전달물질(아래 참조: 관련성 있는 풀)의 용해와 배출을 준비하기 위해 염실 융기를 "프리미엄"하는 것으로 생각된다. Vesicle이 primed 된 후 complexin이 TRING complex에 결합되어 이것을 "superprimed"라고 부른다. 초경화 된 방광은 쉽게 강등할 수 있는 풀장 내에 있으며(아래 참조) 빠르게 방출될 준비가 되어 있다. 작용 전위의 도래는 DLOG/복합체 복합체 근처의 전압 게이트 칼슘 채널을 개방한다. 그러면 칼슘은 시냅토타그민의 순응을 변화시키기 위해 결합된다. 이러한 의 순응의 변화는 시냅토타그민이 콤플렉스를 탈구시키고, TRING 콤플렉스에 결합하고, 표적 막에 결합할 수 있게 한다. 시냅토타그민이 DRIG 콤플렉스와 멤브레인에 모두 결합하면 이는 막에 기계적 힘을 유도하여 복실막과 프리시냅틱 막이 융합되도록 한다. 이 융합은 신경전달물질을 방출하는 막의 모공을 열어준다. 모공 크기가 커지면 전체 복막막과 사전 시냅스막을 구분할 수 없게 된다.[11][12][13]
시냅스 vesicle cycle
사전 시냅스 부톤은 염소를 사전 시냅스 막에 융합시켜 신경전달물질을 방출하고 신경전달물질 염소를 재생하는 효율적인 과정을 가지고 있다. 시냅스 소결핵 주기라 불리는 이 과정은 시냅스 전 부톤에 있는 소결핵의 수를 유지하고 시냅스 단자가 자율적인 단위가 될 수 있도록 한다. 주기는 (1) 골지 기구의 영역을 핀으로 쳐서 시냅스를 형성하고 이 시냅스 단자로 운반하는 것으로 시작한다. 단자 (2)에서 음낭은 신경전달물질로 채워진다. (3) 음낭은 활성 구역으로 운반되어 혈장 막 가까이에 도킹한다. (4) 작용 전위 동안 음낭은 막과 융합되어 신경전달물질을 방출하고 이전에 음낭에 있던 막 단백질이 음낭으로 확산되도록 한다. 과민 활동 영역. (5) 과민 활동 영역에서는 막 단백질이 격리되어 클라트린 코팅된 음실체를 형성하는 내포세포화된다. (6) 음실에는 신경전달물질로 채워진 후 다시 활성 영역으로 운반된다.
내분비 메커니즘은 외분비 메커니즘보다 느리다. 이것은 격렬한 활동에서 단자의 음낭이 고갈되어 더 이상 방출될 수 없다는 것을 의미한다. 시냅스 베시클의 고갈을 예방하기 위해 격렬한 활동 중 칼슘의 증가는 클라틴 매개 내피세포 분열에 관여하는 단백질을 고인화시키는 캘시뉴린을 활성화시킬 수 있다.[14]
베시클 수영장
시냅스에는 적어도 두 개의 시냅스 성단, 쉽게 분리할 수 있는 풀과 리저브 풀을 포함하고 있다. 쉽게 분리할 수 있는 풀은 활성 구역 내에 위치하며 예비 풀은 세포골격계에 의해 군집되어 활성 구역에 직접 연결되지 않는 동안 사전 시냅스 막에 직접 연결된다.
관련 풀
관련 풀은 활성 구역에 위치하며 사전 시냅스 막과 직접 결합된다. 활동영역 내의 단백질에 의해 안정되고, SLUG 단백질에 의해 사전 시냅스 막과 결합된다. 이 염전들은 하나의 작용 전위로 방출될 준비가 되어 있고, 예비 수영장에서 염전들로 보충된다. 관련성이 있는 풀은 쉽게 분리할 수 있는 풀과 관련성이 있는 풀로 세분되는 경우가 있다.
예비 풀
예약 풀이 활성 영역에 직접 연결되어 있지 않은 경우. 사전 시냅스 칼슘 농도의 증가는 칼슘-칼모둘린 의존성 단백질 키나아제(CaMK)를 활성화시킨다. CaMK 인산염은 예비 풀 베시클의 군집화와 시토스켈레톤에 부착하는 단백질인 시냅신을 매개한다. 시냅신의 인산화 작용은 예비 풀의 염소를 이동시켜 활성 구역으로 이동시켜 쉽게 강등할 수 있는 풀을 보충할 수 있게 한다.[15][16]
퍼리액티브 존
과활성 영역은 활성 영역을 둘러싸고 있으며 사전 시냅스 단자의 내분비증 발생 지점이다. 생체 활성 구역에서는 교차인 1과 같은 비계 단백질이 다이너민, 클라트린, 내포필린과 같은 내분포를 매개하는 단백질을 모집한다.[17] 드로소필라에서 교차동맥인 Dap160은 고주파 자극 동안 신경근 접합부와 돌연변이 Dap160 시냅스 혈소판을 고갈시키는 생체 활성 영역에 위치한다.[18]
리본 시냅스 활성 영역
리본 시냅스는 광수용체 세포, 망막 양극성 세포, 머리카락 세포와 같은 감각 신경세포에서 발견되는 특별한 형태의 시냅스다. 리본 시냅스에는 시냅스 전 막에 수직인 일련의 베시클을 묶는 촘촘한 단백질 구조가 들어 있다. 전자 마이크로그래프에서 그것은 막에 수직인 구조와 같은 리본으로 나타난다. '전통적인' 시냅스와는 달리 리본 시냅스는 음낭의 단계적 방출을 유지할 수 있다. 즉, 뉴런이 탈분극화될수록 복실 융해율이 높다는 것이다. 리본 시냅스 활성 구역은 대칭 밀도와 리본의 두 영역으로 구분된다. 대칭 밀도는 복실 융합의 현장이며, 리본에는 관련성이 있는 복실 풀이 저장되어 있다. 리본 구조는 주로 리본 부피의 약 64~69%인 리브아이 단백질로 구성되며 바순 등의 비계단백질을 통해 대칭밀도에 테더링된다.[19]
단백질
| 단백질 | 구조/기능 |
| 구조 단백질 | |
| 피콜로 | |
| 바순 | |
| RIMs | |
| ELKS(ERC 또는 CAST) | |
| 캐스크 | |
| 민트 | |
| 리프린 알파-1 | |
| 도킹 및 프라이밍 | |
| 문크-13 | |
| 문크-18 | |
| 올가미 | |
| SNAP25 | |
| 뱀파이어2 | |
| 구문론 | 시냅스 막에 위치하며, SMAP-25와 시냅토브레빈에 결합하여 vesicle 융합을 중재한다. |
| 세포골격계 단백질 | |
| 액틴 | |
| 투불린 | |
| myosin 다중 myosin II 분자는 ATP 가수분해에서 방출된 에너지로 인해 연료가 공급되는 파워 스트로크 메커니즘을 통해 골격 근육에 힘을 생성한다. | |
| 망령들다 | |
| β-카테닌 | |
| 칼슘 해협 | |
| 전압 의존성 칼슘 채널(VDCC) | 작용 가능성 동안 칼슘의 빠른 유입을 허용한다. |
신경전달물질 방출 측정
신경전달물질 방출은 사전 시냅스 뉴런에서 작용 전위를 촉발한 후 시냅스 후 전위의 진폭을 결정하여 측정할 수 있다. 이러한 방법으로 신경전달물질 방출량을 측정하는 것은 시냅스 후 뉴런이 방출된 신경전달물질의 동일한 양에 대한 효과가 시간이 지남에 따라 변할 수 있기 때문에 문제가 될 수 있다. 또 다른 방법은 패치 피펫을 사용하여 직접 전시냅스 막과 염좌 융합을 측정하는 것이다. 세포막은 양과 음이온이 막 양쪽에 저장되어 있다는 점에서 콘덴서로 생각할 수 있다. 막의 면적이 클수록 특정 전위로 막막을 고정하는 데 필요한 이온이 많아진다. 전기생리학에서 이것은 단자에 현재 주입하는 것이 음소 융접 후보다 음소 융접 전에 주어진 전위로 막을 충전하는 데 시간이 덜 걸린다는 것을 의미한다. 막을 전위로 충전하는 시간 코스와 막의 저항을 측정하며, 이 값을 사용하여 막의 정전용량은 타우/저항=캐패시턴스 방정식으로 계산할 수 있다. 이 기술로 연구자들은 시냅스 전 단자의 멤브레인 캐패시턴스 증가를 측정하여 시냅스 방출을 직접 측정할 수 있다.[20]
참고 항목
참조
- ^ Missler M, Südhof TC, Biederer T (2012). "Synaptic cell adhesion". Cold Spring Harb Perspect Biol. 4 (4): a005694. doi:10.1101/cshperspect.a005694. PMC 3312681. PMID 22278667.
- ^ 크레이그 C. 가너와 강심. 척추동물과 무척추동물 활동구역의 구조와 기능 시냅스의 구조 및 기능 조직. 에드: 요하네스 헬과 마이클 엘러스. 2008년 스프링거
- ^ Zhai R. Grace; Bellen Hugo J. (2004). "The Architecture of the Active Zone in the Presynaptic Nerve Terminal". Physiology. 19 (5): 262–270. doi:10.1152/physiol.00014.2004. PMID 15381754. S2CID 9609266.
- ^ a b Phillips GR; et al. (2001). "The presynaptic particle web: ultrastructure, composition, dissolution, and reconstitution". Neuron. 32 (1): 63–77. doi:10.1016/s0896-6273(01)00450-0. PMID 11604139. S2CID 5996555.
- ^ Mark L.; et al. "Harlow et al. The architecture of active zone material at the frog's. neuromuscular junction". Nature. 409: 2001.
- ^ Siksou; et al. (2007). "Three-Dimensional Architecture of Presynaptic Terminal Cytomatrix". The Journal of Neuroscience. 27 (26): 6868–6877. doi:10.1523/jneurosci.1773-07.2007. PMC 6672225. PMID 17596435.
- ^ Ziv, Garner (2004). "Cellular and molecular mechanisms of presynaptic assembly". Nature Reviews Neuroscience. 5 (5): 385–399. doi:10.1038/nrn1370. PMID 15100721. S2CID 21516580.
- ^ Georgiev, Danko D .; James F . Glazebrook (2007). "Subneuronal processing of information by solitary waves and stochastic processes". In Lyshevski, Sergey Edward (ed.). Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17-1–17-41. doi:10.1201/9781315221670-17. ISBN 978-0-8493-8528-5.
- ^ Heidelberger; et al. (1994). "Calcium dependence of the rate of exocytosis in a synaptic terminal". Nature. 371 (6497): 513–515. Bibcode:1994Natur.371..513H. doi:10.1038/371513a0. PMID 7935764. S2CID 4316464.
- ^ Stanley EF (1993). "Single calcium channels and acetylcholine release at a presynaptic nerve terminal". Neuron. 11 (6): 1007–1011. doi:10.1016/0896-6273(93)90214-c. PMID 8274272. S2CID 7311805.
- ^ 아타소이와 카발랄리. 신경전달물질 방출기계 : 신경전달물질 복합체의 구성 요소와 그 기능 시냅스 지옥 및 엘러스의 구조 및 기능 조직 (eds.) 2008
- ^ Pang Z.; Sudhof T. (2010). "Cell biology of Ca2+-triggered exocytosis". Current Opinion in Cell Biology. 22 (4): 496–505. doi:10.1016/j.ceb.2010.05.001. PMC 2963628. PMID 20561775.
- ^ Carr C.; Munson M. (2007). "Tag team action at the synapse". EMBO Reports. 8 (9): 834–838. doi:10.1038/sj.embor.7401051. PMC 1973957. PMID 17767192.
- ^ Jung Nadja; Haucke Volker (2007). "Clathrin-Mediated Endocytosis at Synapses". Traffic. 8 (9): 1129–1136. doi:10.1111/j.1600-0854.2007.00595.x. PMID 17547698. S2CID 11320827.
- ^ Ping Chi; Paul Greengard; Timothy A Ryan (10 April 2003). "Synaptic Vesicle Mobilization Is Regulated by Distinct Synapsin I Phosphorylation Pathways at Different Frequencies". Neuron. 38 (1): 69–78. doi:10.1016/S0896-6273(03)00151-X. PMID 12691665. S2CID 17405359.
- ^ Cesca 외 연구진(2010) 시냅신: 시냅스 기능과 가소성의 핵심 배우들. 신경생물학의 발전. 제91권 313-348호
- ^ Dergai; et al. (2010). "Intersectin 1 forms complexes with SGIP1 and Reps1 in clathrin-coated pits". Biochemical and Biophysical Research Communications. 402 (2): 408–413. doi:10.1016/j.bbrc.2010.10.045. PMID 20946875.
- ^ Marie; et al. (2004). "Dap160/Intersectin Scaffolds the Periactive Zone to Achieve High-Fidelity Endocytosis and Normal Synaptic Growth". Neuron. 43 (2): 207–219. doi:10.1016/j.neuron.2004.07.001. PMID 15260957. S2CID 16296285.
- ^ 조지 자나치 & 게리 매튜스. 리본 프리시냅틱 단자의 분자 구조몰 뉴로바이올(2009) 39:130-148
- ^ 게르스도르프 H.와 매튜스 G. (1994) 시냅스 단자의 시냅스 vesicle 융접 및 막 회수 역학. 자연. 제367권 735-739호





