신경블라스토마
Neuroblastoma| 신경블라스토마 | |
|---|---|
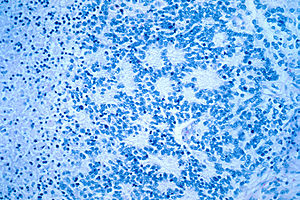 | |
| 로제트 형성을 가진 일반적인 신경성 출혈종의 현미경 보기 | |
| 전문 | 신경 종양학 |
| 증상 | 뼈의[1] 통증, 혹 |
| 평상시 시작 | 5살[1] 미만 |
| 원인들 | 유전자 돌연변이[1] |
| 진단법 | 조직생검[1] |
| 치료 | 관찰, 수술, 방사선, 화학요법, 줄기세포 이식[1] |
| 예후 | 미국 5년 생존율 95%(< 1세), 68%(1~14세)[2] |
| 빈도 | 7[2],000명 중 1명 |
| 죽음 | 어린이[3] 암으로 인한 사망률 15% |
NB(Neuroblastoma, Neuroblebastoma)는 특정 유형의 신경 조직에서 형성되는 암의 일종이다.[1]그것은 부신 중 하나에서 가장 자주 시작되지만 목, 가슴, 복부 또는 척추에서도 발병할 수 있다.[1]증상으로는 뼈의 통증, 복부, 목, 가슴에 혹이 있거나 피부 밑에 통증이 없는 푸르스름한 덩어리가 있을 수 있다.[1]
전형적으로 신경블라스토마는 초기 개발 과정에서 발생하는 유전적 돌연변이로 인해 발생한다.[4]드물게 사람의 부모로부터 물려받은 돌연변이 때문일 수도 있다.[1]환경적 요인이 관련된 것으로 판명되지 않았다.[2]진단은 조직 생검에 근거한다.[1]가끔 임신 중 초음파 검사를 통해 아기에게 발견되기도 한다.[1]진단 결과 암은 이미 전이된 경우가 대부분이다.[1]암은 아이의 나이, 암기, 암기, 암의 생김새를 기준으로 저위험군, 중위험군, 고위험군으로 나뉜다.[1]
치료와 결과는 한 개인이 속한 위험군에 따라 달라진다.[1][4]치료에는 관찰, 수술, 방사선, 화학요법 또는 줄기세포 이식이 포함될 수 있다.[1]아기의 저위험 질병은 일반적으로 수술이나 단순한 관찰로 좋은 결과를 얻는다.[4]그러나 고위험성 질환의 경우 공격적인 치료에도 불구하고 장기 생존 가능성은 40%에도 미치지 못한다.[4]
신경블라스토마는 아기에게 가장 흔한 암이고 백혈병과 뇌암에 이어 어린이에게 세 번째로 흔한 암이다.[4]7,000명당 약 1명의 아이들이 어떤 시기에 영향을 받는다.[2]약 90%가 5세 미만 아동에서 발생하며, 성인에게서는 드물다.[2][3]소아암 사망자 중 약 15%는 신경성블라스토마 때문이다.[3]그 질병은 1800년대에 처음 설명되었다.[5]
징후 및 증상
신경블라스토마의 첫 증상은 모호한 경우가 많아 진단이 어렵다.피로, 식욕 상실, 발열, 관절통 등이 흔하다.증상은 기본 종양 위치와 전이가 있는 경우 전이에 따라 달라진다.[6]
- 복부에서는 종양이 복부 팽만감과 변비를 일으킬 수 있다.
- 가슴에 종양이 생기면 호흡곤란을 일으킬 수 있다.
- 척수를 누르는 종양은 허약함을 유발할 수 있어 서 있거나 기어가거나 걸을 수 없게 된다.
- 다리와 엉덩이의 뼈 병변은 고통과 절뚝거림을 유발할 수 있다.
- 눈이나 궤도에 있는 뼈의 종양은 뚜렷한 멍과 붓기를 유발할 수 있다.
- 골수가 침투하면 빈혈로 인해 창백해질 수 있다.
신경블라스토마는 어떤 증상이 나타나기 전에 신체의 다른 부위로 퍼지는 경우가 많으며, 모든 신경블라스토마 환자의 50~60%가 전이를 가지고 있다.[7]
신경성 출혈종(즉, 1차 종양)이 발생하는 가장 흔한 위치는 부신 내에 있다.이것은 국부성 종양의 40%와 널리 퍼진 질병의 60%에서 발생한다.신경블라스토마 역시 목부터 골반까지 교감신경계 체인을 따라 어디서나 발병할 수 있다.각기 다른 위치의 빈도는 목(1%), 가슴(19%), 복부(30% 비아드레날린) 또는 골반(1%)이다.드문 경우지만, 1차 종양을 알아낼 수 있는 것은 아니다.[8]
하지만 특유의 희귀한 프레젠테이션 횡단 척수 장애(종양 척수 압박한 5%), 항료성 설사(종양 혈관 에 작용하는 장내 펩티드 분비물인 경우의 4%), 호너 증후군(자궁 경부 종양의 경우 2.4%),opsoclonus 근육 간 대경련 syndrome[9]과 운동 실조증(혐의를 받고 부종 양 원인, 사건의 1.3%), a을 포함한다알몬드고혈압(카테콜라민 분비 또는 신장동맥압박, 사례의 1.3%)[10]
원인
신경성 출혈의 원인은 잘 파악되지 않는다.대부분의 경우들은 산발적이고 비가족적이다.약 1~2%의 케이스가 가족 내에서 진행되며 특정 유전자 돌연변이와 연관되어 있다.가족성 신경블라스토마는 어떤 경우에는 무탄성 림프종 키나아제(ALK) 유전자의 희귀한 생식선 돌연변이에 의해 발생한다.[11]PHOX2B 또는 KIF1B 유전자의 생식선 돌연변이도 가족성 신경블라스토마에 관련되어 있다.신경블라스토마 역시 신경섬유종 1형과 벡위드위데만 증후군의 특징이다.
종양 내 MYCN 종양 증폭은 신경블라스토마에서 흔히 발견된다.증폭의 정도는 3배에서 10배 또는 100배에서 300배의 양배 분포를 보여준다.이 돌연변이의 존재는 질병의 진보된 단계와 매우 상관관계가 있다.[12]
신경블라스토마 종양 세포 내 LMO1 유전자의 중복된 부분은 공격적인 형태의 암 발생 위험을 증가시키는 것으로 나타났다.[13]
신경블라스토마는 NBPF10 유전자 내의 복사 번호 변동과 연관되어 있어 1Q21.1 삭제 증후군 또는 1Q21.1 중복 증후군이 발생한다.[14]
몇 가지 위험 요소가 제안되었으며 현재 진행 중인 연구의 대상이다.특징적인 조기발견으로 인해, 많은 연구들이 임신과 임신 중 부모들의 요인에 초점을 맞추고 있다.조사된 요소에는 직업(즉, 특정 산업의 화학물질에 대한 노출), 흡연, 알코올 소비, 임신 중 약제 사용, 출산 요인 등이 포함되었으나 결론에 이르지 못했다.[15]
다른 연구들은 아토피와 가능한 연관성, 초기에는 감염에 노출되는 [16]것, 호르몬과 생식력 약물의 사용,[17] 그리고 모발 염료의 모성 사용 등을 조사했다.[18][19]
진단
이 진단은 대개 수술 병리학자가 임상적 제시, 현미경 소견 및 기타 실험실 테스트를 고려하여 확인한다.그것은 교감신경계(SNS)의 어떤 신경 파고 요소로부터도 발생할 수 있다.
후각신경블라스토마라고도 알려진 에스테시온유로블라스토마는 후각상피에서 발생하는 것으로 알려져 있으며 그 분류는 여전히 논란이 되고 있다.그러나 교감신경계 악성종양이 아니기 때문에 에스테시온유로블라스토마는 뚜렷한 임상적 실체로서 신경블라스토마와 혼동해서는 안 된다.[20][21]
생화학
신경블라스토마 환자의 약 90%에서 카테콜아민이나 그 대사물의 높은 수치는 소변이나 혈액에서 발견된다.카테콜아민과 그 대사물에는 도파민, 호모바닐산(HVA) 및/또는 바닐리만델산(VMA)이 포함된다.[22]
이미징
신경블라스토마를 검출하는 또 다른 방법은 메타오도벤질구아니딘 스캔으로, 모든 신경블라스토마들의 90~95%를 차지하며, 흔히 "mIBG-avid"[23]라고 불린다.메카니즘은 mIBG가 교감 뉴런에 의해 차지되며, 신경전달물질인 노르에피네프린과 기능이 유사한 것이다.I-131 또는 I-123(방사능 요오드 동위원소)으로 무선조절을 했을 때, 이 질병에 대한 치료 반응의 진단과 모니터링에 매우 좋은 방사선 의약품이다.반감기가 13시간인 I-123은 영상 감도와 품질을 위해 선호되는 동위원소다.I-131의 반감기는 8일이며, 높은 복용량은 재발 및 내화성 신경블라스토마에 대한 표적 방사선으로 효과적인 치료법이다.[24]mIBG가 항상 신경블라스토마에 의해 취해지는 것은 아니기 때문에, 연구자들은 신경블라스토마가 있는 어린이들에게 종종 "F-FDG-PET"라고 불리는 다른 유형의 핵 이미징인 형광 투과성-글루코스-양전자 방출 단층 촬영이 유용할 지에 대해 연구해왔다.[25]증거는 이것이 mIBG가 작용하지 않는 신경블라스토마를 가진 아이들에게 사용하는 것이 바람직할 수 있다는 것을 암시하지만, 이 분야에서 더 많은 연구가 필요하다.[25]
역사학
현미경 검사에서 종양 세포는 전형적으로 작고 동그랗고 파란색으로 묘사되며, 로제트 무늬(호머 라이트 유사점)를 볼 수 있다.호머 라이트 필로세트는 신경일 주위의 종양 세포로, 빈 발광 주위의 종양 세포인 참 로제트와 혼동해서는 안 된다.[26]그것들은 또한 혈관을 향해 테이핑되는 GFAP(glial fibrillary acid prote)-양성 과정을 가진 종양 세포로 구성된 후두종의 유사점들과도 구별된다.[27]병리학자들이 횡문근육종, 유잉의 육종, 림프종, 윌름스의 종양 등 신경블라스토마(신경블라스토마)와 조직적 모방을 구별하기 위해 다양한 면역항화학적 얼룩을 사용한다.[28]
신경블라스토마는 말초신경블라스틱종양(pNT) 중 하나로 양성 간염성 간염에서 신경블라스틱 세포가 혼재되거나 결절된 스트로마 풍부한 간염성 간염성 간염성 간염까지 다양한 분화 패턴을 보인다.이러한 전처리 종양병리학의 구별은 나이와 유사분열-카리호르헥시스 지수(MKI)와 함께 중요한 예후 요인이다.이 병리학 분류 체계(시마다 체계)는 1999년 설립돼 2003년 개정된 국제신경블라스토마병리학위원회(INPC)의 '호감'과 '호감' 종양을 기술하고 있다.[29]
스테이징
1986년에 설립되어 1988년에 개정된 "국제 신경성 출혈 준비 시스템" (INSS)은 진단 시 해부학적 존재에 따라 신경성 출혈종을 성층화한다.[30][31][32]
- 1단계: 국부성 종양은 원산지에 국한된다.
- 2A 단계: 총절제가 불완전한 일방적 종양, 종양의 경우 식별 가능한 편측 림프절 음극.
- 2B 단계: 완전하거나 불완전한 총 절제술을 받은 일방적 종양, 종양의 경우 입자 림프절 양성, 종양의 경우 식별할 수 있는 횡방향 림프절 음극.
- 3단계: 지역 림프절 관여 여부와 무관하게 중간선을 가로질러 침투하는 종양, 또는 횡방향 림프절 관여가 있는 일방적인 종양, 또는 양쪽 림프절 관여가 있는 중간선 종양.
- 4단계: 4S단계에서 정의한 경우를 제외하고 먼 림프절, 골수, 뼈, 간 또는 기타 장기에 종양을 전파한다.
- 4S단계: 1단계 또는 2단계에서 정의된 국부적인 1차 종양을 가진 나이 <1세, 간, 피부, 골수에 한정된 전파(핵 골수 세포의 10% 미만이 종양이다).
스테이징(INSS)에 대한 국제 합의가 사용되었지만, 연구 결과에서 유사한 코호트를 비교하기 위해 위험 할당에 대한 국제적 합의의 필요성도 인정되었다.2005년부터 주요 소아 종양학 협력단체 대표들이 만나 1990년부터 2002년 사이에 유럽, 일본, 미국, 캐나다, 호주에서 치료받은 신경마비종 환자 8800명에 대한 자료를 검토했다.이 태스크포스는 국제신경블라스토마 위험 그룹(INRG) 분류 시스템을 제안했다.소급 연구는 이전에 고위험군으로 분류되었던 12~18개월 연령층의 높은 생존율을 밝혀냈으며, N-myc(일반적으로 MYCN이라고도 함)[33] 확장이 없는 12~18개월 아동을 중간 위험 범주로 재분류하기로 결정하게 했다.
새로운 INRG 위험 할당은 진단 시 새로운 INRGS(International NeuroBlastoma Risk Group Staging System)에 기초하여 신경블라스토마를 분류한다.
- L1단계: 이미지 정의 위험 요인이 없는 국부적 질병.
- L2단계: 이미지 정의 위험 요인을 포함한 국부적 질병.
- M단계: 전이성 질환.
- 단계 MS: MS가 4S 단계에 해당하는 전이성 질환 "특수"
새로운 위험 계층화는 새로운 INRGSS 준비 시스템, 연령(18개월에서 역도화), 종양 등급, N-myc 증폭, 불균형 11q 일탈 및 4개의 전처리 위험 그룹(매우 낮음, 낮음, 중간 및 높음)에 기초한다.[4][34]
선별
소변 카테콜아민 농도는 임상 전 신경블라스토마에서 상승할 수 있다.1980년대부터 일본, 캐나다, 오스트리아, 독일에서 3주, 6개월, 1년 단위로 무증상 유아를 선별하는 작업이 진행되어 왔다.[35][36]일본은 1984년 호모바닐산과 바닐만델산의 수치 분석을 통해 생후 6개월 된 신경블라스토마 검사를 시작했다.2004년 캐나다와 독일에서 실시한 연구 결과 신경성블라스토마에 의한 사망률이 감소하지 않고 오히려 치료 없이 사라졌을 진단이 증가하면서 불필요한 수술과 항암치료를 받게 되면서 검진이 중단됐다.[37][38][39]
치료
병변이 국소화되면 일반적으로 치료할 수 있다.하지만, 진보된 질병을 가진 아이들을 위한 장기 생존 18개월 이하 쇠고기 공격적인 복합 치료에도 불구하고(집중적인 화학 요법, 수술, 방사선 치료 줄기 세포 이식, 분화제 명인 이소트레티노인 또한,13-cis-retinoic 산성과 자주anti-GD2 단일 클론 항체 번째와 함께 immunotherapy[40]가난하다.시대py – dinutuximab).
생물학적 및 유전적 특성이 확인되었으며, 이는 고전적 임상적 준비 과정에 추가되었을 때 치료 강도를 계획하기 위한 위험 그룹에 할당을 허용했다.[41]이 기준에는 연령, 질병 확산 정도, 미세한 외모, DNA 플로이드, N마이크 종양증폭(N-myc가 미세RNA를 조절)을 포함한 유전적 특징 등이 저·[42]중·고위험 질병으로 분류된다.최근 생물학 연구(COG ANBL00B1)가 신경블라스토마 2687명을 분석한 결과, 신경블라스토마 환자 중 37%는 저위험, 18%는 중간위험, 45%는 고위험으로 위험배분 스펙트럼이 결정됐다.[43](고위험 유형과 저위험 유형은 서로 다른 메커니즘에 의해 발생하며, 동일한 메커니즘의 두 가지 다른 표현 정도에 불과하지 않다는 증거가 있다.[44]
이러한 다른 위험 범주에 대한 치료법은 매우 다르다.
- 저위험 질환은 아예 치료 없이 관찰되거나 수술만으로 치유되는 경우가 많다.[45]
- 중간위험 질병은 수술과 화학요법으로 치료한다.[46]
- 고위험 신경블라스토마는 집중 항암치료, 수술, 방사선치료, 골수/조혈모세포이식,[47] 13-cis-retinoic acid(이소트레티노인 또는 어큐탄)[48]를 이용한 생물학적 기반치료, 보통 사이토카인 GM-CSF와 IL-2로 투여하는 항체요법으로 치료한다.[49]메타분석 결과 고위험 신경블라스토마 소아에서 골수성 요법으로 치료하면 사건 없는 생존이 개선되지만 기존 항암치료와 비교할 때 신장질환 등 부작용 위험이 높아질 수 있다는 증거가 나왔다.[50]
저위험·중간위험질환자는 치료율이 저위험 90% 이상, 중간위험은 70~90% 이상으로 예후가 우수하다.이와는 대조적으로 지난 20년[when?] 동안 고위험성 신경블라스토마에 대한 치료는 약 30%의 치료만을 초래했다.[51]항체치료제가 추가되면서 고위험성 질환의 생존율이 크게 높아졌다.2009년 3월 고위험군 226명을 대상으로 한 어린이 종양학그룹(COG) 연구를 조기 분석한 결과, 줄기세포 이식 후 2년 동안 유전자변형-CSF와 IL-2로 ch14.18 항체를 무작위로 받아낸 집단의 66%가 항체를 받지 않은 집단의 46%만 생존하고 무질병인 것으로 나타났다.무작위화가 중단되어 재판에 등록하는 모든 사람들이 항체 치료를 받게 되었다.[52]
조합에 사용되는 화학요법제는 신경블라스토마에 효과가 있는 것으로 밝혀졌다.유도 및 줄기세포 이식 조절에 일반적으로 사용되는 제제는 백금 화합물(시스플라틴, 카보플라틴), 알킬링제(사이클로인산아미드, 이포스파미드, 멜팔란), 토포아세머레이즈 II 억제제(에토포사이드), 안트라시클린 항생제(독소루비신), 빈카알칼로이드(빈크리스틴) 등이다.새로운 요법으로는 재발성 질환에 효과가 있는 것으로 밝혀진 인덕션의 Topoosomerase I 억제제(topotecan 및 irinotecan)가 있다.
naxitamab은 2020년 11월, 종양이 반응하지 않거나 이전 치료 후에 돌아온 골수나 골수에 고위험 신경 출혈종을 가진 1세 이상 노인을 치료하기 위해 granulocy-macropage coly-stimulation factor(GM-CSF)와 결합하여 미국에서 의료용으로 승인되었다.스폰스, 경미한 반응 또는 사전 치료에 대한 안정적 질병.[53][54]
예후
영국의 자료에 따르면 신경블라스토마의 전체 5년 생존율은 67%[55]이다.고위험 사례의 20%~50%는 유도 고선량 화학요법에 적절하게 반응하지 않으며 진행성 또는 내화성이 있다.[56][57]전방 치료 완료 후 재발하는 것도 일반적이다.신경블라스토마에 대해 새로운 제제와 제제 조합을 시험하는 1상 및 2상 임상시험에서 추가 치료가 가능하지만, 재발한 고위험성 질환의 결과는 매우 좋지 않다.[58]
오늘날 생존해 있는 대부분의 장기 생존자들은 고위험군에 비해 위험도가 낮거나 중간 정도인 질병과 가벼운 치료 과정을 가지고 있었다.생존자의 대다수는 치료의 장기적 효과를 가지고 있다.중·고위험 치료의 생존자들은 종종 청력 상실, 성장 감소, 갑상선 기능 장애, 학습 어려움, 2차 암의 위험 증가 등을 경험하게 된다.[59][60]소아암 생존자 3명 중 2명으로 추정되는 사람은 암 진단 후 20~30년 이내에 최소한 1개의 만성적, 때로는 생명을 위협하는 건강 문제가 발생할 것이다.[61][62][63]
세포유전학적 프로파일
일련의 493개의 신경블라스토마 샘플에 기초하여 배열 기반 카리오타이핑에 의해 테스트된 전반적인 유전체 패턴은 신경블라스토마에서의 결과를 예측하는 것으로 보고되었다.[64]
- 전체 염색체 복사 번호 변경만으로 나타나는 종양은 탁월한 생존과 관련이 있었다.
- 어떤 종류의 세그먼트 염색체 복사 번호 변경과 함께 나타나는 종양은 재발의 높은 위험과 연관되어 있었다.
- 부분적 변화를 보여주는 종양 내에서 전체적인 생존 감소에 대한 추가적인 독립적 예측 변수는 N-myc 증폭, 1p 및 11q 삭제, 1q 증가였다.
이전 출판물들은 신경성형성체를 세포유전학적 프로파일에 기초하여 세 가지 주요 하위 유형으로 분류했다.[65][66]
- Subtype 1: 삼극에 가깝고 수적 손익의 우위에 있는 유리한 신경블라스토마(Neuro Blastoma)로, 주로 비금속 NB 1, 2, 4S단계를 나타낸다.
- Subtype 2A 및 2B: N-myc 증폭(subtype 2A)이 없거나 N-myc 증폭과 함께 1p 삭제 및 17q 이득(subtype 2B)이 종종 발생하며, 3, 4단계에서 불리하게 확산되는 신경블라스토마에서 발견된다.
가상 카리오타이핑은 이 로키에서 복사 번호를 평가하기 위해 신선한 종양이나 파라핀이 함유된 종양에 대해 수행될 수 있다.SNP 어레이 가상 카리오타이핑은 이형성(취득된 단항성 절개)의 복사 중성 손실을 감지할 수 있기 때문에 신경블라스토마(Neurobastomas)를 포함한 종양 검체에 선호된다.중성 복사 LOH는 생물학적으로 삭제와 동일할 수 있으며 신경블라스토마의 키 로키에서 검출되었다.[67]어레이CGH, FICH 또는 기존 세포유전학은 복사 중성 LOH를 검출할 수 없다.
역학
신경블라스토마는 전체 소아암의 6-10%, 소아암 사망자의 15%로 구성된다.연간 사망률은 0~4세 연령대 아동 100만명, 4~9세 연령대 아동 400만명이다.[69]
가장 많은 경우는 생후 1년차에 있으며, 선천적인 경우도 있다.연령대는 노년층, 성인층 등 광범위하지만 5세 이상에서 발생하는 경우는 10%에 불과하다.[70][23]유럽의 한 대규모 연구는 4,000명 이상의 신경블라스토마 환자들 중 2퍼센트 미만이 18세 이상이었다고 보고했다.[71]
역사

1864년 독일의 의사 루돌프 비르초는 어린이의 복부 종양을 "교모종"이라고 처음 묘사했다.이어 1891년 독일의 병리학자 펠릭스 마샹드(Felix Marchand)가 교감신경계 및 부신중합에서 나온 종양의 특성을 주목했다.[72][73]1901년에 윌리엄 페퍼에 의해 4S단계의 유아(간에는 뼈의 전이 없음)에 대한 특색 있는 발현이 설명되었다.1910년 제임스 호머 라이트는 이 종양이 원시 신경세포에서 유래된 것임을 이해하고 신경블라스토마라고 명명했다.그는 또한 현재 "호머 라이트 로제츠"라고 불리는 골수 샘플의 원형 세포 뭉치에 주목했다.물론, 하이픈이 있는 "호머 라이트"는 문법적으로 틀리는데, 그 말은 라이트 박사를 지칭하기 때문이다.[74]
사회와 문화
입법 노력
텍사스주 와코의 쳇 에드워즈 미 하원의원은 신경성 출혈종과 다른 암의 치료법을 위해 1억 5천만 달러를 책정하는 법안을 성공적으로 도입했다.이 법안은 2008년 7월 조지 W 부시 미국 대통령에 의해 법안으로 통과되었다.에드워즈는 그의 선거구 중 한 사람인 텍사스 A&M 대학의 역사학과장인 월터 L. 벵거의 딸 브라이언의 병과 그에 따른 사망에 의해 그 노력에서 영감을 받았다.[75]
리서치
사전 임상 모델
신경블라스토마 환자 유도 종양 유전기류(PDX)는 종양 검체를 면역 결핍 생쥐에 직교적으로 이식해 만들어졌다.[76]PDX 모델은 기존 암세포라인(CCL)에 비해 몇 가지 장점이 있다.[77]신경블라스토마 PDX는 해당 종양의 유전학적 특징을 유지하고 있으며 PDX는 먼 장기에 침투하는 성장과 전이가 나타난다.[76]PDX 모델은 기존 암세포 라인 이종 이식보다 임상 결과를 더 예측한다.[78]따라서 신경블라스토마 PDX는 신경블라스토마에 대한 효과적인 화합물을 식별하는 임상적으로 관련되는 모델 역할을 할 수 있다.[76]
치료
최근 초점은 [79]생존율을 90%로 유지하면서 저위험과 중간위험 신경블라스토마에 대한 치료를 줄이는 것이었다.1997년부터 2005년까지 A3961에 등록된 중간위험자 467명을 대상으로 한 연구는 이 위험군에 대한 치료가 성공적으로 감소될 수 있다는 가설을 확인했다.성질이 양호한 사람(등급 및 반응)은 4주기 화학요법을 받았고, 특성이 좋지 않은 사람은 8주기 화학요법을 받았으며, 전체 코호트의 경우 3년 사건 자유 생존과 전반적인 생존이 90%로 안정되었다.향후 계획은 1p36 또는 11q23 염색체 이상자는 물론 치료 초기 대응이 부족한 사람에 대해서도 치료를 강화할 계획이다.[80][81]
이와는 대조적으로, 지난 20년 이상 동안 초점은 고위험 신경성 출혈종에 대한 치료를 강화하는 것이었다.화학요법유도변화, 수술시기, 줄기세포이식요법, 방사선에 대한 다양한 전달방식, 최소잔여질환을 치료하기 위한 단핵항체 및 레티노이드 사용 등이 계속 조사되고 있다.최근 3단계 임상시험은 고위험성 질환의 생존을 개선하기 위해 다음과 같은 질문에 답하기 위해 수행되었다.
내화성 및 재발 신경블라스토마
토포테칸과 사이클로인산아미드를 사용한 화학요법은 내화적 설정과 재발 후 자주 사용된다.[82]
부모에게서 얻은 기증자 세포, 즉 기증자 세포는 그 사람의 줄기 세포 자체가 유용하지 않기 때문에 내화성 또는 신경블라스토마를 가진 세포에서 연구되고 있다.[83]
참조
- ^ a b c d e f g h i j k l m n o "Neuroblastoma Treatment". National Cancer Institute. 20 January 2016. Archived from the original on 10 November 2016. Retrieved 9 November 2016.
- ^ a b c d e "Neuroblastoma Treatment". National Cancer Institute. 25 August 2016. Archived from the original on 10 November 2016. Retrieved 10 November 2016.
- ^ a b c World Cancer Report 2014. World Health Organization. 2014. Chapter 5.16. ISBN 978-9283204299. Archived from the original on 2016-09-19. Retrieved 2016-11-10.
- ^ a b c d e f Maris JM, Hogarty MD, Bagatell R, Cohn SL (June 2007). "Neuroblastoma". Lancet. 369 (9579): 2106–20. doi:10.1016/S0140-6736(07)60983-0. PMID 17586306. S2CID 208790138.
- ^ Olson, James Stuart (1989). The History of Cancer: An Annotated Bibliography. ABC-CLIO. p. 177. ISBN 9780313258893. Archived from the original on 2017-09-10.
- ^ Wheeler, Kate (January 1, 2013). "Neuroblastoma in children". Macmillan. Archived from the original on October 5, 2015.
- ^ "Neuroblastoma: Pediatric Cancers: Merck Manual Professional". Archived from the original on 2007-12-18. Retrieved 2008-01-01.
- ^ Friedman GK, Castleberry RP (December 2007). "Changing trends of research and treatment in infant neuroblastoma". Pediatric Blood & Cancer. 49 (7 Suppl): 1060–5. doi:10.1002/pbc.21354. PMID 17943963. S2CID 37657305.
- ^ Rothenberg AB, Berdon WE, D'Angio GJ, Yamashiro DJ, Cowles RA (July 2009). "The association between neuroblastoma and opsoclonus-myoclonus syndrome: a historical review". Pediatric Radiology. 39 (7): 723–6. doi:10.1007/s00247-009-1282-x. PMID 19430769. S2CID 24523263.
- ^ Cheung, Nai-Kong (2005). Neuroblastoma. Springer-Verlag. pp. 66–7. ISBN 978-3-540-40841-3.
- ^ Mossé YP, Laudenslager M, Longo L, Cole KA, Wood A, Attiyeh EF, et al. (October 2008). "Identification of ALK as a major familial neuroblastoma predisposition gene". Nature. 455 (7215): 930–5. Bibcode:2008Natur.455..930M. doi:10.1038/nature07261. PMC 2672043. PMID 18724359.
- ^ Brodeur GM, Seeger RC, Schwab M, Varmus HE, Bishop JM (June 1984). "Amplification of N-myc in untreated human neuroblastomas correlates with advanced disease stage". Science. 224 (4653): 1121–4. Bibcode:1984Sci...224.1121B. doi:10.1126/science.6719137. PMID 6719137.
- ^ Wang K, Diskin SJ, Zhang H, Attiyeh EF, Winter C, Hou C, et al. (January 2011). "Integrative genomics identifies LMO1 as a neuroblastoma oncogene". Nature. 469 (7329): 216–20. Bibcode:2011Natur.469..216W. doi:10.1038/nature09609. PMC 3320515. PMID 21124317. Lay summary – Children's Hospital of Philadelphia (November 30, 2010).
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용한다.lay-date=(도움말) - ^ Diskin SJ, Hou C, Glessner JT, Attiyeh EF, Laudenslager M, Bosse K, et al. (June 2009). "Copy number variation at 1q21.1 associated with neuroblastoma". Nature. 459 (7249): 987–91. Bibcode:2009Natur.459..987D. doi:10.1038/nature08035. PMC 2755253. PMID 19536264.
- ^ Olshan AF, Bunin GR (2000). "Epidemiology of Neuroblastoma". In Brodeur GM, Sawada T, Tsuchida Y, et al. (eds.). Neuroblastoma. Amsterdam: Elsevier. pp. 33–9. ISBN 978-0-444-50222-3.
- ^ Menegaux F, Olshan AF, Neglia JP, Pollock BH, Bondy ML (May 2004). "Day care, childhood infections, and risk of neuroblastoma". American Journal of Epidemiology. 159 (9): 843–51. doi:10.1093/aje/kwh111. PMC 2080646. PMID 15105177.
- ^ Olshan AF, Smith J, Cook MN, Grufferman S, Pollock BH, Stram DO, et al. (November 1999). "Hormone and fertility drug use and the risk of neuroblastoma: a report from the Children's Cancer Group and the Pediatric Oncology Group". American Journal of Epidemiology. 150 (9): 930–8. doi:10.1093/oxfordjournals.aje.a010101. PMID 10547138.
- ^ McCall EE, Olshan AF, Daniels JL (August 2005). "Maternal hair dye use and risk of neuroblastoma in offspring". Cancer Causes & Control. 16 (6): 743–8. doi:10.1007/s10552-005-1229-y. PMID 16049813. S2CID 24323871.
- ^ Heck JE, Ritz B, Hung RJ, Hashibe M, Boffetta P (March 2009). "The epidemiology of neuroblastoma: a review". Paediatric and Perinatal Epidemiology. 23 (2): 125–43. doi:10.1111/j.1365-3016.2008.00983.x. PMID 19159399.
- ^ e메디컬의 에스테시온유로블라스토마
- ^ Cheung, Nai-Kong (2005). Neuroblastoma. Springer-Verlag. p. 73. ISBN 978-3-540-40841-3.
- ^ Strenger V, Kerbl R, Dornbusch HJ, Ladenstein R, Ambros PF, Ambros IM, Urban C (May 2007). "Diagnostic and prognostic impact of urinary catecholamines in neuroblastoma patients". Pediatric Blood & Cancer. 48 (5): 504–9. doi:10.1002/pbc.20888. PMID 16732582. S2CID 34838939.
- ^ a b Howman-Giles R, Shaw PJ, Uren RF, Chung DK (July 2007). "Neuroblastoma and other neuroendocrine tumors". Seminars in Nuclear Medicine. 37 (4): 286–302. doi:10.1053/j.semnuclmed.2007.02.009. PMID 17544628.
- ^ Pashankar FD, O'Dorisio MS, Menda Y (January 2005). "MIBG and somatostatin receptor analogs in children: current concepts on diagnostic and therapeutic use". Journal of Nuclear Medicine. 46 Suppl 1 (Suppl 1): 55S–61S. PMID 15653652.
- ^ a b Bleeker G, Tytgat GA, Adam JA, Caron HN, Kremer LC, Hooft L, van Dalen EC (September 2015). "123I-MIBG scintigraphy and 18F-FDG-PET imaging for diagnosing neuroblastoma". The Cochrane Database of Systematic Reviews (9): CD009263. doi:10.1002/14651858.cd009263.pub2. PMC 4621955. PMID 26417712.
- ^ Robbins and Cotran pathologic basis of disease (9 ed.). Elsevier. 2015. ISBN 978-1455726134.
- ^ e메디컬의 후두종
- ^ Carter RL, al-Sams SZ, Corbett RP, Clinton S (May 1990). "A comparative study of immunohistochemical staining for neuron-specific enolase, protein gene product 9.5 and S-100 protein in neuroblastoma, Ewing's sarcoma and other round cell tumours in children". Histopathology. 16 (5): 461–7. doi:10.1111/j.1365-2559.1990.tb01545.x. PMID 2163356. S2CID 6461880.
- ^ Peuchmaur M, d'Amore ES, Joshi VV, Hata J, Roald B, Dehner LP, et al. (November 2003). "Revision of the International Neuroblastoma Pathology Classification: confirmation of favorable and unfavorable prognostic subsets in ganglioneuroblastoma, nodular". Cancer. 98 (10): 2274–81. doi:10.1002/cncr.11773. PMID 14601099. S2CID 27081822.
- ^ "Neuroblastoma Treatment—National Cancer Institute". 1980-01-01. Archived from the original on 2008-10-02. Retrieved 2008-07-30.
- ^ Brodeur GM, Seeger RC, Barrett A, Berthold F, Castleberry RP, D'Angio G, et al. (December 1988). "International criteria for diagnosis, staging, and response to treatment in patients with neuroblastoma" (PDF). Journal of Clinical Oncology. 6 (12): 1874–81. doi:10.1200/JCO.1988.6.12.1874. PMID 3199170.
- ^ Brodeur GM, Pritchard J, Berthold F, Carlsen NL, Castel V, Castelberry RP, et al. (August 1993). "Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment". Journal of Clinical Oncology. 11 (8): 1466–77. doi:10.1200/JCO.1993.11.8.1466. PMID 8336186.
- ^ Schmidt ML, Lal A, Seeger RC, Maris JM, Shimada H, O'Leary M, et al. (September 2005). "Favorable prognosis for patients 12 to 18 months of age with stage 4 nonamplified MYCN neuroblastoma: a Children's Cancer Group Study". Journal of Clinical Oncology. 23 (27): 6474–80. doi:10.1200/JCO.2005.05.183. PMID 16116154.
- ^ Cohn SL, London WB, Monclair T, Matthay KK, Ambros PF, Pearson AD (2007). "Update on the development of the international neuroblastoma risk group (INRG) classification schema". Journal of Clinical Oncology. 25 (18 Suppl): 9503. doi:10.1200/jco.2007.25.18_suppl.9503. Archived from the original on 2016-01-10.
- ^ Woods WG, Gao RN, Shuster JJ, Robison LL, Bernstein M, Weitzman S, et al. (April 2002). "Screening of infants and mortality due to neuroblastoma". The New England Journal of Medicine. 346 (14): 1041–6. doi:10.1056/NEJMoa012387. PMID 11932470.
- ^ Schilling FH, Spix C, Berthold F, Erttmann R, Sander J, Treuner J, Michaelis J (July 2003). "Children may not benefit from neuroblastoma screening at 1 year of age. Updated results of the population based controlled trial in Germany". Cancer Letters. 197 (1–2): 19–28. doi:10.1016/S0304-3835(03)00077-6. PMID 12880955.
- ^ Tsubono Y, Hisamichi S (May 2004). "A halt to neuroblastoma screening in Japan". The New England Journal of Medicine. 350 (19): 2010–1. doi:10.1056/NEJM200405063501922. PMID 15128908.
- ^ "Neuroblastoma Screening". National Cancer Institute. 1980-01-01. Archived from the original on 2008-10-01. Retrieved 2008-07-30.
- ^ Darshak Sanghavi, "화면경보: RX Prevention 1온스가 어떻게 1파운드의 상처를 입힐 수 있는가" 2006년 11월 28일 Slate 잡지 웨이백머신에 2006-12-01 보관
- ^ Johnson E, Dean SM, Sondel PM (December 2007). "Antibody-based immunotherapy in high-risk neuroblastoma". Expert Reviews in Molecular Medicine. 9 (34): 1–21. doi:10.1017/S1462399407000518. PMID 18081947. S2CID 32358612.
- ^ Brodeur GM (March 2003). "Neuroblastoma: biological insights into a clinical enigma". Nature Reviews. Cancer. 3 (3): 203–16. doi:10.1038/nrc1014. PMID 12612655. S2CID 6447457.
- ^ Schulte JH, Horn S, Otto T, Samans B, Heukamp LC, Eilers UC, et al. (February 2008). "MYCN regulates oncogenic MicroRNAs in neuroblastoma". International Journal of Cancer. 122 (3): 699–704. doi:10.1002/ijc.23153. PMID 17943719.
- ^ "Translating Neuroblastoma Genomics to the Clinic—J. Maris presentation ASCO 2007". Archived from the original on 2009-01-02. Retrieved 2008-01-13.
- ^ Gisselsson D, Lundberg G, Ora I, Höglund M (September 2007). "Distinct evolutionary mechanisms for genomic imbalances in high-risk and low-risk neuroblastomas". Journal of Carcinogenesis. 6: 15. doi:10.1186/1477-3163-6-15. PMC 2042979. PMID 17897457.
- ^ "Neuroblastoma Treatment". National Cancer Institute. 1980-01-01. Archived from the original on 2008-05-03. Retrieved 2008-02-02.
- ^ Haase GM, Perez C, Atkinson JB (March 1999). "Current aspects of biology, risk assessment, and treatment of neuroblastoma". Seminars in Surgical Oncology. 16 (2): 91–104. doi:10.1002/(SICI)1098-2388(199903)16:2<91::AID-SSU3>3.0.CO;2-1. PMID 9988866.
- ^ Fish JD, Grupp SA (January 2008). "Stem cell transplantation for neuroblastoma". Bone Marrow Transplantation. 41 (2): 159–65. doi:10.1038/sj.bmt.1705929. PMC 2892221. PMID 18037943.
- ^ Matthay KK, Villablanca JG, Seeger RC, Stram DO, Harris RE, Ramsay NK, et al. (October 1999). "Treatment of high-risk neuroblastoma with intensive chemotherapy, radiotherapy, autologous bone marrow transplantation, and 13-cis-retinoic acid. Children's Cancer Group". The New England Journal of Medicine. 341 (16): 1165–73. doi:10.1056/NEJM199910143411601. PMID 10519894.
- ^ Yu AL, Gilman AL, Ozkaynak MF, London WB, Kreissman SG, Chen HX, et al. (September 2010). "Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma". The New England Journal of Medicine. 363 (14): 1324–34. doi:10.1056/NEJMoa0911123. PMC 3086629. PMID 20879881.
- ^ Yalçin B, Kremer LC, van Dalen EC (October 2015). "High-dose chemotherapy and autologous haematopoietic stem cell rescue for children with high-risk neuroblastoma". The Cochrane Database of Systematic Reviews (10): CD006301. doi:10.1002/14651858.cd006301.pub4. PMID 26436598.
- ^ "Neuroblastoma Treatment". National Cancer Institute. 1980-01-01. Archived from the original on 2008-10-02. Retrieved 2008-07-30.
- ^ Yu AL, Gilman MF, Ozkaynak WB, London S, Kreissman HX, Chen KK, Matthay SL, Cohn JM, Maris JM, Sondel PM (2009). "A phase III randomized trial of the chimeric anti-GD2 antibody ch14.18 with GM-CSF and IL2 as immunotherapy following dose intensive chemotherapy for high-risk neuroblastoma: Childrens Oncology Group (COG) study ANBL0032". Journal of Clinical Oncology. 27 (15 Suppl): 10067z. Archived from the original on 2016-01-10. Retrieved 2015-09-10.
- ^ "Drugs Trials Snapshot: Danyelza". U.S. Food and Drug Administration (FDA). 25 November 2020. Retrieved 25 December 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ "Drug Approval Package: Danyelza". U.S. Food and Drug Administration (FDA). 22 December 2020. Retrieved 25 December 2020.
- ^ "Neuroblastoma overview". Children with Cancer UK. Retrieved 2020-07-01.
- ^ Kushner BH, Kramer K, LaQuaglia MP, Modak S, Yataghene K, Cheung NK (December 2004). "Reduction from seven to five cycles of intensive induction chemotherapy in children with high-risk neuroblastoma". Journal of Clinical Oncology. 22 (24): 4888–92. doi:10.1200/JCO.2004.02.101. PMID 15611504.
- ^ Kreissman SG, Villablanca JG, Diller L, London WB, Maris JM, Park JR, Reynolds CP, von Allmen D, Cohn SL, Matthay KK (2007). "Response and toxicity to a dose-intensive multi-agent chemotherapy induction regimen for high risk neuroblastoma (HR-NB): A Children's Oncology Group (COG A3973) study". Journal of Clinical Oncology. 25 (18 Suppl): 9505. doi:10.1200/jco.2007.25.18_suppl.9505. Archived from the original on 2016-01-10.
- ^ Ceschel S, Casotto V, Valsecchi MG, Tamaro P, Jankovic M, Hanau G, et al. (October 2006). "Survival after relapse in children with solid tumors: a follow-up study from the Italian off-therapy registry". Pediatric Blood & Cancer. 47 (5): 560–6. doi:10.1002/pbc.20726. PMID 16395684. S2CID 31490896.
- ^ Gurney JG, Tersak JM, Ness KK, Landier W, Matthay KK, Schmidt ML (November 2007). "Hearing loss, quality of life, and academic problems in long-term neuroblastoma survivors: a report from the Children's Oncology Group". Pediatrics. 120 (5): e1229-36. doi:10.1542/peds.2007-0178. PMID 17974716. S2CID 10606999.
- ^ Trahair TN, Vowels MR, Johnston K, Cohn RJ, Russell SJ, Neville KA, et al. (October 2007). "Long-term outcomes in children with high-risk neuroblastoma treated with autologous stem cell transplantation". Bone Marrow Transplantation. 40 (8): 741–6. doi:10.1038/sj.bmt.1705809. PMID 17724446.
- ^ Mozes, Alan (February 21, 2007). "Childhood Cancer Survivors Face Increased Sarcoma Risk". HealthDay. Archived from the original on September 8, 2015.
- ^ Oeffinger KC, Mertens AC, Sklar CA, Kawashima T, Hudson MM, Meadows AT, et al. (October 2006). "Chronic health conditions in adult survivors of childhood cancer". The New England Journal of Medicine. 355 (15): 1572–82. doi:10.1056/NEJMsa060185. PMID 17035650.
- ^ Laverdière C, Liu Q, Yasui Y, Nathan PC, Gurney JG, Stovall M, et al. (August 2009). "Long-term outcomes in survivors of neuroblastoma: a report from the Childhood Cancer Survivor Study". Journal of the National Cancer Institute. 101 (16): 1131–40. doi:10.1093/jnci/djp230. PMC 2728747. PMID 19648511.
- ^ Janoueix-Lerosey I, Schleiermacher G, Michels E, Mosseri V, Ribeiro A, Lequin D, et al. (March 2009). "Overall genomic pattern is a predictor of outcome in neuroblastoma" (PDF). Journal of Clinical Oncology. 27 (7): 1026–33. doi:10.1200/JCO.2008.16.0630. PMID 19171713.
- ^ Vandesompele J, Baudis M, De Preter K, Van Roy N, Ambros P, Bown N, et al. (April 2005). "Unequivocal delineation of clinicogenetic subgroups and development of a new model for improved outcome prediction in neuroblastoma" (PDF). Journal of Clinical Oncology. 23 (10): 2280–99. doi:10.1200/JCO.2005.06.104. PMID 15800319.
- ^ Michels E, Vandesompele J, Hoebeeck J, Menten B, De Preter K, Laureys G, et al. (2006). "Genome wide measurement of DNA copy number changes in neuroblastoma: dissecting amplicons and mapping losses, gains and breakpoints". Cytogenetic and Genome Research. 115 (3–4): 273–82. doi:10.1159/000095924. PMID 17124410. S2CID 14012430.
- ^ Carén H, Erichsen J, Olsson L, Enerbäck C, Sjöberg RM, Abrahamsson J, et al. (July 2008). "High-resolution array copy number analyses for detection of deletion, gain, amplification and copy-neutral LOH in primary neuroblastoma tumors: four cases of homozygous deletions of the CDKN2A gene". BMC Genomics. 9: 353. doi:10.1186/1471-2164-9-353. PMC 2527340. PMID 18664255.
- ^ 파이 차트에 대한 데이터와 참조는 Wikimedia Commons의 파일 설명 페이지에 있다.
- ^ Brodeur GM, Hogarty MD, Mosse YP, Maris JM (1997). "Neuroblastoma". In Pizzo PA, Poplack DG (eds.). Principles and Practice of Pediatric Oncology (6th ed.). pp. 886–922. ISBN 978-1-60547-682-7.
- ^ Franks LM, Bollen A, Seeger RC, Stram DO, Matthay KK (May 1997). "Neuroblastoma in adults and adolescents: an indolent course with poor survival". Cancer. 79 (10): 2028–35. doi:10.1002/(SICI)1097-0142(19970515)79:10<2028::AID-CNCR26>3.0.CO;2-V. PMID 9149032.
- ^ Ladenstein R, Pötschger U, Hartman O, Pearson AD, Klingebiel T, Castel V, et al. (June 2008). "28 years of high-dose therapy and SCT for neuroblastoma in Europe: lessons from more than 4000 procedures". Bone Marrow Transplantation. 41 Suppl 2 (Suppl 2): S118-27. doi:10.1038/bmt.2008.69. PMID 18545256.
- ^ Berthold F, Simon T (2006). "Clinical Presentation". In Cheung NV, Cohn SL (eds.). Neuroblastoma. Springer. pp. 63–85. ISBN 978-3-540-26616-7.
- ^ Beckwith JB, Perrin EV (December 1963). "In Situ Neuroblastomas: A Contribution to the Natural History of Neural Crest Tumors". The American Journal of Pathology. 43: 1089–104. PMC 1949785. PMID 14099453.
- ^ Rothenberg AB, Berdon WE, D'Angio GJ, Yamashiro DJ, Cowles RA (February 2009). "Neuroblastoma-remembering the three physicians who described it a century ago: James Homer Wright, William Pepper, and Robert Hutchison". Pediatric Radiology. 39 (2): 155–60. doi:10.1007/s00247-008-1062-z. PMID 19034443. S2CID 19611725.
- ^ "Erin Buenger had a zest for living life fully". The Bryan College Station Eagle. April 12, 2009. Archived from the original on June 11, 2011.
- ^ a b c Braekeveldt N, Wigerup C, Gisselsson D, Mohlin S, Merselius M, Beckman S, et al. (March 2015). "Neuroblastoma patient-derived orthotopic xenografts retain metastatic patterns and geno- and phenotypes of patient tumours". International Journal of Cancer. 136 (5): E252-61. doi:10.1002/ijc.29217. PMC 4299502. PMID 25220031.
- ^ Malaney P, Nicosia SV, Davé V (March 2014). "One mouse, one patient paradigm: New avatars of personalized cancer therapy". Cancer Letters. 344 (1): 1–12. doi:10.1016/j.canlet.2013.10.010. PMC 4092874. PMID 24157811.
- ^ Tentler JJ, Tan AC, Weekes CD, Jimeno A, Leong S, Pitts TM, et al. (April 2012). "Patient-derived tumour xenografts as models for oncology drug development". Nature Reviews. Clinical Oncology. 9 (6): 338–50. doi:10.1038/nrclinonc.2012.61. PMC 3928688. PMID 22508028.
- ^ "Neuroblastoma Committee—Current Focus of Research". Archived from the original on September 25, 2006. Retrieved 2008-01-13.
- ^ Baker DL, Schmidt ML, Cohn SL, Maris JM, London WB, Buxton A, et al. (September 2010). "Outcome after reduced chemotherapy for intermediate-risk neuroblastoma". The New England Journal of Medicine. 363 (14): 1313–23. doi:10.1056/NEJMoa1001527. PMC 2993160. PMID 20879880. Archived from the original on 2013-01-13.
- ^ Baker DL, Schmidt ML, Cohn SL, Maris JM, London WB, Buxton A, et al. (September 2010). "Outcome after reduced chemotherapy for intermediate-risk neuroblastoma". The New England Journal of Medicine. 363 (14): 1313–23. doi:10.1056/NEJMoa1001527. PMC 2993160. PMID 20879880.
- ^ Morgenstern DA, Baruchel S, Irwin MS (July 2013). "Current and future strategies for relapsed neuroblastoma: challenges on the road to precision therapy". Journal of Pediatric Hematology/Oncology. 35 (5): 337–47. doi:10.1097/MPH.0b013e318299d637. PMID 23703550. S2CID 5529288.
- ^ Illhardt T, Toporski J, Feuchtinger T, Turkiewicz D, Teltschik HM, Ebinger M, et al. (May 2018). "Haploidentical Stem Cell Transplantation for Refractory/Relapsed Neuroblastoma". Biology of Blood and Marrow Transplantation. Elsevier BV. 24 (5): 1005–1012. doi:10.1016/j.bbmt.2017.12.805. PMID 29307718.