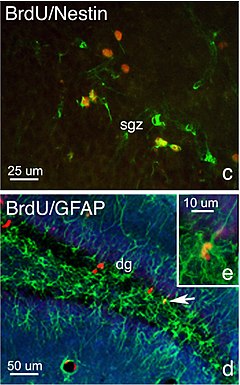
성인신경생식
Adult neurogenesis성인의 신경생성은 성인의 신경줄기세포에서 뉴런이 생성되는 과정이다. 이 과정은 태아기 신경생식과는 다르다.
대부분의 포유류에서, 새로운 뉴런은 성년기 내내 뇌의 두 영역에서 태어난다.[3]
- 신경줄기세포가 과립세포(기억 형성 및 학습에 임플란트)를 낳는 [4][5]해마의 틀니트 회리의 일부인 아구(SGZ) 영역이다.[citation needed]
- 측면 심실의 심실하부(SVZ)는 측면, 등측, 내측 등 3개의 마이크로돔으로 나눌 수 있다.[6] 신경줄기세포는 후각 전구로 이동하며, 후각의식에 참여하는 내동맥류로 분화한다. 그러나 인간에게 있어서 출생 후에 후각 전구 뉴런이 생성되는 경우는 거의 없다.[7][8]
선조체보다 틀니트 회에 있는 신경 유전자에 더 많은 관심이 주어졌다. 설치류에서는 새로 태어난 틀니트 회 뉴런 중 상당수가 태어난 직후 사망하지만,[4] 그 중 상당수는 기능적으로 주변 뇌조직에 통합된다.[9][10][11] 인간 해마에서 태어난 뉴런의 수는 여전히 논쟁의 여지가 남아 있다; 일부 연구는 성인 인간에게 매일 700개의 새로운 뉴런이 해마에 추가된다고 보고한 반면,[12] 다른 연구들은 성인 해마 신경 유전자가 인간에게 존재하지 않는다는 것을 보여주거나, 만약 있다면, 감지할 수 없는 수준에 있다는 것을 보여준다.[13] 따라서 성인 뇌 기능에서 새로운 뉴런의 역할은 불분명하다. 성인 신경 유전자는 학습과 기억, 감정, 스트레스, 우울증, 부상 반응, 그 밖의 다른 조건들에 영향을 미치는 것으로 보고되고 있다.[14]
메커니즘
성인 신경줄기세포
신경줄기세포(NSC)는 신경계의 주요 표현형을 생성하는 자생적이고 다기능적인 세포다.
계통 재프로그래밍(전환 차별화)
거주자 활혈세포의 지시에 따라 신경 미세혈관 과실체가 내부 동맥으로 재프로그래밍되고 국소 신경 미세회로를 풍부하게 한다는 증거가 나오고 있다.[15] 이 반응은 동반성 혈관신생에 의해 증폭된다.
신경생물의 모델 유기체
플라나리아어
플라나리아인은 팔라스와 함께 플라나리아 연구의 선조로 재생 연구를 하는 데 사용된 가장 초기 모델 유기체 중 하나이다. 플라나리아인은 최근 몇 십 년 동안 신경생식을 검사하는 데 사용된 전형적인 무척추동물 모델이다. 평면주의자의 중추신경계는 머리에 2개의 로브와 2개의 복측신경줄로 완전히 형성되긴 했지만 단순하다. 이 모델은 분열 후 완전하고 완전하게 기능하는 신경계를 무성으로 재현하여 신경생물의 일관된 검사를 가능하게 한다.
액솔로틀
액솔로틀은 다른 척추동물들에 비해 흔하게 쓰이지 않지만 여전히 재생과 신경생식을 검사하는 고전적인 모델이다. 비록 악솔로틀이 사지 재생의 측면에서 생물 의학 연구에서 자리를 잡았지만,[16][17] 모델 유기체는 손상에 이어 새로운 뉴런을 생성하는 강력한 능력을 보여주었다.[18][19] 액솔로틀은 무척추동물과 포유류 사이의 교량 유기체로서 기여해 왔는데, 이 종은 작은 틈새에 국한되지 않고 광범위한 뉴런 집단을 형성하는 완전한 신경 유전체를 겪을 수 있는 재생 능력을 가지고 있기 때문이다.[20] 그러나 복잡성과 구조는 인간의 신경 발달에 여러 면에서 복잡하고 유사하다.
제브라피쉬
제브라피쉬는 장기생식 시 투명성 때문에 오랜 기간 고전적인 발달모델로 활동해 왔으며, 초기 발달 신경생식에 많이 활용돼 왔다.)[21][22] 제브라피쉬는 수명을 통해 신경생성 지속으로 다양한 조직과 완전한 뉴런 다양성을 재생할 수 있는 강한 신경생성 능력을 보이고 있다(제브라피쉬 뇌 내에서 아직 확인되지 않았기 때문에 아스트로사이테스는 제외). 최근 수십 년 동안 이 모델은 피해에 따른 성인 재생과 신경 유전자에서 그 역할을 확고히 해 왔다.[23][24][25] 제브라피쉬는 액솔로틀과 마찬가지로 무척추동물과 포유류 사이의 교량 유기체로서 핵심적인 역할을 해 왔다. 제브라피쉬는 유전적 조작의 현장 용이성과 복잡한 신경계를 제공하면서 상대적으로 유지 비용이 적게 드는 빠르게 발전하는 유기체다.
병아리
비록 아비안들이 주로 초기 배아 발달을 연구하는데 사용되었지만, 최근 수십 년 동안 발달한 병아리는 신경생성 및 재생에 중요한 역할을 해왔는데, 이 병아리는 어린 나이에 뉴런 전환이 가능하지만, 성인이 되어서야 신경생성 능력을 상실하기 때문이다.[26] 성숙기에 비해 신경 재생 능력이 상실됨에 따라, 조사자들은 신경 유전체의 유전적 조절 장치를 더 자세히 조사할 수 있게 되었다.
설치류
설치류인 쥐와 쥐는 산티아고 라몬 이 카잘에 의해 현대 뉴런이 발견된 이후 가장 두드러진 모델 유기체였다. 설치류들은 매우 유사한 구조와 인간에게서 발견되는 것과 유사한 재생 능력이 거의 없는 복잡한 신경계를 가지고 있다. 그러한 이유로 설치류는 임상 전 시험에서 많이 사용되어 왔다. 설치류는 복잡한 행동을 담당하는 광범위한 신경회로를 표시해 둔부 가지치기 및 축삭 연구에 이상적이다.[27] 유기체가 강한 인간 아날로그를 만드는 반면, 모델은 이전 모델에서 찾아볼 수 없었던 한계점을 가지고 있다: 더 높은 유지 비용, 더 낮은 번식 수, 그리고 제한된 신경 생성 능력이다.
설치류에서 성인 신경생물은 아스트로사이테스에서의 노치 신호 전달의 선택적 붕괴에 의해 유발될 수 있다:[28] 이것은 선조체 회로에 기능적으로 통합되는 새로운 뉴런을 생성한다.[29]
설치류의 심실하부 및 덴트레이트 교리 성인의 신경생성은 산화 스트레스를 발생시키고 활성산소의 생성으로 DNA와 지질을 모두 손상시킬 수 있다.[30] 산후 신경생식으로 인한 산화 스트레스는 나이가 들면서 발생하는 학습량과 기억력 저하에 크게 기여할 수 있다.[30]
문어
일반적인 문어 a, 두팔로포드라고도 알려진 이 유기체는 새로운 세포를 생산할 수 있는 뇌의 능력을 보여주는 복잡한 신경계를 가지고 있다. 이 경우, 그리고 비교했을 때, 이 유기체들은 새롭게 형성된 뇌세포를 사용함으로써 예측할 수 없는 환경에 적응한다.[31] 이것은 짧은 수명(약 1년)을 넘는 것으로, 야생 일반 문어들은 대부분의 에너지를 짝짓기와 새끼 돌봄에 집중한다.[32][33] 다른 단명종과 마찬가지로 문어속은 해마가 복잡하게 번져 공간/내비게이션에 필요하며,[34][35] 장단기 기억력이 있다는 연구결과가 나왔다.[36][circular reference]
치카데스
검은머리 병아리는 노래 발성, 가소성, 기억력 등에서 신경 메커니즘으로 신경과학 분야에서 잘 알려진 모델종이다. 검은머리 병아리는 먹이를 캐는 행동이 특징이기 때문에 큰 무리의 송새와 다른 종이다. 이러한 행동 때문에, 박새들은 그들의 놀라운 공간 기억을 통해 묘사될 수 있다. 해마 밀도의 계절적 변화는 1994년[37] 가을(10월)에 뉴런 생존이 절정에 달한 이후, 주사 몇 주 [37]후 티미딘(아래 신경생성 추적 참조)[37]으로 표시된 세포에 의해 측정되었다. 집참새와 같은 새를 캐싱하는 비식품 캐싱하는 것과 비교하면, 박새들은 가을부터 봄까지 해마 뉴런 모집이 상당히 많았다.[38] 해마의 밀도의 변화는 특히 더 나은 공간적 기억력이 생존을 극대화하는 겨울 동안 사재기 행태의 증가와 직접적인 관련이 있다.[38]
최초 발견 이후 20년이 넘는 기간 동안,[37] 기억 속에 있는 병아리 해마의 구체적인 역할은 많은 주목을 받았다. 실험 환경에서 해마 병변은 위치의 메모리에 영향을 미치며,[39] 이 특정 역할에 대한 이전의 개념을 검증한다. 또한, 뉴런 증식을 실험적으로 억제하면 공간 기억 작업에 대한 점수가 감소하여 새로운 뉴런이 기존 뉴런과 동일한 역할을 한다는 것을 뒷받침한다.[40] 해마의 특정한 기능은 해마의 부피의 계절적 변화와 결합되어 공간 기억력 통합에 대한 그들의 일시적인 이점을 가리킨다. 모두 종합하면, 검은 모자를 쓴 병아리의 해마에 있는 성인 신경 유전자는 계절 음식 캐싱 행동과 직접적인 상관관계에서 뉴런 생존을 위한 선택적 메커니즘을 제안한다.
발달적으로 방사형 글라이알 세포라고 불리는 유전자 세포는 그들의 목적지에 새로 태어난 뉴런을 완화시키는 것으로 생각된다.[41] 방사상 활엽세포는 조류 심실영역의 소마에서 성인 전뇌의 실질까지 과정을 확장한다.[42] 이 뉴 뉴런들은 HVC에서[43] 티미딘 투여 후 3일 후, 해마에 도달하기 7일 전에 관찰되었다.[38] 새로운 뉴런의 조류 이동은 포유류 종과 유사하며,[42] 포유류 종 및 그 이상의 신경 유전자를 탐구하는 미래 방향을 제공한다. 그러나, 포획은 야생 해마에 비해 해마의 양을 줄이는 것으로 나타났다.[44] 포획된 새의 신경생성 감소는 스트레스, 운동 부족, 사회적 상호작용 감소, 제한된 캐싱 기회 등에 의해 야기될 수 있다.[44]
추적신경생식
새로운 기능 뉴런의 생성은 다음과 같은 섹션에 요약되어 여러 가지 방법으로 측정할 수 있다.[45]
DNA 라벨 표시
라벨이 붙은 DNA는 분열된 세포의 혈통을 추적할 수 있고, 딸 세포의 위치를 결정할 수 있다. 핵산 아날로그는 뉴런 생성 세포의 게놈(글리알 세포나 신경 줄기 세포 등)에 삽입된다.[46] 티민 아날로그(3H) 티미딘과[47] 브르두[48](BrdU)는 일반적으로 사용되는 DNA 라벨로, 각각 방사선과 면역화학에 사용된다.
뉴런 혈통 표지를 통한 운명 결정
DNA 라벨링은 신경 혈통 표지와 함께 새로운 기능 뇌세포의 운명을 결정하는 데 사용될 수 있다. 첫째, 라벨이 부착된 뉴클레오티드가 새로 분할된 딸 세포의 모집단을 검출하는 데 사용된다. 그리고 나서 면역측정에서 항원으로 사용될 수 있는 단백질의 발현에 있어서 특정한 세포 타입이 독특한 차이로 결정된다. 예를 들어 NeuN/Fox3와 GFAP는 뉴런, 글리아, 후피 세포를 검출하는 데 흔히 사용되는 항원이다. Ki67은 세포 증식을 탐지하는 데 가장 많이 사용되는 항원이다. 일부 항원은 특정 줄기세포 단계를 측정하는 데 사용될 수 있다. 예를 들어 줄기세포는 플뤼리포텐도를 유지하기 위해 sox2 유전자를 필요로 하며 CNS 조직에서 줄기 세포의 지속적인 농도를 검출하는 데 사용된다. 단백질 네스틴은 중간 필라멘트로 액손의 방사형 성장에 필수적이기 때문에 새로운 시냅스의 형성을 감지하는 데 사용된다.
크레-록스 재조합
일부 유전적 추적 연구는 크레-록스 재조합을 이용하여 lacZ나 GFP 유전자와 같은 기자 유전자에 프로모터를 결합시킨다.[46][49] 이 방법은 세포분할과 라벨링의 장기정량화에 사용할 수 있는 반면, 앞서 언급한 절차는 단기정량화에만 유용하다.
바이러스 벡터
재조합 바이러스를 이용해 특정 종류의 세포로만 표현되는 특정 표지자(일반적으로 GFP와 같은 단백질 불소포레)를 인코딩하는 유전자 정보를 삽입하는 것이 최근 보편화되고 있다. 마커 유전자는 프로모터의 다운스트림에 삽입되어, 해당 프로모터와 결합되는 전사 인자를 포함하는 세포에만 마커를 전사하게 된다. 예를 들어, 재조합형 플라스미드,는 동안 비 doublecortin 영향을 세포들을 표현하는 떠나더라도 그들이 함유한 감염된 세포 녹색 빛에 노출되면 푸른 옷을 입은 range[50]자외선에, fluoresce를 만들고 doublecortin의 프로모터는 단백질 주로 뉴런들에 의해 표현된 GFP을 위한 순서 부호화 상류 포함할 수 있다. 그 플라스미드의 많은 세포들이 플라스미드와 형광체의 복제본을 여러 개 포함할 것이며, 이로 인해 형광 성질은 감염된 세포의 혈통을 따라 전달될 수 있게 된다.
신경줄기세포나 신경전구세포처럼 뉴런을 발생시키는 세포에 라벨을 붙임으로써 새로 생성된 뉴런의 생성, 증식, 나아가 이동까지 추적할 수 있다.[51] 단, 플라스미드는 장기간 안정적이지만, 그 단백질 제품은 반수명이 매우 가변적일 수 있고 형광이 감소할 수 있으며, 너무 희석되어 복제 횟수에 따라 보이지 않을 수 있으므로, 이 방법은 자가시미 추적에 더욱 유용하다는 점에 유의해야 한다.뉴런 자체보다는 신경 전구체나 신경줄기세포. 바이러스 벡터를 통한 유전물질의 삽입은 특정 조직 영역의 총 세포 수에 비해 산발적이고 드물게 나타나는 경향이 있어 세포분열의 정량화가 부정확하다. 그러나 위의 방법은 완전한 세포 형태뿐만 아니라 세포가 언제 태어났는지에 관한 매우 정확한 데이터를 제공할 수 있다.[52]
신경생식억제방법
성인 신경생물의 역할을 분석하는 많은 연구들은 특정 뇌 부위의 세포 증식을 억제하고 신경생물의 억제를 모방하는 방법을 사용하여 행동에 미치는 영향을 관찰한다.[14]
약리학적 억제
약리학적 억제는 많은 이점을 제공하기 때문에 다양한 연구에서 널리 사용된다. 조사 등 다른 방법에 비해 일반적으로 저렴하며, 다양한 종에 사용할 수 있으며, 대상자에 대한 침습적 시술이나 수술이 필요하지 않다.
그러나 이러한 억제제를 특정 지역의 확산을 억제하는 데 사용할 수 없기 때문에 다른 시스템이 영향을 받는 비특정적 효과를 초래할 수 있기 때문에 이 방법은 특정한 난제를 제기한다. 이러한 영향을 피하려면 신경생성과 무관한 시스템에 미치는 영향을 최소화하기 위해 최적의 선량을 결정하기 위한 더 많은 작업이 수행되어야 한다.
성인의 신경생식에 대한 일반적인 약리학적 억제제는 화학요법제인 메틸아조시메탄올 아세테이트(MAM)이다. 연구에 흔히 사용되는 다른 세포분열억제제는 시타라빈과 테모졸로미드다.
약리유전학
성인 신경생물의 효과를 연구하기 위해 사용되는 또 다른 방법은 약리학적 모델을 사용하는 것이다. 이 모델들은 신경 유전자와 특정 줄기세포 촉진자에게 특정 전구체를 표적으로 하여 보다 구체성을 부여할 수 있기 때문에 약리학적 경로와는 다른 이점을 제공한다. 그것은 또한 특정 약물의 상호작용과 시간적 특수성을 허용한다. 이것은 뇌의 다른 부위가 정상적으로 발달한 후, 특히 성인기에 신경생식을 관찰하는 데 유익하다.
헤르페스 심플렉스 바이러스 티미딘키나아제(HSV-TK)는 항바이러스제와 연계해 성인 신경생식을 억제하는 연구에 활용돼 왔다. 유리섬유질 산성 단백질과 네스틴 발현을 이용한 줄기세포 타겟팅으로 작용한다. 이들 표적 줄기세포는 항바이러스제에 노출되면 세포 증식 대신 세포사멸을 겪는다.
크레 단백질은 또한 타목시펜으로 치료할 때 유전자 변화를 겪을 줄기세포를 타겟으로 하는 데 흔히 사용된다.
조사
조사법은 성인의 신경생식을 매우 구체적으로 억제하는 방법이다. 다른 시스템에 영향을 미치고 비특이적인 영향을 주지 않도록 뇌를 대상으로 할 수 있다. 특정 뇌 영역을 대상으로 하는 데까지 사용될 수 있는데, 뇌의 다른 영역에 있는 성인의 신경 유전자가 행동에 어떤 영향을 미치는지 결정하는 데 중요하다.
그러나 조사에는 다른 방법보다 비용이 많이 들고 훈련된 개인이 있는 대형 장비도 필요하다.
해마에서 성인의 신경생성 억제
많은 연구들은 쥐나 쥐와 같은 다른 포유류에서 성인의 신경생식을 억제하는 것이 그들의 행동에 어떤 영향을 미치는지 관찰해왔다.[14] 해마에서 성인의 신경생성 억제는 학습과 기억력, 조건화, 그리고 조사 행동에 다양한 영향을 미치는 것으로 나타났다.
해마에서 성인의 신경 유전자가 부족한 쥐와 관련된 연구에서 손상된 공포 조절이 관찰되었다.[53] 해마에서 성인의 신경생성 억제는 조사를 수반하는 과제의 행동 변화와도 연관되어 있다.[54] 쥐는 또한 성인 신경 유전자가 부족할 때 문맥화된 공포와 공간적 위치의 학습 장애에 대응하여 문맥화된 동결 행동을 감소시키는 것을 보여준다.[55][56]
패턴 분리 효과
앞서 언급한 연구들에서 나타난 학습과 기억력의 변화는 패턴 분리를 조절하는 데 있어서 성인 신경생물의 역할과 관련이 있다고 생각된다.[14] 패턴 분리는 "이벤트가 서로 분리되고 간섭이 감소할 수 있도록 유사한 입력에서 중복성을 제거하는 프로세스와 더불어 보다 직교, 희소, 범주화된 출력 세트를 생산할 수 있다"[57]로 정의된다.
패턴 분리의 이러한 장애는 다른 학습 및 기억 작업에서 나타나는 장애를 설명할 수 있다. 간섭을 줄이는 능력이 떨어지면 학습에서 신경생물이 미치는 영향과 해석 행동 결과의 한계로 패턴 분리가 구별되기는 어렵지만 새로운 기억을 형성하고 유지하는 데 더 큰 어려움을 겪을 수 있다."[14][58]
연구에 따르면 억제된 성인 신경 유전자를 가진 쥐는 문맥화된 공포 조절을 구별하고 배우는 데 어려움을 보여준다.[14] 성체 신경생성이 차단된 쥐도 유사한 맥락에서 구별해야 할 때 미분 동결이 손상된다.[59] 이것은 또한 팔이 더 멀리 떨어져 있을 때보다 더 가까이 있을 때 방사형 팔 미로 시험에서 공간 인식에 영향을 미친다.[60] 서로 다른 패턴 분리 테스트에서 신경생성 효과를 평가하는 행동 연구의 메타 분석은 문헌에 예외가 있기는 하지만 신경생성 절제술의 성과에 대한 일관된 효과를 보여주었다. "[61]
행동억제에 미치는 영향
행동 억제는 쥐와 다른 동물들에게 그들이 현재 하고 있는 것을 멈추는 데 있어 중요한데, 위협이나 그들의 주의가 필요할 수 있는 다른 것에 대응하여 상황을 재평가하기 위해서입니다.[14]
해마가 있는 쥐는 고양이 냄새와 같은 위협에 노출되었을 때 행동 억제가 덜 된다.[62] 정상적인 세포 증식과 쥐의 발달에 있어서의 틀니트 회의 발달도 생소한 성인 수컷 쥐에게 노출되었을 때 행동 억제의 한 예인 냉동 반응을 약화시킨다.[63]
잘못된 대답이나 행동을 억제하는 것은 그러한 반응을 억제하는 능력을 요구하기 때문에, 행동 억제의 이러한 장애는 학습과 기억의 과정에도 연관되어 있다.[14]
시사점
배움의 역할
성인 신경생물의 기능적 관련성은 불확실하지만,[64] 학습과 기억력에 해마 성인 신경생식이 중요하다는 일부 증거가 있다.[65] 새로운 뉴런이 기억 용량을 증가시키거나,[66] 기억 사이의 간섭을 줄이거나,[67] 기억에 대한 시간에 대한 정보를 추가한다는 것을 증명하기 위한 계산 이론을 포함하여, 증가된 신경생성과 인식 개선 사이의 관계에 대한 여러 메커니즘이 제안되었다.[68] 는 신경 발생의 비율 실질적으로 성인기 동안 바뀌지 않는다를 감안할 때 독특한 삽화적 기억은 단순히 특정한 나이의 젊은 뉴런의 생산에 동료들 이벤트의 독특한 특징을 나타내는 기억할 만할 경우 6과 안정된 새로운 시냅스를 설립하기 위해 의지하며 생성될 수 있는 것이 제안되고 있다.9] 신경생물을 감소시키는 것을 목표로 한 실험은 결론에 이르지 못한 것으로 증명되었지만, 몇몇 연구들은 어떤 종류의 학습에서 신경생물에 의존하는 것을 제안했고,[70] 다른 연구들은 효과가 없다고 보았다.[71] 학습 행위 자체가 뉴런 생존 증가와 관련이 있다는 연구결과가 나왔다.[72] 그러나 성인의 신경생식이 어떤 종류의 학습에도 중요하다는 전반적인 발견은 모호하다.
알츠하이머병
해마 신경생성 감소가 알츠하이머병(AD)의 발달을 가져올 수 있다는 연구결과도 있지만, 뉴런 손실을 보상하기 위해 암몬의 뿔 CA1 부위(AD 해마병리학의 주요 부위)에서 AD환자가 신경생성을 증가시켰다는 가설도 있다.[73][74] 신경생성과 알츠하이머병의 정확한 관계는 알려지지 않았지만, 인슐린 유사 성장인자 1-절연 신경생물은 해마의 가소성에 큰 변화를 일으키고 알츠하이머 병리학에 관여하는 것처럼 보인다.[75] 신경스테로이드인 알롭페르놀론은 뇌에서 계속되는 신경생식을 돕는다. 노령과 알츠하이머 병에 걸린 뇌의 알로페놀론 수치가 감소한다.[76] 알로페탄올론은 알츠하이머병 마우스 모델의 인지결손을 되돌리기 위해 신경생성 역손상을 통해 나타났다.[77] 에프 수용체와 에프린 신호는 해마에서 성인 신경 유전체를 조절하는 것으로 나타났으며 AD의 일부 증상을 치료할 수 있는 잠재적 대상으로 연구되어 왔다.[78] 아포이, PS1, APP 등 AD의 병리학과 관련된 분자도 해마의 성체 신경 유전자에 영향을 미치는 것으로 밝혀졌다.[79]
정신분열증의 역할
조현병 환자의 해마 부피 감소는 성인 신경생식 감소에 따른 것으로 추정된다는 연구결과가 나왔다. 이에 상응하여, 이러한 현상은 질병의 많은 증상의 근본적인 원인일 수 있다. 나아가 여러 연구 논문에서는 4개의 유전자인 디스트로브레빈 결합 단백질 1(DTNBP1)과 조현병 1(DISC1)에서 교란된 네우레굴린 1(NRG1)과 뉴런 1 수용체(ERB4)를 뉴런의 정상적인 재생에서 이러한 결손의 원인으로 언급하였다.[80][81] 우울증과 정신분열증의 유사성은 두 질병 사이의 생물학적 연관성을 시사한다. 그러나 이러한 관계를 명확히 증명하기 위해서는 더 많은 연구가 이루어져야 한다.[82]
성인 신경생성과 주요 우울증
연구에 따르면 성인 해마 신경 유전자는 주요 우울증 장애(MDD)와 반비례한다.[83] 주요 우울장애 동물모델 해마에서 신경유전증이 감소하고 항우울제, 전기충격요법 등 많은 질환 치료법이 해마 신경유전증을 증가시킨다. 주요 우울장애를 가진 개인의 해마 신경생성 감소는 글루코코르티코이드라고 불리는 스트레스 호르몬의 수치가 높은 것과 관련이 있을 수 있다는 이론이 나왔다. 해마는 시상하부-하수체-아드레날린 축에 글루코코르티코이드 수치가 높을 때 글루코코르티코이드를 적게 생산하도록 지시한다. 그러므로 오작동하는 해마는 주요 우울증을 가진 사람들의 만성적으로 높은 글루코코르티코이드 수치를 설명할 수 있다. 그러나 일부 연구에서는 해마가 주요 우울장애를 가진 개인에서 낮아지지 않고 해마가 변해도 혈당류코르티코이드 수치가 변하지 않아 연관성이 여전히 불확실하다는 결과가 나왔다.
스트레스와 우울증
현재 많은 사람들은 스트레스가 우울증의 시작에 가장 중요한 요소라고 믿고 있다. 위에서 논의한 바와 같이 해마세포는 스트레스에 민감하여 신경생성 감소로 이어질 수 있다. 이 지역은 우울증의 원인과 치료법을 조사할 때 더 자주 고려되고 있다. 쥐의 부신 제거가 틀니트 회의 신경 유전자를 증가시켰다는 연구결과가 나왔다.[84] 부신은 스트레스 요인에 반응해 코티솔을 생성하는 역할을 하는데, 만성적으로 생성되면 세로토닌 수용체 감소를 유발하고 뉴런의 탄생을 억제하는 물질이다.[85] 코르티코스테론을 정상 동물에게 투여하면 그 반대 효과인 신경생식을 억제한다는 사실이 같은 연구에서 밝혀졌다.[84] 이 병에 투여되는 가장 대표적인 항우울제는 선택적 세로토닌 재흡수 억제제(SSRI)[86]이며 그 효능은 신경유전증에 의해 설명될 수 있다. 정상적인 뇌에서 세로토닌의 증가는 해마와의 연결을 통해 코르티코트로핀 방출 호르몬(CRH)의 억제를 유발한다. 그것은 CRH 방출을 감소시키고 로쿠스 코울루아에서 기능하는 노르에피네프린 기능을 다운 조절하기 위해 파라브실 핵에 직접 작용한다.[84] CRH가 억제되고 있기 때문에, CRH의 레벨 상승과 관련된 신경생물의 감소도 역전되고 있다. 이것은 특히 우울증 증상을 개선시키는 것으로 보여진 해마의 틀니트 회에 있는 5-HT1a 수용체에서 더 많은 뇌 세포의 생성을 가능하게 한다. 보통 뉴런이 성숙하는 데는 약 3주에서 6주가 걸리며,[87] 이는 SSRI가 발효되는 데 걸리는 시간과 거의 같은 시간이다. 이 상관관계는 SSRI가 우울증 증상을 줄이기 위해 신경유전증을 통해 작용한다는 가설을 강화한다. 일부 신경과학자들은 소수의 초창기 뉴런이 실제로 기존의 신경 회로에 통합되어 있다는 점에서 신경생성이 기능적으로 유의하다는 회의감을 표명했다. 그러나, 최근의 한 연구는 항우울제 효능에 신경 유전자가 필요하다는 것을 증명하기 위해 비인간 영장류(NHP)의 초기 해마 뉴런의 조사를 이용했다.[88]
성인으로 태어난 뉴런은 스트레스 조절에 역할을 하는 것으로 보인다.[89][90] 연구는 신경 유전자를 특정 항우울제의 유익한 작용과 연관시켜, 감소된 해마 신경 유전자와 우울증 사이의 연관성을 시사했다.[91][92] 과학자들은 선구자적 연구에서 신경생식을 X선방사 기술로 예방할 때 생쥐의 항우울제 투여의 행동적 편익이 역전된다는 것을 입증했다.[93] 실제로 신생 뉴런은 GABA 수용체의 차등 발현으로 인해 구식 뉴런보다 흥분성이 높다.[94] 따라서 그럴듯한 모델은 이러한 뉴런들이 HPA 축의 부정적 피드백 메커니즘(생리학적 스트레스)과 어쩌면 편도체(자극에 대한 두려운 반응을 담당하는 뇌의 영역)를 억제하는 데 있어 해마의 역할을 증대시키는 것이다.[vague] 실제로 성인 신경생물의 억제는 약간의 스트레스를 받는 상황에서 HPA 축 스트레스 반응을 증가시킬 수 있다.[89] 이는 스트레스 완화 활동(학습, 새롭지만 양성적인 환경에 대한 노출, 운동)과 신경생리학적 스트레스(코르티솔) 또는 심리적 스트레스(예: 격리)에 노출된 동물이 신생아 n의 현저한 감소된 수준을 보인다는 관찰을 연결하는 수많은 발견과 일치한다.urons. 만성적인 스트레스 조건에서 항우울제에 의한 신생아 뉴런의 상승은 스트레스 반응에 대한 해마의 의존적 제어를 향상시킨다; 신생 뉴런이 없으면 항우울제는 스트레스 반응의 조절을 회복할 수 없고 회복이 불가능해진다.[90]
일부 연구는 학습과 기억력이 우울증과 연관되어 있으며, 신경생식증(Neurogenesis)이 신경성 플라스틱을 촉진할 수 있다는 가설을 세웠다. 한 연구는 기초 수준에서, 가소성에 의해, 그리고 따라서 화학이 아닌, 분위기를 조절할 수 있다고 제안한다. 따라서 항우울제 치료의 효과는 가소성 변화에 부차적일 뿐이다.[95] 그러나 또 다른 연구는 항우울제와 가소성 사이의 상호작용을 입증했다; 항우울제 플루옥세틴은 성인 쥐의 뇌에서 가소성을 회복시키는 것으로 나타났다.[96] 이 연구의 결과는 가소성 변화에 부차적인 것이 아니라 항우울제 치료가 그것을 촉진시킬 수 있다는 것을 암시한다.
수면 감소 효과
한 연구는 수면 부족을 설치류 해마의 신경생식 감소와 연관시켰다. 관찰된 감소에 대해 제안된 메커니즘은 글루코코르티코이드의 증가된 수준이었다. 2주간의 수면부족이 신경유전 억제제 역할을 한 것으로 나타났는데, 정상수면 복귀 후 역전돼 정상세포 증식의 일시적 증가까지 이어진 것으로 나타났다.[97] 더 정확히 말하면, 코르티코스테론의 수치가 높아지면 수면부족은 이 과정을 억제한다. 그럼에도 불구하고 만성 수면부족 후 정상적인 신경생성 수치는 2주 후에 돌아오며 일시적으로 신경생성이 증가한다.[98] 이것이 인정되지만, 간과되고 있는 것은 일시적인 당뇨성 저혈당 상태 동안에 나타나는 혈당 수요다. 미국 당뇨병 협회는 많은 문서들 중에서 일시적인 저혈당 상태 동안에 발견되는 유사감소증과 동요를 문서화한다. 혈액학적 포도당 감소와 신경 활동 및 기분 사이의 연관성을 능숙하게 입증하려면 훨씬 더 많은 임상 문서가 필요하다.
파킨슨병 치료에 사용 가능
파킨슨병은 실체성 니그라의 도파민성 뉴런이 점진적으로 손실되는 것이 특징인 신경퇴행성 질환이다. 태아 도파민성 전구세포 이식은 해당 환자의 임상 증상을 개선시킬 수 있는 세포 교체 치료법의 가능성을 열어놓았다.[99] 최근 몇 년 동안 과학자들은 성인 포유류 뇌에서 특히 도파민성 표현형 같은 새로운 뉴런을 만들어낼 수 있는 잠재력을 가진 신경줄기세포의 존재에 대한 증거를 제공해 왔다.[100][101][102] 설치류에서 도파민의 실험적인 고갈은 피부하위 영역과 뇌하위 영역의 전구세포 증식을 감소시킨다.[103] 증식은 D2형(D2L) 수용체의 선택적 작용제에 의해 완전히 회복된다.[103] 신경줄기세포는 신경유전성 뇌영역에서도 확인되었는데, 신경유전성이 구성적으로 진행 중인 신경유전성 뇌영역에서는 신경유전성이 정상적인 생리적 조건에서 발생하지 않는다고 생각되는 중간뇌나 선조체 등 비신경유전성 영역에서도 확인되었다.[99] 새로운 연구는 사실 선조체 안에 신경생물이 있다는 것을 보여주었다.[104] 체내 성인 신경줄기세포를 지배하는 요인에 대한 세밀한 이해는 결국 퇴화된 뉴런을 대체하기 위해 자가생성 신경줄기세포를 동원함으로써 파킨슨병과 같은 신경퇴행성 질환에 대한 우아한 세포치료로 이어질 수 있다.[99]
외상성 뇌손상
외상성 뇌 손상은 부상 메커니즘에 따라 다양하며, 1차 및 2차 부상을 초래하는 둔기 또는 관통성 외상을 유발하여 흥분성 및 비교적 넓게 퍼진 신경 사인이 발생한다. 테러와의 전쟁으로 인한 외상성 뇌 손상의 수가 압도적으로 많기 때문에, 엄청난 양의 연구가 외상성 뇌 손상의 병태생리학뿐만 아니라, 신경 보호적 개입과 회복적 신경 유전자를 촉진하는 가능한 개입에 대해 더 잘 이해하기 위해 배치되었다. 프로게스테론, 에스트로겐, 알롭 메탄올론과 같은 호르몬 개입은 최근 수십 년 동안 염증 반응 스턴트 뉴런 사망을 줄이기 위해 외상성 뇌손상에 따른 가능한 신경보호제로서 크게 연구되어 왔다.[105][106][107][108] 성인 신경생식에 대한 재생능력이 부족한 설치류에서 α7 니코틴닉 아세틸콜린 수용체 작용제 PNU-282987) 투여에 따른 줄기세포 활성화가 손상된 망막에서 확인됐으며 외상성 뇌손상 후 포유류 신경생물의 활성화를 검사하는 후속 작업이 진행됐다.[109] 현재 인구에 사용하기 위해 임상-III상을 통과한 의료 개입은 없다.
영향을 미치는 요인
노년의 변화
신경생식증은 노령 동물의 해마에서 현저히 감소하고 있어 해마 기능의 노령 관련 감소와 연관될 가능성이 제기된다. 예를 들어, 노령 동물의 신경생성 비율은 기억력의 예측이다.[110] 그러나, 나이든 동물에서 새로 태어난 세포는 기능적으로 통합된다.[111] 신경생물이 일생에 걸쳐 발생한다는 점을 감안할 때, 해마는 성인기에 크기가 꾸준히 증가하여, 따라서 노령 동물에서 과립세포의 수가 증가할 것으로 예상할 수 있다. 그러나 증식이 세포사멸에 의해 균형을 이루고 있음을 나타내는 것은 그렇지 않다. 따라서 해마 기능과 연계된 것으로 보이는 것은 해마에 새로운 뉴런이 추가된 것이 아니라 과립세포의 회전율이다.[112]
운동의 효과
과학자들은 자발적인 운동 형태의 신체 활동이 쥐와 쥐의 해마에서 신생아 뉴런의 수를 증가시키는 결과를 가져온다는 것을 보여주었다.[113][114] 이것들과 다른 연구들은 두 종에서 배우는 것이 육체적인 운동에 의해 향상될 수 있다는 것을 보여주었다.[115] 최근 연구에 따르면 뇌에서 유래된 신경영양인자와 인슐린과 같은 성장인자 1이 운동유발 신경생물의 핵심 매개체라고 한다.[114][116] 운동은 NMDA 수용체의 NR2B 하위 단위뿐만 아니라 BDNF의 생산을 증가시킨다.[114] 운동은 혈류에서 해마를 포함한 다양한 뇌 영역으로 IGF-1의 흡수를 증가시킨다. 게다가, IGF-1은 해마에서 c-fos 표현을 바꾼다. IGF-1이 차단되면 운동은 더 이상 신경유전증을 유발하지 않는다.[116] 다른 연구에서는 기분전환 호르몬인 베타엔돌핀을 생성하지 않은 쥐를 운동시키는 것은 신경생식에 아무런 변화가 없다는 것을 증명했다. 그러나 운동과 함께 이 호르몬을 생산한 쥐들은 신생 세포의 증가와 생존율을 보였다.[117] 운동 매개 신경 유전자와 학습 강화 사이의 연관성은 여전히 불분명하지만, 이 연구는 노화 및/또는 알츠하이머 질환 분야에서 강한 시사점을 가질 수 있다.
카나비노이드의 영향
일부 연구는 카나비노이드의 자극이 배아줄기세포와 성체줄기세포 모두에서 해마의 새로운 신경세포의 성장을 초래한다는 것을 보여주었다. 2005년 서스캐처원 대학의 쥐를 대상으로 한 임상 연구는 해마의 신경 세포가 재생되는 것을 보여주었다.[118] 마리화나의 주요 정신 활성 성분인 THC와 유사한 합성 약물이 뇌 염증으로부터 어느 정도 보호를 제공한다는 연구 결과가 나왔다. 이는 새로운 뉴런의 생성에도 영향을 미칠 수 있는 시스템 내의 수용체 때문이다.[119] 그럼에도 불구하고, Rutgers University를 대상으로 한 연구는 쥐의 해마에서 행동 가능성의 동기화가 THC 투여 후 어떻게 변화되었는지를 보여주었다. 동기화 부족은 메모리 표준 테스트에서 성능 저하에 해당한다.[120] 최근 연구에 따르면 대마초 천연 캐나비노이드인 카나비디올(CBD)이 성인 신경생식을 증가시키면서도 학습에는 아무런 영향을 미치지 않는다고 한다. 그러나 THC는 학습을 손상시켰고 신경생성에는 아무런 영향을 미치지 않았다.[121] 대마초 사용자의 모발 분석에서 더 큰 CBD 대 THC 비율은 오른쪽 해마의 회백질 감소에 대한 보호와 관련이 있다.[122] CBD는 또한 현재 대마초의 영향을 받고 있는 사람들의 산문 리콜과 시각-공간 연상 기억의 결손을 약화시키는 것으로 관찰되어,[123][124] 심한 THC 노출에 대한 신경 보호 효과를 시사했다. 신경생물은 신경보호 효과에 역할을 할 수 있지만, 더 많은 연구가 필요하다.
몇몇 연구는 THC와 해마 신경생성 사이에 긍정적인 연관성이 있다고 보고했다.[125][126] 그들 중 일부는 biphasic 효과를 저평가하고,[125] 그들 중 일부는 부정적인 효과의 일부가 특정 기간 동안의 노출로 인한 노이로제에 기인할 수 있으며, 그것은 역전될 수 있다고 표현한다.[127]
규정
많은 요소들이 해마의 신경생성 속도에 영향을 미칠 수 있다. 운동과 풍요로운 환경은 뉴런의 생존을 촉진하고 신생아 세포를 기존 해마에 성공적으로 통합시키는 것으로 나타났다.[128][129][130][131] 뇌 허혈,[132] 간질 발작,[133] 세균성 뇌수막염 이후 신경 유전자가 발생하기 때문에 중추신경계 손상이 또 다른 요인이다.[134] 반면 만성 스트레스, 바이러스 감염, 노화 등의 질환은 뉴런 증식 감소로 이어질 수 있다.[135][136][137][138] 혈액 내 순환 인자는 신경생식을 감소시킬 수 있다. 건강한 노화인간에서는 특정 화학요소의 혈장과 뇌척수액이 상승한다. 마우스 모델에서 이러한 케모카인의 혈장 수준은 신경생성 감소와 상관관계가 있으며, 신경생성은 특정 전지구적 연령 의존적 전신 변화에 의해 변조될 수 있음을 시사한다. 이들 화학 물질에는 생쥐와 인간 염색체에 고도로 국부화된 CCL11, CCL2, CCL12 등이 포함되어 있어 노화에 유전적 위치를 포함하고 있다.[65] 또 다른 연구는 글리아에 의해 생산되는 사이토카인 IL-1베타를 포함한다. 그 연구는 IL-1을 차단하는 것이 바이러스 감염으로 인한 신경생물의 심각한 손상을 부분적으로 막을 수 있다는 것을 발견했다.[139]
후생유전적 조절은 신경생성에도 큰 역할을 한다. DNA 메틸화는 Dlx2, Neurog2, Sp8과 같은 신경 유전자의 조절을 통해 산후 신경생물에 대한 심실 부위의 성인 신경줄기세포의 운명 결정에 중요하다. miR-124와 miR-9와 같은 많은 마이크로RNA는 개발 중 피질 크기와 레이어링에 영향을 미치는 것으로 나타났다.[140]
역사
산티아고 라몬 이 카잘을 포함한 초기 신경원자학자들은 신경계가 고정되어 재생이 불가능하다고 생각했다. 대뇌피질에서 성인 포유류 신경생식에 대한 최초의 증거는 1962년 조셉 알트먼에 의해 제시되었고,[141] 1963년 해마의 움푹 들어간 회에서 성인 신경생식에 대한 시연이 이어졌다.[142] 1969년 조셉 알트먼은 후각구 안에 성체가 생성해 내는 과립세포 뉴런의 근원으로 이 회전철수를 발견하고 이름을 붙였다.[143] 1980년대까지 과학계는 초기 연구에서 세포 증식을 입증하는 가장 직접적인 방법, 즉 3H-시미딘 자동방사선촬영법을 사용했음에도 불구하고 이러한 발견을 무시했다. 그 무렵 셜리 바이얼[144][145](그리고 마이클 카플란)은 포유류(래트)에 성체 신경 유전자가 존재한다는 것을 다시 보여주었고, 노트봄은 조류에서도[146] 같은 현상을 보여 이 주제에 대한 새로운 관심을 불러일으켰다. 1990년대의[147][148] 연구는 마침내 성인의 신경생식에 대한 연구를 주류로 내세웠다. 또한 1990년대 초에는 비인간 영장류와 인간에게서 해마 신경 유전자가 입증되었다.[149][150] 더 최근에는 어른 토끼의 소뇌에 있는 신경생식도 특징으로 나타나고 있다.[151] 또한 일부 저자들(특히 엘리자베스 굴드)은 성인의 신경 유전자가 일반적으로 신피질을 포함한 신경 유전자와 관련이 없는 뇌 내의 영역에서도 발생할 수 있다고 제안했다.[152][153][154] 그러나, 다른 사람들은[155] 새로운 세포가 광택에서 유래했을 수도 있다고 주장하면서, 이러한 발견의 과학적 증거에 의문을 제기했다. 최근의 연구는 신경줄기세포에 대한 GABA의 규제 효과를 입증했다. GABA의 잘 알려진 뇌 억제 효과는 줄기세포가 휴면 상태가 되는 국소 회로에도 영향을 미친다. 그들은 디아제팜(발륨)이 비슷한 효과를 가지고 있다는 것을 발견했다.[156]
참고 항목
참조
- ^ Faiz M; Acarin L; Castellano B; Gonzalez B (2005). "Proliferation dynamics of germinative zone cells in the intact and excitotoxically lesioned postnatal rat brain". BMC Neuroscience. 6: 26. doi:10.1186/1471-2202-6-26. PMC 1087489. PMID 15826306.
- ^ Oomen CA; Girardi CE; Cahyadi R; et al. (2009). Baune, Bernhard (ed.). "Opposite effects of early maternal deprivation on neurogenesis in male versus female rats". PLOS ONE. 4 (1): e3675. Bibcode:2009PLoSO...4.3675O. doi:10.1371/journal.pone.0003675. PMC 2629844. PMID 19180242.
- ^ Ernst, A; Frisén, J (January 2015). "Adult neurogenesis in humans- common and unique traits in mammals". PLOS Biology. 13 (1): e1002045. doi:10.1371/journal.pbio.1002045. PMC 4306487. PMID 25621867.
- ^ a b Dayer, A.G.; Ford, A.A.; Cleaver, K.M.; Yassaee, M.; Cameron, H.A. (2003). "Short-term and long-term survival of new neurons in the rat dentate gyrus". The Journal of Comparative Neurology. 460 (4): 563–572. doi:10.1002/cne.10675. PMID 12717714. S2CID 7153599.
- ^ Vadodaria, Krishna C.; Gage, Fred H. (2014). "SnapShot: Adult Hippocampal Neurogenesis". Cell. 156 (5): 1114–1114.e1. doi:10.1016/j.cell.2014.02.029. PMID 24581504.
- ^ Fiorelli, Roberto; Azim, Kasum; Fischer, Bruno; Raineteau, Olivier (2015-06-15). "Adding a spatial dimension to postnatal ventricular-subventricular zone neurogenesis". Development. 142 (12): 2109–2120. doi:10.1242/dev.119966. ISSN 1477-9129. PMID 26081572.
- ^ Ernst A, Alkass K, Bernard S, Salehpour M, Perl S, Tisdale J, Possnert G, Druid H, Frisén J (2014). "Neurogenesis in the striatum of the adult human brain". Cell. 156 (5): 1072–83. doi:10.1016/j.cell.2014.01.044. PMID 24561062.
- ^ Bergmann, O.; Liebel, J.; Bernard, S.; Alkass, K.; Yeung, M.S.Y.; Steier, P.; Kutschera, W.; Johnson, L.; Landen, M.; Druid, H.; Spalding, K.L.; Frisen, J. (2012). "The age of olfactory bulb neurons in humans". Neuron. 74 (4): 634–639. doi:10.1016/j.neuron.2012.03.030. PMID 22632721.
- ^ Toni, N.; Teng, E.M.; Bushong, E.A.; Aimone, J.B.; Zhao, C.; Consiglio, A.; van Praag, H.; Martone, M.E.; Ellisman, M.H.; Gage, F.H. (2007). "Synapse formation on neurons born in the adult hippocampus". Nature Neuroscience. 10 (6): 727–734. doi:10.1038/nn1908. PMID 17486101. S2CID 6796849.
- ^ Vivar, C.; Potter, M.C.; Choi, J.; Lee, J.; Stringer, T.P.; Callawy, E.M.; Gage, F.H.; Suh, H.; van Praag, H. (2012). "Monosynaptic inputs to new neurons in the dentate gyrus". Nature Communications. 3 (1038): 1107. Bibcode:2012NatCo...3E1107V. doi:10.1038/ncomms2101. PMC 4603575. PMID 23033083.
- ^ Toni, N.; Laplagne, D.A.; Zhao, C.; Lombardi, G.; Ribak, C.E.; Gage, F.H.; Schinder, A.F. (2008). "Neurons born in the adult dentate gyrus form functional synapses with target cells". Nature Neuroscience. 11 (8): 901–907. doi:10.1038/nn.2156. PMC 2572641. PMID 18622400.
- ^ Spalding, Kirsty L.; Bergmann, Olaf; Alkass, Kanar; Bernard, Samuel; Salehpour, Mehran; Huttner, Hagen B.; Boström, Emil; Westerlund, Isabelle; Vial, Céline (2013-06-06). "Dynamics of hippocampal neurogenesis in adult humans". Cell. 153 (6): 1219–1227. doi:10.1016/j.cell.2013.05.002. ISSN 1097-4172. PMC 4394608. PMID 23746839.
- ^ Sorrells, SF; Paredes, MF; Cebrian-Silla, A; Sandoval, K; Qi, D; Kelley, KW; James, D; Mayer, S; Chang, J; Auguste, KI; Chang, EF; Gutierrez, AJ; Kriegstein, AR; Mathern, GW; Oldham, MC; Huang, EJ; Garcia-Verdugo, JM; Yang, Z; Alvarez-Buylla, A (15 March 2018). "Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults". Nature. 555 (7696): 377–381. Bibcode:2018Natur.555..377S. doi:10.1038/nature25975. PMC 6179355. PMID 29513649.
- ^ a b c d e f g h Cameron, Heather A.; Glover, Lucas R. (2015-01-03). "Adult Neurogenesis: Beyond Learning and Memory". Annual Review of Psychology. 66 (1): 53–81. doi:10.1146/annurev-psych-010814-015006. ISSN 0066-4308. PMC 5612417. PMID 25251485.
- ^ Farahani, Ramin M.; Rezaei‐Lotfi, Saba; Simonian, Mary; Xaymardan, Munira; Hunter, Neil (2019). "Neural microvascular pericytes contribute to human adult neurogenesis". Journal of Comparative Neurology. 527 (4): 780–796. doi:10.1002/cne.24565. ISSN 1096-9861. PMID 30471080. S2CID 53711787.
- ^ Carlson, B. M. (December 1975). "The effects of rotation and positional change of stump tissues upon morphogenesis of the regenerating axolotl limb". Developmental Biology. 47 (2): 269–291. doi:10.1016/0012-1606(75)90282-1. hdl:1874/15361. ISSN 0012-1606. PMID 1204936.
- ^ Kragl, Martin; Knapp, Dunja; Nacu, Eugen; Khattak, Shahryar; Maden, Malcolm; Epperlein, Hans Henning; Tanaka, Elly M. (2009-07-02). "Cells keep a memory of their tissue origin during axolotl limb regeneration". Nature. 460 (7251): 60–65. Bibcode:2009Natur.460...60K. doi:10.1038/nature08152. ISSN 1476-4687. PMID 19571878. S2CID 4316677.
- ^ Maden, Malcolm; Manwell, Laurie A.; Ormerod, Brandi K. (2013-01-17). "Proliferation zones in the axolotl brain and regeneration of the telencephalon". Neural Development. 8: 1. doi:10.1186/1749-8104-8-1. ISSN 1749-8104. PMC 3554517. PMID 23327114.
- ^ Clarke, J. D.; Alexander, R.; Holder, N. (1988-06-17). "Regeneration of descending axons in the spinal cord of the axolotl". Neuroscience Letters. 89 (1): 1–6. doi:10.1016/0304-3940(88)90471-5. ISSN 0304-3940. PMID 3399135. S2CID 23650500.
- ^ Amamoto, Ryoji; Huerta, Violeta Gisselle Lopez; Takahashi, Emi; Dai, Guangping; Grant, Aaron K; Fu, Zhanyan; Arlotta, Paola (2016). "Adult axolotls can regenerate original neuronal diversity in response to brain injury". eLife. 5. doi:10.7554/eLife.13998. ISSN 2050-084X. PMC 4861602. PMID 27156560.
- ^ Zupanc, G. K. H. (2006-06-01). "Neurogenesis and neuronal regeneration in the adult fish brain". Journal of Comparative Physiology A. 192 (6): 649–670. doi:10.1007/s00359-006-0104-y. ISSN 0340-7594. PMID 16463148. S2CID 24063389.
- ^ Schmidt, Rebecca; Strähle, Uwe; Scholpp, Steffen (2013-02-21). "Neurogenesis in zebrafish – from embryo to adult". Neural Development. 8: 3. doi:10.1186/1749-8104-8-3. ISSN 1749-8104. PMC 3598338. PMID 23433260.
- ^ Hentig, James T.; Byrd-Jacobs, Christine A. (2016-08-31). "Exposure to Zinc Sulfate Results in Differential Effects on Olfactory Sensory Neuron Subtypes in Adult Zebrafish". International Journal of Molecular Sciences. 17 (9): 1445. doi:10.3390/ijms17091445. ISSN 1422-0067. PMC 5037724. PMID 27589738.
- ^ Gorsuch, Ryne A.; Hyde, David R. (June 2014). "Regulation of Müller glial dependent neuronal regeneration in the damaged adult zebrafish retina". Experimental Eye Research. 123: 131–140. doi:10.1016/j.exer.2013.07.012. ISSN 1096-0007. PMC 3877724. PMID 23880528.
- ^ Kroehne, Volker; Freudenreich, Dorian; Hans, Stefan; Kaslin, Jan; Brand, Michael (November 2011). "Regeneration of the adult zebrafish brain from neurogenic radial glia-type progenitors". Development. 138 (22): 4831–4841. doi:10.1242/dev.072587. ISSN 1477-9129. PMID 22007133.
- ^ Fischer, Andy J. (March 2005). "Neural regeneration in the chick retina". Progress in Retinal and Eye Research. 24 (2): 161–182. doi:10.1016/j.preteyeres.2004.07.003. ISSN 1350-9462. PMID 15610972. S2CID 43652371.
- ^ Jones, Theresa A.; Schallert, Timothy (1992-05-22). "Overgrowth and pruning of dendrites in adult rats recovering from neocortical damage". Brain Research. 581 (1): 156–160. doi:10.1016/0006-8993(92)90356-E. PMID 1498666. S2CID 34248397.
- ^ Magnusson, Jens (2014-10-10). "A latent neurogenic program in astrocytes regulated by Notch signaling in the mouse". Science. 346 (6206): 237–241. doi:10.1126/science.346.6206.237. PMID 25301628.
- ^ Dorst, Matthijs (2021-08-17). "Astrocyte-derived neurons provide excitatory input to the adult striatal circuitry". Proceedings of the National Academy of Sciences. 118 (33). doi:10.1073/pnas.2104119118. PMC 8379996. PMID 34389674.
- ^ a b 월튼 NM, 신 R, 타지마 K, 후스너 CL, 코간 JH, 미야케 S, 천큐, 다무라 K, 마츠모토 M. 성인의 신경생성은 일시적으로 산화적 스트레스를 발생시킨다. PLoS One. 2012;7(4):e35264. doi: 10.1371/journal.pone.0035264. Epub 2012년 4월 30일. PMID 22558133; PMCID: PMC3340368
- ^ 디 코스모, A. D. 베르타펠레, C. 포셀리니, A. & 폴리스, G. (2018) 유동 세포측정법을 이용한 문어속 뇌에서 성인의 신경생성 규모 평가 생리학 분야 프런티어, 9. doi: 10.3389/fphys.2018.01050
- ^ 디 코스모, A, 폴리스, G. (2014) 몰루스크의 신경생태학 및 신경윤리학 - 행동과 환경 사이의 접점 A에서 "문어 속물 생식 행동에서 화학적 감각의 역할: 신경생태학을 만난다. Di Cosmo와 W. Winlow (뉴욕, NY: NYVA Science Publisher), 117–132.
- ^ Polese G, Bertapelle C, Di Cosmo A (January 2015). "Role of olfaction in Octopus vulgaris reproduction". Gen. Comp. Endocrinol. 210: 55–62. doi:10.1016/j.ygcen.2014.10.006. PMID 25449183.
- ^ Amrein I, Lipp HP (February 2009). "Adult hippocampal neurogenesis of mammals: evolution and life history". Biol. Lett. 5 (1): 141–144. doi:10.1098/rsbl.2008.0511. PMC 2657751. PMID 18957357.
- ^ Amrein I, Isler K, Lipp HP (September 2011). "Comparing adult hippocampal neurogenesis in mammalian species and orders: influence of chronological age and life history stage" (PDF). Eur. J. Neurosci. 34 (6): 978–87. doi:10.1111/j.1460-9568.2011.07804.x. PMID 21929629. S2CID 36231667.
- ^ 해마
- ^ a b c d Barnea, A.; Nottebohm, F. (1994-11-08). "Seasonal recruitment of hippocampal neurons in adult free-ranging black-capped chickadees". Proceedings of the National Academy of Sciences. 91 (23): 11217–11221. Bibcode:1994PNAS...9111217B. doi:10.1073/pnas.91.23.11217. ISSN 0027-8424. PMC 45198. PMID 7972037.
- ^ a b c Hoshooley, Jennifer S.; Sherry, David F. (March 2007). "Greater hippocampal neuronal recruitment in food-storing than in non-food-storing birds". Developmental Neurobiology. 67 (4): 406–414. doi:10.1002/dneu.20316. ISSN 1932-8451. PMID 17443797. S2CID 15930160.
- ^ Hampton, Robert R.; Shettleworth, Sara J. (1996). "Hippocampal lesions impair memory for location but not color in passerine birds". Behavioral Neuroscience. 110 (4): 831–835. doi:10.1037/0735-7044.110.4.831. ISSN 1939-0084. PMID 8864273.
- ^ Hall, Zachary J.; Delaney, Shauna; Sherry, David F. (2014-04-28). "Inhibition of cell proliferation in black-capped chickadees suggests a role for neurogenesis in spatial learning". Developmental Neurobiology. 74 (10): 1002–1010. doi:10.1002/dneu.22180. ISSN 1932-8451. PMID 24723376. S2CID 17537082.
- ^ Doetsch, Fiona (2003-10-28). "The glial identity of neural stem cells". Nature Neuroscience. 6 (11): 1127–1134. doi:10.1038/nn1144. ISSN 1097-6256. PMID 14583753. S2CID 16088822.
- ^ a b Sherry, David F.; Hoshooley, Jennifer S. (2010-03-27). "Seasonal hippocampal plasticity in food-storing birds". Philosophical Transactions of the Royal Society B: Biological Sciences. 365 (1542): 933–943. doi:10.1098/rstb.2009.0220. ISSN 0962-8436. PMC 2830249. PMID 20156817.
- ^ Kirn, John R.; Fishman, Yon; Sasportas, Kari; Alvarez-Buylla, Arturo; Nottebohm, Fernando (1999-08-30). <487::aid-cne10>3.0.co;2-m "Fate of new neurons in adult canary high vocal center during the first 30 days after their formation". The Journal of Comparative Neurology. 411 (3): 487–494. doi:10.1002/(sici)1096-9861(19990830)411:3<487::aid-cne10>3.0.co;2-m. ISSN 0021-9967. PMID 10413781.
- ^ a b Tarr, Bernard A.; Rabinowitz, Jeremy S.; Imtiaz, Mubdiul Ali; DeVoogd, Timothy J. (December 2009). "Captivity reduces hippocampal volume but not survival of new cells in a food-storing bird". Developmental Neurobiology. 69 (14): 972–981. doi:10.1002/dneu.20736. ISSN 1932-8451. PMC 4597778. PMID 19813245.
- ^ Aimone J. B.; Li Y.; Lee S. W.; Clemenson G. D.; Deng W.; Gage F. H. (2014). "Regulation and Function of Adult Neurogenesis: From Genes to Cognition". Physiological Reviews. 94 (4): 991–1026. doi:10.1152/physrev.00004.2014. PMC 4280160. PMID 25287858.
- ^ a b Ming Guo-Li, Song Hongjun (2011). "Adult Neurogenesis in the Mammalian Brain: Significant Answers and Significant Questions". Neuron. 70 (4): 687–702. doi:10.1016/j.neuron.2011.05.001. PMC 3106107. PMID 21609825.
- ^ Altman J (1962). "Are new neurons formed in the brains of adult mammals?". Science. 135 (3509): 1127–1128. Bibcode:1962Sci...135.1127A. doi:10.1126/science.135.3509.1127. PMID 13860748. S2CID 1606140.
- ^ Kuhn HG, Cooper-Kuhn CM (2007). "Bromodeoxyuridine and the detection of neurogenesis". Curr Pharmaceutical Biotechnol. 8 (3): 127–131. doi:10.2174/138920107780906531. PMID 17584085.
- ^ Imayoshi I, Sakamoto M, Ohtsuka T, Takao K, Miyakawa T, Yamaguchi M, Mori K, Ikeda T, Itohara S, Kageyama R (2008). "Roles of continuous neurogenesis in the structural and functional integrity of the adult forebrain". Nat Neurosci. 11 (10): 1153–1161. doi:10.1038/nn.2185. PMID 18758458. S2CID 11627647.
- ^ Prendergast, Franklyn G.; Mann, Kenneth G. (1978-08-22). "Chemical and physical properties of aequorin and the green fluorescent protein isolated from Aequorea forskalea". Biochemistry. 17 (17): 3448–3453. doi:10.1021/bi00610a004. ISSN 0006-2960. PMID 28749.
- ^ Gonçalves, J. Tiago; Schafer, Simon T.; Gage, Fred H. (2016). "Adult Neurogenesis in the Hippocampus: From Stem Cells to Behavior". Cell. 167 (4): 897–914. doi:10.1016/j.cell.2016.10.021. PMID 27814520.
- ^ Zhao C, Teng EM, Summers RG Jr, Ming GL, Gage FH (2006). "Distinct morphological stages of dentate granule neuron maturation in the adult mouse hippocampus". J Neurosci. 26 (1): 3–11. doi:10.1523/jneurosci.3648-05.2006. PMC 6674324. PMID 16399667.
- ^ Shors, Tracey J.; Miesegaes, George; Beylin, Anna; Zhao, Mingrui; Rydel, Tracy; Gould, Elizabeth (2001). "Neurogenesis in the adult is involved in the formation of trace memories". Nature. 410 (6826): 372–376. Bibcode:2001Natur.410..372S. doi:10.1038/35066584. PMID 11268214. S2CID 4430850.
- ^ Denny, Christine A.; Burghardt, Nesha S.; Schachter, Daniel M.; Hen, René; Drew, Michael R. (2012-05-01). "4- to 6-week-old adult-born hippocampal neurons influence novelty-evoked exploration and contextual fear conditioning". Hippocampus. 22 (5): 1188–1201. doi:10.1002/hipo.20964. ISSN 1098-1063. PMC 3193906. PMID 21739523.
- ^ Plack, C. J.; Oxenham, A. J.; Drga, V. (2006). "The Journal of Neurosci". The Journal of Neuroscience. 26 (34): 8767–8773. doi:10.1523/JNEUROSCI.1134-06.2006. PMC 1808348. PMID 16928865.
- ^ Drew, Michael R.; Denny, Christine A.; Hen, Rene (2010). "Arrest of adult hippocampal neurogenesis in mice impairs single- but not multiple-trial contextual fear conditioning". Behavioral Neuroscience. 124 (4): 446–454. doi:10.1037/a0020081. PMC 2925248. PMID 20695644.
- ^ Kesner, Raymond P. (2013-10-01). "An analysis of the dentate gyrus function". Behavioural Brain Research. SI:Medial Temporal Lobe Memory Networks. 254: 1–7. doi:10.1016/j.bbr.2013.01.012. PMID 23348108. S2CID 5486456.
- ^ França, Thiago F.A.; Bitencourt, Alexandre M.; Maximilla, Naiana R.; Barros, Daniela M.; Monserrat, Jose M. (2017-07-20). "Hippocampal neurogenesis and pattern separation: a meta-analysis of behavioral data". Hippocampus. 9. 27 (9): 937–950. doi:10.1002/hipo.22746. PMID 28597491. S2CID 205914396.
- ^ Sahay, Amar; Scobie, Kimberly N.; Hill, Alexis S.; O'Carroll, Colin M.; Kheirbek, Mazen A.; Burghardt, Nesha S.; Fenton, André A.; Dranovsky, Alex; Hen, René (2011). "Increasing adult hippocampal neurogenesis is sufficient to improve pattern separation". Nature. 472 (7344): 466–470. Bibcode:2011Natur.472..466S. doi:10.1038/nature09817. PMC 3084370. PMID 21460835.
- ^ Clelland, C. D.; Choi, M.; Romberg, C.; Clemenson, G. D.; Fragniere, A.; Tyers, P.; Jessberger, S.; Saksida, L. M.; Barker, R. A. (2009-07-10). "A functional role for adult hippocampal neurogenesis in spatial pattern separation". Science. 325 (5937): 210–213. Bibcode:2009Sci...325..210C. doi:10.1126/science.1173215. ISSN 1095-9203. PMC 2997634. PMID 19590004.
- ^ França, Thiago F.A.; Bitencourt, Alexandre M.; Maximilla, Naiana R.; Barros, Daniela M.; Monserrat, Jose M. (2017-07-20). "Hippocampal neurogenesis and pattern separation: a meta-analysis of behavioral data". Hippocampus. 9. 27 (9): 937–950. doi:10.1002/hipo.22746. PMID 28597491. S2CID 205914396.
- ^ Kheirbek, Mazen A.; Drew, Liam J.; Burghardt, Nesha S.; Costantini, Daniel O.; Tannenholz, Lindsay; Ahmari, Susanne E.; Zeng, Hongkui; Fenton, André A.; Hen, René (2013-03-06). "Differential control of learning and anxiety along the dorsoventral axis of the dentate gyrus". Neuron. 77 (5): 955–968. doi:10.1016/j.neuron.2012.12.038. ISSN 1097-4199. PMC 3595120. PMID 23473324.
- ^ Gould E, Cameron HA (1997). "Early NMDA receptor blockade impairs defensive behavior and increases cell proliferation in the dentate gyrus of developing rats". Behav. Neurosci. 111 (1): 49–56. doi:10.1037/0735-7044.111.1.49. PMID 9109623.
- ^ Kempermann G, Wiskott L, Gage FH (April 2004). "Functional significance of adult neurogenesis". Current Opinion in Neurobiology. 14 (2): 186–91. doi:10.1016/j.conb.2004.03.001. PMID 15082323. S2CID 6241827.
- ^ a b G. Neves, G; S.F. Cooke; T.V. Bliss (2008). "Synaptic plasticity, memory and the hippocampus: A neural network approach to causality". Nature Reviews Neuroscience. 9 (1): 65–75. doi:10.1038/nrn2303. PMID 18094707. S2CID 33104731.
- ^ Becker S (2005). "A computational principle for hippocampal learning and neurogenesis". Hippocampus. 15 (6): 722–38. doi:10.1002/hipo.20095. PMID 15986407. S2CID 1316469.
- ^ Wiskott L, Rasch MJ, Kempermann G (2006). "A functional hypothesis for adult hippocampal neurogenesis: avoidance of catastrophic interference in the dentate gyrus". Hippocampus. 16 (3): 329–43. CiteSeerX 10.1.1.408.8944. doi:10.1002/hipo.20167. PMID 16435309. S2CID 788860.
- ^ Aimone JB, Wiles J, Gage FH (June 2006). "Potential role for adult neurogenesis in the encoding of time in new memories". Nat. Neurosci. 9 (6): 723–7. doi:10.1038/nn1707. PMID 16732202. S2CID 10586519.
- ^ Kovács KA (September 2020). "Episodic Memories: How do the Hippocampus and the Entorhinal Ring Attractors Cooperate to Create Them?". Frontiers in Systems Neuroscience. 14: 68. doi:10.3389/fnsys.2020.559186. PMC 7511719. PMID 33013334.
- ^ Shors TJ, Townsend DA, Zhao M, Kozorovitskiy Y, Gould E (2002). "Neurogenesis may relate to some but not all types of hippocampal-dependent learning". Hippocampus. 12 (5): 578–84. doi:10.1002/hipo.10103. PMC 3289536. PMID 12440573.
- ^ Meshi D, Drew MR, Saxe M, et al. (June 2006). "Hippocampal neurogenesis is not required for behavioral effects of environmental enrichment". Nat. Neurosci. 9 (6): 729–31. doi:10.1038/nn1696. PMID 16648847. S2CID 11043203.
- ^ Gould, E.; Beylin, A.; Tanapat, P.; Reeves, A.; Shors, T. J. (1999). "Learning enhances adult neurogenesis in the hippocampal formation". Nature Neuroscience. 2 (3): 260–265. doi:10.1038/6365. PMID 10195219. S2CID 12112156.
- ^ Donovan, M. H.; Yazdani, U; Norris, R. D.; Games, D; German, D. C.; Eisch, A. J. (2006). "Decreased adult hippocampal neurogenesis in the PDAPP mouse model of Alzheimer's disease". The Journal of Comparative Neurology. 495 (1): 70–83. doi:10.1002/cne.20840. PMID 16432899. S2CID 20559097.
- ^ Jin, K; Peel, A. L.; Mao, X. O.; Xie, L; Cottrell, B. A.; Henshall, D. C.; Greenberg, D. A. (2004). "Increased hippocampal neurogenesis in Alzheimer's disease". Proceedings of the National Academy of Sciences. 101 (1): 343–7. Bibcode:2004PNAS..101..343J. doi:10.1073/pnas.2634794100. PMC 314187. PMID 14660786.
- ^ Foster, P. P.; Rosenblatt, K. P.; Kuljiš, R. O. (2011). "Exercise-induced cognitive plasticity, implications for mild cognitive impairment and Alzheimer's disease". Frontiers in Neurology. 2: 28. doi:10.3389/fneur.2011.00028. PMC 3092070. PMID 21602910.
- ^ Marx CE, Trost WT, Shampine LJ, et al. (December 2006). "The neurosteroid allopregnanolone is reduced in prefrontal cortex in Alzheimer's disease". Biol. Psychiatry. 60 (12): 1287–94. doi:10.1016/j.biopsych.2006.06.017. PMID 16997284. S2CID 27813000.
- ^ Wang JM, Singh C, Liu L, Irwin RW, Chen S, Chung EJ, Thompson RF, Brinton RD (2010). "Allopregnanolone reverses neuron and cognitive deficits in a mouse model of Alzheimer's disease". Proc. Natl. Acad. Sci. U.S.A. 107 (14): 6498–6503. Bibcode:2010PNAS..107.6498W. doi:10.1073/pnas.1001422107. PMC 2851948. PMID 20231471.
- ^ Cissé, M; Checler, F (2014). "Eph receptors: New players in Alzheimer's disease pathogenesis". Neurobiology of Disease. 73C: 137–149. doi:10.1016/j.nbd.2014.08.028. PMID 25193466. S2CID 28922292.
- ^ Mu, Y; Gage, F. H. (2011). "Adult hippocampal neurogenesis and its role in Alzheimer's disease". Molecular Neurodegeneration. 6: 85. doi:10.1186/1750-1326-6-85. PMC 3261815. PMID 22192775.
- ^ LeStrat, Y (May 2009). "The role of genes involved in neuroplasticity and neurogenesis in the observation of a gene-environment interaction (GxE) in schizophrenia". Current Molecular Medicine. 9 (4): 506–18. doi:10.2174/156652409788167104. PMID 19519407.
- ^ Schreiber, Rudy; Newman-Tancredi, Adrian (April 2014). "Improving cognition in schizophrenia with antipsychotics that elicit neurogenesis through 5-HT1A receptor activation". Neurobiology of Learning and Memory. 110: 72–80. doi:10.1016/j.nlm.2013.12.015. PMID 24423786. S2CID 28027825.
- ^ Reif, Andreas; Schmitt, Angelika; Fritzen, Sabrina; Lesch, Klaus-Peter (27 Apr 2007). "Neurogenesis and schizophrenia: dividing neurons in a divided mind?". European Archives of Psychiatry and Clinical Neuroscience. 257 (5): 290–299. doi:10.1007/s00406-007-0733-3. PMID 17468935. S2CID 28750292.
- ^ Numakawa, Tadahiro; Odaka, Haruki; Adachi, Naoki (2017). "Impact of glucocorticoid on neurogenesis". Neural Regeneration Research. 12 (7): 1028–1035. doi:10.4103/1673-5374.211174. PMC 5558474. PMID 28852377.
- ^ a b c Jacobs, B. L.; H. van Praag; F. H. Gage (2000). "Depression and the Birth and Death of Brain Cells". American Scientist. 88 (4): 340. Bibcode:2000AmSci..88..340J. doi:10.1511/2000.4.340.
- ^ Kandel, E. R.; J. H. Schwartz & T. M. Jessell (2012-10-26). Principles of Neural Science (fifth ed.). ISBN 978-0071390118.
- ^ National Institute of Mental Health (2010). "Mental Health Medications" (PDF).
- ^ Davies-Sala, M. G.; Espósito, M. S.; Piatti, V. C.; Mongiat, L. A.; Trinchero M. F. & Schinder A. F. (25 May 2011). "The Timing for Neuronal Maturation in the Adult Hippocampus Is Modulated by Local Network Activity". The Journal of Neuroscience. 31 (21): 7715–28. doi:10.1523/JNEUROSCI.1380-11.2011. PMC 3701257. PMID 21613484.
- ^ Perera TD, Dwork AJ, Keegan KA, Thirumangalakudi L, Lipira CM, Joyce N, Lange C, Higley JD, Rosoklija G, Hen R, Sackeim HA, Coplan JD (2011). "Necessity of hippocampal neurogenesis for the therapeutic action of antidepressants in adult nonhuman primates". PLOS ONE. 6 (4): e17600. Bibcode:2011PLoSO...617600P. doi:10.1371/journal.pone.0017600. PMC 3078107. PMID 21525974.
- ^ a b Schloesser RJ, Manji HK, Martinowich K (April 2009). "Suppression of adult neurogenesis leads to an increased hypothalamo-pituitary-adrenal axis response". NeuroReport. 20 (6): 553–7. doi:10.1097/WNR.0b013e3283293e59. PMC 2693911. PMID 19322118.
- ^ a b Surget A, Tanti A, Leonardo ED, et al. (December 2011). "Antidepressants recruit new neurons to improve stress response regulation". Molecular Psychiatry. 16 (12): 1177–88. doi:10.1038/mp.2011.48. PMC 3223314. PMID 21537331.
- ^ Malberg JE, Eisch AJ, Nestler EJ, Duman RS (December 2000). "Chronic antidepressant treatment increases neurogenesis in adult rat hippocampus". J. Neurosci. 20 (24): 9104–10. doi:10.1523/JNEUROSCI.20-24-09104.2000. PMC 6773038. PMID 11124987.
- ^ Manev H, Uz T, Smalheiser NR, Manev R (January 2001). "Antidepressants alter cell proliferation in the adult brain in vivo and in neural cultures in vitro". Eur J Pharmacol. 411 (1–2): 67–70. doi:10.1016/S0014-2999(00)00904-3. PMID 11137860.
- ^ Santarelli L, Saxe M, Gross C, et al. (August 2003). "Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants". Science. 301 (5634): 805–9. Bibcode:2003Sci...301..805S. doi:10.1126/science.1083328. PMID 12907793. S2CID 9699898.
- ^ Bradley, Joseph (2015). Addiction: From Suffering to Solution. Las Vegas, NV: Breaux Press International. p. 173. ISBN 978-0-9854418-0-7.
- ^ Castrén E (March 2005). "Is mood chemistry?". Nature Reviews Neuroscience. 6 (3): 241–6. doi:10.1038/nrn1629. PMID 15738959. S2CID 34523310.
- ^ Vetencourt, J. F. M.; Sale, A.; Viegi, A.; Baroncelli, L.; De Pasquale, R.; f. o'Leary, O.; Castren, E.; Maffei, L. (2008). "The Antidepressant Fluoxetine Restores Plasticity in the Adult Visual Cortex". Science. 320 (5874): 385–8. Bibcode:2008Sci...320..385M. doi:10.1126/science.1150516. PMID 18420937. S2CID 39565465.
- ^ Mirescu C, Peters JD, Noiman L, Gould E (December 2006). "Sleep deprivation inhibits adult neurogenesis in the hippocampus by elevating glucocorticoids". Proc. Natl. Acad. Sci. U.S.A. 103 (50): 19170–5. Bibcode:2006PNAS..10319170M. doi:10.1073/pnas.0608644103. PMC 1748194. PMID 17135354.
- ^ Mirescu C.; Peters J. D.; Noiman L.; Gould E. (2006). "Sleep deprivation inhibits adult neurogenesis in the hippocampus by elevating glucocorticoids". Proceedings of the National Academy of Sciences. 103 (50): 19170–19175. Bibcode:2006PNAS..10319170M. doi:10.1073/pnas.0608644103. PMC 1748194. PMID 17135354.
- ^ a b c Arias-Carrión O, Freundlieb N, Oertel WH, Höglinger GU (October 2007). "Adult neurogenesis and Parkinson's disease". CNS Neurol Disord Drug Targets. 6 (5): 326–35. doi:10.2174/187152707783220875. PMID 18045161. Archived from the original on 2013-04-14.
- ^ Fallon J, Reid S, Kinyamu R, et al. (December 2000). "In vivo induction of massive proliferation, directed migration, and differentiation of neural cells in the adult mammalian brain". Proc. Natl. Acad. Sci. U.S.A. 97 (26): 14686–91. Bibcode:2000PNAS...9714686F. doi:10.1073/pnas.97.26.14686. PMC 18979. PMID 11121069.
- ^ Arias-Carrión O, Verdugo-Díaz L, Feria-Velasco A, et al. (October 2004). "Neurogenesis in the subventricular zone following transcranial magnetic field stimulation and nigrostriatal lesions". J Neurosci Res. 78 (1): 16–28. doi:10.1002/jnr.20235. PMID 15372495. S2CID 6349942.
- ^ Arias-Carrión O, Hernández-López S, Ibañez-Sandoval O, Bargas J, Hernández-Cruz A, Drucker-Colín R (November 2006). "Neuronal precursors within the adult rat subventricular zone differentiate into dopaminergic neurons after substantia nigra lesion and chromaffin cell transplant". J Neurosci Res. 84 (7): 1425–37. doi:10.1002/jnr.21068. PMID 17006899. S2CID 21995251.
- ^ a b Höglinger GU, Rizk P, Muriel MP, et al. (July 2004). "Dopamine depletion impairs precursor cell proliferation in Parkinson disease". Nat. Neurosci. 7 (7): 726–35. doi:10.1038/nn1265. PMID 15195095. S2CID 952173.
- ^ 성인 인간 두뇌의 선조체 내 신경생성
- ^ Guo, Qingmin; Sayeed, Iqbal; Baronne, Lon M.; Hoffman, Stuart W.; Guennoun, Rachida; Stein, Donald G. (April 2006). "Progesterone administration modulates AQP4 expression and edema after traumatic brain injury in male rats". Experimental Neurology. 198 (2): 469–478. doi:10.1016/j.expneurol.2005.12.013. ISSN 0014-4886. PMID 16445913. S2CID 26143265.
- ^ Petrone, Ashley B.; Gatson, Joshua W.; Simpkins, James W.; Reed, Miranda N. (2014-05-25). "Non-feminizing estrogens: a novel neuroprotective therapy". Molecular and Cellular Endocrinology. 389 (1–2): 40–47. doi:10.1016/j.mce.2013.12.017. ISSN 1872-8057. PMC 4040321. PMID 24424441.
- ^ Han, S.; Zhao, B.; Pan, X.; Song, Z.; Liu, J.; Gong, Y.; Wang, M. (2015-12-03). "Estrogen receptor variant ER-α36 is involved in estrogen neuroprotection against oxidative toxicity". Neuroscience. 310: 224–241. doi:10.1016/j.neuroscience.2015.09.024. ISSN 1873-7544. PMID 26383254. S2CID 44289364.
- ^ Singh, Surjit; Hota, Debasish; Prakash, Ajay; Khanduja, Krishan L.; Arora, Sunil K.; Chakrabarti, Amitava (January 2010). "Allopregnanolone, the active metabolite of progesterone protects against neuronal damage in picrotoxin-induced seizure model in mice". Pharmacology Biochemistry and Behavior. 94 (3): 416–422. doi:10.1016/j.pbb.2009.10.003. ISSN 1873-5177. PMID 19840816. S2CID 45591868.
- ^ Webster, Mark K.; Cooley-Themm, Cynthia A.; Barnett, Joseph D.; Bach, Harrison B.; Vainner, Jessica M.; Webster, Sarah E.; Linn, Cindy L. (2017-03-27). "Evidence of BrdU-positive retinal neurons after application of an Alpha7 nicotinic acetylcholine receptor agonist". Neuroscience. 346: 437–446. doi:10.1016/j.neuroscience.2017.01.029. ISSN 1873-7544. PMC 5341387. PMID 28147247.
- ^ Drapeau, E.; Mayo, W.; Aurousseau, C.; Moal, M.L.; Piazza, P. & Abrous, D.N. (2003). "Spatial memory performances of aged rats in the water maze predict levels of hippocampal neurogenesis". PNAS. 100 (24): 14385–14390. Bibcode:2003PNAS..10014385D. doi:10.1073/pnas.2334169100. PMC 283601. PMID 14614143.
- ^ Marrone, D.F.; Ramirez-Amaya, V. & Barnes, C.A. (2012). "Neurons generated in senescence maintain capacity for functional integration". Hippocampus. 22 (5): 1134–1142. doi:10.1002/hipo.20959. PMC 3367380. PMID 21695743.
- ^ von Bohlen und Halbach O (2010). "Involvement of BDNF in age-dependent alterations in the hippocampus". Front Aging Neurosci. 2. doi:10.3389/fnagi.2010.00036. PMC 2952461. PMID 20941325.
- ^ Praag H, Christie BR, Sejnowski TJ, Gage FH (1999). "Running enhances neurogenesis, learning, and long-term potentiation in mice". Proc Natl Acad Sci U S A. 96 (23): 13427–31. Bibcode:1999PNAS...9613427V. doi:10.1073/pnas.96.23.13427. PMC 23964. PMID 10557337.
- ^ a b c Farmer J, Zhao X, van Praag H, Wodtke K, Gage FH, Christie BR (2004). "Effects of voluntary exercise on synaptic plasticity and gene expression in the dentate gyrus of adult male Sprague-Dawley rats in vivo". Neuroscience. 124 (1): 71–9. doi:10.1016/j.neuroscience.2003.09.029. PMID 14960340. S2CID 2718669.
- ^ van Praag H; Christie BR; Sejnowski TJ; Gage FH (Nov 1999). "Running enhances neurogenesis, learning, and long-term potentiation in mice". Proc Natl Acad Sci U S A. 96 (23): 13427–31. Bibcode:1999PNAS...9613427V. doi:10.1073/pnas.96.23.13427. PMC 23964. PMID 10557337.
- ^ a b Carro, E; Trejo, J. L.; Busiguina, S; Torres-Aleman, I (2001). "Circulating insulin-like growth factor I mediates the protective effects of physical exercise against brain insults of different etiology and anatomy". The Journal of Neuroscience. 21 (15): 5678–84. doi:10.1523/JNEUROSCI.21-15-05678.2001. PMC 6762673. PMID 11466439.
- ^ "Adult neurogenesis". Brain Briefings. Society for Neuroscience. June 2007. Retrieved 2011-11-26.
- ^ Wen Jiang; Yun Zhang; Lan Xiao; Jamie Van Cleemput; Shao-Ping Ji; Guang Bai; Xia Zhang (2005-11-01). "Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects". Journal of Clinical Investigation. 115 (11): 3104–16. doi:10.1172/JCI25509. PMC 1253627. PMID 16224541.
- ^ 11-19-2008년 오하이오 주 연구: 과학자들은 마리화나가 기억력 장애를 감소시킨다는 생각을 가지고 있다. OSU.edu
- ^ 2006년 11월 29일. 연구: 마리화나는 뉴런 발화에 영향을 미칠 수 있다. 유나이티드 프레스 인터내셔널
- ^ Wolf, Susanne A.; Bick-Sander, Anika; Fabel, Klaus; Leal-Galicia, Perla; Tauber, Svantje; Ramirez-Rodriguez, Gerardo; Müller, Anke; Melnik, Andre; Waltinger, Tim P.; Ullrich, Oliver; Kempermann, Gerd (2010). "Cannabinoid receptor CB1 mediates baseline and activity-induced survival of new neurons in adult hippocampal neurogenesis". Cell Communication and Signaling. 8 (1): 12. doi:10.1186/1478-811X-8-12. PMC 2898685. PMID 20565726.
- ^ Demirakca, T.; Sartorius, A.; Ende, G.; Meyer, N.; Welzel, H.; Skopp, G.; Mann, K.; Hermann, D. (2010). "Diminished gray matter in the hippocampus of cannabis users: Possible protective effects of cannabidiol". Drug and Alcohol Dependence. 114 (2–3): 242–245. doi:10.1016/j.drugalcdep.2010.09.020. PMID 21050680.
- ^ Wright, M. J.; Vandewater, S. A.; Taffe, M. A. (2013). "Cannabidiol attenuates deficits of visuospatial associative memory induced by Δ9tetrahydrocannabinol". British Journal of Pharmacology. 170 (7): 1365–1373. doi:10.1111/bph.12199. PMC 3838683. PMID 23550724.
- ^ Morgan, C. J. A.; Schafer, G.; Freeman, T. P.; Curran, H. V. (2010). "Impact of cannabidiol on the acute memory and psychotomimetic effects of smoked cannabis: Naturalistic study". The British Journal of Psychiatry. 197 (4): 285–290. doi:10.1192/bjp.bp.110.077503. PMID 20884951.
- ^ a b Calabrese, Edward J.; Rubio-Casillas, Alberto (May 2018). "Biphasic effects of THC in memory and cognition". European Journal of Clinical Investigation. 48 (5): e12920. doi:10.1111/eci.12920. PMID 29574698.
- ^ Suliman, Noor Azuin; Taib, Che Norma Mat; Moklas, Mohamad Aris Mohd; Basir, Rusliza (21 September 2017). "Delta-9-Tetrahydrocannabinol (∆9-THC) Induce Neurogenesis and Improve Cognitive Performances of Male Sprague Dawley Rats". Neurotoxicity Research. 33 (2): 402–411. doi:10.1007/s12640-017-9806-x. PMC 5766723. PMID 28933048.
- ^ Cuccurazzu, Bruna; Zamberletti, Erica; Nazzaro, Cristiano; Prini, Pamela; Trusel, Massimo; Grilli, Mariagrazia; Parolaro, Daniela; Tonini, Raffaella; Rubino, Tiziana (November 2018). "Adult Cellular Neuroadaptations Induced by Adolescent THC Exposure in Female Rats Are Rescued by Enhancing Anandamide Signaling". International Journal of Neuropsychopharmacology. 21 (11): 1014–1024. doi:10.1093/ijnp/pyy057. PMC 6209859. PMID 29982505.
- ^ Lazarov O, Robinson J, Tang YP, Hairston IS, Korade-Mirnics Z, Lee VM, Hersh LB, Sapolsky RM, Mirnics K, Sisodia SS (March 2005). "Environmental enrichment reduces Abeta levels and amyloid deposition in transgenic mice". Cell. 120 (5): 701–13. doi:10.1016/j.cell.2005.01.015. PMID 15766532. S2CID 16756661.
- ^ Van Praag, H.; Shubert, T.; Zhao, C.; Gage, F. (2005). "Exercise enhances learning and hippocampal neurogenesis in aged mice". Journal of Neuroscience. 25 (38): 8680–8685. doi:10.1523/JNEUROSCI.1731-05.2005. PMC 1360197. PMID 16177036.
- ^ Van Praag, H.; Kempermann, G.; Gage, F. (1999). "Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus". Nature Neuroscience. 2 (3): 266–270. doi:10.1038/6368. PMID 10195220. S2CID 7170664.
- ^ Bjørnebekk A, Mathé AA, Brené S (September 2005). "The antidepressant effect of running is associated with increased hippocampal cell proliferation". Int J Neuropsychopharmacol. 8 (3): 357–68. doi:10.1017/S1461145705005122. PMID 15769301.
- ^ Jin K, Wang X, Xie L, et al. (August 2006). "Evidence for stroke-induced neurogenesis in the human brain". Proc. Natl. Acad. Sci. U.S.A. 103 (35): 13198–202. Bibcode:2006PNAS..10313198J. doi:10.1073/pnas.0603512103. PMC 1559776. PMID 16924107.
- ^ Parent JM; Elliott, RC; Pleasure, SJ; Barbaro, NM; Lowenstein, DH (2006). "Aberrant seizure-induced neurogenesis in experimental temporal lobe epilepsy". Annals of Neurology. 59 (1): 81–91. doi:10.1002/ana.20699. hdl:2027.42/49280. PMID 16261566. S2CID 9655613.
- ^ Gerber J, Tauber SC, Armbrecht I, Schmidt H, Brück W, Nau R (2009). "Increased neuronal proliferation in human bacterial meningitis". Neurology. 73 (13): 1026–32. doi:10.1212/WNL.0b013e3181b9c892. PMID 19786694. S2CID 26108905.
- ^ Sharma A, Valadi N, Miller AH, Pearce BD (2002). "Adult neurogenesis in the hippocampus is impaired following neonatal viral infection". Neurobiology of Disease. 11 (2): 246–56. doi:10.1006/nbdi.2002.0531. PMID 12505418. S2CID 6405590.
- ^ Lee AL, Ogle WO, Sapolsky RM (April 2002). "Stress and depression: possible links to neuron death in the hippocampus". Bipolar Disord. 4 (2): 117–28. doi:10.1034/j.1399-5618.2002.01144.x. PMID 12071509.
- ^ Sheline YI, Gado MH, Kraemer HC (August 2003). "Untreated depression and hippocampal volume loss". Am J Psychiatry. 160 (8): 1516–8. doi:10.1176/appi.ajp.160.8.1516. PMID 12900317.
- ^ Jiang, W.; et al. (2005). "Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects". The Journal of Clinical Investigation. 115 (11): 3104–3116. doi:10.1172/JCI25509. PMC 1253627. PMID 16224541.
- ^ Orr, Anna G.; Sharma, Anup; Binder, Nikolaus B.; Miller, Andrew H.; Pearce, Bradley D. (2010). "Interleukin-1 Mediates Long-Term Hippocampal Dentate Granule Cell Loss Following Postnatal Viral Infection". Journal of Molecular Neuroscience. 41 (1): 89–96. doi:10.1007/s12031-009-9293-5. PMID 19774496. S2CID 2427299.
- ^ Hu, X.L.; Wang, Y.; Shen, Q. (2012). "Epigenetic control on cell fate choice in neural stem cells". Protein & Cell. 3 (4): 278–290. doi:10.1007/s13238-012-2916-6. PMC 4729703. PMID 22549586.
- ^ Altman, J. (1962). "Are new neurons formed in the brains of adult mammals?". Science. 135 (3509): 1127–1128. Bibcode:1962Sci...135.1127A. doi:10.1126/science.135.3509.1127. PMID 13860748. S2CID 1606140.
- ^ Altman, J. (1963). "Autoradiographic investigation of cell proliferation in the brains of rats and cats". The Anatomical Record. 145 (4): 573–591. doi:10.1002/ar.1091450409. PMID 14012334. S2CID 5340726.
- ^ Altman, J. (1969). "Autoradiographic and histological studies of postnatal neurogenesis. IV. Cell proliferation and migration in the anterior forebrain, with special reference to persisting neurogenesis in the olfactory bulb". The Journal of Comparative Neurology. 137 (4): 433–457. doi:10.1002/cne.901370404. PMID 5361244. S2CID 46728071.
- ^ Bayer, S. A.; Yackel, J. W.; Puri, P. S. (1982). "Neurons in the rat dentate gyrus granular layer substantially increase during juvenile and adult life". Science. 216 (4548): 890–892. Bibcode:1982Sci...216..890B. doi:10.1126/science.7079742. PMID 7079742.
- ^ Bayer, S. A. (1982). "Changes in the total number of dentate granule cells in juvenile and adult rats: a correlated volumetric and 3H-thymidine autoradiographic study". Experimental Brain Research. Experimentelle Hirnforschung. Experimentation Cerebrale. 46 (3): 315–323. doi:10.1007/bf00238626. PMID 7095040. S2CID 18663323.
- ^ Goldman SA, Nottebohm F (April 1983). "Neuronal production, migration, and differentiation in a vocal control nucleus of the adult female canary brain". Proc. Natl. Acad. Sci. U.S.A. 80 (8): 2390–4. Bibcode:1983PNAS...80.2390G. doi:10.1073/pnas.80.8.2390. PMC 393826. PMID 6572982.
- ^ Reynolds, B. A.; Weiss, S. (Mar 1992). "Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system". Science. 255 (5052): 1707–1710. Bibcode:1992Sci...255.1707R. doi:10.1126/science.1553558. ISSN 0036-8075. PMID 1553558.
- ^ Gage, F. H.; Ray, J.; Fisher, L. J. (1995). "Isolation, Characterization, and use of Stem Cells from the CNS". Annual Review of Neuroscience. 18: 159–92. doi:10.1146/annurev.ne.18.030195.001111. PMID 7605059.
- ^ Eriksson PS, Perfilieva E, Björk-Eriksson T, et al. (November 1998). "Neurogenesis in the adult human hippocampus". Nat. Med. 4 (11): 1313–7. doi:10.1038/3305. PMID 9809557.
- ^ Gould, E.; Reeves; Fallah; Tanapat; Gross; Fuchs (1999). "Hippocampal neurogenesis in adult Old World primates". Proceedings of the National Academy of Sciences of the United States of America. 96 (9): 5263–5267. Bibcode:1999PNAS...96.5263G. doi:10.1073/pnas.96.9.5263. PMC 21852. PMID 10220454.
- ^ Ponti, G.; Peretto, B.; Bonfanti, L. (2008). Reh, Thomas A. (ed.). "Genesis of neuronal and glial progenitors in the cerebellar cortex of peripuberal and adult rabbits". PLOS ONE. 3 (6): e2366. Bibcode:2008PLoSO...3.2366P. doi:10.1371/journal.pone.0002366. PMC 2396292. PMID 18523645.
- ^ Gould, E.; Reeves, A. J.; Graziano, M. S.; Gross, C. G. (1999). "Neurogenesis in the neocortex of adult primates". Science. 286 (5439): 548–552. doi:10.1126/science.286.5439.548. PMID 10521353.
- ^ Zhao, M.; Momma, S.; Delfani, K.; Carlen, M.; Cassidy, R. M.; Johansson, C. B.; Brismar, H.; Shupliakov, O.; Frisen, J.; Janson, A. (2003). "Evidence for neurogenesis in the adult mammalian substantia nigra". Proceedings of the National Academy of Sciences of the United States of America. 100 (13): 7925–7930. Bibcode:2003PNAS..100.7925Z. doi:10.1073/pnas.1131955100. PMC 164689. PMID 12792021.
- ^ Shankle; Rafii, M. S.; Landing, B. H.; Fallon, J. H. (1999). "Approximate doubling of numbers of neurons in postnatal human cerebral cortex and in 35 specific cytoarchitectural areas from birth to 72 months". Pediatric and Developmental Pathology. 2 (3): 244–259. doi:10.1007/s100249900120. PMID 10191348. S2CID 23546857.
- ^ Rakic P (February 2002). "Adult neurogenesis in mammals: an identity crisis". J. Neurosci. 22 (3): 614–8. doi:10.1523/JNEUROSCI.22-03-00614.2002. PMC 6758501. PMID 11826088.
- ^ Song, Juan; Zhong, Chun; Bonaguidi, Michael A.; Sun, Gerald J.; Hsu, Derek; Gu, Yan; Meletis, Konstantinos; Huang, Z. Josh; Ge, Shaoyu; Enikolopov, Grigori; Deisseroth, Karl; Luscher, Bernhard; Christian, Kimberly M.; Ming, Guo-li; Song, Hongjun (2012). "Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision". Nature. 489 (7414): 150–154. Bibcode:2012Natur.489..150S. doi:10.1038/nature11306. PMC 3438284. PMID 22842902.
- 메모들
- 아이몬 JB, 제스버거 S, Gage FH(2007) 성인 신경생식. 스콜라페디아, 페이지 8739
- Gould E, Reeves AJ, Fallah M, Tanapat P, Gross CG, Fuchs E (April 1999). "Hippocampal neurogenesis in adult Old World primates". Proc. Natl. Acad. Sci. U.S.A. 96 (9): 5263–7. Bibcode:1999PNAS...96.5263G. doi:10.1073/pnas.96.9.5263. PMC 21852. PMID 10220454.
- Gould E, Reeves AJ, Graziano MS, Gross CG (October 1999). "Neurogenesis in the neocortex of adult primates". Science. 286 (5439): 548–52. doi:10.1126/science.286.5439.548. PMID 10521353.
- Gould E, Beylin A, Tanapat P, Reeves A, Shors TJ (March 1999). "Learning enhances adult neurogenesis in the hippocampal formation". Nat. Neurosci. 2 (3): 260–5. doi:10.1038/6365. PMID 10195219. S2CID 12112156.
- Moghadam KS, Chen A, Heathcote RD (August 2003). "Establishment of a ventral cell fate in the spinal cord". Dev. Dyn. 227 (4): 552–62. doi:10.1002/dvdy.10340. PMID 12889064. S2CID 209599.
- Rakic P (January 2002). "Neurogenesis in adult primate neocortex: an evaluation of the evidence". Nature Reviews Neuroscience. 3 (1): 65–71. doi:10.1038/nrn700. PMID 11823806. S2CID 15725675.
- 롤스, E.T & Treves, A. (1998년) 신경망과 뇌기능. OUP. ISBN 0-19-852432-3.
- Santarelli L, Saxe M, Gross C, et al. (August 2003). "Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants". Science. 301 (5634): 805–9. Bibcode:2003Sci...301..805S. doi:10.1126/science.1083328. PMID 12907793. S2CID 9699898.
- Schloesser RJ, Manji HK, Martinowich K (April 2009). "Suppression of adult neurogenesis leads to an increased hypothalamo-pituitary-adrenal axis response". NeuroReport. 20 (6): 553–7. doi:10.1097/WNR.0b013e3283293e59. PMC 2693911. PMID 19322118.
- Shankle WR, Rafii MS, Landing BH, Fallon JH (1999). "Approximate doubling of the numbers of neurons in the postnatal human cortex and in 35 specific cytoarchitectonic areas from birth to 72 months". Pediatric and Developmental Pathology. 2 (3): 244–259. doi:10.1007/s100249900120. PMID 10191348. S2CID 23546857.
- Zhao M, Momma S, Delfani K, et al. (June 2003). "Evidence for neurogenesis in the adult mammalian substantia nigra". Proc. Natl. Acad. Sci. U.S.A. 100 (13): 7925–30. Bibcode:2003PNAS..100.7925Z. doi:10.1073/pnas.1131955100. PMC 164689. PMID 12792021.
외부 링크
- Wellesley College의 신경생식에 대한 간략한 소개
- 라파예트 칼리지의 신경생식에 관한 종합 웹사이트
- 성인의 신경생식에 관한 초기 문헌
- 성인의 뇌 신경 유전체 - 프레드 H. Gage와 헨리에트 반 프라그
- "뉴로제네시스·파킨슨병"
- 스콜라페디아 성인 신경생식에 관한 논문
- 뉴로사이언스의 트렌드, 2001년 10월 10일 (마이클 카플란 MD, 박사)
- 뉴욕 타임즈: 뇌가 새로운 세포를 배양한다는 연구
- 마이클 스펙터: 두뇌에 대한 재고 - 카나리아의 노래가 과학의 기본 원리를 어떻게 뒤집었는가
- 신경생성 실험 - 성인 인간의 신경생식에 관한 기사 시리즈
- 시드 매거진: 자아의 재발명 - 신경생성 분야의 역사적 배경과 이 연구의 시사점
- BBC 라디오 4: 기억력 체험 - 사용 또는 분실
- PBS: 마음을 바꾸는 것 - 자신만의 두뇌를 기르십시오.
- 강철 로브: 에어로빅 운동은 2007년 8월 19일 뉴욕 타임즈의 신경생식을 촉진하는 것으로 보인다.
 Wikimedia Commons의 신경 유전자와 관련된 미디어
Wikimedia Commons의 신경 유전자와 관련된 미디어