망막아세포종
Retinoblastoma| 망막아세포종 | |
|---|---|
 | |
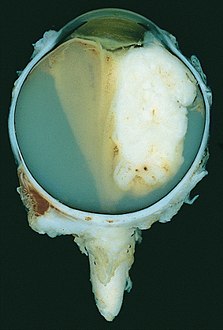
| 3세 여성의 적출된 눈에서 나온 망막아세포종 종양의 총병리 표본 | |
| 전문 | 신경학 |
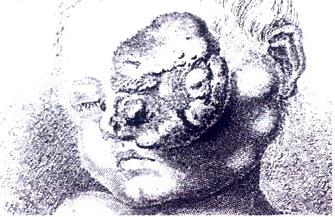
망막아종(Rb)은 눈의 빛을 감지하는 조직인 망막의 미성숙한 세포에서 빠르게 발생하는 희귀한 형태의 암이다.그것은 어린이에게 가장 흔한 원발성 악성 안구내암이며,[1] 거의 전적으로 어린 아이들에게서 발견된다.
대부분의 아이들이 이 암을 이겨내지만, 그들은 영향을 받은 눈에서 시력을 잃거나 눈을 [citation needed]제거해야 할 수도 있습니다.
망막아세포종이 있는 어린이의 거의 절반은 망막아세포종과 관련된 유전적인 결함을 가지고 있다.다른 경우에는 13번 염색체 유전자 13q14(망막아종 단백질)[2]의 선천적 돌연변이에 의해 발생한다.
징후 및 증상

망막아세포종은 일반적으로 어린이들 사이에서 가장 침입성이 높은 안구내암으로 알려져 있다.생존과 눈의 보존의 가능성은 전적으로 심각도에 달려있다.망막아세포종은 미국에서 매년 약 200명에서 300명 정도밖에 발생하지 않기 때문에 매우 드물다.전 세계적으로 망막아종을 살펴보면, 약 15,000명 중 1명만이 악성종양을 앓고 있지만, 이 수치는 계속 [3]증가하고 있습니다.
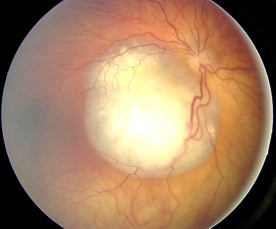
안구내 악성종양은 조기 진단과 조기 치료 예후로 인해 안구외 악성종양보다는 치료가 더 쉽다.영유아 검진을 할 때 청력 검진처럼 안구 검진을 도입하면 조기에 발견돼 확산을 막을 수 있다.Leucocoria는 망막아종의 주요 징후이며 암이 아직 안구 내, 즉 눈 안에 있는 경우입니다.백색 종양이 빛을 반사하면 붉은 망막의 시야가 차단된다.망막아세포종은 초기 증상 후 그리고 종양이 안구내라면 6개월까지 치료할 수 있다.류코리아 증세가 있는 안과를 합리적인 시간 내에 방문하지 않으면 진단이 늦어지면 예후가 더 심각해질 수 있다.진단의 지연으로 인해 가장 심각한 [4]안구외로 간주되는 예방증이 발생할 수 있습니다.
망막아세포종의 가장 흔하고 명백한 징후는 눈동자를 통해 본 망막의 비정상적인 모습이며, 의학 용어로는 류코리아(leukocoria)로, 무수해 고양이 눈 [1]반사라고도 알려져 있다.다른 징후와 증상으로는 시력 저하, 녹내장으로 인한 붉고 자극적인 눈, 그리고 성장이 느려지거나 발달이 지연되는 것이 있다.망막아세포종이 있는 몇몇 어린이들은 사시가 생길 수 있는데, 이것은 보통 "사시"[5] 또는 "벽눈"이라고 불립니다.망막아세포종은 개발도상국에서 발달된 질병을 나타내며 눈 확대는 흔한 [citation needed]발견입니다.
종양의 위치에 따라 눈동자를 통해 관찰하기 위해 안경을 사용한 간단한 시력 검사에서 종양이 보일 수 있습니다.양성 진단은 보통 마취(EUA) 검사를 통해서만 이루어집니다.흰 눈의 반사가 항상 망막아세포종의 긍정적인 징후는 아니며 빛이 심하게 반사되거나 코츠병과 [citation needed]같은 다른 조건에 의해 발생할 수 있습니다.
한쪽 눈에만 사진 결함 적목 현상이 있는 것은 망상아종의 징후일 수 있습니다.더 명확한 사인은 "하얀 눈" 또는 "고양이의 [6]눈"이다.
원인
염색체에서 발견되는 유전자의 돌연변이는 세포들이 [7]몸 안에서 자라고 발달하는 방식에 영향을 미칠 수 있다.RB1 또는 MYCN의 변화는 망막아종을 일으킬 수 있다.
RB1
유전성 망막아종의 유전형태를 가진 아동에서는 13번 염색체의 RB1 유전자에 돌연변이가 발생한다. RB1은 최초로 [7]복제된 종양 억제 유전자였다.RB1은 100개 이상의 [7]세포단백질과 상호작용하지만 세포주기에 대한 RB1의 음성조절효과는 주로 전사인자 E2F의 결합 및 불활성화에 의해 발생하며, 따라서 S상에 [7]필요한 유전자의 전사를 억제한다.
결함이 있는 RB1 유전자는 어느 부모로부터도 유전될 수 있다; 하지만, 일부 아이들의 경우, 돌연변이는 태아 발달의 초기 단계에서 발생한다.RB1 대립 유전자의 발현은 90% [8]침투도로 상염색체 우성입니다.
유전되는 망막아종의 형태는 양쪽성일 가능성이 더 높다.또한 유전되는 단일 또는 양쪽 망막아종은 선모세포종 및 기타 악성 중간선상 원시신경외배엽종(PNETs)과 관련될 수 있으며, PNET과 동시에 발생하는 망막아종은 3측 망막아종으로 [9]알려져 있다.2014년 메타분석 결과, 조기 발견과 화학요법 [10]개선에 힘입어 3측망막종의 5년 생존율이 1995년 6%에서 2014년 57%로 증가했다.
망막아세포종의 발생은 투히트 모델로 설명할 수 있다.두 번 맞은 모델에 따르면 두 개의 대립 유전자가 모두 영향을 받아야 하기 때문에 망막 세포나 세포가 종양으로 발전하기 위해서는 두 가지 현상이 필요하다.첫 번째 돌연변이 사건은 유전될 수 있고 (독일 또는 체질) 그것은 체내의 모든 세포에 존재할 것이다.두 번째 "히트"는 나머지 정상 대립 유전자의 손실을 초래하고 특정 망막 [11]세포 내에서 발생합니다.산발적이고 상속할 수 없는 형태의 망막아세포종에서, 두 돌연변이 사건은 수정 후 단일 망막 세포 내에서 발생합니다(신체적 사건). 산발성 망막아세포종은 일방적인 경향이 있습니다.
RB1 유전자 [12][13]돌연변이를 검출하기 위한 몇 가지 방법이 개발되었습니다.유전자 돌연변이를 현재 단계에 연관시키려는 시도는 [14]상관관계에 대한 설득력 있는 증거를 보여주지 못했다.
MYCN
모든 망막아종 사례가 RB1 불활성화를 수반하는 것은 아닙니다.RB1 돌연변이가 1개뿐이거나 기능성 RB1 대립 유전자가 2개라도 보고된 사례가 있는데, 이는 망막아세포종의 [15]다른 종양 유발 병변을 나타낸다.MYCN 종양유전자의 체세포증폭은 비유전성, 조기발작성, 공격성, 일방성 망막아종의 일부 경우에 책임이 있다.MYCN은 전사 인자로 작용할 수 있으며 세포 주기 [16][17]유전자의 발현을 조절하여 증식을 촉진합니다.MYCN 증폭은 망막아종 사례의 1.4%에 불과했지만, 연구자들은 생후 6개월 미만의 진단을 받은 영아의 18%에서 이를 확인했다.MYCN 망막아종에 대한 진단 시 중간 연령은 4.5개월이었고, 두 개의 RB1 유전자 [18]돌연변이를 가진 비가족성 단측성 질환을 가진 사람은 24개월이었다.
진단.
망막아종에 대한 검사는 생후 첫 3개월 동안 신생아에 대한 "웰 베이비" 검사의 일부로,[citation needed] 다음을 포함해야 합니다.
- 적색 반사: 약 30cm 또는 1피트(1피트)의 안경 또는 망막으로 눈의 망막에서 정상적인 적황색 반사를 확인합니다.보통 어둡거나 어두운 방에서 이루어집니다.
- 각막광 반사 또는 Hirschberg 테스트: 각막에 빛이 비칠 때 각 눈의 같은 지점에서 광선의 대칭 반사를 확인하여 눈이 교차하는지 여부를 판단합니다.
- 시력검사 : 구조적 이상 유무 확인
분류
이 질병의 두 가지 형태는 유전형식과 비 유전형식이다. (모든 암은 유전형의 돌연변이가 그들의 발달을 위해 필요하다는 점에서 유전적인 것으로 간주되지만, 이것은 그들이 유전적이거나 자손에게 전염된다는 것을 의미하지는 않는다.)망막아세포종이 있는 어린이의 약 55%가 유전되지 않는 형태를 가지고 있다.가족 내에 질병의 병력이 존재하지 않는 경우, 그 질병은 "스포라딕"으로 표기되지만, 이것이 반드시 유전되지 않는 형태임을 나타내는 것은 아니다.양쪽 망막아종은 일반적으로 유전성이 있는 반면, 한쪽 망막아종은 일반적으로 유전성이 [citation needed]없다.
약 [19]3분의 2의 경우 한쪽 눈만 영향을 받고(일측 망막아종), 다른 3분의 1은 양쪽 눈에서 종양이 발생한다(양측 망막아종).각 눈에 있는 종양의 수와 크기는 다를 수 있습니다.어떤 경우에는 송과선 또는 상완골 또는 파라셀 영역(또는 매우 드문 경우 다른 중간선 두개 내 위치)도 영향을 받는다(삼측망막아종).종양의 [citation needed]위치, 크기, 양은 질병의 치료 유형을 선택할 때 고려됩니다.
차동 진단
- 1. 지속성 과형성 1차 유리체란 선천적으로 선천적으로 발생하는 눈의 발달 이상으로, 배아학적, 1차 유리체 및 히알로이드 혈관 구조가 퇴보하지 못하여 눈이 짧아지고 백내장이 발생하며 동공 미백이 나타날 수 있다.
- 2. 외투병은 망막 뒤에 혈관이 비정상적으로 발달하여 망막의 혈관 이상과 망막 박리를 초래하여 망막아세포종을 모방하는 전형적인 일방성 질환이다.
- 3. 톡소카리아증은 감염된 강아지들에 대한 노출과 관련된 눈의 기생 질환으로 망막 병변을 유발하여 망막 박리를 초래합니다.
- 4. 미숙아 망막증은 출생 직후에 보충산소를 공급받는 저체중아에 관련되며 망막조직에 손상을 주어 망막박리를 일으킬 수 있다.
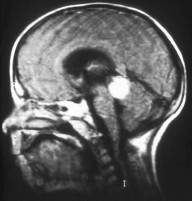
안검사에 이상이 있는 경우 컴퓨터 단층촬영(CT), 자기공명영상(MRI), 초음파 [20]등의 영상검사가 추가될 수 있습니다.CT와 MRI는 구조 이상을 정의하고 칼슘의 침적을 밝혀내는 데 도움을 줄 수 있습니다.초음파는 종양의 높이와 두께를 정의하는데 도움을 줄 수 있다.골수 검사나 요추 천자 또한 뼈나 [citation needed]뇌로의 전이를 결정하기 위해 행해질 수 있다.
형태학
망막아세포종의 총체적, 현미경적 외형은 유전형과 산발형 모두 동일하다.거시적으로 볼 때 혈관 근처에서 생존 가능한 종양세포가 발견되는 반면, 괴사 영역은 상대적으로 혈관이 없는 영역에서 발견됩니다.현미경으로 볼 때 미분화 및 미분화 요소가 모두 존재할 수 있다.미분화되지 않은 원소는 초색소 핵을 가진 작고 둥근 세포 집합으로 나타난다. 미분화 원소는 Flexner-Wintersteiner 로제트, Homer Wright 로제트 [21]및 광수용체 [22]분화의 플뢰레트를 포함한다.
유전자 검사
아이의 망막아종을 초래한 RB1 유전자 돌연변이를 식별하는 것은 영향을 받은 개인의 임상 치료와 (미래의) 형제자매와 자손의 보살핌에서 중요할 수 있다.집안 내력일 수도 있어요.
- 양쪽에 영향을 받는 사람과 일방적으로 영향을 받는 사람의 [23][24]13-15%가 혈액에서 RB1 돌연변이를 보일 것으로 예상된다.영향을 받는 개인, (미래의) 형제자매, 자녀 및 기타 친족에서 RB1 돌연변이를 동정함으로써 돌연변이에 대한 시험을 할 수 있다. 만약 돌연변이를 수반하지 않는다면, 자녀 친척은 망막아종의 위험이 없으므로 [25]마취 상태에서 외상 및 검사 비용을 받을 필요가 없다.일방적으로 영향을 받은 환자의 85%가 혈액에 안종양 RB1 돌연변이를 일으키지 않는 것으로 판명된 경우, 형제자매에 대한 분자 검사나 임상 감시가 필요하지 않습니다.
- 만약 감염된 개인의 RB1 돌연변이가 확인된다면, 위험에 처한 임신의 양수 세포는 가족 돌연변이에 대한 시험을 할 수 있다; 돌연변이를 옮기는 모든 태아는 눈 종양의 조기 치료를 가능하게 하여, 더 나은 시각적 [25]결과를 이끌어 낼 수 있다.
- 없으면 RB1돌연변이 혈액에high-sensitivity 분자 시험(즉>93%RB1돌연변이 검출 감도)후 탐지되는 곳에 없다 종양에 대한 시험 가능하다 일방적인 망막 아종의 경우, 생식계 RB1돌연변이의 위험 1%미만에에 클리닉 시험( 아니라 시험 u. 수준 ,[24]감소한다한 nder에스테틱)은 해당 개인과 그 미래의 자손에게 권장된다(National Retinablastoma Strategy, Canadian Guidelines for Care).[26]
이미징
종래의 초음파 B스캔은 종양의 석회화를 검출할 수 있는 반면, 고주파 초음파 B스캔은 종래의 초음파보다 높은 분해능을 제공할 수 있어 종양의 앞부분과 종양의 근접성을 판정할 수 있다.MRI 스캔은 시신경 침입, 맥락막 침입, 강막 침입 및 두개 내 침입과 같은 고위험 특성을 탐지할 수 있습니다.방사선이 RB1 유전자 [27]돌연변이를 가진 사람들에게 더 많은 눈 종양의 형성을 자극할 수 있기 때문에 CT 스캔은 일반적으로 피한다.
스테이징
망막아세포종을 제대로 진단하기 위해서는 종양의 위험을 적절히 분류하기 위한 지침이 있어야 한다.Reese Ellsworth Classification System by Dr.알제논 리스와 로버트 엘스워스 박사는 [28]종양의 크기, 위치, 다초점 등을 알아내는 데 보편적으로 사용된다.이 시스템은 원래 외부 빔 방사선 치료를 사용하여 최적의 치료 결과를 결정하는 데 사용되었으며, 눈의 지구본을 인양하는 데에도 사용되었습니다.화학요법은 리스 엘스워스 분류 시스템의 일부가 아니기 때문에 화학요법의 치료 결과를 예측하기 위한 업데이트된 분류 시스템이 필요했다.안구내 망막아종에 대한 국제 분류는 현재 사용되고 있으며, Murphree와 관련자들에 [28]의해 만들어졌습니다.리스와 엘스워스에 따르면, 지구 인양에 매우 호의적인 것으로 분류하기 위해 다양한 특징을 가진 다른 그룹들이 있었다.환부를 살리기 위해서는 원반 지름이 4DD 정도여야 하고 적도 뒤에 있어야 더 높은 호감도를 가질 수 있었다.종양이 디스크 직경이 약 10개이고 망막의 약 50%를 포함하는 경우, 지구본을 회수하는 것이 바람직하지 않아 적출이 발생할 수 있다.Murphree에 따르면, 다른 그룹들은 주어진 종양의 특징에 의해 결정되는 매우 낮은 위험에서 매우 높은 위험으로 분류되었다.위험이 매우 낮다는 것은 종양이 3mm 미만이어야 하고 유리체 또는 망막하 부위에 파종이 없어야 한다는 것을 의미합니다.환자가 매우 고위험일 때 종양은 여러 가지 특징을 보이며 보수적인 치료 방법이나 [29]적출로 치료되어야 합니다.
| 그룹. | 임상적 특징 |
| A 리스크가 매우 낮다 | 모든 종양은 3mm 이하이며 망막에 국한되어 있으며, 망막에서 3mm 이상, 시신경에서 1.5mm 이상 떨어져 있습니다.유리체 또는 망막하 파종 없음 |
| B 리스크가 낮다 | 망막 종양은 그룹 A에 속하지 않는 모든 크기 또는 위치에 있을 수 있으며 유리체 또는 망막하 파종은 허용되지 않는다.종양의 밑부분에서 5mm 이하로 뻗은 망막하액의 작은 커프가 허용됩니다 |
| C 중간 정도의 리스크 | 국소 유리체 또는 망막하 파종과 모든 크기와 위치의 망막 종양만 있는 눈.유리체 또는 망막하 파종은 종양으로부터 3mm 이하로 확장될 수 있습니다.최대 1사분면의 망막하액이 존재할 수 있습니다 |
| D 리스크가 높다 | 확산성 유리체 또는 망막하 파종 및/또는 거대하고 비구체성 내생성 또는 외생성 질환을 가진 눈.망막 박리의 사분면 이상 |
| E 매우 위험성이 높은 눈 | 다음 중 하나 이상의 눈: 불가역성 혈관 녹내장 대규모 안구내 출혈 무균성 안와세포염 Phthis 또는 Phthis 이전 유리면 전방에서 유리면 전방의 종양 수정체에 닿는 종양 확산성 침윤성 망막아세포종 |
치료
망막아세포종 치료는 아이의 생명을 보존하고 시력을 보존하며, 치료의 합병증이나 부작용을 최소화하는 것이 우선입니다.정확한 치료 과정은 개별 사례에 따라 다르며 안과 의사가 소아암 [30]전문의와 협의하여 결정합니다.또한 정확한 치료는 생식계 RB1 돌연변이, 산발적 RB1 돌연변이 또는 기능적 RB1에 [31]의한 MYCN 증폭 중 어느 것이든 돌연변이 유형에 따라 달라집니다.진단 시 양쪽 눈이 관여하는 아동은 일반적으로 다형성 치료(화학요법, 국소요법)가 필요합니다.
망막아세포종의 다양한 치료 양식은 다음과 같습니다.[30]
- 안구 적출 – 안구 내 질환이 있는 편측성 질환 환자는 대부분 안구 내 질환이 있으므로 대개 95%의 완치율을 보이는 적출 수술을 받습니다.양쪽 Rb에서, 적출은 일반적으로 알려진 모든 효과적인 치료법에 실패했거나 유용한 시력이 없는 눈을 위해 남겨진다.
- 외부 빔 방사선 치료(EBR) – EBR의 가장 일반적인 징후는 화학 치료 및 국소 치료 완료 후 활성 또는 재발성 질환을 가진 양쪽 망막아종이 있는 어린 아이의 눈에 대한 것입니다.그러나 EBR 치료를 받은 유전병 환자는 두 번째 [32]암에 걸릴 위험이 35%로 보고되었다.
- 브라키테라피는 방사성 임플란트(플라크)를 종양 기저부에 인접한 강막에 배치하는 것을 포함한다.이는 작은 종양이 있는 환자 또는 이전 EBR 치료를 포함한 초기 치료에 실패한 환자들에게 일차 치료제로 또는 더 자주 사용되었다.
- 열요법은 보통 적외선 방사선의 형태로 종양에 직접 열을 가하는 것을 포함한다.그것은 작은 종양에도 사용된다.
- 레이저 광응고술은 작은 후부 종양에만 권장됩니다.아르곤, 다이오드 레이저 또는 크세논 아크를 사용하여 종양에 대한 모든 혈액 공급을 응고합니다.
- 저온 요법은 혈관 내피를 급속 동결시켜 2차 혈전증 및 종양 조직의 경색으로 손상시킨다.작은 말초 종양이나 이전에 다른 방법으로 치료한 작은 재발성 종양에 대한 1차 치료제로 사용될 수 있다.
- 전신화학요법은 지난 10년 동안 지구 보존 조치의 모색과 EBR 치료의 부작용을 피하기 위해 치료의 최전선이 되었다.안구내 망막아종에 대한 화학요법의 일반적인 징후는 크기가 크고 양쪽 종양이 있는 어린이에게는 국소적인 치료만으로는 치료될 수 없는 종양을 포함한다.종양이 작은 편측성 질환 환자에게도 사용되지만 국소 치료만으로는 통제할 수 없다.
- 동맥 내 화학요법 – 화학요법 약물은 사타구니, 대동맥 및 목을 통해 시신경 [33]혈관에 직접 나사산된 얇은 카테터에 의해 국소적으로 투여됩니다.
- 나노입자 화학요법 – 전신요법의 부작용을 줄이기 위해 화학요법제(카르보플라틴)를 함유한 나노입자담체의 서브콘셉티벌(국소) 주입이 개발되어 동물모델에서 부작용 [34][35]없이 망막아세포종을 치료하는 데 유망한 결과를 보이고 있습니다.
- 화학요법을 사용하여 종양의 크기를 초기에 줄이고 종양을 [36][37]조절하기 위해 보조적 초점 치료(transufular therapy)를 사용하는 복합 접근법이다.
예후
선진국에서 망막아종은 모든 소아암 중 최고의 치료율 중 하나이며(95-98%), 환자의 90% 이상이 성인이 될 때까지 생존한다.영국에서는 매년 [38]40~50건의 새로운 환자가 진단된다.
좋은 예후는 보건 시설에서 아이의 조기진단에 달려있다.
늦게 나타나는 것은 [40]예후 불량과 관련이 있다.
유전성 망막아세포종의 생존자들은 나중에 다른 암에 걸릴 위험이 더 높다.
역학
망막아종은 전 [41]세계 정상 출생아 18000~3만 명당 망막아종의 누적 평생 발생률을 나타낸다.개발도상국에서 높은 발병률은 낮은 사회경제적 지위와 망막아종 조직에 [42]인간 유두종 바이러스 배열의 존재에 기인한다.
망막아종이 있는 어린이의 거의 80%는 3세 이전에 진단되며 6세 이상의 아동에서는 진단이 [43]매우 드물다.영국에서는 보통 14~16개월 내에 쌍방의 사례가 나타나는 반면, 일방적인 사례의 진단은 24~30개월 사이에 최고조에 달한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b American Cancer Society (2003). "Chapter 85. Neoplasms of the Eye". Cancer Medicine. Hamilton, Ontario: BC Decker Inc. ISBN 978-1-55009-213-4.
- ^ Ryan SJ, Schachat AP, Wilkinson CP, Hinton DR, Sadda SR, Wiedemann P (2012-11-01). Retina. Elsevier Health Sciences. p. 2105. ISBN 978-1455737802.
- ^ "Retinoblastoma - Symptoms and causes". Mayo Clinic. Retrieved 2021-03-17.
- ^ Dimaras H, Kimani K, Dimba EA, Gronsdahl P, White A, Chan HS, Gallie BL (April 2012). "Retinoblastoma". Lancet. 379 (9824): 1436–1446. doi:10.1016/s0140-6736(11)61137-9. PMID 22414599. S2CID 235331617.
- ^ Elkington AR, Khaw PT (September 1988). "ABC of eyes. Squint". BMJ. 297 (6648): 608–611. doi:10.1136/bmj.297.6648.608. PMC 1834556. PMID 3139234.
- ^ White Eye Archived 2011-04-26 소개: Daisy's Eye Cancer Fund의 Wayback Machine.
- ^ a b c d Du W, Pogoriler J (August 2006). "Retinoblastoma family genes". Oncogene. 25 (38): 5190–5200. doi:10.1038/sj.onc.1209651. PMC 1899835. PMID 16936737.
- ^ Lohmann, Dietmar R.; Gallie, Brenda L. (1993), Adam, Margaret P.; Mirzaa, Ghayda M.; Pagon, Roberta A.; Wallace, Stephanie E. (eds.), "Retinoblastoma", GeneReviews®, Seattle (WA): University of Washington, Seattle, PMID 20301625, retrieved 2022-06-27
- ^ Kivelä T (June 1999). "Trilateral retinoblastoma: a meta-analysis of hereditary retinoblastoma associated with primary ectopic intracranial retinoblastoma". Journal of Clinical Oncology. 17 (6): 1829–1837. doi:10.1200/JCO.1999.17.6.1829. PMID 10561222.
- ^ de Jong MC, Kors WA, de Graaf P, Castelijns JA, Kivelä T, Moll AC (September 2014). "Trilateral retinoblastoma: a systematic review and meta-analysis". The Lancet. Oncology. 15 (10): 1157–1167. doi:10.1016/s1470-2045(14)70336-5. PMID 25126964.
- ^ Harbour J.W., Dean D.C. Rb는 세포주기 조절과 세포자멸" 자연세포생물학에서 기능한다.2000;94:E65–E67
- ^ Parsam VL, Kannabiran C, Honavar S, Vemuganti GK, Ali MJ (December 2009). "A comprehensive, sensitive and economical approach for the detection of mutations in the RB1 gene in retinoblastoma". Journal of Genetics. 88 (4): 517–527. doi:10.1007/s12041-009-0069-z. PMID 20090211. S2CID 10723496.
- ^ Lohmann DR, Gallie BL (2010). "Retinoblastoma". GeneReviews. Seattle, WA: University of Washington. PMID 20301625.
- ^ Ali MJ, Parsam VL, Honavar SG, Kannabiran C, Vemuganti GK, Reddy VA (October 2010). "RB1 gene mutations in retinoblastoma and its clinical correlation". Saudi Journal of Ophthalmology. 24 (4): 119–123. doi:10.1016/j.sjopt.2010.05.003. PMC 3729507. PMID 23960888.
- ^ Rushlow DE, Mol BM, Kennett JY, Yee S, Pajovic S, Thériault BL, et al. (April 2013). "Characterisation of retinoblastomas without RB1 mutations: genomic, gene expression, and clinical studies". The Lancet. Oncology. 14 (4): 327–334. doi:10.1016/S1470-2045(13)70045-7. PMID 23498719.
- ^ Woo CW, Tan F, Cassano H, Lee J, Lee KC, Thiele CJ (February 2008). "Use of RNA interference to elucidate the effect of MYCN on cell cycle in neuroblastoma". Pediatric Blood & Cancer. 50 (2): 208–212. doi:10.1002/pbc.21195. PMID 17420990. S2CID 22765085.
- ^ Stenfelt S, Blixt MK, All-Ericsson C, Hallböök F, Boije H (November 2017). "Heterogeneity in retinoblastoma: a tale of molecules and models". Clinical and Translational Medicine. 6 (1): 42. doi:10.1186/s40169-017-0173-2. PMC 5680409. PMID 29124525.
- ^ Lewis R (March 19, 2013). "Some Aggressive Retinoblastomas Lack RB1 Mutations". Medscape Online. Archived from the original on September 19, 2017.
- ^ MacCarthy A, Birch JM, Draper GJ, Hungerford JL, Kingston JE, Kroll ME, et al. (January 2009). "Retinoblastoma in Great Britain 1963-2002". The British Journal of Ophthalmology. 93 (1): 33–37. doi:10.1136/bjo.2008.139618. PMID 18838413. S2CID 27049728.
- ^ de Jong MC, de Graaf P, Noij DP, Göricke S, Maeder P, Galluzzi P, et al. (May 2014). "Diagnostic performance of magnetic resonance imaging and computed tomography for advanced retinoblastoma: a systematic review and meta-analysis". Ophthalmology. 121 (5): 1109–1118. doi:10.1016/j.ophtha.2013.11.021. PMID 24589388.
- ^ Sehu WK, Lee W (2005). Ophthalmic pathology : an illustrated guide for clinicians. Malden: Blackwell Publishing. p. 262. ISBN 978-0-7279-1779-9.
- ^ Kumar V, Abbas AK, Fausto N (1999). Robbins pathologic basis of disease (6th ed.). Philadelphia: Saunders. p. 1442. ISBN 978-0-7216-0187-8.
- ^ Schüler A, Weber S, Neuhäuser M, Jurklies C, Lehnert T, Heimann H, et al. (March 2005). "Age at diagnosis of isolated unilateral retinoblastoma does not distinguish patients with and without a constitutional RB1 gene mutation but is influenced by a parent-of-origin effect". European Journal of Cancer. 41 (5): 735–740. doi:10.1016/j.ejca.2004.12.022. PMID 15763650.
- ^ a b Rushlow D, Piovesan B, Zhang K, Prigoda-Lee NL, Marchong MN, Clark RD, Gallie BL (May 2009). "Detection of mosaic RB1 mutations in families with retinoblastoma". Human Mutation. 30 (5): 842–851. doi:10.1002/humu.20940. PMID 19280657. S2CID 31887184.
- ^ a b Richter S, Vandezande K, Chen N, Zhang K, Sutherland J, Anderson J, et al. (February 2003). "Sensitive and efficient detection of RB1 gene mutations enhances care for families with retinoblastoma". American Journal of Human Genetics. 72 (2): 253–269. doi:10.1086/345651. PMC 379221. PMID 12541220.
- ^ Canadian Ophthalmological Society (December 2009). "National Retinoblastoma Strategy Canadian Guidelines for Care" (PDF). Canadian Journal of Ophthalmology. 44 (suppl.2): S1-88. doi:10.3129/i09-194. PMID 20237571. Archived from the original (PDF) on 2011-09-29.
- ^ Dimaras H, Corson TW (January 2019). "Retinoblastoma, the visible CNS tumor: A review". Journal of Neuroscience Research. 97 (1): 29–44. doi:10.1002/jnr.24213. PMC 6034991. PMID 29314142.
- ^ a b c Chawla B, Jain A, Azad R (September 2013). "Conservative treatment modalities in retinoblastoma". Indian Journal of Ophthalmology. 61 (9): 479–485. doi:10.4103/0301-4738.119424. PMC 3831762. PMID 24104705.
- ^ a b Fabian ID, Reddy A, Sagoo MS (2018). "Classification and staging of retinoblastoma". Community Eye Health. 31 (101): 11–13. PMC 5998397. PMID 29915461.
- ^ a b Chintagumpala M, Chevez-Barrios P, Paysse EA, Plon SE, Hurwitz R (October 2007). "Retinoblastoma: review of current management". The Oncologist. 12 (10): 1237–1246. CiteSeerX 10.1.1.585.5448. doi:10.1634/theoncologist.12-10-1237. PMID 17962617.
- ^ Li WL, Buckley J, Sanchez-Lara PA, Maglinte DT, Viduetsky L, Tatarinova TV, et al. (July 2016). "A Rapid and Sensitive Next-Generation Sequencing Method to Detect RB1 Mutations Improves Care for Retinoblastoma Patients and Their Families". The Journal of Molecular Diagnostics. 18 (4): 480–493. doi:10.1016/j.jmoldx.2016.02.006. PMC 5820122. PMID 27155049.
- ^ Roarty JD, McLean IW, Zimmerman LE (November 1988). "Incidence of second neoplasms in patients with bilateral retinoblastoma". Ophthalmology. 95 (11): 1583–1587. doi:10.1016/s0161-6420(88)32971-4. PMID 3211467.
- ^ Shields CL, Ramasubramanian A, Rosenwasser R, Shields JA (September 2009). "Superselective catheterization of the ophthalmic artery for intraarterial chemotherapy for retinoblastoma". Retina. 29 (8): 1207–1209. doi:10.1097/IAE.0b013e3181b4ce39. PMID 19734768.
- ^ Shome D, Poddar N, Sharma V, Sheorey U, Maru GB, Ingle A, et al. (December 2009). "Does a nanomolecule of Carboplatin injected periocularly help in attaining higher intravitreal concentrations?". Investigative Ophthalmology & Visual Science. 50 (12): 5896–5900. doi:10.1167/iovs.09-3914. PMID 19628744. S2CID 7361361.
- ^ Kang SJ, Durairaj C, Kompella UB, O'Brien JM, Grossniklaus HE (August 2009). "Subconjunctival nanoparticle carboplatin in the treatment of murine retinoblastoma". Archives of Ophthalmology. 127 (8): 1043–1047. doi:10.1001/archophthalmol.2009.185. PMC 2726977. PMID 19667343.
- ^ Fabian ID, Johnson KP, Stacey AW, Sagoo MS, Reddy MA (June 2017). "Focal laser treatment in addition to chemotherapy for retinoblastoma". The Cochrane Database of Systematic Reviews. 2017 (6): CD012366. doi:10.1002/14651858.CD012366.pub2. PMC 6481366. PMID 28589646.
- ^ Shields CL, Mashayekhi A, Cater J, Shelil A, Ness S, Meadows AT, Shields JA (June 2005). "Macular retinoblastoma managed with chemoreduction: analysis of tumor control with or without adjuvant thermotherapy in 68 tumors". Archives of Ophthalmology. 123 (6): 765–773. doi:10.1001/archopht.123.6.765. PMID 15955977.
- ^ Beddard, N; McGeechan, GJ; Taylor, J; Swainston, K (2019). "Childhood eye cancer from a parental perspective: The lived experience of parents with children who have had retinoblastoma". European Journal of Cancer Care. 29 (2): e13209.
- ^ Concise ophthalmology : for medical students (4th ed.). Karachi, Pakistan: Paramount Books. 2014. pp. 80–81. ISBN 9789696370017.
- ^ Rai P, Shah IA, Narsani AK, Lohana MK, Memon MK, Memon MA (2009). "Too late presentation of 53 patients with retinoblastoma". International Journal of Ophthalmology. 9 (2): 227–230.
- ^ Abramson DH, Schefler AC (December 2004). "Update on retinoblastoma". Retina. 24 (6): 828–848. doi:10.1097/00006982-200412000-00002. PMID 15579980. S2CID 26883037.
- ^ Orjuela M, Castaneda VP, Ridaura C, Lecona E, Leal C, Abramson DH, et al. (October 2000). "Presence of human papilloma virus in tumor tissue from children with retinoblastoma: an alternative mechanism for tumor development". Clinical Cancer Research. 6 (10): 4010–4016. PMID 11051250.
- ^ Abramson DH, Frank CM, Susman M, Whalen MP, Dunkel IJ, Boyd NW (March 1998). "Presenting signs of retinoblastoma". The Journal of Pediatrics. 132 (3 Pt 1): 505–508. doi:10.1016/s0022-3476(98)70028-9. PMID 9544909.
외부 링크
- MedlinePlus에서 망막아종 정보 가져오기
- NIH/UW 유전자 테스트 망막아세포종
- RB1 변환 데이터베이스
- Curlie 망막아세포종
- NCBI 유전자 검사 등록부