모세포
Hair cell| 모세포 | |
|---|---|
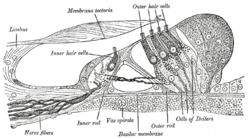 코티의 나선형 기관을 관통하는 부분이야확대('외부 모발세포'는 상단 부근에, '내부 모발세포'는 중앙 부근에 표시). | |
 달팽이관의 단면입니다.내부 모세포는 "내부 모세포 신경"의 말단에 위치하고, 외부 모세포는 "외부 모세포 신경"의 말단에 위치합니다. | |
| 세부 사항 | |
| 위치 | 코클레아과 |
| 모양. | 고유(텍스트 참조) |
| 기능. | 음파를 증폭하고 청각 정보를 뇌간으로 전달합니다. |
| 신경전달물질 | 글루탐산염 |
| 시냅스 전 접속 | 없음. |
| 시냅스 후 연결 | 청각신경을 통해 전정골신경에서 하교골신경으로 |
| 식별자 | |
| NeuroLex ID | sao429277527, sao4292862, sao42862, |
| 신경해부술의 해부학적 용어 | |
모세포는 모든 척추동물의 귀와 물고기의 외측선 기관에 있는 청각계와 전정계 모두의 감각 수용체이다.모발세포는 기계이식을 통해 주변 [1]환경의 움직임을 감지한다.
포유동물에서 청각모세포는 내이의 달팽이관에 있는 얇은 기저막 위에 있는 코르티의 나선 기관 안에 있습니다.그들은 세포의 꼭대기 표면에서 액체로 채워진 달팽이관으로 돌출된 머리카락 다발이라고 불리는 입체성애의 다발에서 이름을 얻었다.각 세포에서 50-100개의 스테레오실리아 숫자가 촘촘히 채워져[2] 있고 키노실륨에서 [3]멀리 떨어져 있을수록 크기가 감소합니다.머리카락 다발은 [4]끝 부분에 가해지는 자극에 반응하여 바닥에서 움직이는 단단한 기둥으로 배열됩니다.
포유류의 달팽이관 털 세포는 외부와 내부 털 세포로 알려진 해부학적, 기능적으로 구별되는 두 가지 유형입니다.이러한 모발세포가 손상되면 청력이 저하되고 내이모세포가 재생되지 않기 때문에 [5]영구적인 손상이 된다.머리카락 세포가 손상되면 전정계가 손상되어 균형 유지에 어려움을 겪을 수 있습니다.하지만, 자주 연구되는 제브라피쉬와 같은 다른 유기체들과 새들은 재생될 [6][7]수 있는 털 세포를 가지고 있다.인간의 달팽이관은 태어날 [8]때 3,500개의 내모세포와 12,000개의 외모세포를 포함하고 있다.
외부 모세포는 [9][10]달팽이관으로 들어가는 낮은 수준의 소리를 기계적으로 증폭시킨다.증폭은 머리카락 다발의 움직임이나 세포체의 전기 구동 운동성에 의해 작동될 수 있습니다.이 소위 체세포전동성은 모든 육지 척추동물에서 소리를 증폭시킨다.그것은 머리카락 [citation needed]다발 끝의 기계적 감각 이온 채널의 폐쇄 메커니즘에 의해 영향을 받는다.
내부 털 세포는 달팽이관 액체의 소리 진동을 전기 신호로 변환하고, 전기 신호는 청각 신경을 통해 청각 뇌간과 청각 피질에 전달됩니다.
내부 모발 세포 – 소리에서 신경 신호까지

모세포 입체 성애의 편향은 기계적으로 게이트 이온 채널을 열어 양전하를 띤 작은 이온(주로 칼륨과 칼슘)이 [11]세포 안으로 들어오게 합니다.다른 많은 전기 활성 세포와 달리, 머리카락 세포는 활동 전위를 일으키지 않습니다.대신 스칼라 배지의 내림프로부터 양이온이 유입되면 세포가 탈분극되어 수용체 전위가 발생한다.이 수용체 전위는 전압 게이트 칼슘 채널을 엽니다. 그러면 칼슘 이온이 세포로 들어가 세포의 기저부에서 신경 전달 물질의 방출을 트리거합니다.신경전달물질은 머리카락 세포와 신경 말단 사이의 좁은 공간에 확산되어 수용체에 결합하고 신경에서 활동전위를 유발합니다.이와 같이 기계음성신호를 전기신경신호로 변환한다.모발세포의 재분극은 특별한 방법으로 이루어진다.스칼라 팀파니의 주변 림프는 매우 낮은 양의 이온 농도를 가지고 있다.전기화학적 구배는 양이온을 채널을 통해 페리림프로 흐르게 합니다.
모발세포는 만성적으로 Ca를 누출한다2+.이 누출은 시냅스로의 신경전달물질의 강장성 방출을 일으킨다.이 강장제 방출이 머리카락 세포가 기계적 자극에 반응하여 매우 빠르게 반응하도록 하는 것으로 생각된다.모발세포 반응이 빠른 것은 막 [12]전위의 100μV에 불과한 변화에 반응하여 신경전달물질 방출량을 증가시킬 수 있기 때문일 수도 있다.
머리카락 세포는 또한 두 가지 방법 중 하나를 통해 톤을 구별할 수 있다.첫 번째 방법은 모발세포 기저막의 전기적 공명을 이용한다.이 방법의 전기적 공명은 인가된 전류 펄스에 반응하는 멤브레인 전위의 감쇠 진동으로 나타납니다.두 번째 방법은 기저막의 색소 차이를 사용한다.이 차이는 모발세포의 다른 위치로부터 온다.고주파 공명을 가진 모세포는 기저부에 위치하는 반면, 현저하게 낮은 주파수 공명을 가진 모세포는 [13]상피의 꼭대기 끝에서 발견됩니다.
외부 모발 세포 – 음향 프리앰프
포유류의 외모세포에서는 다양한 수용체 전위가 세포체의 활성 진동으로 변환된다.전기 신호에 대한 이러한 기계적 반응을 [14]체전동성이라고 합니다. 이것은 들어오는 소리 신호에 동기화되어 셀 길이의 변화를 유도하고 전달되는 [15]파동에 대한 피드백에 의해 기계적 증폭을 제공합니다.
외부 털 세포는 포유류에서만 발견됩니다.포유류의 청각 민감도는 다른 종류의 척추동물과 비슷하지만, 외부 털세포가 기능을 하지 않으면, 민감도는 약 50dB [16]감소한다.외부 털 [17]세포는 일부 해양 포유류에서 청력 범위를 약 200킬로헤르츠까지 확장합니다.그들은 또한 정교한 음성과 음악을 가능하게 했기 때문에 인간에게 특히 유용한 주파수 선택성(주파수 식별)을 향상시켰다.외부 머리카락 세포는 세포에 저장된 ATP가 [14]고갈된 후에도 기능한다.
이 시스템의 효과는 큰 소리보다 조용한 소리를 비선형적으로 증폭시켜 광범위한 음압을 훨씬 작은 모발 [18]변위 범위로 줄일 수 있도록 하는 것입니다.이 증폭 특성은 달팽이관 증폭기라고 불립니다.
모발세포의 분자생물학은 최근 몇 년 동안 상당한 발전을 보였으며, 외부 모발세포에서 체세포의 전기동성을 뒷받침하는 운동단백질(프레스틴)의 식별이 이루어졌다.프레스틴의 기능은 염화물 채널 시그널링에 의존하며 일반적인 해양 농약 트리부틸틴에 의해 저하되는 것으로 나타났다.이 종류의 오염 물질 생물 농축은 먹이사슬을 따라 올라가기 때문에, 그 효과는 범고래와 [19]이빨고래와 같은 해양 포식자들에게서 두드러진다.
모발 세포 신호 어댑테이션
칼슘 이온 유입은 모발 세포가 신호의 증폭에 적응하는 데 중요한 역할을 한다.이것은 인간이 더 이상 새로운 것이 아닌 끊임없는 소리를 무시할 수 있게 하고 우리 주변의 다른 변화에 민감하게 반응하게 한다.주요 적응 메커니즘은 느린 적응을 가능하게 하고, 변환 채널을 감작시키기 위한 장력을 제공하며, 신호 변환 [20][21]장치에도 참여하는 모터 단백질 myosin-1c에서 비롯됩니다.최근 연구에 따르면 칼모듈린의 myosin-1c에 대한 칼슘 민감 결합은 실제로 적응 모터와 변환 장치의 다른 구성 요소의 상호작용을 조절할 수 있다.[22][23]
신속한 적응:고속적응 중 열린 MET 채널을 통해 스테레오실륨에 들어간 Ca 이온은 채널2+ 위 또는 그 부근에 빠르게 결합하여 채널 폐쇄를 유도한다.채널이 닫히면 팁 링크의 장력이 증가하여 번들을 반대 방향으로 [20]당깁니다.빠른 적응은 전정세포보다는 소리와 청각을 감지하는 모세포에서 더 두드러진다.
느린 적응:지배적 모델은 myosin-1c가 다발 [20]변위 중 높아진 장력에 반응하여 스테레오실륨 아래로 미끄러져 내려갈 때 느린 적응이 일어난다는 것을 시사한다.그 결과 팁 링크의 장력이 감소하여 번들이 반대 방향으로 더 멀리 이동할 수 있습니다.장력이 감소하면 채널이 닫히면서 변환 전류가 [20]감소합니다.느린 적응은 공간적 움직임을 감지하는 전정모세포에서 가장 두드러지고 청각 [21]신호를 감지하는 달팽이관모세포에서는 덜 두드러진다.
신경 연결
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2016년 9월 (이 및 ) |
청각 또는 전정신경(제8뇌신경)의 신경세포와 전정모세포.[24]구심성 뉴런의 말초 신경축을 자극하는 머리카락 세포에 의해 방출되는 신경전달물질은 글루탐산염으로 생각됩니다.시냅스 전 접합부에는 뚜렷한 시냅스 전 밀도의 몸체 또는 리본이 있습니다.이 촘촘한 몸은 시냅스 소포로 둘러싸여 있고 신경전달물질의 빠른 방출을 돕는 것으로 생각됩니다.
신경섬유 신경화는 모발세포보다 모발세포가 훨씬 더 밀도가 높다.단일 내부 모세포는 많은 신경 섬유에 의해 신경화되어 있는 반면, 단일 신경 섬유는 많은 외부 모세포에 신경화되어 있습니다.내측 모세포 신경 섬유는 또한 매우 많이 미엘리네이트 되어 있는데, 이는 미엘리네이트된 외측 모세포 신경 섬유와는 대조적이다.특정 구심성 신경 섬유에 입력을 공급하는 기저막 영역은 수용장으로 간주될 수 있다.
뇌에서 달팽이관으로의 효율적인 돌기 또한 소리의 지각에 역할을 한다.외부 모발세포와 내부 모발세포 아래의 구심성 축삭에서 시냅스가 발생한다.시냅스 전 말단 부톤은 아세틸콜린을 포함한 소포와 칼시토닌 유전자 관련 펩타이드라고 불리는 신경펩타이드로 채워져 있다.이러한 화합물의 효과는 다양하다; 어떤 머리카락 세포에서는 아세틸콜린이 세포를 과분극시켜 국소적으로 달팽이관의 민감도를 감소시킨다.
리그로즈
달팽이관 세포의 재생에 대한 연구는 청력을 회복시키는 의학적인 치료로 이어질 수 있다.새나 어류와 달리, 인간과 다른 포유류는 일반적으로 나이가 들거나 질병에 [7][25]의해 손상되었을 때 소리를 신경 신호로 변환하는 내이의 세포를 재생시킬 수 없다.연구자들은 손상된 세포를 재생시킬 수 있는 유전자 치료와 줄기세포 치료에서 진전을 보이고 있다.조류와 물고기의 청각과 전정계의 털세포가 재생되는 것이 발견되었기 때문에 그 능력이 [7][26]상세하게 연구되었다.또한, 기계 전달 기능을 가진 가로줄모세포는 제브라피쉬와 [27]같은 유기체에서 다시 자라는 것으로 나타났습니다.
연구자들은 보통 [28]성인의 달팽이관 털 세포의 재생을 차단하는 분자 스위치 역할을 하는 포유류의 유전자를 밝혀냈다.Rb1 유전자는 종양 억제제인 망막아종 단백질을 암호화한다.Rb는 세포주기에서 [29][30]세포분열을 촉진함으로써 세포분열을 막는다.배양 접시의 털세포는 Rb1 유전자가 삭제되면 재생될 뿐만 아니라 유전자를 잃도록 사육된 쥐는 유전자를 가진 쥐보다 더 많은 털세포가 자란다.또한 소닉 헤지호그 단백질은 망막아종 단백질의 활성을 차단하여 세포주기 재진입 및 새로운 세포의 [31]재증식을 유도하는 것으로 나타났다.
감마 시크리테아제 억제제 LY3056480을 포함한 여러 노치 신호 경로 억제제는 달팽이관에서 [32][33]모세포를 재생하는 잠재적 능력을 위해 연구되고 있다.
TBX2(T-box 전사인자 2)는 내모세포와 외모세포의 [34]분화에 있어 주요 조절인자로 나타났다.이 발견은 연구자들이 모세포가 내부 또는 외부 모세포로 발달하도록 지시할 수 있게 해주었는데, 이것은 죽은 모세포를 대체하고 청력 [35][36]손실을 예방하거나 되돌리는데 도움을 줄 수 있다.
세포주기억제제 p27kip1(CDKN1B)은 또한 유전자 결실 또는 p27을 [37][38]대상으로 한 siRNA로 생쥐의 달팽이관 털세포의 재생을 촉진하는 것으로 밝혀졌다.모발세포 재생에 대한 연구는 모발세포 손상이나 사망에 의해 야기되는 청력 손실의 임상 치료에 우리를 더 가깝게 할 수 있다.
기타 이미지
망막 및 아인접 구조.
레퍼런스
- ^ Lumpkin, Ellen A.; Marshall, Kara L.; Nelson, Aislyn M. (2010). "The cell biology of touch". The Journal of Cell Biology. 191 (2): 237–248. doi:10.1083/jcb.201006074. PMC 2958478. PMID 20956378.
- ^ McPherson, Duane (June 18, 2018). "Sensory Hair Cells: An Introduction to Structure and Physiology". Integrative and Comparative Biology. 58 (2): 282–300. doi:10.1093/icb/icy064. PMC 6104712. PMID 29917041.
- ^ Schlosser, Gerhard (June 1, 2018). "A Short History of Nearly Every Sense—The Evolutionary History of Vertebrate Sensory Cell Types". Integrative and Comparative Biology. 58 (2): 301–316. doi:10.1093/icb/icy024. PMID 29741623.
- ^ Swalla, Billie (June 20, 2018). "High Time for Hair Cells: An Introduction to the Symposium on Sensory Hair Cells". Integrative and Comparative Biology. 58 (2): 276–281. doi:10.1093/icb/icy070. PMC 6104703. PMID 30137315.
- ^ Nadol, Joseph B. (1993). "Hearing loss". New England Journal of Medicine. 329 (15): 1092–1102. doi:10.1056/nejm199310073291507. PMID 8371732.
- ^ Lush, Mark E.; Piotrowski, Tatjana (2013). "Sensory hair cell regeneration in the zebrafish lateral line". Developmental Dynamics. 243 (10): 1187–1202. doi:10.1002/dvdy.24167. PMC 4177345. PMID 25045019.
- ^ a b c Cotanche, Douglas A. (1994). "Hair cell regeneration in the bird cochlea following noise damage or ototoxic drug damage". Anatomy and Embryology. 189 (1): 1–18. doi:10.1007/bf00193125. PMID 8192233. S2CID 25619337.
- ^ Remy Pujol, Regis Nouvian, Marc Lenoir, "헤어셀(cochlea.eu)"
- ^ Ashmore, Jonathan Felix (1987). "A fast motile response in guinea-pig outer hair cells: the cellular basis of the cochlear amplifier". The Journal of Physiology. 388 (1): 323–347. doi:10.1113/jphysiol.1987.sp016617. ISSN 1469-7793. PMC 1192551. PMID 3656195.
- ^ Ashmore, Jonathan (2008). "Cochlear Outer Hair Cell Motility". Physiological Reviews. 88 (1): 173–210. doi:10.1152/physrev.00044.2006. ISSN 0031-9333. PMID 18195086. S2CID 17722638.
- ^ Müller, U (October 2008). "Cadherins and mechanotransduction by hair cells". Current Opinion in Cell Biology. 20 (5): 557–566. doi:10.1016/j.ceb.2008.06.004. PMC 2692626. PMID 18619539.
- ^ Chan DK, Hudspeth AJ (February 2005). "Ca2+ current-driven nonlinear amplification by the mammalian cochlea in vitro". Nature Neuroscience. 8 (2): 149–155. doi:10.1038/nn1385. PMC 2151387. PMID 15643426.
- ^ McPherson, Duane R (2018-08-01). "Sensory Hair Cells: An Introduction to Structure and Physiology". Integrative and Comparative Biology. 58 (2): 282–300. doi:10.1093/icb/icy064. ISSN 1540-7063. PMC 6104712. PMID 29917041.
- ^ a b Brownell WE, Bader CR, Bertrand D, de Ribaupierre Y (1985-01-11). "Evoked mechanical responses of isolated cochlear outer hair cells". Science. 227 (4683): 194–196. Bibcode:1985Sci...227..194B. doi:10.1126/science.3966153. PMID 3966153.
- ^ 전기자극에 따라 움직이는 고립된 외모세포를 보여주는 동영상은 이곳에서 볼 수 있다(physiol.ox.ac.uk).Wayback Machine에서 2012-03-07 아카이브 완료
- ^ Géléoc GS, Holt JR (2003). "Auditory amplification: outer hair cells pres the issue". Trends Neurosci. 26 (3): 115–7. doi:10.1016/S0166-2236(03)00030-4. PMC 2724262. PMID 12591210.
- ^ Wartzog D, Ketten DR (1999). "Marine Mammal Sensory Systems" (PDF). In Reynolds J, Rommel S (eds.). Biology of Marine Mammals. Smithsonian Institution Press. p. 132. S2CID 48867300. Archived from the original (PDF) on 2018-09-19.
- ^ Hudspeth AJ (2008-08-28). "Making an effort to listen: mechanical amplification in the ear". Neuron. 59 (4): 530–45. doi:10.1016/j.neuron.2008.07.012. PMC 2724262. PMID 18760690.
- ^ Santos-Sacchi Joseph; Song Lei; Zheng Jiefu; Nuttall Alfred L (2006-04-12). "Control of mammalian cochlear amplification by chloride anions". Journal of Neuroscience. 26 (15): 3992–8. doi:10.1523/JNEUROSCI.4548-05.2006. PMC 6673883. PMID 16611815.
- ^ a b c d Gillespie, P. G.; Cyr, J. L. (2004). "Myosin-1c, the hair cell's adaptation motor". Annual Review of Physiology. 66: 521–45. doi:10.1146/annurev.physiol.66.032102.112842. PMID 14977412.
- ^ a b Stauffer, E. A.; Holt, J. R. (2007). "Sensory transduction and adaptation in inner and outer hair cells of the mouse auditory system". Journal of Neurophysiology. 98 (6): 3360–9. doi:10.1152/jn.00914.2007. PMC 2647849. PMID 17942617.
- ^ Cyr, J. L.; Dumont, R. A.; Gillespie, P. G. (2002). "Myosin-1c interacts with hair-cell receptors through its calmodulin-binding IQ domains". The Journal of Neuroscience. 22 (7): 2487–95. doi:10.1523/JNEUROSCI.22-07-02487.2002. PMC 6758312. PMID 11923413.
- ^ Housley, G D; Ashmore, J F (1992). "Ionic currents of outer hair cells isolated from the guinea-pig cochlea". The Journal of Physiology. 448 (1): 73–98. doi:10.1113/jphysiol.1992.sp019030. ISSN 1469-7793. PMC 1176188. PMID 1593487.
- ^ "Cranial Nerve VIII. Vestibulocochlear Nerve". Meddean. Loyola University Chicago. Retrieved 2008-06-04.
- ^ Edge AS, Chen ZY (2008). "Hair cell regeneration". Current Opinion in Neurobiology. 18 (4): 377–82. doi:10.1016/j.conb.2008.10.001. PMC 5653255. PMID 18929656.
- ^ Lombarte A, Yan HY, Popper AN, Chang JS, Platt C (January 1993). "Damage and regeneration of hair cell ciliary bundles in a fish ear following treatment with gentamicin". Hear. Res. 64 (2): 166–74. doi:10.1016/0378-5955(93)90002-i. PMID 8432687. S2CID 4766481.
- ^ Whitfield, T.T (2002). "Zebrafish as a model for hearing and deafness". Journal of Neurobiology. 53 (2): 157–171. doi:10.1002/neu.10123. PMID 12382273.
- ^ Henderson M (2005-01-15). "Gene that may no longer turn a deaf ear to old age". Times Online.
- ^ Sage, Cyrille; Huang, Mingqian; Vollrath, Melissa A.; Brown, M. Christian; Hinds, Philip W.; Corey, David P.; Vetter, Douglas E.; Zheng-Yi, Chen (2005). "Essential role of retinoblastoma protein in mammalian hair cell development and hearing". Proceedings of the National Academy of Sciences of the United States of America. 103 (19): 7345–7350. Bibcode:2006PNAS..103.7345S. doi:10.1073/pnas.0510631103. PMC 1450112. PMID 16648263.
- ^ Raphael Y, Martin DM (July 2005). "Deafness: lack of regulation encourages hair cell growth". Gene Ther. 12 (13): 1021–2. doi:10.1038/sj.gt.3302523. PMID 19202631. S2CID 28974038.
- ^ Lu, Na; Chen, Yan; Wang, Zhengmin; Chen, Guoling; Lin, Qin; Chen, Zheng-Yi; Li, Huawei (2013). "Sonic hedgehog initiates cochlear hair cell regeneration through downregulation of retinoblastoma protein". Biochemical and Biophysical Research Communications. Elsevier. 430 (2): 700–705. doi:10.1016/j.bbrc.2012.11.088. PMC 3579567. PMID 23211596.
- ^ Erni, Silvia T.; Gill, John C.; Palaferri, Carlotta; Fernandes, Gabriella; Buri, Michelle; Lazarides, Katherine; Grandgirard, Denis; Edge, Albert S. B.; Leib, Stephen L.; Roccio, Marta (13 August 2021). "Hair Cell Generation in Cochlear Culture Models Mediated by Novel γ-Secretase Inhibitors". Frontiers in Cell and Developmental Biology. Frontiers Media SA. 9. doi:10.3389/fcell.2021.710159. ISSN 2296-634X.
- ^ Samarajeewa, Anshula; Jacques, Bonnie E.; Dabdoub, Alain (8 May 2019). "Therapeutic Potential of Wnt and Notch Signaling and Epigenetic Regulation in Mammalian Sensory Hair Cell Regeneration". Molecular Therapy. Elsevier BV. 27 (5): 904–911. doi:10.1016/j.ymthe.2019.03.017. ISSN 1525-0016.
- ^ García-Añoveros, Jaime; Clancy, John C.; Foo, Chuan Zhi; García-Gómez, Ignacio; Zhou, Yingjie; Homma, Kazuaki; Cheatham, Mary Ann; Duggan, Anne (2022-05-04). "Tbx2 is a master regulator of inner versus outer hair cell differentiation". Nature: 1–6. doi:10.1038/s41586-022-04668-3. ISSN 1476-4687. PMID 35508658. Retrieved 2022-05-08.
- ^ Paul, Marla (2022-05-04). "New Tool to Create Hearing Cells Lost in Aging". Northwestern Medicine News Center. Retrieved 2022-05-11.
- ^ Handsley-Davis, Matilda (2022-05-05). "Genetic discovery may help scientists reverse hearing loss". Cosmos. Royal Institution of Australia. Retrieved 2022-05-11.
- ^ Löwenheim H, ShakespeareDN수 있다고 J-Zinn C, Gültig K, Fero 맥스 경우 프로스트는 D, Gummer 아이 차, 로버츠 JM, Rubel 전자장비, 해크니 CM, Zenner HP(1999-03-30)."p27의 유전자 혼란(Kip1)코르티의 성인 산후 기관에 세포 증식할 수 있".Proc Natl로 Sci USA96(7):4084–8.Bibcode:1999PNAS...96.4084L. doi:10.1073/pnas.96.7.4084. 1.22424.PMID 10097167.(주요 근원지)
- ^ Ono K, Nakagawa T, Kojima K, Matsumoto M, Kawauchi T, Hoshino M, Ito J (Dec 2009). "Silencing p27 reverses post-mitotic state of supporting cells in neonatal mouse cochleae" (PDF). Mol Cell Neurosci. 42 (4): 391–8. doi:10.1016/j.mcn.2009.08.011. hdl:2433/87734. PMID 19733668. S2CID 206831997. (프라이머리 소스)
참고 문헌
- Coffin A, Kelley M, Manley GA, Popper AN (2004). "Evolution of sensory hair cells". In Manley, et al. (eds.). Evolution of the Vertebrate Auditory System. pp. 55–94.
- Fettiplace R, Hackney CM (2006). "The sensory and motor roles of auditory hair cells". Nature Reviews. Neuroscience. 7 (1): 19–29. doi:10.1038/nrn1828. PMID 16371947. S2CID 10155096.
- Kandel ER, Schwartz JH, Jessell TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. pp. 590–594. ISBN 0-8385-7701-6.
- Manley GA, Popper AN, Fay RR (2004). Evolution of the Vertebrate Auditory System. New York: Springer-Verlag. ISBN 0-387-21093-8.
- Manley GA (2004). "Advances and perspectives in the study of the evolution of the vertebrate auditory system". In Manley, et al. (eds.). Evolution of the Vertebrate Auditory System. pp. 360–368.
- Rabbitt RD, Boyle R, Highstein SM (1–5 February 2010). "Mechanical amplification by hair cells in the semicircular canals". Proceedings of the National Academy of Sciences. 107 (8): 3864–9. Bibcode:2010PNAS..107.3864R. doi:10.1073/pnas.0906765107. PMC 2840494. PMID 20133682.
- "Built-in amps: How subtle head motions, quiet sounds are reported to the brain". Medical Xpress. February 9, 2010.
- Breneman KD, Brownell WE, Rabbitt RD (22 April 2009). Brezina V (ed.). "Hair cell bundles: flexoelectric motors of the inner ear". PLOS ONE. 4 (4): e5201. Bibcode:2009PLoSO...4.5201B. doi:10.1371/journal.pone.0005201. PMC 2668172. PMID 19384413.
- "Power steering for your hearing: Ears have tiny 'flexoelectric' motors to amplify sound". Phys.org (Press release). April 22, 2009.
외부 링크
- 청력의 분자적 기초
- 외부 모발세포 춤 '록 어라운드 24시간'
- 댄싱 OHC 비디오 예일 이어랩
- NIF 검색 – 신경과학 정보 프레임워크를 통한 모발 세포
- Hair-Tuning-Sound-Sensor Archive 2021-08-26 Wayback Machine SMME, IIT Ropar 학생들의 헤어 튜닝을 기반으로 한 사운드 센서의 최근 개발에 대한 간결한 보고서




