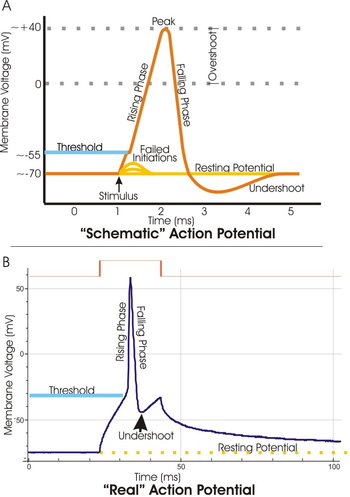
임계값 전위
Threshold potential전기생리학에서 임계 전위는 작용 전위를 시작하기 위해 막 전위를 탈극화해야 하는 임계 레벨이다.신경과학에서는 중추신경계(CNS)와 말초신경계(PNS) 양쪽에서 신호를 조절하고 전파하기 위해 문턱전위가 필요하다.null
대부분의 경우 임계 전위는 –50 ~ –55mV 사이의 막 전위 값이지만,[1] 몇 가지 요인에 따라 달라질 수 있다.뉴런의 휴식막 전위(–70mV)는 나트륨과 칼륨 이온을 통해 문턱에 도달할 가능성을 증가시키거나 감소시키기 위해 변경될 수 있다.개방된 전압 정량 나트륨 채널을 통해 세포로 나트륨이 유입되면 임계값을 지나 막이 탈극화될 수 있어 이를 흥분시킬 수 있고, 칼륨의 유출이나 염화물이 유입되면 세포가 초극화되어 문턱에 도달하지 못하게 할 수 있다.null
디스커버리
초기 실험은 뉴런에서 발생하는 어떠한 전기적 변화도 이온의 작용을 통해 일어나야 한다는 개념을 중심으로 진행되었다.독일의 물리 화학자 발터 네른스트는 신경 흥분성을 발견하기 위해 이 개념을 실험에 적용시켰고, 반투과성 막을 통한 국소 흥분 과정은 이온농도에 따라 결정된다고 결론지었다.또한 이온농도는 흥분제한인자로 나타났다.만약 이온의 적절한 농도에 도달했다면, 확실히 흥분은 일어날 것이다.[2]이것이 임계값을 발견하기 위한 기초였다.null
1950년대 액션 잠재력을 재구성하는 것과 함께 앨런 로이드 호지킨과 앤드류 헉슬리는 또한 흥분 임계치 뒤의 메커니즘을 실험적으로 결정할 수 있었다.호지킨-로 알려져 있다.헉슬리 모델.오징어 거대 액손에 전압 클램프 기법을 사용함으로써, 그들은 흥분성 조직이 일반적으로 작용 전위를 발사하기 위해 특정 막 전위에 도달해야 하는 현상을 보인다는 것을 발견했다.이 실험은 이온 전도성 변화의 관찰을 통해 결과를 얻었기 때문에, 호지킨과 헉슬리는 이 용어를 사용하여 임계 전위를 논했다.그들은 처음에 나트륨 또는 칼륨의 전도성에 불연속성이 있어야 한다고 제안했지만, 실제로는 두 전도성이 막 전위와 함께 부드럽게 변화하는 경향이 있었다.[3]null
그들은 곧 임계 전위에서 나트륨과 칼륨 이온의 내부와 외부 전류가 각각 정확히 같으며 반대라는 것을 발견했다.휴면막 전위와 반대로 문턱 전위의 조건은 불안정한 전류의 균형을 보였다.불안정성은 더 이상의 탈분극화가 훨씬 더 많은 전압 게이트 나트륨 채널을 활성화하고, 유입되는 탈분극화 전류가 칼륨의 지연된 외부 전류를 극복한다는 사실을 말한다.[4]반면 휴식 수준에서는 칼륨과 나트륨 전류가 안정적 방식으로 동일하고 반대인데, 이때 이온이 갑자기 연속적으로 흐르면 안 된다.그 근거는 특정한 탈극화 수준에서 전류가 불안정한 방식으로 동일하고 반대일 때, 양전하의 추가 진입은 작용 전위를 발생시킨다는 것이다.이 특정한 탈극화 값(mV 단위)은 임계 전위로 알려져 있다.null
생리적 기능 및 특성
임계값은 들어오는 자극이 작용 잠재력을 생성하기에 충분한지 여부를 제어한다.그것은 들어오는 억제 자극과 흥분 자극의 균형에 의존한다.자극에 의해 생성되는 전위는 부가적이며, 그 주파수와 진폭에 따라 임계치에 도달할 수 있다.중추신경계의 정상적인 기능에는 뉴런의 덴드리트 나무에 주로 만들어진 시냅스 입력의 합계가 수반된다.주로 외부 자극과 관련이 있는 이러한 국소 등급의 잠재력은 축 초기 세그먼트에 도달하고 한계값에 도달할 때까지 구축한다.[5]자극이 클수록 탈극화가 크거나 문턱에 도달하려고 시도한다.탈극화 작업은 세포의 해부학적 요인에 의존하는 몇 가지 핵심 단계를 필요로 한다.관련된 이온 전도성은 막 전위와 막 전위가 변화한 후의 시간에 따라 달라진다.[6]null
휴면막전위
세포막의 인지질 빌레이어는 그 자체로 이온에 매우 불침투성이다.세포막의 전체 구조는 지질 빌레이어에 내장되거나 완전히 교차하는 많은 단백질을 포함한다.그 단백질들 중 일부는 이온, 이온 채널의 매우 특정한 통로를 허용한다.누출 칼륨 채널은 세포 내부와 외부(낮은 농도) 칼륨 농도의 격차에 대응하여 칼륨이 막을 통해 흐를 수 있도록 한다.세포 내부에서 칼륨(K+) 이온의 양(+) 전하가 손실되면 세포막 외 표면에 비해 음전위가 발생한다.[7]셀에 나트륨(Na+)이 훨씬 더 작으면 실제 휴식 전위 약 –70mV가 되며, K+에만 대해 계산된 전위, 평형 전위 약 –90mV보다 음수가 적다.[7]나트륨-칼륨 ATPase는 세포 내에서 칼륨(2 이온)을 세포로, 나트륨(3 이온)을 세포 밖으로 다시 펌프하는 활성 전달체로, 두 이온의 농도를 유지하면서 전압 양극화를 보존한다.null
탈극화
그러나, 자극이 일단 전압에 의한 나트륨 채널을 활성화시켜 개방하면 양의 나트륨 이온이 세포로 흘러들어와 전압이 증가한다.이 과정은 또한 리간드 또는 신경전달물질을 리간드 게이트 채널에 결합함으로써 시작될 수 있다.내부에 비해 더 많은 나트륨이 세포 바깥에 있고, 세포 내 양전하가 지연정화 전압-기화 칼륨 채널을 통해 칼륨 이온의 유출을 촉진한다.세포막 내의 칼륨 채널이 지연되기 때문에 나트륨의 추가 유입은 점점 더 많은 전압 정량 나트륨 채널을 활성화시킨다.임계값을 초과하는 탈분극화는 즉시 바깥쪽 칼륨 운동을 늪에 빠뜨릴 수 있는 내부 나트륨 이동에 충분한 Na의 전도성을 증가시킨다.[3]나트륨 이온의 유입이 임계치에 도달하지 못하면 나트륨 전도성은 휴식 중인 칼륨 전도율을 초과할 만큼 충분히 증가하지 않는다.그 경우, 어떤 종류의 뉴런에서 아임계 막 전위 진동이 관찰된다.성공하면 양전하의 갑작스러운 유입으로 막이 탈극화되고, 칼륨은 세포의 재확립, 즉 과극화가 지연된다.나트륨 유입은 세포의 내부를 외부와 비교하여 보다 양성으로 만들기 위해 자신의 평형전위(약 +52mV)를 확립하기 위해 세포의 분극화를 시도한다.null
변형
임계값은 수많은 요인에 따라 달라질 수 있다.나트륨 또는 칼륨의 이온 전도율 변화는 임계값을 높이거나 낮출 수 있다.또한 액손의 직경, 전압 활성 나트륨 채널의 밀도, 액손 내 나트륨 채널의 특성이 모두 임계값에 영향을 미친다.[8]일반적으로 액손이나 덴드라이트에는 선행 자극으로 인한 소량의 탈극화 또는 초극화 신호가 있다.이러한 신호의 수동적 확산은 셀의 수동적 전기적 특성에 따라 달라진다.이 신호들은 세포의 막 저항과 캐패시턴스를 통과할 수 있을 정도로 충분히 강할 경우에만 뉴런을 따라 계속하여 작용 전위를 더 떨어뜨릴 수 있다.예를 들어 직경이 큰 뉴런은 작은 세포보다 막에 이온 채널이 많아 이온 전류의 흐름에 대한 저항이 낮다.전류는 저항이 적은 세포에서 더 빨리 퍼지며, 뉴런의 다른 부분에서 문턱에 도달할 가능성이 더 높다.[3]null
또한 이러한 나트륨 채널을 전체적으로 비활성화할 뿐만 아니라 나트륨 채널 밀도를 조절하여 느린 입력 특성 변화에 적응하기 위한 임계값 전위도 실험적으로 입증되었다.지연정화 칼륨 채널에 의한 극지방화는 상대적 내화 기간을 유발하여 문턱에 도달하기 훨씬 더 어렵게 한다.지연 보정 칼륨 채널은 빠르게 활성화된 나트륨 채널과 비교하여 다른 전압 자극으로 개방되는 작용 전위의 늦은 바깥 위상에 책임이 있다.그들은 칼륨이 세포 안쪽에서 바깥쪽으로 농도 경사로를 열고 아래로 흐르게 함으로써 막을 가로질러 이온의 균형을 바로잡거나 보수한다.또한 천천히 닫히므로 필요한 잔액을 초과하는 양의 전하가 바깥으로 흐르게 된다.그것은 세포의 과도한 부정을 초래하고, 극도로 큰 자극을 필요로 하며, 반응을 일으키기 위해 탈극화를 초래한다.null
추적 기법
문턱 추적 기법은 신경 흥분성을 시험하며, 축막의 특성과 자극 부위의 특성에 따라 달라진다.그들은 막 전위와 이 전위의 변화에 극도로 민감하다.이러한 테스트는 제어 임계값(또는 정지 임계값)을 이전의 단일 임펄스, 임펄스 열차 또는 하위 임계값 전류에 의해 환경 변화에 의해 생성된 임계값과 측정하고 비교할 수 있다.[9]문턱의 변화를 측정하는 것은 막 전위, 축 특성 및/또는 골수 피복의 무결성의 변화를 나타낼 수 있다.null
임계값 추적은 최대 신경 또는 근육 전위의 정의된 부분을 활성화하기 위해 컴퓨터가 시험 자극의 강도를 조정할 수 있도록 한다.문턱 추적 실험은 1ms 자극이 일정한 간격으로 신경에 가해지는 것으로 구성된다.[10]작용 전위는 촉발 충동에서 하류로 기록된다.자극은 반응이 목표치(행동 잠재력 생성) 이하로 떨어질 때까지 설정된 비율의 단계에서 자동으로 감소한다.그 후, 휴식(또는 제어) 임계값이 설정될 때까지 이전의 반응이 목표 반응보다 작았거나 더 컸는지에 따라 자극이 상향 또는 하향 조정된다.신경 흥분성은 신경 환경을 바꾸거나 추가 전류를 가함으로써 바뀔 수 있다.단일 임계값 전류 값은 피사체 내에서 또는 피사체 간에 다르기 때문에 임계값 측정 쌍에 따라 달라지기 때문에 제어 임계값을 굴절성, 초정규성, 강도-기간 상수 또는 "임계값 전자동"에 의해 생성된 임계값과 비교하는 것이 과학 및 클론에서 더 유용하다.비논리적 [11]연구null
추적 임계값은 상수 자극 방법과 같은 다른 전기생리학 기법보다 장점이 있다.이 기법은 200%의 동적 범위 내에서 임계값 변화를 추적할 수 있으며 일반적으로 다른 시험보다 축 특성에 대한 더 많은 통찰력을 제공한다.[12]또한 이 기법은 문턱값의 변화를 정량적 값으로 부여할 수 있게 하는데, 수학적으로 백분율로 환산할 때 다른 종에서 단일 섬유질과 다구체 준비물, 서로 다른 신경 부위, 신경 흥분성 등을 비교하는 데 사용할 수 있다.[12]null
"트레스홀드 전자동"
특정 임계값 추적 기법은 임계값 추적 설정을 사용하여 멤브레인 내에서 분극화 또는 과극화 전류를 장기간 지속하는 임계 추적 설정을 사용한다.세포의 흥분성의 변화는 이러한 오래 지속되는 전류를 생성함으로써 관찰되고 기록될 수 있다.광범위한 탈극화 동안 임계값 감소는 명백하며, 광범위한 초극화로 임계값 증가가 명백하다.초극화하면 칼륨 채널 폐쇄로 인해 내부 막의 저항이 증가하며, 결과적으로 플롯이 "빠져 나간다"는 것이다.탈분극화는 칼륨 채널을 활성화하여 "팬스 인" 줄거리를 만들어내면서 반대의 효과를 낸다.[13]null
임계 전자동위원소를 결정하는 가장 중요한 요소는 막 전위(membrane potential)이기 때문에 임계 전자동위원소는 막 전위 지수로도 사용될 수 있다.또한 문턱값 전위에 대한 해당 조건의 영향과 실험적으로 본 영향을 비교함으로써 유의미한 의료 조건의 특성을 식별하는 데 사용할 수 있다.예를 들어, 허혈과 탈극화는 전자파 파형의 동일한 "팬닝 인" 효과를 유발한다.이러한 관찰은 허혈이 칼륨 채널의 과다 활성화로 인해 발생할 수 있다는 결론을 이끌어낸다.[14]null
임상적 유의성
문턱 전위의 역할은 임상적 맥락, 즉 신경계 자체의 기능뿐 아니라 심혈관계에도 관여되어 왔다.null
발작성 발작
발열성 발작, 즉 "발열성 발작"은 체온의 현저한 상승과 관련된 경련으로, 유아기에 가장 흔히 발생한다.소아 열전 발작의 반복적인 에피소드는 성인기에 측두엽 간질의 위험 증가와 관련이 있다.[15]null
패치 클램프 기록을 통해 체온 유도에 따라 랫드 피질 뉴런에서 유사한 상태가 체외에서 복제되었다. 문턱 전위의 현저한 감소가 관찰되었다.이러한 감소의 메커니즘은 과도한 열 노출로 GABAB 수용체에 의해 매개되는 억제의 억제를 포함할 수 있다.[15]null
ALS와 당뇨병
신경 흥분성의 이상은 근위축성 측경화증 및 당뇨병 환자에게서 발견되었다.궁극적으로 두 조건의 분산을 담당하는 메커니즘은 다르지만, 허혈에 대한 반응을 통한 테스트는 역설적으로 허혈과 그에 따른 허혈에 대한 유사한 저항성을 나타낸다.나트륨-칼륨 펌프의 억제를 통해 허혈이 발생하므로 임계 전위의 이상이 관련된다.[12]null
부정맥증
1940년대 이후, 2분극성 탈분극화, 즉 "우주메이커의 잠재력"이라는 개념이 확립되었다. 이 메커니즘은 심장 조직의 특징이다.[16]임계값에 도달하고 그에 따른 작용 가능성이 발화되면, 심장 박동은 상호작용에서 비롯된다. 그러나, 이 심장 박동이 불규칙한 시간에 발생할 경우, 잠재적으로 심각한 상태가 아르히트리아로 알려질 수 있다.null
의약품 사용
다양한 약물은 QT 간격의 연장을 부작용으로 제시할 수 있다.이 간격의 연장은 나트륨과 칼슘 채널 불활성화의 지연의 결과로, 적절한 채널 불활성화 없이는 임계 전위에 이르기 때문에 부정맥이 발생하는 경향이 있다.[17]친부정맥제라고 알려진 이 약들에는 항균제, 항정신병 약물, 메타돈, 아이러니하게도 부정맥제 등이 포함된다.[18]중환자실에서는 특히 이러한 약제의 사용이 빈번하며, 이러한 환자에서 QT 간격이 길어질 때 특별한 주의를 기울여야 한다: QT 간격이 길어짐에 따른 부정맥은 잠재적으로 치명적인 토르사이드 데 포인트(TdP)를 포함한다.[17]null
식생활의 역할
부정맥의 위험에는 식이요법이 변수가 될 수 있다.어유와 여러 식물유에서 발견되는 다불포화지방산은 부정맥을 예방하는 역할을 한다.[19][20]전압에 의존하는 나트륨 전류를 억제함으로써 이들 오일은 임계 전위를 보다 양의 값으로 이동시키므로 작용 전위는 탈극화를 증가시켜야 한다.[20]이러한 추출물을 임상적으로 치료적으로 사용하는 것은 여전히 연구 대상이지만, 정기적인 어유 섭취와 심방세동 입원의 빈도수 감소 사이에 강한 상관관계가 형성되어 심하고 점점 흔해지고 있다.[21]null
메모들
- ^ Seifter 2005, 페이지 55. 대상 2005
- ^ 러시턴 1927 페이지 358.
- ^ a b c Nicholls 2012, 페이지 121. 오류: 없음:
- ^ Nicholls 2012, 페이지 . sfn
- ^ 스튜어트 1997, 페이지 127.
- ^ 1963년 트라우트웨인 페이지 330.
- ^ a b Nichols 2012, 페이지 144. 대상
- ^ 1963년 트라우트웨인 페이지 281.
- ^ 보스토크 1997, 페이지 137.
- ^ 보스토크 1997, 페이지 138.
- ^ 버크 2001, 페이지 1576. (
- ^ a b c 보스토크 1997, 페이지 141.
- ^ 버크 2001, 페이지 1581. (
- ^ 보스토크 1997, 페이지 150.
- ^ a b Wang 2011, 페이지 87. (
- ^ 몬프레디 2010, 페이지 1392. 2010
- ^ a b Nelson 2011, 페이지 292. (
- ^ Nelson 2011, 페이지 291. (
- ^ "Polyunsaturated Fat". American Heart Association. Retrieved 22 May 2018.
- ^ a b Savelieva 2010, 페이지 213.
- ^ Savelieva 2010, 페이지 213–215.
참조
- Bostock, Hugh; Cikurel, Katia; Burke, David (1998). "Threshold tracking techniques in the study of human peripheral nerve". Muscle & Nerve. 21 (2): 137–158. doi:10.1002/(SICI)1097-4598(199802)21:2<137::AID-MUS1>3.0.CO;2-C.
- Burke, D; Kiernan, Matthew C; Bostock, Hugh (2001). "Excitability of human axons". Clinical Neurophysiology. 112 (9): 1575–1585. doi:10.1016/S1388-2457(01)00595-8.
- Monfredi, O; Dobrzyński, H; Mondal, T; Boyett, MR; Morris, GM (2010). "The Anatomy and Physiology of the Sinoatrial Node—A Contemporary Review". Pacing and Clinical Electrophysiology. 33 (11): 1392–1406. doi:10.1111/j.1540-8159.2010.02838.x. PMID 20946278.
- Nelson, S; Leung, J (2011). "QTc Prolongation in the Intensive Care Unit: A Review of Offending Agents". AACN Advanced Critical Care. 22 (4): 289–295. doi:10.1097/NCI.0b013e31822db49d. PMID 22064575.
- Nicholls, J. G.; Martin, A. R.; Fuchs, P. A.; Brown, D. A.; Diamond, M. E.; Weisblat, D. A. (2012). From Neuron to Brain (5th ed.). Sunderland, Massachusetts: Sinauer Associates, Inc.
- Rushton, W. A. H. (1927). "The effect upon the threshold for nervous excitation of the length of nerve exposed, and the angle between current and nerve". The Journal of Physiology. 63 (4): 357–377. doi:10.1113/jphysiol.1927.sp002409. PMC 1514939. PMID 16993895.
- Savelieva, I; Kourliouros, Antonios; Camm, John (2010). "Primary and secondary prevention of atrial fibrillation with statins and polyunsaturated fatty acids: review of evidence and clinical relevance". Naunyn-Schmiedeberg's Archives of Pharmacology. 381 (3): 207–219. doi:10.1007/s00210-009-0468-y. PMID 19937318.
- Seifter, Julian; Ratner, Austin; Sloane, David (2005). Concepts in Medical Physiology. Lippincott Williams & Wilkins. ISBN 978-0781744898.
- Stuart, G; Spruston, N; Sakmann, B; Häusser, M (1997). "Action potential initiation and backpropagation in neurons of the mammalian CNS" (PDF). Trends in Neurosciences. 20 (3): 125–131. doi:10.1016/S0166-2236(96)10075-8. PMID 9061867.
- Trautwein, W (1963). "Generation and conduction of impulses in the heart as affected by drugs". Pharmacological Reviews. 15 (2): 277–332.
- Wang, Y; Qin, J; Han, Y; Cai, J; Xing, G (2011). "Hyperthermia induces epileptiform discharges in cultured rat cortical neurons". Brain Research. 1417: 87–102. doi:10.1016/j.brainres.2011.08.027. PMID 21907327.
외부 링크
- Nosek, Thomas M. "Section 1/1ch4/s1ch4_8". Essentials of Human Physiology. Archived from the original on 2016-03-24.
- 설명(cameron.edu
- 다이어그램(nih.gov